Ja jako poštujem ovaj statut VIIA-skupine.
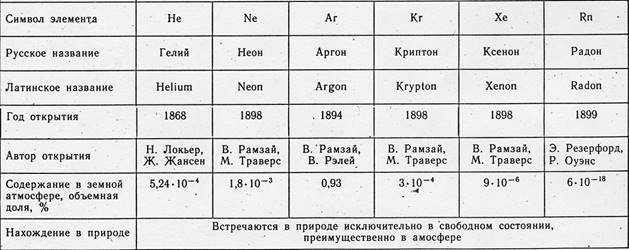
Tse elementi: helij(On), neon(Ne), argon(Ar), kripton(Kr), ksenon(Xe) (tse osnovni), kao i radioaktivni radon(Rn).
Í formalno, moguće je uvesti dio po dio otrimanie ununoktíy (Uuo).
Qia grupu elemenata također ću imenovati svoju - aerogeni, ale najčešće zovem plemenita, abo unutarnji plin.
Inertní Gazi
U isto vrijeme, reakcijska aktivnost je niska. Pod riječju “inertnost” još uvijek nedostaje aktivnosti. Dugo nismo znali mnogo o tome. Nije moguće osloniti se na dodatne reakcije za pomoć. Viyavili í̈kh at povítrí (ime aerogeneze), nakon što je vidio iz ny kissen i ínshi ínshi ínshi ínshi ínshi ínshi ínshi ínshi ínshi ín u plinu ín da je to dušik, koji je eksperimentalno ustao od takvog nitrogena mala kuća. Inertni pogledi pretvorili su se u kuće tsimi.
Za inteligenciju, koja je povezana s niskom reakcijskom aktivnošću plina, potrebno je koristiti ove elektronske dijagrame:

Mi mogomo bachichi, scho nema neuparene elektronike, orbitalija skladištenja. Tse duzhe pryutkovy mlin elektroničke ljuske. Tome i elementima ínshí, koji se postavljaju u poluvremenu, da oprostimo elektroničkoj konfiguraciji plemićkih novina (pogodite pravilo okteta), neki od njih su energetski živopisni, a atomi, poput ljudi, na neki način vole.
Zbog neaktivnosti atoma plemenitih plinova nemoguće je akumulirati se u dvoatomskoj molekuli (kao jezgra: O2, Cl2, N2 itd.).
Plemeniti plinovi prolaze oko monoatomskih molekula.
Nemoguće je reći da je plemeniti plin apsolutno inertan. Deyak aerogenija može biti u vilnym orbitalama u granicama jedne energetske ryvnye, a to znači da postoji vrlo moćan proces generiranja elektronike. Nina je, u praznovjernim ekstremnim umovima, odbacila deyakis spoluky "linivyh" iz pogleda na kemijsku aktivnost elemenata. Pivo u školski programi, tim više unutra, pazi.
Fizička snaga
- helij i neon osvijetljeni za dobrotu, oni plemeniti plinovi, koji su niži - važni, koji se uvećavaju rastom atomske mase.
- putem kemije, okusa i mirisnih receptora, prisutnost plemenitih plinova u svačijem umu ne može se percipirati, jer smrad ne miriše ni na užitak ni miris.
Praktični značaj plemeniti plinovi.
Gel - sve vrste plina za punjenje starih vreća, koji će otimati glas najpametnijima. Helij zapovnyuyut zračne brodove (sve plin, na vidminu vodu, a ne vibukonesecure).
Shlyakhetní plinovi i vikoristovuyut iz stabljike inertne (kemijski neaktivne) atmosfere. Deyak aerogene ulazi u skladište dichal sume, razrijedi kissen (ljubac je jak oksidirajući i dihotomija u čistom viglyadi nije moguća).
Kada se prođe kroz pražnjenje plemenitog plina, smrad smrada može uzrokovati snagu strujanja. Osigurat ću skladište aerogena za rasvjetnu opremu. Viglyadaê završiti vrste.
Više o qiu temi:
- Fizička snaga.
- Veseli autoriteti.
- Povijest prikaza unutarnjih plinova.
- Galuz zasosuvannya.
- Injekcija u organizam ljudi.
1. Fizička snaga unutarnjih plinova.
Inertni plinovi ne uzrokuju boju ili miris. Í ê jednoatomski. Inertni gazi su vvazhayutsya plemstvo. Mogu vidjeti električnu vodljivost (u pravilu), a kad struma prođe kroz njih, zasvijetlit će.
Neon je svjetlo koje se zove vatreni crv, tako da se najljepše linije nalaze u crvenom području spektra.
Geliy - yaskravoo-zhovtim svjetlo, vrijedno je objasniti da, u smislu jednostavnog spektra pod-linija zhovta linia perevazhaê nad usima ínshi.
Inertni plinovi mogu uzrokovati najniže točke rasta i smrzavanja, zbog prisutnosti plinova iz samog molekularnog tijela. To se može vidjeti kroz karakterizaciju atomskih molekula unutarnjih plinova.
2. Kemija snage unutarnjih plinova.
Inertni plin može biti čak i manje kemijski aktivan, što se objašnjava tvrdom osmoelektronskom konfiguracijom elektronske kuglice. Kao rezultat povećanja broja elektronskih kuglica dolazi do polarizacije atoma u rastu. Otzhe, nećete moći provesti sat vremena prelazeći s helija na radon.
Dugo vremena u prošlosti nisu poznavali umove, za koje su plemeniti ljudi mogli stupiti u kemijski odnos i uspostaviti pošten kemijski razgovor. Njihovnya valencija na nulu. Prva nova grupa kemičara dobila je nultu jedinicu.
Godine 1924. postala je očita ideja da su neki od najvažnijih energetskih plinova (zokrem, fluorid i ksenon klorid) termodinamički stabilni i da se mogu temeljiti na pametnim umovima. Teoretski, i elektronska struktura ljuske kriptona i ksenona s pozicija kvantne mehanike, ali i plina se može postaviti fluorom.
To je sat vremena, ali u praksi su svi eksperimenti u cijelom galusu završili neuspjehom. Ksenon fluorid nije aktivan. Nastavno otišao na visnovku, ali nije bilo šteta, i dok se nisu navikli.
Tek 1961. godine rođen je Bartlett 1961., suradnik jednog od kanadskih sveučilišta, u kojem je utvrđena moć platina heksafluorida, bez samog fluora, ugradivši potencijal 12 u donji ksenon i fiksirajući poljubac platinastim heksafluoridom u skladište O2PtF6 ...
Na sobnoj temperaturi, Bartlett je dala heksafluorid platine nalik plinu i ksenon sličan plinu, skidajući čvrsti narančasto-žuti govor, koji je nazvala XePtF6 heksafluoroplatinat u ksenon.
Kada se zagrijava u vakuumu, XePtF6 heksafluoroplatinat treba zagrijavati bez preklapanja. Klizite po vodi, pogledajte ksenon:
2XePtF6 + 6H2O = 2Xe + O2 + 2PtO2 + 12HF
Prije nego što je Bartlett održao novi govor, Bartlett je krenuo na posao, ali ponašanje heksafluoroplatinata ne bi se trebalo vidjeti iz ponašanja opakih kemičara.
Bartlettovi roboti su dopustili stajati, ali je ksenon taložen u umovima reakcije, gradeći vrata s platinastim heksafluoridom: XePtF6 i Xe (PtF6) 2. Ako postoji nedostatak hidrolize, postoji samo jedan od najboljih proizvoda.
1962. da rock Bartlett posrće u pozadinu.
Već tri godine kasnije, pokus je ponovila skupina američkih prelata u Argonne National Laboratory u Choly s Chernikom. Razmotrimo prvi put u daljini sintezu analognih spoluka na ksenon s rutenijevim heksafluoridima, rutenijem i plutonijem.
Sada, prije svega, ksenon: XePtF6, Xe (PtF6) 2, XeRuF6, XeRhF6, XePuF6
Mit o apsolutnoj tromosti plinova nije potvrđen.
Postoji hipoteza o mogućnosti izravne interakcije između ksenona i fluora.
Stavili smo puno plina (1 dio ksenona i 5 dijelova fluora) u posudu od nikla, kao najbolje rješenje za fluor, i zagrijali ga malim škripcem.
Tijekom godine dana posuda je hlađena, a plin je upumpavan. Plin, koji je bio preliven, nije se pojavio, kao fluor. Sav xenon je reagirao!
Zatim su na otvorenim posudama bez kristala vavili na ksenon tetrafluorid XeF4.
U lancu otopina, molekula je oblikovana kao kvadrat s ionima fluora duž rezova i ksenonom blizu središta.
Ksenon tetrafluorid XeF4 fluor živa, platina (razrijeđena vodenom otopinom fluorida): XeF4 + 2Hg = Xe + 2HgF2
Za divno čudo, oni koji mijenjaju reakcije mogu se odbaciti kao XeF4, a isti fluor, na primjer XeF2, XeF6.
V.M. Khutoretskiy i V.A.
Koriste se za predlaganje načina da se količina ksenona i fluora (u molekularnom omjeru 1:1) unese u zdjelu iz stakla od nehrđajućeg čelika, a kada se pritisak povisi do 35 atm, reakcija je popravljen.
XeF2 - Pojedinačni ksenon fluorid, s ubrizganim električnim pražnjenjem ksenona i tetrafluorida u ugljiku, bez fluorida.
Čisti XeF2 se oslobađa kada se ksenon i fluor optimiziraju ultraljubičastim zračenjem.
Difluorid XeF2 ima blagi specifičan miris.
Otpornost na difluorid u vodi je niska. Yogo roschin je najjači oksidant. Vjerojatno vín samozamrzavanje na ksenon, kisen i fluoridnu vodu. U sredini bazena distribucija je posebno brza.
p align = "justify"> Metoda za sintezu ksenon difluorida, koja se temelji na ubrizgavanju u zbroj plinova ultraljubičastog viprominuvanja (do 2500-3500 A) je od velikog teorijskog interesa.
Viprominuvannya wiklicaê cijepanje molekula fluora u vilny atome. Prvi razlog za odobrenje difluorida, jer atomski fluor je supraspecifično aktivan.
Za odbacivanje ksenon heksafluorida XeF6 potrebna je potrebna količina energije: 700 ° C i 200 atm. Za takve umove, zbroj ksenona i fluora, od 1:4 do 1:20, praktički će se sav ksenon pretvoriti u XeF6.
Ksenon heksafluorid je površinski aktivan i nabora se s vibukom.
Lako reagira s fluoridima stranih metala (crim LiF): XeF6 + RbF = RbXeF7
Čak i pri 50 °C, syl se kolabira: 2RbXeF7 = XeF6 + Rb2XeF8
Viskozni fluorid XeF8 stabilan je na temperaturama ispod minus 196 °C.
Još ranije su se u blizini nulte skupine vidjeli plemeniti plinovi, ali je ona bila potpuno informirana o valenciji, tada je sinteza prve polovice ksenona stavljena pred kemičare napajanja oko sredine unutarnje plinski sustavi. Odlučeno je da se inertni plinovi prebace u VIII skupinu, ako postanu vrsta s najvećim fluorom, valencija ksenona je veća od osam, tako da se može u potpunosti potrošiti iz pupoljka elektroničke ljuske.
Bez napora eliminirajte fluoride iz ksenona. Zmushiti ksenon stupiti u reakciju bez sudjelovanja fluora (neki od njih spoluch) bez dospijeća igdje.
Ljubazno vivcheno razmjenu fluorida ksenona s vodom.
Kada se XeF4 hidrolizira u kiselom okruženju, stvara se ksenon oksid XeO3 - kristali bez šipka, koji se mogu rastopiti.
Molekula XeO3 ima strukturu trokutaste piramide koja prska s atomom ksenona na vrhu.
Tse duzhe nestíyke z'êdnannya, kada je raspoređen, nagon vibucha da se približi nagonu vibucha od TNT-a. Za to je dovoljno nekoliko stotina miligrama XeO3, eksikator je razbijen u komadiće.
U perspektivi prijenosa vicarystannya na ksenon trioksid jak vibukhivka. Takva vibučivka metka bila bi više ručna, tako da su svi proizvodi vibučivske reakcije plinovi. Metitoksenon trioksidima je skupo riješiti ga se zbog malih rezervi u atmosferi i tehničkog preklapanja.
Za uklanjanje 1 m3 ksenona potrebno je probiti 11 milijuna m3 uvijanja.
Neotporna kiselina heksavalentnog ksenona H6XeO6, koja je slična trioksidu, nastala je kao rezultat hidrolize XeF6 na temperaturama od 0 °C:
XeF6 + 6H2O = 6HF + H6XeO6
I prije produkta lanca reakcija potrebno je dodati Va (OH) 2, vipada amorfni bilij
opsade Va3HeO6. Na 125 °C vino se taloži na oksid, ksenon i kisik.
Otrimano analogne soli-ksenonat natrij i kalcij.
Od ozona do raspona XeO3 u jednomolarnom natrijevom hidroksidu, postavlja se s kiselom kiselinom i ksenonom Na4XeO6. Natrijev perksenonat se može vidjeti u obliku kristalnog hidrata bez šipki Na4XeO6 · 6H2O. Također, dok perksenonati ne budu odobreni, potaknite hidrolizu XeF6 u natrij i kalcijev hidroksid.
Dovoljno je samljeti čvrsti Na4XeO6 otopinom olovnog nitrata, ili čak urana i nekim od sljedećih perksenonata:
Ag4XeO6 je crn, bXeO6 i (UO2) 2XeO6 je crn.
Analogne soli daju kalcij, kalcij, litij, cezij,.
Jak u oktafluoridu, valencija na ksenon je do osam.
Čvrsti chotirikis na temperaturi od 0 ° C razlaže se na ksenon i muslin, a plinolik (na sobnoj temperaturi) - na ksenon trioksid, ksenon i mussen.
Molekula XeO4 ima oblik tetraedra s atomom ksenona u središtu. Postoje dva načina za prijeći od hidrolize do ksenon heksafluorida:
- unesite tetraoksifluorid XeOF4,
- unesite dioksifluorid XeO2F2.
Izravna sinteza elemenata za proizvodnju oksifluorida XeOF2.
Nedavno je ubrizgan u reakciju ksenon difluorida s bezvodnim NS1O4.
Otrimano novo za ksenon XeClO4 je zamoran oksidant, kao rezultat cijele reakcije najmoćniji je perklorat. Sintetiziran s pola ksenona, da se ne osveti kiselom.
Lanac podsoli, produkti interakcije fluorida u ksenonu s fluoridima surmija, mish'yaka, bora, tantala: XeF2 · SbF5, XeF6 · AsF3, XeF6 · BF3 i XeF2 · 2TaF5.
Ja nareshty, zbunjeni govor tipa XeSbF6, stil za sobnu temperaturu, a XeSiF6 je nestabilan kompleks. Na ovaj dan, ustanite u daljinu, radon također stupa u interakciju s fluorom, čineći fluor nehlapljivim.
Vidjeli smo razliku između difluorida KrF2 i tetrafluorida za kripton KrF4 izvan snage koja se može koristiti za polovicu količine ksenona. 4. Povijest prikaza unutarnjih plinova. Prije plinova gentry leže helij, neon, argon, kripton, ksenon i radon. Zbog svoje snage, smrdi nisu slični onima od elemenata i u periodičnom sustavu rastu između tipičnih metala i nemetala.
Povijest razvoja energetskih plinova vrlo je zanimljiva: prije svega, kao trijumf koji je Lomonosov uveo u neke kemijske metode (u slučaju argona), odnosno kao trijumf teorijske transmisije
U tom je času uvedena inspekcija fizičara Releja i kemije Ramzama prvog plemenitog plina - argona, ako je periodični sustav bio dovršen i nekoliko praznih ćelija lišeno njih.
Već 1785. godine engleski kemičar i fizičar G. Kavendish pronašao je novi plin na prijelazu, izvanredno stabilnu kemiju. Približno sto dvadeset dijelova obsyagu povitrya palo je ispred plina. Ale scho tse za plin, Kavendish z'yasuvati nije stigao.
Oko 107 sudbina se nagađala o tome, budući da ga je John William Stratt (Lord Rayleigh) utrljao na istu kuću, vodeći računa da je dušik važniji, a manje dušik, vizije iz spoluka. Ne znajući pouzdano objašnjenje anomalije, Rayleigh se preko časopisa “Nature” obratio svojim kolegama-prirodoslovcima i predložio da se odmah razmisli o tome i pokuša riješiti problem razloga.
Nakon dvije rakete, Raleigh i U. Ramzai su ustali, u dušiku, to je kuća nečuvenog plina, važnog za dušik, a na rubu inertne kemije.
U redu, za dodatnu glazbu za pečenje, dodajte malo kiselosti, a zatim zagrijte malo magnezija u cjevčici s malim komadićima. Osim toga, budući da je količina dušika značajna, bod se zaglavi s magnetima, količina dušika određena je količinom viška.
Profitabilnost je bila 15 puta veća za obilje vode, dok je obilje dušika samo 14 puta veća za godinu. Razina znanja je narasla i preuzela korištenje dušika, dokovi su dosegli 18.
Dakle, rečeno je da je veća vjerojatnost da će se osvetiti plin, čiji je postotak veći za dušik... Wono vyavilsya jednoatomski plin.
Ako je smrad dolazio iz javnih vijesti o napadu, onda je neprijateljstvo učinjeno na lukav način. Bagaty je izgledao kao neymovyr, ali su se još nekoliko učenika, poput tisuću analiza, pogledali. skladišnog dijela, taj isti taku će zapamtiti - mayzhe vidsotok! Do govora, istoga dana i godine, 13 srp 1894., argon je odsjekao svoju sliku, što na orahu znači “nije sjajno”.
Helij naprijed za identifikaciju jakova kemijskog elementa na 1868 str. P. Zhansen tijekom razvoja pospanog zamračenja u Indiji. Tijekom spektralne analize uspavane kromosfere otkrivena je linija koja je dovedena u spektar natrija, ali 1871. J. Lok'êr i E. Frankland nazvali su novi element helij vid orasi. "Helios", što znači sunce.
Todi nije znao je li helij inertan plin, ali su ga pustili, ali bio je metal. I tek nakon četvrt stoljeća pojave helija na zemlji. Godine 1895., kroz nekoliko minuta pisanja argonu, U. Ramzai i odmah švedski kemičari P. Cleve i N. Lengle ustali su, da se gel vidi kada se mineral zagrije.
Preko Rika G. Keysera razvio je kuću s helijem u atmosferi, a 1906. procvjetao je helijem u skladištu prirodnog plina u dubinama nafte Kansasa. Istodobno su instalirani E. Rutherford i T. Royds, čiji a-dijelovi, koje oslobađaju radioaktivni elementi, predstavljaju jezgru helija.
Za cijeli prikaz će raditi Ramzai, a to je cijela skupina kemijskih elemenata, koji se u periodičnim sustavima miješaju s metalima i halogenima. Nagrizeni periodičnim zakonom i Mendelevovom metodom, određeni su brojni neuključeni plemićke novine i moći, izdanak atomskih masi. Tse je dopustio da revnitelji dođu do šala plemićkih novina.
Ramzay i yogo sportaši bili su zauzeti mineralima, prirodnim vodama i meteoritima uz buku unutarnjih plinova. U znak protesta, sve je bujalo bezuspješno, analize su uvijek bile negativne.
Tim je sat vremena - imaju novi plin, ali nisu koristili metode, nisu koristili one osjetljive, a nisu ih koristili.
Čuvši do kraja dana, sve za sljedećih nekoliko trenutaka nadolazećeg rocka, vidjet ćete nove elemente, kao i plin, poput neona, kriptona i ksenona, vidjet ćete vizije s početka.
Za cijelu hrpu, očišćeni ispred ugljičnog dioksida i u teologiji, zridžuvali, a zatim popravljeni viparovati. Tijekom cijelog postupka ne biste trebali imati dovoljno plina za isparavanje i važne energije, ali ste izgubili količinu vapinga i koristite je.
Otrimanizirane frakcije davane su mladima.
Spektralnu analizu je lako razumjeti kao jednu od metoda za određivanje vrijednosti:
To je jednostavan postupak koji omogućuje identifikaciju plina bez energije duž linija raspona.
Za cijeli plin se stavlja u razvodnu cijev, prije spajanja cijevi.
Ako u epruvetu stave prvu, najbolju i frakciju niskog vrenja, onda se u spektru reda s vidljivim linijama dušika, helija i argona pojavljuju nove linije, posebno svijetli meci crva. Smrad je ulijevao svjetlo u cijevi u vatri staje. Cíkava povijest naziv plin:
Ako Ramzai sposterígav, u blizini Chergovyu dosvídí, spektar dobro izrezanog plina, prije nego što je laboratorij uvíyshov yogo dvadtsyatiríchny grijeh, koji je dobio status "shanuvalnom" očevi roboti... Nakon što je popravio neopaku dragu, osvoji viguknuv: "novi!" , scho stari grčki znači "novi".
Tako je Vinikla plin nazvao "neon".
Upoznati unutarnje plinove, kako dovršiti četvrtine, pojmove i prve periode Mendelovih tablica, u daljini ne odjednom, makar samo zbog plamena helija, neona i argona, kako dovršiti tri prva stupnja Mendelovog stola, na prvom mjestu
Ale, u taj čas, dosjetili su se malo slanog jela, puno zavdjaka na napore engleskog djevojačkog Traversea.
Nakon što je postao dostupan zavičajnoj vodi.
Ja sam Ramzai odmah iz Traversea uspio se pobrinuti za nekoliko posljednjih važnih događaja u danu, kako ići slati poruke heliju, vodi, neonu, kiselini, dušiku i argonu.
Zalishok otrimav Sirija (nepročišćavanje) kripton. Prvi put kad sam ga vidio u posudi, dobio sam puno plina. Sav plin daje širok raspon vodova u područjima od narančaste do ljubičaste i mav blakitne svjetlo u električnoj utičnici. Zapravo, spektralne linije mogu se koristiti za identifikaciju elementa bez pompe. Í Ramzai í Traverse mali svi su opskrbljeni novim plinom.
Nazvat ću ga ksenon, što na orah znači "vanzemaljac". Iako je frakcija Kryptona stranac, istina je.
Na šale novog elementa vivchennya vlasti, Ramzai i Travers zdrobili su gotovo stotinu tona sirove hrane. Zm_st do ksenona u atmosferi nije dovoljno, ali čak i više - ksenonu praktički nije dosadno (može sav ksenon pretvoriti u atmosferu).
Instalirana je individualnost ksenona kao novog kemijskog elementa koji djeluje s manje od 0,2 cm3 plina.
Ramsay također može preuzeti zasluge za poruku visoki predstavnik inertnih plinova. Vikoristovuchi fini tehnički priyomi, vin doviv, tako radioaktivno pretvarajući se iz radija - radio emanation radio - je plin koji je u skladu sa svim zakonima modernih plinova, kemijski inertan i nisko karakteristični spektar. Ramzai vimíryav fluidnost difuzije, koja je omogućila postavljanje molekularne težine plina, scho je postala približno 220:
Kada jezgra atoma emanira iz radija - cijeli višak jezgre se šalje u helij (a -čestice), tada je naboj atoma odgovoran za 88-2 = 86. Dakle, novi element buty s inertnim plinom. Atomski automobil yogo 226-4 = 222. Službeno je prekršeno uključivanjem nove skupine kemijskih elemenata u periodični sustav 16. ožujka 1900., uz pomoć Ramzaija iz Mendeleva.
- Područje skladištenja unutarnjih plinova.
Geliy - dzherelo niskih temperatura.
Ridkiy helij vikoristovutsya često mrze jajnike, na primjer, overprovodníst u čvrstom staní. Toplinsko iscrpljivanje atoma i električnih elektrona u čvrstim tijelima praktički je izvan dana na temperaturama niskih helija.
Osim toga, rijedak helij je izvrstan za hlađenje magnetskih supervizora, prskanja čestica i dodataka. Isporučiti nevidljivi usisni helij kao rashladno sredstvo, je proces neprekidne redukcije 3He i 4He, za postavljanje i podešavanje temperatura niže od 0,005 K
Helij sličan plinu vikoristovuyat jak lagani plin sličan suhim vrećama.
Oskil osvojio nije zapaljiv, njen íí̈ íí̈ íí̈ íí̈ íí̈ íí̈ íí̈ íí̈ íí̈ íí̈ do zapovnenya za školjku zračnog broda, završavajući do vode.
Helijev vikoristovuyak kao unutarnja sredina za zagrijavanje luka, posebno magnezija i te legure, kada se eliminiraju Si, Ge, Ti i Zr, za hlađenje nuklearnih reaktora.
Ostalo skladištenje helija - za plinsko žvakanje ležajeva, za detektore neutrona (helij-3), plinske termometre, rendgensku spektroskopiju, za prijenos plina, za pumpe visoke opruge... Na vrhu s ostalim plemenitim plinovima, helij je opak na posljednjim neonskim reklamama (kod cijevi za plinsko pražnjenje).
Ima puno helija zastoja u glavama ludih za robusnošću, odnosno helij je bolji u krvi, manje dušika. Na primjer, s morskim bušotinama, s otvorima podvodnih tunela i sporuda.
U slučaju vikoristannyh helija, vizija plina osiromašena iz krvi, dekompresija, ronilac ima mnogo boli, postoji mala bolest u ronioca.
Oklevajući He – O2 stagnira niske viskoznosti za osobe s napadima astme i za djecu starih bolesnih.
Argon se široko koristi za skladištenje.
Trajno zruchno lučno električno grijanje u sredini argona, tk. U mlazu argona možete spaliti suptilnosti virobija i metala, koje su prije bile važne. Vvazhaêtsya, kako je električni luk u atmosferi argona donio revoluciju u tehnologiji proizvodnje metala. Proces se brzo ubrzao, postojala je mogućnost rezanja limova vatrostalnih metala.
Kada se argon puše kroz čelik, može vidjeti uključene plinove. Smanjit ću snagu metala. Argonski luk se puše kroz argon (u slučaju vode), rubovi su omotani i volframove elektrode su izrađene od oksidnih, nitridnih i drugih kuglica. Jedan sat obrišem luk i koncentriram luk na malu površinu, kroz temperaturu u zoni koja doseže 4000-6000 °C.
Osim toga, struja plina je vrsta razvoja proizvoda.
A kada se spali u mlazu argona, nije potrebno koristiti fluksove i elektrode, a zatim, u čišćenju šava od troske i viška toka.
Zastosuvannya ksenon, često runtutsya na tlu ući u reakciju s fluorom.
U medicinskim slučajevima, ksenon se proširio fluoroskopijom u mozgu. Stagnirati s crijevnim prosvjetljenjem (ksenon se snažno drži ksenona viprominuvannya i dodatna pomoć da se zna problem). Istodobno, on apsolutno nije sramežljiv.
I aktivni izotop ksenon, ksenon - 133, vikoristovuyut na naprednu funkcionalnu učinkovitost nogu i srca.
Svjetlosna tehnologija ima širok raspon ksenonskih svjetiljki i visok porok. Princip rada je da se vodi činjenicom da se u takvim žaruljama lučno pražnjenje stvara u blizini ksenona, te da postoji zahvat od nekoliko desetaka atmosfera.
Svjetlo u takvim svjetiljkama je jako i bez prekida spektra - od ultraljubičastog do bliskog infracrvenog područja, a pojavljuje se čim se upali.
6. Diya na organizam ljudi.
To će biti prirodno poštovati, ali plemeniti plinovi nisu krivi za izlijevanje živih organizama, što je vrlo cool. Međutim, nije tako. U ludilu kiselosti, udisanje drugih unutarnjih plinova treba dovesti ljude u logor, spremne za alkoholnu sp'yaninnyu. Takvo narkotično djelovanje unutarnjih plinova akumulira se u razlikama u živčanim tkivima. Prva stvar je da je nuklearna energija inertna na plin, da je učinkovitija i da je više narkotika.
Popis literature.
- Guzei L.S. Predavanja iz kućne kemije
- Ahmetov N.S. "Žagalna i neorganska kemija"
- Petrov M.M., Mikhil'ev L.A., Kukushkin Yu.M. "anorganska kemija"
- B.V. Nekrasov "Pidruchnik zagalnoy chemistry"
- Glinka N.L. "Zagalna Khimiya"
Na zvaryuvanni se često naziva vikoryuvanní tzv. ínertní plin. Prije njih, postoji skupina kemijskih elemenata, koji mogu imati slične karakteristike. Inertni plin je plemenit za normalne umove je jednoatoman. Praktički svi smradovi ne mirišu ni boju ni miris. Karakteristična reaktivnost je još niža u kemiji. Miris je praktičan da ne ulazi u reakciju s metalima, što je potrebno normalnom robotu. Takvi plinovi zauzimaju prvih 6 razdoblja i odnose se na osmu skupinu kemijskih elemenata u periodnom sustavu.
Snaga unutarnjih plinova može se objasniti iz teorije atomskih struktura. Miris dolazi iz elektroničkih ljuski iz valentnih elektrona. Pomislite samo, u kojim govorima može doći sudbina lišena malog broja kemijskih reakcija. Naravno, za sve plemenite plinove manje od 10 stupnjeva po Celzijusu, praktično je za sve plemenite plinove uzeti u obzir temperature vrenja i taljenja.
Galuz zasosuvannya
Snaga unutarnjih plinova da ih obuzda još je više zahtijevana iz zdravstvene sfere. Glavne metode skladištenja su plinsko i plinsko izgaranje. Miris vikonuyut ulogu zhisny sredine, kao vidgorodzhuv kupka s topljenjem metala od negativnog priljeva drugih čimbenika, uključujući hranu sredinu. U pravilu, smrad stagnira istodobno s tehničkom kiselinom, a krhotine će povećati temperaturu peći. U slučaju pobjedničkih unutarnjih plinova, oni idu sve više i iznova, ali se količina novca smanjuje satima.
Rechivini vikoristovuyutsya na strašan maidanchiks s ugradnjom metalnih konstrukcija, posebno neporoznih dijelova. Učinkovito su dizajnirani s delikatnim detaljima, cijevima i drugim predmetima, koji se lako mogu prilagoditi električnom zvuku. U radionicama za ažuriranje automobila i tehnologije preklapanja nije dovoljno koristiti inertne plinove kao glavnu metodu uklanjanja dijelova, a na materijal je malo gubljenja vremena. U komunalnoj sferi potrebno je govoriti o popravku cijevi i drugim govorima, a o tome također treba razgovarati. Kada virobnitví metalni virobív ružičastog tipa, posebno od metala u boji, lako se upali, inertni plin je plemenit u glavnoj siruvini za robote.
Perevagi
Pošto je odrastao, to znači inertni plin, varto zrozumiti, koji je sam po sebi toliko popularan kod tsiy galuzy. Tse se ulijeva uz brojne perevag, yaki runtuyutsya na yogo moć. Naravno, oni mogu imati svoje specijalitete, ali općenito možete vidjeti takve pozitivne trenutke:
- Rechovina praktički ne ulazi u reakciju s metalima, koju provodi robot, kiseli smo, preslabi;
- Plin se tijekom kuhanja dopušta da dosegne visoku temperaturu, što će spriječiti kuhanje veće količine metala;
- Ê Mogućnost reguliranja polovice uma, yogh spivvidnoshennya s kiselim za odbacivanje potrebnih autoriteta;
- Zberigannya i prevezen iz logora za odrasle, ili pod velikim stiskom, da se pojavi s velikim pravom za kompaktnost;
- Pogled na te plinove može se instalirati bez potrebe za a priori na radnoj stanici za posebne instalacije generatora.
Nepotpun
Tim nije čovjek, želim za puno galuzy gazi i jedno od najčešćih rješenja, í̈kh vikorstannya male nedostatke, od kojih su sredina glavni:
- Zberigannya i transportirani baloni iz plinova ê završiti s preklapanjem desno, ostaci ê risik vibuhu;
- Većina ovakvih riječi fitilj u otrov, ako njihova koncentracija u sljedećem danu dosegne vrijednost pjevanja;
- Deyakí gazi je douzhe shkídliví za organe obrazovanja i mozhut viclikati profesionalne bolesti za relativno kratko vrijeme za to je neophodan sat vremena POJEDINACA zahist;
- Acetilen i neki drugi plinovi mogu biti puno posla, tako da je proces kuhanja skuplji.
Vidite unutarnje plinove
Argon nije brendiran, ne miriše na boju. Pobjeda je važna za povećanje veličine za 1,5 puta. Plin ne izlazi u metalima, kao u čvrstom ili tvrdom čeliku. Za promislovostí vypuskayut na viglyadí prve sorte. Vyshy sorta osveti 99,993% čistog govora i postaje stagnirajuća u slučaju rastućih spora. Prvi razred otkriva 99,98% čist govor. Yak aditivi su dušik i guska. Dobro za ići.

Geliy nije otruyny, ne miriše na tu boju. Pobjeda za sreću. Rechovina je dopuštena u skladu s GOST 20461-75. Može postojati tehnički plin čistoće od 99,8% i stupnja visoke čistoće od 99,985%. U zvaryuvanny vikoristovuyutsya ne tako često, kao argon, tako draga i manjkava. Pobjeda može biti učinkovitija, jer je luk s njima vidio više energije i manje štete i više ključanja. Glavna sfera pobjede je priprema aktivnih i kemijski čistih materijala na bazi magnezija i aluminija.

Dušik nije markiran, ne miriše na boju. Freeze za razvoj glazbe i legure za metal. Izdaje se u skladu s GOST 9293-74, a standard uključuje 4 glavne vrste. Viski ima 99,9% čistog materijala, prvi ima 99,5%, drugi 99%, a treći 97%.
![]()
Upute za sisanje
Kada vikorystanní ínertnyh gazív smrad u Persha, pokrenuti u paleti, da preispita svoje prasezdatníst. Poljubac možete dodati samo u hranu. Polovica toga može biti pobjednička za frontalnu igru i postignuće korak po korak, a ne samo za angažman. Na klipu je potrebno prikazati parametre opskrbe plinom i dovod u željeni način rada.
Prije pokretanja klipa potrebno je promijeniti sva crijeva za pravilan rad, kako iz njih ne bi dolazio plin."
Uđi na sigurno
- Poznato je da su baloni s plinom na mjestu od 5 metara od džerela polovice i lako posuđeni govor;
- Blizina nije kriva za masne plaže;
- Na sat vremena, robot baloni može biti sigurno pričvršćen;
- Potrebno je paziti na tabor zagađenja plinom, da nema mirisa zraka.
Zberigannya i transport
Prijevoz se ne obavlja na prijevoz s resorima. Baloni su krivi ali su popravljeni, ali ne mogu ih iznevjeriti, udare jedan o jedan i padnu. Zberigannya je kriva što se provodi na selu, tako da se možete testirati.
Visnovok
Nevažni po svim nedostacima i sklopivosti, inertni plinovi su preplavljeni zahtjevnim vitratnim materijalima za dobar i kvalitetan zvuk.
Britanska međunarodna škola
Sažetak iz kemije
"Inertne novine i vlasti"
Škola 9 b razred
Sokolenko Oleksija
Kerivnik:
Chernishova I.V.
I Ulaz ……………………………………………………………………………………………… 2
1.1 Inertni gazi - elementi VIIIA grupe ……………………………………………… ... 2
1.2 Argon zemlje na allsvit …………………………………………………………… .5
II Povijest detekcije plina ………………………………………………………… 7
2.1 Argon ……………………………………………………………………………… 7
2.2 Geliy …………………………… .. ……………………………………………………… ..8
2.3 Kripton ……………………………………………………… .. ………………… ..9
2.4 Neon …………………………………………………………………… .. …………………………… 9
2.5 Ksenon …………………………………………………………………………………. ……………. …………… .9
2.6 Radon ……………………………………………………………………… .. …………… .10
III Snaga inertnih plinova i spoluka …………………………………………………………………………………………………………… ..... 10
3.1 Fizička snaga unutarnjih plinova ………………………………………… .10
3.2 Kemija snage inertnih plinova ……………………………………………………………………………………………………………………………… …… ..... 11
3.3 Odbijanje argona ………………………………………………………… ... ………… ..14
3.4 Fiziološki autoriteti unutarnjih plinova ……………………………………………… 15
IV Stagnacija inertnih plinova ………………………………………………………… ..… ..16
Popis pobjedničke literature ……………………………………………………… .... 18
ja
Skryz i svugdje ću ostaviti atmosferu dobrote. Od koga je? Odgovor je nezgodan: od 78,08 do dušika, 20,9 do kisika, 0,03 do ugljičnog dioksida, 0,00005 do vode, blizu 0,94 do dijela takozvanog unutarnjeg plina. Ostatak boćanja doživio je gubitak prošlog stoljeća.
Radon se uspostavlja u slučaju radioaktivnog pada radioaktivnosti iu bilo kojoj količini materijala koji otkriva uran, kao iu nekim prirodnim vodama. Helij je proizvod radioaktivnog α-raspada elemenata, koji se ponekad nalazi u prirodnom plinu i plinu, što se može vidjeti iz naftnih rupa. Veličanstveni brojevi ceija imaju element koji se odvija na Pjesmama i zvijezdama. U svakom trenutku (za sada) postoji sasvim drugi element širine.
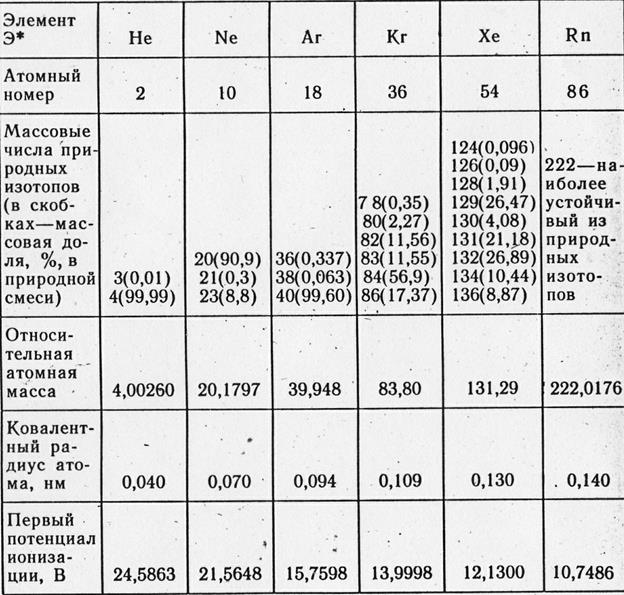
1.1 Inertni plin - elementi grupe 8A.
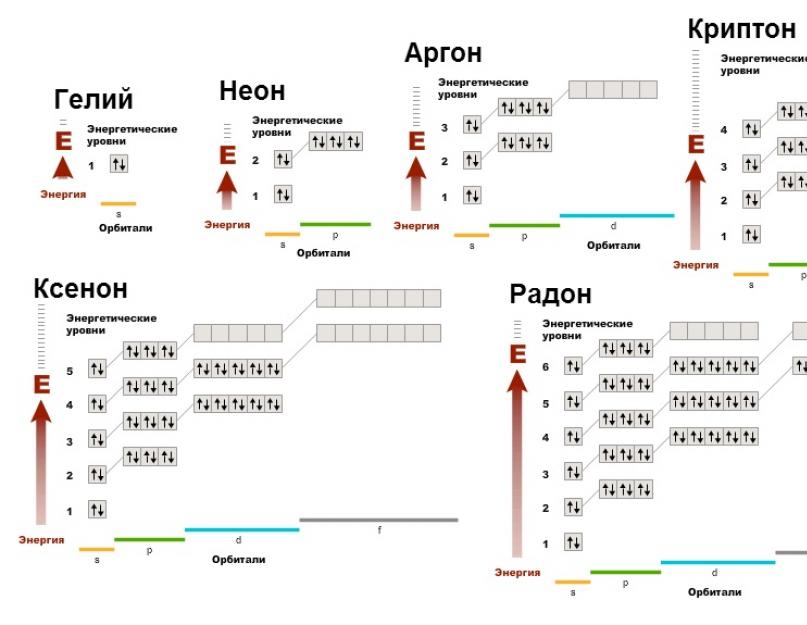
Konfiguriranje nove elektronske lopte atoma helija 1 s 2, najveći elementi grupe VIII - ns 2 np 6 .
1.2 Argonska zemlja uopće.
Na Zemlji je argon moćniji, ali ne i jedini elementi ove skupine, odjednom. Yogo sredina umjesto zemljine kore (clarke) na 14 puta više, manje gela, i 57 puta više, manje neona. Ê argona u vodi, do 0,3 cm 3 u morskoj vodi i do 0,55 cm 3 u slatkoj vodi. Tsikavo, u sumrak plutajućeg mikrofona, rebrasti argon zna više, niže u atmosferskom sumraku. Štoviše, u vodi je argon ljepši za dušik... Atmosfera je glava zemaljskog argona. Yogo u níy (iza wagoya) 1,286%, s 99,6% atmosferskog argona - nyvazhchy izotop - argon-40. Još veći dio izotopa u zemlji argon ospica. Tim za sat vremena, na prijelazu na veliki broj svjetlosnih elemenata, slika je gigantska - prevladati svjetlosne izotope. Razlog ove anomalije otkriven je 1943. godine. U zemljinoj kori postoji čvrsto prianjanje za argon-40 - radioaktivni izotop od 40 K kalorija. Međutim, apsolutni broj kalorija-40 je velik, a nekoliko kalorija jedan je od najrasprostranjenijih elemenata na našem planetu. U dermalnim tonama pasmina spaljivanja, 3,1 g kalorija-40. Radioaktivni pad atomskih jezgri caliyu-40 i dva puta odjednom. Otprilike 88% kalcija-40 će pasti u beta i pretvoriti se u kalcij-40. Ale u 12 kapi od 100 (u sredini) jezgre kalija-40, nije viprominuyut, ali, navpaki, jedan elektron najbliže jezgri K-orbite (K-poplava). Akumulacija elektrona z'ênutsya s protonom - potvrđuje novi neutron u jezgri i neutrino viprominuêuet. Atomski broj elementa se mijenja za jedan, a masa jezgre se prekriva. Tako će se kalij pretvoriti u argon. Razdoblje za razdoblje od 40 K do dostizanja velikog - 1,3 milijarde rubalja. Zbog toga je proces uspostavljanja 40 Ar u nadri Zemlje trivijalan i zastrašujući. Na činjenicu da argon "vidi" litosfera kao rezultat vulkanskih procesa, u oživljavanju i rekristalizaciji takve vode i izvora vode. Zapravo, za sat vremena opskrba Zemlje radioaktivnim kalorijama dramatično je povećana - postala je 10 puta manja (što znači da je zaliha Zemlje jednaka 4,5 milijardi rubalja). Raspodjela izotopa 40 Ar: 40 K i 40 Ar: 36 Ap u stjenovitim stijenama činila je osnovu argonske metode za određivanje apsolutne vrijednosti minerala. Očito je starija od pasmine. Argonska metoda je najvažnija u smislu vječne generacije i većeg broja visokokvalitetnih minerala. Profesor E.K. Gerlingu je 1963. dodijeljena Lenjinova nagrada. Otzhe, cijeli ili čak cijeli Argon-40 postavljen je na Zemlju u obliku calia-40. Ovo je važan izotop i dominacija zemljinog argona. Tsim birokrat objasnio je, prije govora, jednu od anomalija periodnog sustava. Dok primarni princip njezina induciranja - princip atomskih automobila - stavlja argon ispred stola ispred kalorija. Yakbi u argonu, kao u susidníh elementima, prolazi kroz svjetlosne izotope (kao što su tse, mabut, mali miševi u svemiru), tada bi atomski automobil do argona imao dva ili tri pojedinačna mensha ... Sada o svjetlosnim izotopom. Jesu li zvijezde snimljene 36 Ar i 38 Ar? Ymovírno, scho dio cich atoma rekreacijske šetnje, tobto. Komad svjetlosnog argona došao je u Zemljinu atmosferu iz svemira kako bi formirao naš planet i atmosferu. Nešto više svjetlosnih izotopa u argonu rođeno je na Zemlji tijekom nuklearnih procesa. Ali svi ti procesi još nisu otkriveni. Shvidshe za sve deyakí od njih davno, krhotine su pokupili kratkotrajni atomi - "očevi", ale i í nuklearni procesi, koji poniní protiv, u kojima se pojavljuju argon-36 i argon-38. Tse beta-raspad klora-36, bombardiran alfa-česticama (u mineralima urana) sirki-33 i klorom-35:
36 17 Cl β - → 36 18 Ar + 0 –1 e + ν.
33 16 S + 4 2 He → 36 18 Ar + 1 0 n .
35 17 Cl + 4 2 He → 38 18 Ar + 1 0 n + 0 +1 e .
Majka svega argona ideja jasnija je nego na našoj planeti. Posebno su bogate govorom vruće zvijezde i planetarne maglice. U svemiru je bolji od argona, manje klora, fosfora, kalcija, kalorija - elemenata koji su čak i širi od Zemlje. Kozmički argon panuyut izotopi 36 Ap i 38 Ap, argon-40 u Vsesvitu je mnogo manji. Istovremeno je u tijeku i maseno-spektralna analiza argona iz meteorita. Istodobno, za ponovno povezivanje širine kalibra. Čini se, kozmos ima kalibar od otprilike 50 tisuća. razvio manje, manje argona, tada kao na Zemlji, jasno je da su kalorije cimet - 660: 1. A ako nema dovoljno kalorija, tada će argon-40 uzeti zvijezde ?!
IIÍPovijest prikaza unutarnjih plinova.
Sve do kraja 18. stoljeća bilo je dosta novih plinova. Pred njima je ležalo: kissen - gas, scho pídtrimu gornnya; plin ugljični dioksid - lako se može pronaći iza još primitivnije moći: osvojite vodu; ja, nareshty, dušik, tako da se peć ne koristi i voda se ne troši. Takav bum otkrio se u tom času, skladište atmosfere, a to je bilo, osim doma engleskog lorda Cavendisha, koji to nije mogao saznati.
I vin mav privid za sumniv.
Godine 1785. rotsi vin zrobiv završiti prostituciju. Nasamper vín vín vítrya vítrya vítrya vítrya plin. Na zbroju dušika i kiselosti, bio sam preplavljen, dobio sam struju. Dušik, reagirajući s kiselim, dajući burliviju par oksida dušiku, koji se nalaze u vodi za piće, pretvoren je u dušičnu kiselinu. Ova operacija je ponovljena bagatorazov.
Međutim, tri manje od jednog dijela obsyagu povitrya, uzeta za publicitet, postala su nevidljiva. Šteta što cijela prošla epizoda nije baš kamenita.
U 1785. str. Engleska kemija i fizičar G. Kavendish je na prijelazu dana pronašao novi plin, izvanredno stabilan. Približno sto dvadeset dijelova obsyagu povitrya palo je ispred plina. Ale scho tse za plin, Kavendish z'yasuvati nije stigao. Oko 107 sudbina se nagađala o tome, budući da ga je John William Stratt (Lord Rayleigh) utrljao na istu kuću, vodeći računa da je dušik važniji, a manje dušik, vizije iz spoluka. Ne znajući pouzdano objašnjenje anomalije, Relay se preko časopisa "Nature" obratio svojim kolegama-prirodoslovcima da odmah predlože da razmisle i pokušaju riješiti problem razloga... što je još važnije, nižeg dušika, a u rub inertne kemije. Ako je smrad dolazio iz javnih vijesti o napadu, onda je neprijateljstvo učinjeno na lukav način. Bagaty je izgledao kao neymovirny, tako da je nekoliko generacija studenata, gledajući tisuće analiza, gledalo svoj dio skladišta i tako ću ga pamtiti! Do govora, na isti dan i godinu, 13 srp, rođen 1894. godine, argon je odsjekao svoj lik, što na orahu znači “nije sjajno”. Yogo proponuvav dr. Medan, kao glava na ogradi. Tim je sat ničeg čudesnog u činjenici da je argon dosad visio sa svih strana svijeta. Adzhe u prirodi vina ne pokazuje ništa za sebe! Mogla bi se postaviti paralela s nuklearnom energijom: govoreći o teškim stvarima, A. Einstein, pošto je poštivao da nije lako prepoznati bagaž, jer nije lako osvojiti moje novčiće... Ale nije bez moralnih potresa: muka napadima kolega (osobito kemičara). Sjajni dojmovi, pobjeda i u tjelesnim postignućima značajni rezultati, za scho 1904. str. Bouv je dobio Nobelovu nagradu. Todi je u Stockholmu jer poznajem Ramzaêma, koji se toga dana riješio Nobelova nagrada za otvaranje plemenitih plinova, uključujući argon.
 |
U žestokoj stijeni iz 1895. Razmay na listovima londonskog meteorologa Maursa, za djecu o sjećanjima američkog geologa Gillebranda, koji je ključao na kiselim kiselinama, snaga urana prikazana je snazi plina Kako se više urana može naći u mineralima, onda se vidi više plina. Gillebrand ga je pametno pustio, poput plina ê s dušikom. "Možda argon?" - hranjenje autora lista.
Nezabarom Rosemay poslao je svoje prijatelje u londonske apoteke za hlađenje minerala urana. Bulo je kupio 30 grama kleveita, a tog dana Rosemay je sa svojim prijateljem Matthewsom kupio bocu kubičnih centimetara plina. Rosemay je isporučila plin za spektroskopsko doziranje. Osvojiti probijanje yaskravu zhovtu liniyu, i dalje idem na liniju natrija i u isti čas je vidim iza svoje pozicije na spektru. Rozmay knjigu zgrade, zatim uzmi spektroskop, očisti ga i, s novim saznanjima, otkrij novu liniju, koja se nije riješila linije. Rosemay je bacila pogled na spektar svih elemenata. Nareshty pobijediti pogađajući zagonetku linije u spektru pospane krune.
 |
Godine 1868. počeo je sat pospanog mraka, francuski propovjednik Zhansen i engleski Lok'or vyavili su na spektru pospanih izbočina yaskravu zhovtu liniyu, koji se nisu pojavili u zemaljskom spektru dzherel svjetlosti. Godine 1871. pojavio se Lok'ar visloviv, koji nije odgovarao cijelom spektru neobičnih govora na Zemlji.
Vin naziva hipotetički element helijem, tobto "pospanim". Pivo na zemlji nije bujalo. Fiziku i kemiju nisam uhvatio: na Sontsi, seli se, zove nas, ide voda za helij.
Što je to što je helij u vašim rukama? Rosemay je možda najbolji tekstopisac u zajednici, čak i ako se osjećate kao da je to potvrdio Crookesov kućni spektroskopist. Rose bi mogla dobiti plin sljedeći dan i pisati o onima koji poznaju novi plin, njihova imena su kripton, orah znači "prikhovaniye". Crooksov telegram je rekao: "Crypton ê heliy."
2.3 Kripton.
 |
Do 1895. stijena se proizvodila s dva unutarnja plina. Bilo je jasno da između njih postoji jedan plin, snaga onoga što je Rosemay opisala iza Mendelevove zadnjice. Lecoq de Boisbaudran, nakon što je prešao u navi neometanog plina - 20.0945.
Nehotice, nakon što smo vidjeli vijesti o najnovijim vijestima, zadnjih sat vremena Linde u Genmaniji i Hempson u Engleskoj nisu preko noći uzeli patent za automobil, ali ga nismo dobili.
Tsya car nemovbi Bula posebno je dizajniran za detekciju unutarnjih plinova. Načelo í̈í̈ í̈ díí̈ učenja na nekoj vrsti fizičke manifestacije, kao da je stisnuto, onda brzo raste, hladno je. Rashladit ćemo se noću, ohladit ćemo novi dio dana, doći do auta itd.
Viparuvavshih sav dušik i poljubac, Rosemay rídke povítrya, scho prelila, držeći plinomjer. Ako ste mislili upoznati helij na nekom novom mjestu, zapitali ste se, kako bi plin ispario više, manje kiseline i dušika. Nakon pročišćavanja plina s plinomjera iz kuće, kiselimo dušik i poznajući spektar, koji do sada nije vidio niti jednu liniju.
Dali Rosemay je potrošio 15 litara argona na bocu koju je napravio mali "uradi sam". Da bi upoznao unutarnji plin, iza krunice, svjetlosti, nižeg argona i kriptona, Razmay je pokupio prvu luku isparavanja argona. Vyyshov novi spektar svijetlih linija. Rosemay je viziju plina nazvao neonom, što na orahu znači "noviy".
Dali Rosemay je potrošio 15 litara argona na bocu koju je napravio mali "uradi sam". Da bi upoznao unutarnji plin, iza krunice, svjetlosti, nižeg argona i kriptona, Razmay je pokupio prvu luku isparavanja argona. Vyyshov novi spektar svijetlih linija. Rosemay je novi plin nazvao neon, što na orahu znači "novo".
2.5 ksenon.
Godine 1888., pomichnik razmaya Travers, nakon što je ostao u automobilu, dao je temperaturu od -253 0 C. Bulo je prepoznao sve plinove, osim kriptona. Ksenon ("vanzemaljac") je već bio poznat u nerafiniranom kriptonu. Kako bismo obrezali 300 kubičnih centimetara ksenona, uspjeli smo probiti 77,5 milijuna litara atmosferske energije u 2 godine.
Također kaže da je helij prisutan u mineralima urana. Više je u stvrdnjavanju urana, više u gelu. Rosemay nije znala kako znati vezu između opakog urana i helija, koji nije dopirao do njega. Odgovor je stigao sa strane; Vona Bula s indikacijama radioaktivnosti.
Viyavili, koji je govor sličan plinu, naziva se emanacija. 1 gram radija dnevno za jedan kubni milimetar emanacije. Godine 1903. Rozmay i Vidomy Fizik Soddi preuzeli su posao emanacije. Smrad njihovog naređenog oduzimanja 50 miligrama bromid radija; jedan sat miris trohe više od 0,1 kubični milimetar emanacije.
Za posjetitelja, Robit Rosemay stvorio je simpatični vagi, koji pokazuje nekoliko milijuna komada grama. Nevzí prelídniki z'yasuvali, emanacija ê ostaju predstavnik obitelji unutarnjih plinova.
Nisam ulazio u spektar emanacije. Yakos, nakon što je nekoliko dana zasjenio cijev, stavio je smrad u spektroskop;
Cijela činjenica koja potvrđuje Rutherfordovo i Soddyjevo odobrenje odnosi se na one koji nisu radioaktivno rekonfigurirani povezani s rekonfiguracijom atoma. Radio, umiranje, pretvaranje u emanaciju i gledanje jezgre atoma s helijem. Jedan element se pretvara u jedan.
Vcheny je postao žar, zašto se helij pojavljuje u uranovim materijalima; jedan od proizvoda u padu urana. 1923. godine, prema odlukama Međunarodnog kemijskog odbora, emanacija bule je preimenovana u radon.
III Snaga unutarnjih plinova i spoluka.
3.1 Fizička snaga unutarnjih plinova.
Shlyakhetní plinovi - jalovi jednoatomni plin bez boje i mirisa.
Inertni plinovi mogu imati veću električnu vodljivost u slučaju nekih plinova; kada mlaz prođe kroz njih, mlaz će jako zasvijetliti: gel je jako živo svjetlo, koje je nekako povezano s jednostavnim spektrom. neon u vatri je naziv crva sa svjetlom, fragmenti najljepše linije leže u srcu spektra.
Na upaljeni karakter atomskih molekula unutarnjih plinova ukazuje činjenica da je unutarnji plin najniža točka rasta i smrzavanja, a najniža je plin sa samim molekularnim tijelom. Argon je najlakši u skupini važnih energetskih plinova. Vín važan za okret u 1,38 puta. Ridina raste na -185,9°C, tvrđe na -189,4°C (u normalnom drenažu).
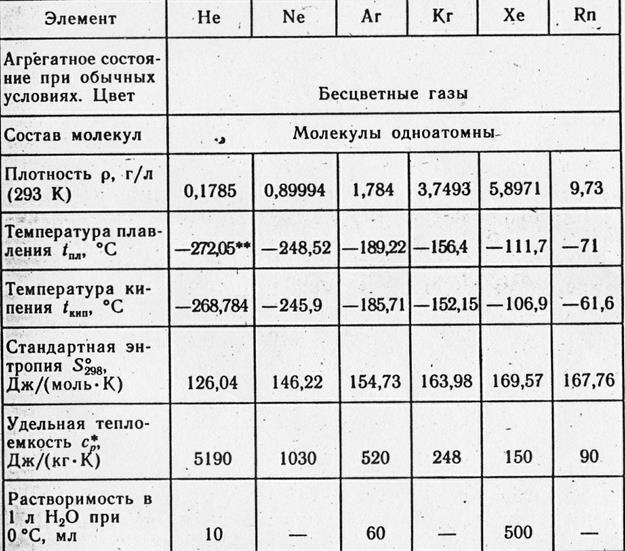
U obliku helija i neona, dobro se adsorbira na površinama čvrstih čestica i raspada u blizini vode (3,29 cm 3 u 100 g vode na 20 °C). Još je ljepše pronaći argon u bagatokh organskim ridinama. To je praktički nerazumno za metale, a ne za njihovu difuziju.
3.2 Kemijska svojstva unutarnjih plinova.
Dugo vremena nije bilo umova za koje bi plemeniti pogledi mogli ući u kemiju. Smrad se nije pravio poštenim drskim spolucima. Drugim riječima, njihova valencija je nula. U trenutku proizvodnje nova skupina kemijskih elemenata je ažurirana na nulu. Minimalna kemijska aktivnost plemićkih novina objašnjava se oštrom osmoelektronskom konfiguracijom zvoneće elektronske kuglice. Polarizacija atoma u rastu zbog povećanja broja elektronskih kuglica. Otzhe, nećete moći provesti sat vremena prelazeći s helija na radon. U isto vrijeme dolazi do velikih promjena i reakcija u izgradnji džentrija.

Tako je već 1924. godine počela teći ideja da su neki važni energetski plinovi (izrasli, fluorid i ksenon klorid) termodinamički stabilni i da bi ih mogli potaknuti zli umovi. Devet puta kasnije, ideju su usvojili i razvili teoretičari - Pauling i Oddo. Uvođenje elektroničke strukture školjki u kripton i ksenon s pozicija kvantne mehanike dovelo je do ideje da se plinovi mogu napraviti s fluorom. Znalo se i eksperimentatori, kako su pokušavali preispitati hipotezu, ali još sat vremena, bili su do posljednjeg, a ksenon fluorid nije korišten. Kao rezultat toga, svi roboti u cijelom galuzziju su prikovani, a misao o apsolutnoj inerciji gentry plinova je rezidualno potvrđena.
Međutim, 1961. rotsi Bartlett, istraživač jednog od kanadskih sveučilišta, u snazi heksafluorida platine, s polovicom aktivnog, nižeg samog fluora, ugradio je potencijal ionizacije u ksenon niži (12 in. Određivanje vremena na sat, postavljanje s platinastim heksafluoridom s dna trgovine O 2 PtF 6 ... Kada se zagrije u vakuumu, XePtF 6 treperi bez rasklapanja, u vodi hidratizira, vidljiv je ksenon:
2XePtF 6 + 6H 2 O = 2Xe + O 2 + 2PtO 2 + 12HF
Bartlettovim ofenzivnim robotima je ostavljeno da stoje, da se ksenon taloži iz umova reakcije na dvije polovice s platinastim heksafluoridom: XePtF 6 i Xe (PtF 6) 2; u slučaju hidrolize uključen je jedan od najukusnijih proizvoda. Nakon što je prešao, tada je ksenon učinkovito ušao u reakciju s platinastim heksafluoridom, Bartlett je, nakon što je podnio dodatno izvješće 1962., objavio članak u časopisu "Proceedings of the Chemical Society" koji je pripisao njegovom zdrobljenom kriteriju. Statut je izazivao veličanstven interes, ako se u njega uložilo puno kemije s neprihvatljivom nevjericom. Više od tri godine Bartlettov pokus ponavljala je skupina američkih preliminara na chol z Chernik u Argonne National Laboratory. Osim toga, Smrad je bio prvi koji je sintetizirao analogne spolude ksenona s heksafluoridima rutenijem, rodijem i plutonijem. Dakle, meci pokazuju prvih pet do pet s ksenonom: XePtF 6, Xe (PtF 6) 2, XeRuF 6, XeRhF 6, XePuF 6 - mit o apsolutnoj tromosti plinova gentry u razvoju novih vremena.
Zbroj plina (1 dio ksenona i 5 dijelova fluora) stavljen je u posudu od nikla (nikel vrlo postojan na fluor) i zagrijavan je s prilično malim škripcem. Godinu dana kasnije, posuda je brzo ohlađena, a plin koji se izlio u novi je upumpan i analiziran. Taj buv fluor. Sav xenon je reagirao! Razbili su posudu i vavili na novi kristal XeF 4. Ksenon tetrafluorid se pojavio u jednom komadu, a molekula je oblikovana kao kvadrat s ionima fluora duž rezova i s ksenonom u sredini. Xenon fluor tetrafluorid živa:
XeF 4 + 2Hg = Xe + 2HgF 2
Platina se može fluorirati po cijeni, ali možemo je usporediti samo s fluorom u vodi.
Moguće je ukloniti ne samo XeF 4, već samo fluorid-XeF 2 XeF 6.
Radianske kemičari V.M. Khutoretskiy i V.A. Za njihovo proponiranje metodom, zbroj ksenona i fluora (u molekularnom omjeru 1:1) se dovodi u posudu iz nikla od nehrđajućeg čelika, a kada se pritisak povisi do 35 atm, popravlja se mimička reakcija.
XeF 2 - pojedinačni ksenon fluorid, koji se može obrezati bez korištenja elementarnog fluora. Win se uspostavlja električnim pražnjenjem ksenona i tetrafluorida u ugljiku. Željna, glasna i izravna sinteza. Čak se i najčišći XeF 2 gasi, kao što je zbroj ksenona i fluora preplavljen ultraljubičastim zračenjem. Otpornost na difluorid u vodi je niska, a otpornost na njega je najjače oksidacijsko sredstvo. Vjerojatno vín samorozladaêtsya na ksenon, kisen i fluoridnu vodu; osobito brzo šireći se negdje blizu središta lokve. Difluorid ima jak specifičan miris. Veliki teorijski interes za metodu za sintezu ksenon difluorida, punjenje za ubrizgavanje ultraljubičastog viprominuvannya na zbroj plinova (za količinu od oko 2500-3500 A). Viprominuvannya wiklicaê cijepanje molekula fluora u vilny atome. U slučaju poliagaêa, razlog za potvrđivanje difluorida je taj što je atomski fluor supra-visoko aktivan. Za uklanjanje XeF 6, potrebne vrijednosti su: 700 ° S í 200 atm. U takvim umovima ksenona i fluora (od 1:4 do 1:20), praktički se sav ksenon pretvara u XeF 6. Ksenon heksafluorid je površinski aktivan i nabora se s vibukom. Vino može lako reagirati s fluoridima stranih metala (crim LiF):
XeF 6 + RbF = RbXeF 7,
ale na 50 °C, syl će se saviti:
2RbXeF 7 = XeF 6 + Rb 2 XeF 8
Također je došlo do sinteze prehrambenog lihen fluorida XeF 8 na temperaturama ispod minus 196 °C.
Sinteza prvih spoluka ksenona stavljanjem pred kemičare hrane o unutarnjim plinovima u periodnim sustavima. Ispred plemenitih plinova vidjeli smo u blizini nulte skupine, ali je cijela najava bila o njezinoj valentnosti. Ako je ksenon ušao u kemijsku reakciju, ako je postao vrsta fluorida, valencija ksenona je do osam (i pritom je potrebno koristiti energiju elektroničke ljuske), dodaju se inertni plinovi do VIII faze. Nullova grupa je prestala postojati.
Zmushiti ksenon stupiti u reakciju bez sudjelovanja fluora (neki od njih spoluch) bez dospijeća igdje. Bez napora eliminirajte fluoride iz ksenona. Govor može dovesti do reakcije zgrade. Naykrasche vivcheno izmjena fluorida ksenona s vodom. Hidroliza XeF 4 u kiselom mediju dok se ne odobri ksenonski oksid XeO 3 - kristali bez šipki, koji se mogu dozirati za upotrebu. Molekula XeO 3 ima strukturu prskajuće trokutaste piramide s atomom ksenona na vrhu. Tse z'êdnannya vkray nestiyke; kada se sila vibucha raširi, to je blizu nagonu vibucha od TNT-a. Nekoliko stotina miligrama XeO 3 razbijeno je u lijesove. Ne viklyucheno, za sat vremena, ksenon trioksid će biti pobjednički, jak vibukhovu govor diii, scho drobljenje. Takva vibučivka metka bila bi više ručna, tako da su svi proizvodi vibučivske reakcije plinovi. Za meti trioksid ksenon je još skuplje pobjeći od njega - još je jeftinije za ksenon u atmosferi, manje zlata u morskoj vodi i teško ga je vidjeti. Nagadaêmo, za uklanjanje 1 m3 ksenona bit će potrebno reciklirati 11 milijuna m3 praha. Nestabilna kiselina heksavalentnog ksenona H 6 XeO 6 slična je trioksidu, a nastaje kao rezultat hidrolize XeF 6 pri 0°
XeF 6 + 6H 2 O = 6HF + H 6 XeO 6
Čak i prije produkta lanca reakcija, shvidko dodati (OH) 2, vipadaê amorfni sediment Ba 3 XeO 6. Na 125 °C vino se taloži na oksid, ksenon i kisik. Otrimano analogne soli-ksenonat natrij i kalcij. Kada ozon dosegne raspon XeO 3 u 1 molarnom natrijevom hidroksidu, uspostavlja se koncentracija kisele kiseline i ksenona Na 4 XeO 6. Natrijev perksenonat se može vidjeti u obliku kristalnog hidrata Na4XeO6 · 6H 2 O. Prije nego što perksenonati budu odobreni, potaknite hidrolizu XeF 6 u natrijevim hidroksidima i kalorijama. Kao i čvrsti Na 4 XeO 6, može se čistiti olovnim nitratom, pomiješanim s uranom, te uključuje sljedeće vrste perksenonata: PbXeO 6 í (UO 2) 2XeO 6 u istoj boji i Ag 4 XeO 6 - crni. Analogne soli daju kalcij, litij, cezij, kalcij.
Oksid, koji pretvara kiselu kiselinu u ksenon, destilira se u obliku Na 4 XeO 6 s ohlađenom bezvodnom sirhanskom kiselinom. Tse chotirikis xenon XeO 4. U níy, yak í u oktafluoridu, valencija ksenona je jednaka osam. Čvrsti chotirikis na temperaturi od 0 ° C razlaže se na ksenon i muslin, a plinolik (na sobnoj temperaturi) - na ksenon trioksid, ksenon i mussen. Molekula XeO 4 ima oblik tetraedra s atomom ksenona u središtu. Postoje dva načina za prolazak kroz drenažu ksenon heksafluorida; u jedan vipad za unos tetraoksifluorida XeOF 4 ínshomu - deoksifluorida XeO 2 F 2. Izravna sinteza elemenata za proizvodnju oksifluorida XeOF 2 do odobrenja. Svi neprocjenjivi čvrsti govori, stigma zlih umova.
Duzhe Tsikava je nedavno dobio reakciju ksenon difluorida s bezvodnim NS1O 4. Kao rezultat niza reakcija, usvaja se nova vrsta ksenona XeClO 4 - super-čvrsto oksidacijsko sredstvo, koje je najmoćnije od svih perklorata.
Sintetizira se i s polovicom ksenona, koji se ne osvećuje kiselom. Još važnije, podsoli, produkti interakcije fluorida u ksenonu s fluoridima surmija, mish'yaka, bora, tantala: XeF 2 SbF 5, XeF 6 AsF 3, XeF 6 BF 3 i XeF 2 2TaF 5. Ja nareshty, zbunjeni govor tipa XeSbF 6, stil za sobnu temperaturu, i XeSiF 6 - nestabilan kompleks.
Kod naručenih kemičara ê dodaju neznatne količine radona, stoje daleko u daljinu, pa je to i zbog fluorida, koji fluor čini nehlapljivim. Za kripton i vivčeni difluorid KrF2 i tetrafluorid KrF 4 za snagu, koji se može naći s polovicom ksenona.
3.3 Odbacivanje argona.
Zemljina atmosfera treba osvetiti 66 · 1013 tona argona. Argon nije bio važan, praktički je sav argon dovoljno ran da se pretvori u atmosferu, a kad pobijedi, nije umišljen ni na kakve fizikalne ili kemijske promjene. Vinjat postaje još beznačajnije količine izotopa u argonu, tako da se ispostavlja da je odbačen u nuklearnim reakcijama novih elemenata i izotopa. Uklonite argon kao nusproizvod kada se alkohol doda kisiku i dušiku. Zvvychay vikoristovuyt pertrozdiluvalny aparati dvorazovy rectifikatsii, koji se pohranjuje iz donje kolonije visokog viska (prednji podil), gornje kolonije. niski škripac ono srednjeg kondenzatora-viparnika. Kinets kinets dušik se uvodi s vrha, a kissen - iz prostora iznad kondenzatora. Hlapljivost argona je veća, manje kiselo, manje nego manje, manje dušika. Ova frakcija argona uzima se u točki, koja se nalazi otprilike na trećoj visini gornje kolonije, i dovodi se u poseban stupac. Skladište za frakciju argona: 10 ... 12% argona, do 0,5% dušika, rasht - kissen. U koloniji "argon", dovedenoj u glavni aparat, operite argon s kućom 3 ... 10% kiselog i 3 ... 5% dušika. Daljnje pročišćavanje "bijelog" argona ide do kiseline (kemijski način ili adsorpcija) i do dušika (rektificiranog). Na industrijskoj vagi, argon se može isprati do 99,99% čistoće. Argon se također baca s ulaza amicus vyrobnitstva - iz dušika, ali je zbog toga izgubljen, jer se većina zvala voda. Argon se koristi za transport u bocama od 40 litara, koji su zbog zelenog smoga i zelenog natpisa osvijetljeni sivim bojama. Njihov porok je 150 atm. Ekonomičnije je transportirati plin argon, prije svega Dewarovu posudu i posebne spremnike. Jednodijelni radioizotopi argona eliminiraju se u slučaju detekcije određenih stabilnih i radioaktivnih izotopa (37 Cl, 36 Ar, 40 Ar, 40 Ca) protonima i deuteronima, kao i u slučaju neutrona potpomognutih proizvodi koji su proizvedeni u nuklearnim reaktorima. Izotopi 37 Ar i 41 Ar mogu se detektirati kao radioaktivni indikatori: prvi - u medicini i farmakologiji, drugi - u slučaju već postojećih tokova plinova, učinkovitosti ventilacije i inteligentne znanosti. Ale, lukavo, ne sisati argon na vodi.
3.4 Fiziološka aktivnost unutarnjih plinova.
Naravno, bilo je ochikuvati, to je bio tako kemijski inertan govor, poput inertnog plina, ne kriv za piće i živi organizmi. Ale tse nije tako. Inspiracija plinova višnje energije (često je za sumy s kiselim) da dovede osobu u kamp, dopunjena alkoholom. Narkotički učinak unutarnjih plinova akumulira se u području živčanih tkiva. Chim vishche atomska energija inertna na plin, tim sve više i više i više i više i više i više i narkotičnije.
Sada o injekciji argona na živi organizam. Udisanjem suma od 69% Ar, 11% dušika i 20% kiselosti pod hvatom od 4 atm dolazi do anestezije, jer povećanje postaje sve jače, manje pri udisanju, pod hvatom hvata. Anestezija je mittêvo uzrokovana potiskivanjem argona. Razlog je nepolarnost molekula argona, pritisak argona u živčanim tkivima. Biolozi viyavili, da argon s rastom roselina. Za navigaciju u atmosferi čistog argona, riže, kukuruza, ogirkiva i zhyta opakih para. Cibulja, mrkva i salata dobro rastu u atmosferi, koja se može pohraniti u 98% argona ili manje od 2% kiselog.
IV Stagnacija unutarnjih plinova.
Geliy je važan džerel niskih temperatura. Na temperaturi rijetkog helija, toplinska degradacija atoma i električnih elektrona u čvrstim tijelima praktički je isključena, što omogućuje razvoj mnogih novih manifestacija, na primjer, prekomjerne providnosti u čvrstom mlinu.
Helij sličan plinu vikoristovuyat jak lagani plin sličan suhim vrećama. Oskilki vin je nezapaljiv, može se dodati u ljusku zračnog broda.


Dakle, kako je helij bolji u krvi, manje dušika, velika količina helija stagnira u opakim sumama za rad u zahvatu, na primjer, s morskim rupama, s otvorenim podvodnim tunelima i s opremom. U slučaju dekompresije vikoristannyh helija (vid ispuštenog plina iz krvi) ronilac ima mnogo boli, postoji manje teška bolest, kao što je anestezija dušikom trajna i nesigurna opskrba vodom. Niska viskoznost za osobe koje pate od napada astme i u slučaju rastuće bolesti bolesnih osoba.
Helijev vikoristovuyak kao unutarnja sredina za zagrijavanje luka, posebno magnezija i te legure, kada se eliminiraju Si, Ge, Ti i Zr, za hlađenje nuklearnih reaktora.
Ostalo skladištenje helija - za žvakanje ležajeva plinom, za detektore neutrona (helij-3), plinske termometre, rendgensku spektroskopiju, za osiguranje energije, za visokoenergetske pumpe. Na vrhu s ostalim plemenitim plinovima, helij je opak na posljednjim neonskim reklamama (kod cijevi za plinsko pražnjenje). Ridky helij je izvrstan za hlađenje magnetnih štitnika iznad glave, prianjanja na čestice i pomoćne zgrade. Neuključeno usisavanje helija kao rashladnog sredstva je proces neprekidne potrošnje 3 He i 4 He za postavljanje i snižavanje temperatura nižih od 0,005 K
Područja za skladištenje ksenona nisu prikladna sat vremena. Lyudina vikoristovu i íí̈ ííí̈ ííí̈ íí̈ íí̈ íí̈ je čudo í̈ ítnítnístnít riješiti reakciju s fluorom. Na svitlotekhnítsí zíznannya zdobul ksenonske svjetiljke vysokogo vise. Takve svjetiljke imaju lučno pražnjenje na ksenonu, ali u zahvatu na nekoliko desetaka atmosfera. Svjetlo u ksenonskim žaruljama pojavljuje se odmah nakon uključivanja, ali spektar je jasan i neprekidan - od ultraljubičastog do bliskog infracrvenog područja. Xenon creep í liječnici - s fluoroskopskim stanjima mozga. Jak i barit kaša, koja stagnira s crijevnim prosvjetljenjem, ksenon je snažno prianja uz X-zrake viprominuvannya i dodatnu pomoć da znaju bijedu. Istodobno, on apsolutno nije sramežljiv. Aktivni izotop elementa br. 54, ksenon - 133, vikoristovuyut u naprednoj funkcionalnoj učinkovitosti nogu i srca.
Kada se argon puše kroz čelik, može vidjeti uključene plinove. Smanjit ću snagu metala.
Sve više i više zastosovutsya lučno električno grijanje u sredini argona. U mlazu argona možete osvijetliti suptilnosti virobija i metala, koje su prije bile važne. Neće biti previše reći da je električni luk u atmosferi argona revolucionirao metalnu tehnologiju. Proces se brzo ubrzao, postojala je mogućnost rezanja limova vatrostalnih metala. Argonski luk se puše kroz argon (u slučaju vode), rubovi su omotani i volframove elektrode su izrađene od oksidnih, nitridnih i drugih kuglica. Jedan sat obrišem hvat i koncentriram luk na malu površinu, kroz temperaturu u zoni rasta koja doseže 4000-6000 ° C. Kada se izgori u mlazu argona, ne troši se u fluksovima i elektrodama, kao ni u čišćenju šava od troske i viška toka.
Neon i argon vikorizovyutsya poput neonskih svjetiljki i dnevnih svjetiljki s kriptonom kako bi podsjetili posebne svjetiljke uz pomoć promjene isparavanja i poboljšanja kvalitete volframove niti. Ksenon podsjeća kvarcne svjetiljke na visoki škripac, s najpotrebnijim džerelima svjetla. Helij i argon se mogu koristiti za plinske lasere.

Popis literature Victory
1. Petrov M.M., Mikhilyov L.A., Kukushkin Yu.M. "anorganska kemija"
2. Guzey L.S. Predavanja iz gotove kemije"
3. Ahmetov NS "Žagalna i neorganska kemija"
4. Nekrasov B.V. "Pidruchnik zagalnoy chemistry"
5. Glinka N.L. „Zagalna kemija
6. Khodakov Yu.V. "Žagalna i neorganska kemija"
Vidkrittya:
U 1893. str. uzavrelo poštovanje za raspodjelu dušika iz prehrane i dušika, posjedovanog tijekom distribucije dušika spoluksa: litra dušika iz svakog razloga važna je 1,257 g, a ona izvađena kemičarskim putem - 1,251 r. Zbog tajanstvenog namještaja, pokazalo se da se, s obzirom na svu kiselost dušika, troši mali višak (blizu 1%), koji nije kemijski reagirao.
Pojava novog elementa, nazvanog argon (orah - nondialny), predstavljena takvim redoslijedom "čistoća trećeg decimalnog mjesta". Molekulska težina argona je 39,9 g/mol.
Inertni plin, koji dolazi sat kasnije, - helij ("pospani"), viđen je na Sontsi ranije, ispod Zemlje. Metoda spektralne analize, koja je razbijena 50-ih godina prošlog stoljeća, postala je moguća.
Kroz malu kamenu poruku argonu i heliju (rođen 1898.), vidjela su se još tri unutarnja plina: neon ("noviy"), kripton ("prikhovaniye") i ksenon ("vanzemaljac"). Naskílka važno, može se vidjeti da, oko 1 m 3 sumraka, oko 9,3 litara argona treba zamijeniti s 18 ml neona, 5 ml helija, 1 ml kriptona i 0,09 ml ksenona.
Preostali unutarnji plin - radon bulo vidkrito 1900 r. schodo deyakim minerali Promjena iz atmosfere u deprivaciju od 6-10 -18% po volumenu (što se odnosi na 1-2 atoma u kubičnom centimetru). Bulo pídrahovano, tako da se cijela zemaljska atmosfera osveti na lišavanju 374 godine radona.
Fizička tijela:
Svi plinovi bez energije pohranjeni su u monoatomskim molekulama. Podil inertnih plinova runtutsya na mišljenja í̈kh fizičkih vlasti.
Inertni plinovi bez barijera nemaju miris. Neka mala količina smrada bude prisutna u svakom obroku. Inertni plinovi se ne prekidaju. Međutim, atmosfera s povećanom koncentracijom energetskih plinova i rezultirajućim smanjenjem koncentracije kiseline može vršiti pritisak na ljude, sve do gubitka dokaza i smrti. Na tragu pada ljudi nakon sata okreta u argonu.
|
Temperatura topljenja, °C |
||||||
|
Temperatura bale, °C |
Količina topline, potrebna za prijenos govora iz čvrstog mlina u ležištu, je toplina taljenja, a za prijenos iz tvrdog mlina u paroliki - toplina isparavanja. Uvreda na veličinu, neka se nosi prije prijelaza, pa da se radi u normalnom zahvatu. Za unutarnje plinove, smrad može biti sljedeći (kcal / g-atom):
|
Toplina taljenja |
||||||
|
Toplina viparovannya |
Dno sobe kritična temperatura
Inertni plinovi i poroci, koji su potrebni i dovoljni za prijenos na istim temperaturama iz plinastog mlina u mali, - kritični škripac:
|
Temperatura je kritična, ° C |
||||||
|
Kritično prianjanje, atm |
Dodatnom kinetičkom teorijom narušena je ishrana atomičnosti molekule argona. Zapravo, količina topline, koja je potrebna da bi vitratnost zagrijala gram-molekulu u plin za jedan stupanj, da taloži neke od atoma u toj molekuli. U slučaju kontinuirane izmjene, gram-molekula monoatomskog plina vimagan 3 izmet, dijatomski - 5 kal. Za argon, davanje 3 izmet, utjecao je na monoatomnost njegove molekule. Oni se također nazivaju najvećim unutarnjim plinovima.
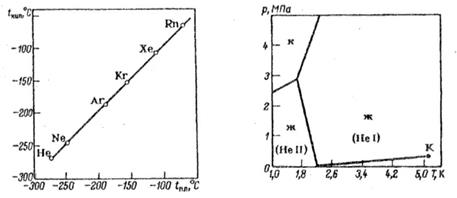
Gelíy buv ostaním íf plin prijevodi u rídky taj čvrsti stan. Kao rezultat ekspanzije na normalnim temperaturama, helij se ne hladi, nego se zagrijava. Ako je niže od -250°C, u redu je početi. Zvuči kao iskustvo vapinga, tako da će ekstravagantni proces oporavka stagnirati dok ne postane previše hladno. S druge strane, temperatura je kritična, helij bi trebao ležati nisko na rubu. Snaga cirkulirajućih uvjeta je prijateljska, rezultati kada se roboti s gelom maltretiraju uklanjaju se iz procesa korištenja metode rada s toplom vodom, koriziranja viparom, koji se može koristiti samo za hlađenje gela na potrebne temperature. Otrimaty rídky gelíy krenuo je naprijed 1908., čvrsti helij-y1926. str.
Veseli autoriteti:
Inertne plinove karakterizira veća (He, Ne, Ar) ili veća frekvencija (Kr, Xe, Rn) u količini kemijske aktivnosti. U periodnom sustavu smradovi čine posebnu skupinu (VIII). Nenametljivu proizvodnju plinova na otvorenom odobrili su u periodičnom sustavu nova grupa Bula se naziva nula, a valencija ovih elemenata je nula, tako da imaju kemijski aktivnu aktivnost. Takav naziv često stagnira u danom satu, protestirajte, prema periodičnom zakonu, ispravnije je poštivati skupinu unutarnjih plinova do osme, neki od elemenata se ne popravljaju, već završavaju.
Vidljivost važnih inertnih plinova s većom kemijskom inercijom bila je lišena 1962. str. Činilo se da je smrad nastao najaktivnijim metalom - fluorom (ako ga nemate). Ksenon (i radon) lako reagiraju, važniji je kripton. Otrimano XeF 2, XeF 4, XeF 6 i niskoenergetski KrF 2. Smrad smrada je pusta curenja kristalnog govora.
Ksenon difluorid(XeF 2) -Ustanovljava se danom dnevnog svjetla Xe i F 2 na br. Postoji karakterističan zamoran miris. Za odobrenje molekule, atom ksenona treba biti napunjen od 5s 2 5p 6 do najbližeg bivalentnog stanja 5s 2 5p 5s 1 - 803 kJ / mol, do 5s 2 5p 5 6p 1 -924 kJ / mol, 25s 2 5p 1 6 ml.
Xe + F 2 → XeF 2
Koncentracija vode je 0,15 mol / l. Roschin je još jače oksidirajući. Rozchin da izloži shemu:
XeF 2 + H 2 O → HF + Xe + O 2
Ksenontetrafluorid Da se potvrdi jednostavnim riječima, reakcija je jako egzotermna, najbolja je od svih fluorida.
XeF 4 + 2Hg = 2HgF 2 + Xe
XeF 4 + Pt = PtF 4 + Xe
Yakisna reakcija na ksenon tetrafluorid :
XeF 4 + 4KI = 4KF + 2I 2 ↓ + Xe
Ksenon tetrafluorid je presavijen iza shema:
3Xe 4+ → Xe 6+ + 2Xe 0 (u kiseloj sredini).
Xe 4+ → Xe 0 + Xe 8+
Bez ksenoneksafluorida, vidomy u tri kristalne modifikacije. Na 49 ℃ pretvara se u zhovtu rídina, kada se stvrdne, više neće smetati. Pari Mayut Blido-Zhovte Zabarvlennya. Rasklopiti iz vibucha. Od početka razgovora slijedi:
XeF 6 + H 2 O → 2HF + OXeF 4
OXeF 4 bez barvne ridine, manje reakcionarna zgrada, niži XeF 6
Daljnjom hidrolizom možete ukloniti ksenon trioksid:
XeF 6 + 3H 2 O → XeO 3 + 6HF
XeO 3 je vibuchovina bez šipka, tako da se može dozirati na svakom koraku. Da otpadne s vibuchom, aleom s urednim zagrijavanjem na 40 stupnjeva Celzijusa, događa se reakcija:
2XeO 3 → 2Xe + 3O 2
Ê kiselina, koja je formalno slična danom oksidu-H 2 XeO 4.
3XeF 4 + 6Ca (OH) 2 → 6CaF 2 ↓ + Xe + 2H 2 XeO 6
Na jakoj mjesečini Xe 6+ dismuth:
4Xe 6+ → Xe 0 + 3Xe 8+
Difluorid u kripton- letki bezbarvní kristali govor je kemijski aktivan. Na promjenjivim temperaturama, lezite fluori kripton ... Buv po prvi put otrimaniyu električno pražnjenje za sumish govor, na -188℃:
F 2 + Kr → KrF 2
Položite vodom iza sheme:
2KrF 2 + 2H 2 O → O 2 + 4HF + 2Kr
Stagnacija unutarnjih plinova:
Inertni plinovi znaju za profitabilnije poslovanje je praktičniji. Ujutro je uloga helija vrlo važna kada se eliminiraju niske temperature, budući da je rijetki helij vrlo hladan. Nedostatak plina zbog rasta hvata je znatno smanjen, da je na početku vode, koja tone u blizini vode i koju osiguravaju ekstravagantni monitori, sklonište za dušik veće, niže u normalnim umovima. Trenutačno, ako stisak padne, dušik se raspada, a kada se uoče žarulje, često začepljuju druge krvne žile, narušavaju normalnu cirkulaciju i napadaju "bolest". Redatelji koji s tegobama zamjenjuju dušikov gel brzo će oslabiti količinu manje helija u krvi, što je posebno prepoznatljivo po sve većem hvatištu. Robot u atmosferi "gel" twist omogućuje roniocima da se spuste na veliki glibini (preko 100 m), što znači podovzhuvati pojam perebuvannya pod vodom.
Dakle, kako je vještina takvog pića otprilike tri čovjeka, vještina ekstravagantnog, dihotomnog nagata je lakša. Tsim je informiran o velikom medicinskom značaju napitka helija u slučaju liječenja astme, gušenje je premalo, ako odvojite kratko vrijeme da olakšate bolesnu osobu, možete se riješiti života. Slično heliju, "xenon" povitra (80% ksenon, 20% kiselo), kada se udiše, to je jaka opojna droga, tako da možete znati lijek.
Neon i argon se široko koriste u elektrotehnici. Kad je prošao električni strumu kryz zapovneni s plinovima cigare bljeskali su plinske cijevi da počnu svijetliti, da se zaglave za registraciju svjetlosnih slova.
Potrebne neonske cijevi ovog tipa posebno su prikladne za svjetionike i signalne anekse, tako da svjetlost nije mnogo zaklonjena maglom. Količina laganog helija u svijetu mijenja svoj zahvat u luli, mijenjajući se iz usta kroz usta u zelenu. Ar, Kr i Xe karakteriziraju različite vrste blakitne boje.
Argon (dodati dušik iz zbroja od 14%) također se može koristiti za pohranu električnih svjetiljki. Istovremeno, znatno nižu toplinsku vodljivost ljepše je koristiti za cijelu obitelj kriptona i ksenona: električne svjetiljke koje se isporučuju s njima daju više svjetla, dok je energija vitalnija, ljepše je pogledati instalaciju i na najpouzdaniji način.
Urednik: Kharlamova Galina Mikolaivna