Reacții de substituție, adăugare și separare a liganzilor în care se modifică sfera de coordonare a metalului.
Reacțiile de substituție au o gamă largă de semnificații și presupun înlocuirea unor liganzi din sfera de coordonare a metalului cu alții.
Mecanism disociativ (D). Procesul în două etape la faza limită se desfășoară printr-un intermediar cu un număr de coordonare mai mic:
ML6<->+ L; + Y --» ML5Y
Mecanism asociativ (A). Un proces în două etape caracterizat prin crearea unui intermediar cu un număr mare de coordonare: ML6 + Y = ; =ML5Y+L
Mecanismul schimbului reciproc (I). Acest mecanism este urmat de un număr mare de reacții de schimb. Procesul este într-o singură etapă și este însoțit de un intermediar aprobat. La stația de tranziție, reactantul și grupul care este conectat la centrul de reacție intră în cea mai apropiată sferă de coordonare, iar în timpul reacției se formează prezența unei grupări sau alteia i, schimbul a doi liganzi:
ML6 + Y = = ML5Y+L
Mecanism intern. Acest mecanism caracterizează procesul de substituție a liganzilor la nivel molecular.
2. Caracteristici ale puterii lantanidelor (Ln), asociate cu efectul compresiei lantanidelor. Spoluki Ln 3+: oxizi, hidroxizi, săruri. Alte etape de oxidare. Aplicați compușii de valoare mare Sm 2+, Eu 2+ și compușii oxidici Ce 4+, Pr 4+.
Modificarea monotonă a razelor atomice și ionice din Rusia pentru un număr de elemente 4f a dus la denumirea de compresie a lantanidelor. eu. Se poate realiza ca razele atomilor adiacente lantanidelor elementelor de tranziție 5d ale grupelor a patra (hafniu) și a cincea (tantal) să fie practic egale cu razele analogilor lor electronici din perioada a cincea: zirconiu și niobiu. Este evident, iar chimia metalelor importante 4d- și 5d au multă rezistență. O altă constrângere f este apropierea razei ionilor de ytriu de razele elementelor f importante: disprosium, holmiu și erbiu.
Toate pământurile rare formează oxizi stabili în stadiul de oxidare +3. Mirosul este de pulberi cristaline refractare care îndepărtează complet dioxidul de carbon și vaporii de apă. Oxizii majorității elementelor sunt îndepărtați prin prăjirea hidroxizilor, carbonaților, nitraților, oxalaților în aer la o temperatură de 800-1000 °C.
Soluție de oxizi M2O3 și hidroxizi M(OH)3
Doar hidroxidul de scandiu este amfoter
Oxizii și hidroxizii se dizolvă ușor în acizi
Sc2O3 + 6HNO3 = 2Sc(NO3)3 + 3H2O
Y(OH)3 + 3HCI = YCI3 + 3H2O
Doar scandiul este hidrolizat în apă
Cl3 ⇔ Cl2 + HCl
Toate halogenurile sunt îndepărtate în etapa de oxidare +3. Usi sunt refractare.
Fluorurile se dezintegrează rău lângă apă. Y(NO3)3 + 3NaF = YF3↓+ 3NaNO3
Zagalna chimie: asistent / O. V. Zholnin; per ed. V. A. Popkova, A. V. Zholnina. – 2012. – 400 p.: ill.
Capitolul 7. COMPLEXE COMPLEXE
Capitolul 7. COMPLEXE COMPLEXE
Elementele complexante sunt organizatori de viață.
K. B. Yatsimirsky
Conexiunile complexe sunt cea mai mare și mai diversă clasă de conexiuni. Organismele vii au compuși complecși ai metalelor biogene cu proteine, aminoacizi, porfirine, acizi nucleici, carbohidrați și compuși macrociclici. Cele mai importante procese ale vieții sunt efectuate prin proceduri complexe. Unele dintre ele (hemoglobina, clorofila, hemocianina, vitamina B 12 și așa mai departe) joacă un rol semnificativ în procesele biochimice. Multe medicamente conțin complexe metalice. De exemplu, insulina (complex de zinc), vitamina 12 (complex de cobalt), platinol (complex de platină), etc.
7.1. TEORIA COORDONĂRII LUI A. WERNER
Budova conexiuni complexe
Atunci când particulele interacționează, coordonarea reciprocă a particulelor este împiedicată, ceea ce poate fi considerat un proces de complexare. De exemplu, procesul de hidratare a ionilor se va încheia cu formarea de complexe acvatice. Reacțiile de formare a complexului sunt însoțite de transferul perechilor de electroni și conduc la stabilirea formării complexe într-o manieră ridicată, despre reacții complexe (de coordonare). Particularitatea reacțiilor complexe este prezența unei legături de coordonare, care este responsabilă pentru mecanismul donor-acceptor:
Semi-semicile complexe sunt numite semi-semici, care apar atât în stare cristalină, cât și în detaliu, în special
dintre care este prezența unui atom central ascuțit de liganzi. Compușii complecși pot fi formați din molecule complexe de ordin înalt, din molecule simple construite până la dezvoltarea independentă în lume.

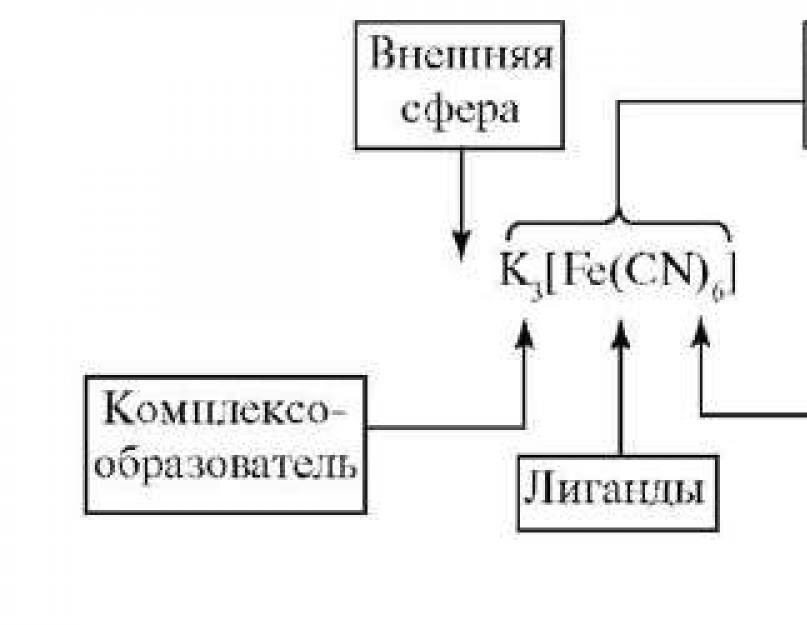
În spatele teoriei coordonării a lui Werner, înțelegerea complexă este împărțită în internі sfera externă. Atomul central cu liganzii săi înstrăinați formează sfera interioară a complexului. Ele ar trebui să fie plasate lângă arcul pătrat. Decizia este de a deveni sfera exterioară a complexului și de a scrie în spatele brațelor pătrate. Un număr mare de liganzi sunt amestecați în jurul atomului central, ceea ce este indicat număr de coordonare(Kch). Numărul de liganzi coordonați este cel mai adesea de la 6 la 4. Ligandul ocupă atomul central al locului de coordonare. În timpul coordonării, puterile atât ale liganzilor, cât și ale atomului central se modifică. Adesea, liganzii coordonați nu pot fi detectați în alte reacții chimice care sunt tipice pentru ei în sălbăticie. Părțile mai strâns legate ale sferei interioare sunt numite complex (ion complex).Între atomul central și liganzi există forțe gravitaționale (o legătură covalentă este creată printr-un mecanism de schimb sau (sau) donor-acceptor), între liganzi există forțe de formare. Deoarece sarcina sferei interne este egală cu 0, sfera de coordonare externă este egală cu 0.
Atom central (complex)- Un atom sau ion care ocupă o poziție centrală într-o conexiune complexă. Rolul complexorului este cel mai adesea de a forma particule, de a forma orbitali liberi și de a adăuga o sarcină pozitivă mare la nucleu, care poate deveni apoi acceptoare de electroni. Aceștia sunt cationi ai elementelor de tranziție. Cei mai puternici agenți de complexare sunt elementele grupelor IB și VIIIB. Rareori complexat
În niciun fel atomii neutri ai elementelor d și atomii nemetalelor nu acționează ca diferite tipuri de oxidare - . Numărul de orbitali atomici liberi care pot fi complexați înseamnă numărul său de coordonare. Valoarea numărului de coordonare depinde de mulți factori și este legată de sarcina subordonată a ionului de complexare:

Ligandi- Sunt fie molecule care sunt direct asociate cu agentul de complexare și sunt donatori de perechi de electroni. Aceste sisteme electronice, care conțin pariuri electronice gratuite și libere, pot fi donatori de electroni, de exemplu:
Semielementele dezvăluie puteri de creare a complexului și acționează ca liganzi pentru complex. Liganzii pot fi atomi și molecule (proteine, aminoacizi, acizi nucleici, carbohidrați). Datorită numărului de vâscozități care sunt stabilizate prin liganzi de complexare, liganzii sunt împărțiți în liganzi mono-, di- și polidentați. Cei mai diverși liganzi (molecule și anioni) sunt monodentați, deoarece donează o pereche de electroni. La liganzii slabi se adaugă molecule sau ioni pentru a găzdui două grupuri funcționale care sunt donatoarele a două perechi de electroni:

Liganzii polidentati pot fi suplimentati cu ligand 6-dentat al acidului etilendiaminotetraocic:

Se numește numărul de spații ocupate de ligandul pielii în sfera internă a conexiunii complexe coordonare amnistia (identitatea) ligandului. Vaughn este indicat de numărul de perechi de electroni ale ligandului, care participă la legătura de coordonare cu atomul central.
Cremă de compuși complecși, chimia de coordonare combină săruri în suspensie, hidrați de cristal care se dezintegrează în apă din depozit, care în stare solidă în multe faze devin la fel de complexe, dar nu stabile.
Cele mai stabile și diverse complexe din spatele depozitului și funcțiile pe care le conțin sunt îndeplinite de elementele d. Deosebit de importanți sunt compușii complecși ai elementelor de tranziție: salivă, mangan, titan, cobalt, cupru, zinc și molibden. S-elemente biogene (Na, K, Mg, Ca) complexe complexe cu liganzi de structură ciclică, acționând și ca agent de complexare. Parte principală R-Elementele (N, P, S, Pro) sunt partea activă activă a particulelor de complexare (liganzi), inclusiv bioliganzi. Care are semnificație biologică.
De asemenea, structura formării complexe este puterea ascunsă a elementelor chimice ale sistemului periodic, a căror structură se modifică în ordinea curentă: f> d> p> s.
7.2. RESPONSABILITATEA FAȚĂ DE ÎNCARCAREA PRINCIPALELOR PĂRȚI ALE TĂCEȚII COMPLEXE
Sarcina sferei interioare a unei conexiuni complexe este suma algebrei sarcinilor care creează particulele sale. De exemplu, valoarea și semnul taxei complexului sunt determinate de comanda viitoare. Sarcina ionului de aluminiu este +3, sarcina totală a șase ioni de hidroxid este -6. Ei bine, sarcina complexului este mai mare (+3) + (-6) = -3 și formula complexului este 3-. Sarcina ionului complex este numeric egală cu sarcina totală a sferei externe și se extinde dincolo de semn. De exemplu, sarcina sferei externe K3 este +3. De asemenea, sarcina ionului complex este încă -3. Sarcina complexului este egală ca mărime și proporțională cu semnul sumei algebrice a sarcinilor tuturor particulelor compusului complex. Deci, în K 3, sarcina ionului compusului este +3, lăsând sarcina totală a particulelor compusului complex să fie (+3) + (-6) = -3.
7.3. NOMENCLATURA SPOLUCURILOR COMPLEXE
Bazele nomenclaturii se bazează pe tradițiile clasice ale lui Werner. Aparent, înaintea lor, membrana complexă unită se numește cation și apoi anion. Ca tip non-electrolitic, este numit într-un singur cuvânt. Numele unui ion complex este scris într-un singur cuvânt.
Ligandul neutru este numit la fel ca molecula, iar liganzilor anionici se adaugă un „o”. Pentru o moleculă de apă coordonată, este utilizată denumirea „aqua-”. Pentru a indica numărul de liganzi noi din sfera interioară a complexului, numerele grecești di-, tri-, tetra-, penta-, hexa-i etc. sunt folosite ca prefix înaintea numelui liganzilor. Prefixul Monone nu este vikorist. Ligandi reacţionează exagerat pentru abetka. Numele ligandului este considerat ca un întreg. După numele ligandului urmează numele atomului central din stadiul de oxidare desemnat, care este indicat cu cifre romane în brațele rotunde. Cuvântul aminu (cu două „m”) este scris exact amiku. Pentru a rezolva aminele, este trăit un singur „m”.
C1 3 - clorură de hexamină cobalt (III).
C1 3 - clorură de cobalt (III) de aquapentamină.
Cl2 - clorură de pentametilamină clorocobalt (III).
diamindibromoplatină (II).
Deoarece un ion complex este un anion, numele său latin se termină în „am”.
(NH4)2 - tetracloropaladat de amoniu (II).
K – platinat de pentabromamină de potasiu (IV).
K 2 – tetrarodancobaltat de potasiu (II).
Numele ligandului de pliere trebuie plasat lângă arcul rotund.
NO 3 - azotat de dicloro-di-(etilendiamină) cobalt (III).
Br - bromură de bromo-tris-(trifenilfosfină) platină (II).
În aceste cazuri, când ligandul leagă doi ioni centrali, litera greacă este folosită înaintea numelui săuμ.

Astfel de liganzi se numesc local si supraasigura restul.
7.4. CONEXIUNEA CHIMICA SI COMPLEXUL BUDOV SPOLUK
În crearea reacțiilor complexe, interacțiunile donor-acceptor dintre ligand și atomul central joacă un rol important. Donatorul perechii de electroni este ligandul. Un acceptor este un atom central care are orbiti liberi. Ligamentul este umed și nu se rupe atunci când complexul este rupt (neionogen) și se numește coordonare
În ordinea legăturilor, legăturile π se formează conform mecanismului donor-acceptor. Atunci când donorul este un ion metalic, care renunță la ligand a electronilor d perechi, ceea ce are ca rezultat orbitali vacante energetic. Astfel de conexiuni se numesc datate. Mirosurile dispar:
a) pentru schimbul de p-orbitali liberi între metal și d-or-bital cu metal, care conține electroni care nu au intrat în legături σ;
b) când orbitalii d vacante ai ligandului sunt suprapusi cu orbitalii d plini ai metalului.
Semnificația sa principală este stadiul de suprapunere a orbitalilor leganului și atomului central. Rectitudinea legăturilor atomului central determină geometria complexului. Pentru a explica directitatea legăturilor, sunt introduse fenomenele vikoriste despre hibridizarea orbitalilor atomici ai atomului central. Orbitalii hibrizi ai atomului central rezultă din amestecarea orbitalilor atomici inegale, în urma căreia forma și energia orbitalilor se schimbă reciproc și se creează orbitali de forme și energii noi, dar diferite. Numărul de orbitali hibrizi este întotdeauna egal cu numărul de orbitali de ieșire. Norii hibrizi cresc în atomi la o distanță maximă de un tip (Tabelul 7.1).
Tabelul 7.1. Tipuri de hibridizare a orbitalilor atomici, formarea complexă și geometria diferitelor structuri complexe

Structura spațială a complexului este determinată de tipul de hibridizare a orbitalilor de valență și de numărul de perechi de electroni neîmpărțiți, care corespund nivelului său de energie de valență.
Prin urmare, eficacitatea interacțiunii donor-acceptor dintre ligand și agentul de complexare și valoarea legăturii cu acestea (stabilitatea complexului) sunt determinate de polarizarea lor. acum își transformă carcasa electronică sub infuzie externă. Conform acestui simbol, reactivii sunt împărțiți în "zhorstki", sau cu polarizare scăzută, asta "m'yaki" - câmpuri luminoase – în formă. Polaritatea unui atom, moleculă sau ion depinde de mărimea și numărul de sfere de electroni. Cu cât raza electronilor dintr-o particulă este mai mică, cu atât este mai puțin polarizată. Cu cât raza este mai mică și cu cât o particulă are mai puțini electroni, cu atât este polarizată mai puternic.
Acizii duri reacționează cu atomii electronegativi O, N, F ai liganzilor (bazele dure) ai complexelor mic (duri), iar acizii blânzi reacționează cu atomii donatori P, S și I ai liganzilor, care au electronegativitate scăzută și suc vi. polarizare, complexe mіtsni (m' yaki). Suntem atenți aici să demonstrăm principiul interzis de „a place să-ți placă”.
Datorită durității lor, practic nu formează complexe stabile cu biosubstratele, iar în mediile fiziologice se găsesc sub formă de complexe acvatice. Ionii de Ca 2+ și Mg 2+ creează complexe stabile cu proteinele și de aceea se găsesc în substanțele fiziologice atât în stare ionică, cât și în stare legată.
Ele combină elementele d cu biosubstrate (proteine) și complexe biologice. Iar acizii moi Cd, Pb, Hg sunt foarte toxici. Mirosurile creează complexe mitotice cu proteine pentru a elimina grupările sulfhidril R-SH:
Ionul de cianura este toxic. Ligandul moale interacționează activ cu d-metale în complexe cu biosubstrate, reziduurile active.
7.5. DISOCIEREA DISCURSĂRILOR COMPLEXE. STABILITATEA COMPLEXULUI. COMPLEXE LABILE ȘI INERTE
Când compușii complecși sunt dizolvați în apă, duhoarea se dezintegrează în sfere externe și interne, similare electroliților puternici, ale căror fragmente sunt legate ionogen, în principal prin forțe electrostatice. Aceasta este evaluată ca disocierea primară a reacțiilor complexe.
Disocierea secundară a uniunii complexe este dezintegrarea sferei interne în componentele sale. Acest proces are loc pe un amestec de electroliți slabi, fragmentele sferei interioare sunt conectate neionic (printr-o legătură covalentă). Disocierea are o natură treptată:

Pentru a caracteriza clar stabilitatea sferei interne a timpului de înjumătățire complex, folosim constanta de egalizare, care descrie disocierea internă, numită constanta de instabilitate a complexului(Kn). Pentru un anion complex, constanta de instabilitate arată astfel:

Cu cât valoarea lui Kn este mai mică, cu atât sfera internă a comunicării complexe este mai stabilă. Astfel se disociază mai puțin în apă. În timpul rămas, înlocuiți Kn cu ajutorul valorilor constantei de duritate (Ku) - valoarea, revenirea lui Kn. Cu cât valoarea lui Ku este mai mare, cu atât complexul este mai stabil.
Constantele de stabilitate permit predicția directă a proceselor de schimb de liganzi.
În apă, ionul metalic apare sub formă de complexe acvatice: 2 + - fier hexaacvatic (II), 2 + - cupru tetraaqua (II). La scrierea formulelor ionilor hidratați nu este indicată coordonarea moleculei de apă a învelișului de hidratare, dar poate fi luată în considerare. Formarea unui complex între un ion metalic și un ligand este văzută ca o reacție de substituție a unei molecule de apă la sfera de coordonare internă cu acest ligand.
Reacțiile de schimb de ligand au loc prin mecanismul de reacție de tip S N. De exemplu:
Valorile constantelor de stabilitate indicate în tabelul 7.2 indică faptul că în timpul procesului de complexare are loc o legare semnificativă a ionilor în substanțele apoase, ceea ce indică eficacitatea acestui tip de reacție pentru legarea ionilor, în special a liganzilor polidentați.
Tabelul 7.2. Durabilitatea complexelor de zirconiu

Ca rezultat al reacției de schimb ionic, crearea de reacții complexe nu este adesea un proces cvasi-instantaneu. De exemplu, când compusul (III) interacționează cu acidul nitritrimetilenfosfonic, echilibrul este stabilit după 4 adăugiri. Pentru caracteristicile cinetice ale complexelor se folosesc următoarele concepte: labil(Șvidko reacționează) și inert(Reacționează complet). Complexele labile, conform propunerii lui G. Taube, sunt cele care schimbă complet liganzi cu o lungime de 1 min la temperatura camerei și o concentrație de 0,1 M. Este necesară separarea clară a conceptelor termodinamice [m Național (stabil)/Germană. complexe (instabile)] și cinetice [inerte și labilny].
În complexele labile, înlocuirea liganzilor se realizează rapid și egalizarea se stabilește rapid. În complexele inerte, substituția ligandului are loc continuu.
Astfel, complexul inert 2+ într-un mediu acid este instabil termodinamic: constanta de instabilitate este mai mare de 10 -6, iar complexul labil 2 este foarte stabil: constanta de stabilitate este mai mare de 10 -30. Labilitatea complexelor Taube se datorează structurii electronice a atomului central. Inerția complexelor de putere, rangul principal, ioni dintr-un d-shell neterminat. Complexele Z, Cr sunt considerate inerte. Complexe de cianuri bogate în cationi din surse externe s 2 p 6 labile.
7.6. COMPLEXE DE PUTERE CHIMICA
Procesele de creare a complexului se bazează pe puterea tuturor particulelor care creează complexul. Cu cât importanța legăturilor dintre liganzi și complexe este mai mare, cu atât puterea atomului central și a liganzilor se manifestă mai puțin, iar particularitățile complexului sunt și mai puțin evidente.
Reacțiile complexe relevă activitatea chimică și biologică datorită neocupării de coordonare a atomului central (orbitali liberi) și prezenței perechilor de electroni liberi de liganzi. Acest tip de complex are puteri electrofile și nucleofile, subordonate puterilor atomului central și ale liganzilor.
Este necesar să ne bazăm pe activitatea chimică și biologică a complexului de coajă hidratată. Procesul de creație
Niciunul dintre complexe nu se varsă în puterea acido-bazică a sistemului complex. Dizolvarea acizilor complecși este însoțită de o rezistență crescută a acidului sau bazei. Astfel, atunci când acizii complecși sunt dizolvați din cei simpli, energia de legare cu ionii H+ scade și puterea acidului crește semnificativ. Dacă sfera externă are un ion OH -, atunci legătura dintre cationul complex și ionul hidroxid al sferei externe se modifică, iar puterea principală a complexului crește. De exemplu, hidroxidul de cupru Cu(OH)2 este o bază slabă, importantă. Când este expus la amoniac nou, se creează un amoniac de cupru (OH) 2. Puterea sarcinii 2+ cu Cu 2+ se modifică, legătura cu ionii BIN se slăbește și (OH) 2 este considerată o bază puternică. Puterea acido-bazică a liganzilor asociați cu agentul de complexare tinde să fie mai puternică decât puterea lor acido-bază mai mică în sălbăticie. De exemplu, hemoglobina (Hb) sau oxihemoglobina (HbO 2) prezintă putere acidă pentru schimbul de grupări carboxil puternice ale proteinei-globinei, care este ligand HHb ↔ H + + Hb - . În același timp, anionul hemoglobină pentru grupa amino a globinei proteice prezintă puterea principală și aceasta se datorează oxidului acid CO 2 cu compoziția anionului carbaminohemoglobină (HbCO 2 -): CO 2 + Hb - ↔ HbCO 2 -.
Complecșii prezintă putere oxidativă datorită interacțiunii compușilor de complexare pe bază de oxizi, care creează etape de oxidare stabile. Procesul de complexare crește foarte mult valorile potențialelor oxidative ale elementelor d. Dacă forma reînnoită a cationilor formează un complex stabil cu ligand, forma inferioară este oxidată, atunci potențialul crește. O scădere a valorii potențiale are loc dacă complexul stabil este creat de forma oxidată. De exemplu, sub influența agenților oxidanți: nitriți, nitrați, NO 2 H 2 O 2, hemoglobina este transformată în methemoglobină ca urmare a oxidării atomului central.
Shosta orbital vikoristovaya în oxihemoglobina creată. Acest orbital are aceeași soartă ca și legătura cu monoxidul de carbon. Ca urmare, se formează complexul macrociclic din salivă – carboxihemoglobina. Acest complex este stabil de 200 de ori, iar complexul inferior este acid în hemi.

Mic 7.1. Transformarea chimică a hemoglobinei la om. Schema din carte: Slesarev V.I. Fundamentele chimiei viețuitoarelor, 2000
Iluminarea ionilor complecși îmbunătățește activitatea catalitică a ionilor de complexare. Într-un număr de episoade, activitatea crește. Acest lucru se datorează dezvoltării unor mari sisteme structurale, care duc la crearea de produse intermediare și la o scădere a energiei de activare a reacției. De exemplu, dacă adăugați Cu 2+ sau NH 3 la H 2 Pro 2, procesul de despachetare nu se va accelera. În prezența complexului 2+, care este stabilit în partea de mijloc, eliberarea de peroxid de apă se va accelera de 40 de milioane de ori.
De asemenea, asupra hemoglobinei se poate analiza puterea compușilor complecși: acido-bazic, complexare și oxid-bază.
7.7. CLASIFICAREA SPLUKLOR COMPLEXE
Există o serie de sisteme de clasificare a compușilor complecși care se bazează pe principii diferite.
1. Pentru statutul de interpretare complexă până la clasa de canto:
Acizi complexi H2;
Baze complexe OH;
Săruri complexe K4.
2. După natura ligandului: complexe acvatice, amioacizi, acidocomplexe (ca liganzi sunt anionii acizilor amețiți, K 4 ; complexe hidroxo (ca liganzii sunt grupări hidroxil, K 3 ); complexe cu liganzi macrociclici, în mijlocul toate gamele scheni atom central.
3. După semnul sarcinii complexului: cation - cation complex într-un compus complex Cl 3; anionni – anion complex în compusul complex K; neutru – sarcina la complex este egală cu 0. Conexiunea complexă a sferei externe nu afectează, de exemplu. Aceasta este formula pentru un medicament antitumoral.
4. După structura internă a complexului:
a) în funcție de numărul de atomi ai agentului de complexare: mononucleare- înainte de particula complexă există un atom al agentului de complexare, de exemplu CI3; nuclear bogat- în depozitul unei piese complexe există un număr de atomi ai unui agent de formare a complexului - un complex lizoproteic:

b) complexele se împart în mai multe tipuri de liganzi: asemănători (un singur ligand),Înlocuiți un tip de ligand, de exemplu 2 +, și alții diferite (diferiți liganzi)- două tipuri de liganzi sau mai multe, de exemplu, Pt(NH3)2Cl2. Complexul conţine liganzii NH3 şi Cl-. Pentru complexe complexe în care sfera interioară a diferiților liganzi este caracterizată prin izomerie geometrică, dacă, totuși, compoziția sferei interioare a liganzilor din aceasta variază în moduri diferite.

Izomerii geometrici ai structurilor complexe variază nu numai datorită influențelor fizice și chimice, ci și activității biologice. Izomerul cis Pt(NH3)2Cl2 are o activitate antitumorală clar pronunţată, iar izomerul trans nu o are;
c) în funcție de densitatea liganzilor care creează complexe mononucleare, se pot vedea grupurile:
Complexe mononucleare cu liganzi monodentati, de exemplu 3+;
Complexe mononucleare cu liganzi polidentati. Se numesc compuși complecși cu liganzi polidentați sulfați chelați;
d) formele ciclice şi aciclice ale reacţiilor complexe.
7.8. COMPLEXE DE CHELAT. Complexe. COMPLEXONATI
Structurile ciclice care sunt create ca urmare a adăugării unui ion metalic la doi atomi donatori sau mai mulți care rezidă într-o moleculă de agent de chelare se numesc compuși chelați. De exemplu, glicinat de cupru:

Au un complex așa cum cunosc mijlocul ligandului, fuziune cu ligamente, precum ghearele, astfel încât duhoarea pentru alte minți egale poate avea o rezistență mai mare, o rezistență mai mică, pentru a nu interfera cu ciclurile. Cele mai stabile cicluri sunt cele care au loc pe cinci sau șase benzi. Această regulă a fost formulată pentru prima dată de L.A. Chugaev. Cu amănuntul
Se numesc stabilitatea complexului chelat și stabilitatea analogului său neciclic efect chelat.
Ca agent de chelare, liganzii polidentați acționează ca două tipuri de grupări:
1) grupări create înainte de formarea legăturilor polare covalente pentru reacția de schimb (donatori de protoni, acceptori de perechi de electroni) -CH 2 COOH, -CH 2 PO(OH) 2 -CH 2 SO 2 OH - grupări acide (centre);
2) grup-donatori de perechi de electroni: ≡N, NH, C = O, -S-, -OH, - grupuri principale (centre).
Deoarece astfel de liganzi există în sfera de coordonare internă a complexului și neutralizează sarcina ionului metalic, ei se numesc complex intern. De exemplu, glicinat de cupru. Al cărui complex are o sferă externă în timpul zilei.
Se numește un grup mare de compuși organici care se află la baza și la centrul acid al moleculei complexuri. Aceștia sunt acizi bogati bazici. Compușii chelatori care sunt creați de complexoni la interacțiunea cu ionii metalici sunt numiți complexonate, de exemplu, complexonat de magneziu cu acid etilendiaminotetraoctic:
La plantele acvatice, complexul există sub formă anioică.
Complexonarea și complexarea este un model simplu de compuși complecși ai organismelor vii: aminoacizi, polipeptide, proteine, acizi nucleici, enzime, vitamine și alți compuși endogeni bogați.
Nina produce o gamă largă de complexuri sintetice cu diferite grupe funcționale. Formulele principalelor complexuri sunt prezentate mai jos:


Complexele minților mari pot produce perechi de electroni nedivizați (divizați) pentru a stabili o legătură de coordonare cu un ion metalic (elementele s-, p- sau d). Ca rezultat, sunt create semisolide stabile de tip chelat cu inele cu 4, 5, 6 sau 8 membri. Reacția are loc într-un interval larg de pH. În funcție de pH, de natura agentului de complexare, relația sa cu ligandul creează complexe de importanță și severitate diferite. Chimia formării complexonaților poate fi reprezentată prin analogie cu sarea de sodiu EDTA (Na 2 H 2 Y), care se disociază în apă: Na 2 H 2 Y → 2Na + + H 2 Y 2- și H 2 Y 2 - ion reciproc cu ionii metalici Indiferent de stadiul de oxidare a cationului metalic, cel mai adesea un ion metalic interacționează cu o moleculă a complexonului (1:1). Reacția se desfășoară rapid (Cr>109).
Complexonii și complexonații prezintă putere amfoterică pe o gamă largă de pH, care participă la reacții de oxidare-reînnoire, complexare și creează reacții cu puteri diferite în funcție de stadiul oxidării metalului, coordonarea sa saturație valoroasă, puteri electrofile și nucleofile. Toate acestea înseamnă capacitatea de a lega un număr mare de particule, ceea ce permite unui număr mic de reactivi să efectueze sarcini mari și variate.
Transferul complexonilor și complexonaților este altfel neobstrucționat - există puțină toxicitate și capacitatea de a converti părți toxice
slab toxic sau biologic activ. Produsele de descompunere a complexonaților nu se acumulează în organism și nu sunt dăunătoare. A treia caracteristică a complexonaților este capacitatea lor de a combina microelemente.
Absorbția crescută se datorează faptului că microelementul este introdus într-o formă biologic activă și are o penetrare mare în membrană.
7.9. COMPLEXE METALICE DE FOSFOR - O FORMA EFICIENTA DE CONVERSIUNE A MICRO-ȘI MACROELEMENTE ÎNTR-UN STAND BIOLOGIC ACTIV ȘI UN MODEL DE BIOLOGIE AVANSATĂ
Concept activitate biologică Miroase un cerc larg de găuri. Din punct de vedere al infuziei chimice sub substante biologic active (BAS), se accepta intelegerea substantelor care pot actiona asupra sistemelor biologice, reglandu-le vitalitatea.
Existența unor astfel de proprietăți este adesea interpretată ca existența activității biologice. Reglarea poate apărea în efectele de stimulare, suprimare, dezvoltarea acestor și a altor efecte. Manifestare extremă a activității biologice acțiune biocidă, dacă în cele din urmă infuz biocidul de vorbire în corpul ginecului rămas. La concentrații mai mici, în cele mai multe cazuri, biocidele produc un efect stimulant, mai degrabă decât letal, asupra organismelor vii.
În acest moment, există un număr mare de astfel de discursuri în ochii publicului. În multe cazuri de stagnare a substanțelor biologic active, eficacitatea acestora este insuficientă, adesea cu o eficacitate departe de maximă, iar stagnarea duce adesea la efecte secundare, care pot fi cauzate de introducerea substanțelor biologic active modificate.Ikatoriv.
Complexele de fosfor creează reacții cu puteri diferite în funcție de natură, stadiul de oxidare a metalului, coordonarea saturației, depozitarea și învelișul de hidratare. Toate acestea înseamnă polifuncționalitatea complexonaților, natura lor unică de acțiune substoichiometrică,
Efectul ionului halal asigură aplicarea largă în medicină, biologie, ecologie și în diverse domenii ale stăpânirii poporului.
Atunci când este coordonat de un ion metalic, complexul suferă o redistribuire a densității electronilor. Ca urmare a participării perechii de electroni neîmpărtășite în timpul interacțiunii donor-acceptor, densitatea de electroni a ligandului (complexonului) este deplasată la atomul central. O scădere a sarcinii negative a ligandului corespunde unei modificări a concentrației coulombice a reactivilor. Prin urmare, coordonarea ligandului devine accesibilă pentru a fi atacată de un reactiv nucleofil, ceea ce determină puterea electronilor în exces la centrul de reacție. Înlocuirea puterii electronilor din complexon în ionul metalic duce la o creștere semnificativă a sarcinii pozitive a atomului de carbon și, prin urmare, la o reducere a atacului reactivului nucleofil, ionul hidroxil. Complexul hidroxilat de enzime, care catalizează procesele metabolice în sistemele biologice, ocupă unul dintre locurile centrale în mecanismul de acțiune enzimatică și de detoxifiere în organism. Ca urmare a interacțiunii în mai multe puncte dintre enzimă și substrat, se creează o orientare care asigură apropierea grupărilor active în centrul activ și transferul reacției în modul intramolecular, până la începutul reacției și crearea tranziției I voi deveni, care va asigura funcția enzimatică a FCM. Moleculele de enzime pot suferi modificări conformaționale. Coordonarea creează motive suplimentare pentru interacțiunea oxidativă dintre ionul central și ligand, în urma căreia se stabilește o legătură directă între agentul de oxidare și ligand, care asigură electronii de tranziție. Complexele de metale de tranziție FCM pot fi caracterizate prin tranziții electronice de tip L-M, M-L, M-L-M, care iau parte la orbitalii metalici (M) și liganzii (L), care sunt legați de complex prin legături donor-acceptor. Complexele pot servi ca un loc prin care electronii complexelor bogate în nuclee oscilează între atomii centrali ai unuia dintre aceleași elemente în diferite condiții de oxidare (complecși de transfer de electroni și protoni). Complexonii înseamnă proprietățile puternice ale complexonaților metalici, care permit funcții antioxidante, adaptogene și homeostatice ridicate.
De asemenea, complexele transformă microelementele într-o formă biologic activă accesibilă organismului. Duhoarea este persistentă,
particule infuzate mai coordonat, biocomplexuri necreate și, prin urmare, forme cu toxicitate scăzută. Complexele funcționează bine atunci când homeostazia microelementelor este perturbată în organism. Ionii elementelor de tranziție în forma complexonată acționează în organism ca un factor care înseamnă sensibilitatea ridicată a celulelor la microelemente ale părților lor în crearea unui gradient de concentrație ridicat, potențial membranar. Complexele de metale de tranziție ale FCM conduc la puteri de bioreglare.
Prezența centrelor acide și bazice în depozitul FCM asigură puterea amfoterică și participarea acestora la menținerea echilibrului acido-bazic (starea izohidrică).
Datorită creșterii numărului de grupe fosfonice în depozitarea complexonei, stocarea și dezvoltarea complexelor complexe și minore se modifică. Un număr crescut de grupări fosfonice previne formarea de complexe de grad scăzut pe un interval mai larg de pH, distrugând sfera dizolvării lor în regiunea acidă. Complexele sunt descompuse la un pH peste 9.
Dezvoltarea proceselor de complexare cu complexoni a permis dezvoltarea unor metode pentru sinteza bioregulatorilor:
Stimulatori de creștere prelungită în formă coloid-chimică - titan și salivă polinucleare homo- și heterocomplex;
Stimulanti de crestere pentru forme bogate in apa. Aceștia sunt complexanți multi-ligand pentru titan pe bază de complexoni și ligand anorganic;
Inhibitori de creștere - complexonați de fosfor ai elementelor s.
Efectul biologic al preparatelor sintetice asupra creșterii și dezvoltării a fost demonstrat în experimente cronice pe plante, animale și oameni.
Bioreglare- prețul unei noi directive științifice care vă permite să reglați direct intensitatea proceselor biochimice care pot fi utilizate pe scară largă în medicină, animale sălbatice și agricultură. Este legat de dezvoltarea metodelor de actualizare a funcției fiziologice a organismului prin prevenirea și tratamentul bolilor și patologiilor vechi. Complexitatea și tratamentele complexe bazate pe acestea pot fi extinse la tratamente promițătoare biologic active. Studiul acestei activități biologice într-un experiment cronic a arătat ce a adus chimia în mâinile medicilor,
Târâtorii, agronomii și biologii au un nou concept promițător care le permite să interacționeze activ cu celulele vii, să regleze aprovizionarea cu alimente, creșterea și dezvoltarea organismelor vii.
Investigarea toxicității complexonilor și complexonaților stagnanți a arătat o prevalență în creștere a influxului de medicamente în organele care formează sânge, presiunea arterială, neliniștea, frecvența respirației: nu a fost observată nicio modificare a funcției hepatice, nu a fost identificată de un toxicolog pe care mă voi concentra. morfologia țesuturilor și organelor. Sarea de potasiu OEDP nu are toxicitate într-o doză care este de 5-10 ori mai mare decât doza de medicament (10-20 mg/kg) cu o doză suplimentară de 181 dB. Apoi, complexele sunt reduse la compuși cu toxicitate scăzută. Sunt utilizate ca preparate medicinale pentru combaterea bolilor virale, epuizării metalelor importante și a elementelor radioactive, tulburărilor metabolismului calciului, în caz de boli endemice și tulburări ale echilibrului microelementelor din organism. Complexele de fosfor și complexonații nu sunt susceptibili la fotoliză.
Există o contaminare progresivă a lumii cu metale importante - produse ale activității guvernamentale a oamenilor și un oficial de mediu activ în mod constant. Mirosurile se pot acumula în organism. Prea multe dintre ele provoacă intoxicație în organism.
Complexele metalice păstrează efectul de chelare al ligandului (complexonului) în organism și sunt esențiale pentru susținerea homeostaziei ligandului metalic. Metalele importante încorporate sunt rapid neutralizate în organism, iar rata scăzută de resorbție interferează cu transferul metalelor către lancetele trofice, rezultând „biominizare”. Sunt toxice, ceea ce este deosebit de important pentru regiunea Ural. De exemplu, ionul puternic de plumb poate fi îndepărtat până când solvenții sunt îndepărtați, iar complexonatul de acid mic al plumbului cu acidul etilendiaminotetraoctic este toxic. Prin urmare, detoxifierea plantelor și animalelor constă în prezența complexonaților metalici stagnanți. Se bazează pe două principii termodinamice: capacitatea lor de a crea legături microscopice cu particule toxice, transformându-le în compuși de calitate scăzută sau rezistenți la apă; Eșecul lor de a distruge biocomplexele endogene. În legătură cu aceasta, este important să combatem direct mediul și să extragem produse ecologice - inclusiv terapia complexă a plantelor și animalelor.
Infuzia creșterilor cu complexe de metale rare a fost efectuată folosind o tehnologie de prelucrare intensivă.
cartofi la depozitul de microelement de bulbi de cartofi. Bulbii au conținut 105-116 mg/kg saliz, 16-20 mg/kg mangan, 13-18 mg/kg midi și 11-15 mg/kg zinc. Compatibilitate cu microelemente tipice pentru țesături naturale. Bulbii crescuți din stagnare și fără stagnarea complexonaților metalici formează un depozit elementar practic nou. Stagnarea chelaților nu împiedică acumularea de metale importante în bulbi. Complexele de grad mai mic, ionii metalici inferiori, sunt absorbite de sol, rezistente la influxul microbiologic, ceea ce le permite să facă față daunelor solului în perioadele dificile. Efect după 3-4 ani. Mirosurile sunt cel mai bine consumate cu diverse substanțe chimice organice. Metalul din complex are toxicitate mai mică. Complexele de fosfor cu metale nu irită membrana mucoasă a ochilor și nu irită pielea. Nu a fost detectată puterea de sensibilizare, puterea cumulativă a complexonaților de titan nu a fost exprimată și, în unele cazuri, a fost foarte slabă. Coeficientul de cumul rămâne același cu 09-30, ceea ce indică un risc potențial scăzut de afectare cronică cu medicamente.
Complexele de fosfor se bazează pe legături de carbură de fosfor (C-P), care se găsesc și în sistemele biologice. Vei intra in depozitul de fosfonolipide, fosfonoglicani si fosfoproteine ale membranelor celulare. Lipidele care îndepărtează compușii aminofosfonici, sunt rezistente la hidroliză enzimatică, asigură stabilitatea și, prin urmare, funcționarea normală a membranelor celulare exterioare. Analogii sintetici ai pirofosfaților - difos-fonatul (P-S-P) sau (P-S-S-P) în doze mari distrug metabolismul calciului, iar în doze mici îl normalizează. Difosfonații sunt eficienți pentru hiperlipemie și sunt promițători din punct de vedere farmacologic.
Difosfonați, care înlocuiesc legăturile P-C-P cu elemente structurale ale biosistemelor. Mirosurile sunt eficiente din punct de vedere biologic și sunt analogi ai pirofosfaților. S-a demonstrat că difosfonații sunt metode eficiente pentru tratamentul diferitelor boli. Difosfonații sunt inhibitori activi ai mineralizării și resorbției chistului. Complexele transformă microelementele într-o formă biologic activă accesibilă organismului, creează particule stabile, înalt coordonate și biocomplexuri nenaturale, precum și forme scăzute de toxicitate. Duhoarea indică sensibilitatea ridicată a celulelor la microelemente, participând la formarea unui gradient de concentrație ridicat. Frații actuali participă la crearea heteronuclearelor de titan seminucleare bogate -
de un nou tip - complexe pentru transferul de electroni și protoni, care participă la bioreglarea proceselor metabolice, rezistența organismului, capacitatea de a rezolva legăturile cu particule toxice, transformându-le în condiții minore sau minore ki, non-ruinare complexe endogene. Prin urmare, sunt stagnate pentru detoxifiere, eliminare din organism, extracție de produse ecologice (terapie complexă), precum și în industrie pentru regenerarea și utilizarea deșeurilor industriale de acizi și săruri anorganice.Există o mulțime de metale promițătoare.
7.10. SCHIMBURI DE LIGANDI SI SCHIMBURI DE METAL
RIVNOVAGI. CHELATOTERAPIE
Dacă în sistem există un număr de liganzi cu un ion metalic sau un număr de ioni metalici cu un ligand, creați înainte de crearea compușilor complecși, atunci procesele concurente sunt evitate: în primul tip, schimbul de liganzi este egal - liganzi de competiție pentru ionul metalic, celălalt tip are rivalitate în schimbul de metale - competiție între ionii metalici pentru ligand. Ceea ce va fi important este procesul de constituire a complexului de angajare. De exemplu, în Rusia există ioni: magneziu, zinc, salivare (III), cupru, crom (II), salivară (II) și mangan (II). Când o cantitate mică de acid etilendiaminotetraoctic (EDTA) este introdusă în această soluție, există competiție între ionii metalici și se leagă de complexul de salivare (III), restul vinului este redus de EDTA în cea mai mare măsură. Complexul Tsniy.
În organism, există o interacțiune constantă între biometale (MB) și bioliganzi (Lb), crearea și restaurarea biocomplexelor esențiale (MbLb):
În corpul uman, animale și plante există diferite mecanisme de protecție și susținere a aceluiași tip de xenobiotice (substanțe străine), inclusiv ioni de metale importante. Sunt metale importante care nu sunt legate în complex, iar complecșii lor hidroxo conțin particule toxice (Mt). În aceste cazuri, pe lângă amestecul natural de liganzi metalici, poate apărea o nouă revoluție, cu crearea unor complecși străini importanți pentru a contracara toxicul metalic (MtLb) sau toxicul ligand (MbLt), care nu vă îngrijorează.
funcții biologice esențiale. Când particulele toxice exogene intră în organism, există un amestec de echilibru și, ca urmare, competiție a proceselor. Ceea ce va fi important este procesul care duce la crearea celui mai mare rezultat cuprinzător posibil:

Perturbarea homeostazei ligandului metalic duce la perturbarea procesului metabolic, inhibarea activității enzimatice, perturbarea metaboliților importanți, cum ar fi ATP, membranele celulare, perturbarea gradientului de concentrație a ionilor în tinah celular. Prin urmare, sistemele fragmentare sunt create de dragul acesteia. Strâns legată de această metodă este terapia de chelare (terapie complexă).
Terapia de chelare este procesul de îndepărtare a particulelor toxice din organism, care se bazează pe chelarea complexonaților lor de elemente s. Medicamentele care sunt folosite pentru a elimina particulele toxice încorporate în organism se numesc detoxifiante.(Lg). Chelarea particulelor toxice cu complexonați de metal (Lg) transformă ionii metalici toxici (Mt) în forme legate netoxice (MtLg), potrivite pentru izolare și penetrare prin membrane, transport și excreție din organism. Mirosurile păstrează efectul chelator în organism, atât pentru ligand (complexon), cât și pentru ionul metalic. Acest lucru asigură homeostazia ligandului metalic în organism. Prin urmare, utilizarea complexonaților în medicină, animale și plante va asigura detoxifierea organismului.
Principiile termodinamice de bază ale terapiei de chelare pot fi formulate în două poziții.
I. Detoxifiantul (Lg) este responsabil pentru legarea eficientă a ionilor toxici (Mt, Lt) care sunt nou creați, care sunt responsabili pentru cei inferioare care au fost prezenți în organism:
II. Detoxifiantul nu este de vină pentru distrugerea tratamentelor complexe necesare vieții (MBLb); compușii care pot fi creați prin interacțiunea dintre un detoxicant și ionii biometali (MBLg) sunt probabil să fie mai puțin semnificativi decât cei care există în organism:
7.11. PERSONALUL COMPLEXONĂRILOR ŞI COMPLEXONAŢILOR ÎN MEDICINĂ
Moleculele de complexon practic nu recunosc scindarea sau orice modificare a compoziției biologice, ceea ce are o mare importanță farmacologică. Complexele nu se descompun în lipide și se dizolvă ușor în apă, astfel încât duhoarea nu pătrunde sau pătrunde prin membranele celulare și, prin urmare: 1) nu este excretată de intestin; 2) absorbția agenților de complexare este posibilă numai atunci când aceștia sunt injectați (cu excepția cazului în care penicilamina este administrată intern); 3) complexele circulă în organism în principal în spațiul post-clinic; 4) îndepărtarea din corp se realizează prin rangul capului prin nirks. Acest proces se realizează rapid.
Cuvintele care lasă urme de influx asupra structurilor biologice și inactivează frunzele prin intermediul reacțiilor chimice se numesc antidoturi.
Unul dintre primele antidoturi folosite în terapia de chelare este British Anti-Luisite (BAL). În acest moment, configurați unitatea:
Acest medicament elimină eficient cenușa, mercurul, cromul și bismutul din organism. Cei mai folosiți compuși sunt cei care conțin zinc, cadmiu, plumb și complecși și complexuri de mercur. Formularea lor se bazează pe crearea de complexe medicinale cu ioni metalici, complexe inferioare ale acestor ioni cu grupe de carbohidrați de proteine, aminoacizi și carbohidrați. Pentru a elimina plumbul, utilizați medicamente pe bază de EDTA. Atunci când doze mari de medicamente sunt introduse în organism, acestea nu sunt sigure, deoarece fragmentele de miros se leagă de calciu, ceea ce duce la întreruperea multor funcții. Tom va stagna tetacină(CaNa 2 EDTA), care este utilizat pentru îndepărtarea plumbului, cadmiului, mercurului, nitriei, ceriului și a altor metale din pământuri rare și cobalt.

De la prima introducere clinică a tetacinei în 1952, acest medicament a fost utilizat pe scară largă în clinica bolilor profesionale și nu mai este un antidot esențial. Mecanismul de acțiune al tetacinei este foarte simplu. Toxicanții ionici interferează cu coordonarea ionului de calciu cu tetacina în legarea lianților esențiali cu acid și EDTA. Ionul de calciu, la rândul său, este înlocuit cu doi ioni de sodiu care s-au pierdut:

Thetacin se administrează organismului în doză de 5-10%, care se bazează pe motive fiziologice. Deci, chiar și după 1,5 ani după injectarea cerebrală internă, organismul pierde 15% din doza administrată de tetacină, după 6 ani - 3%, iar după 2 mai mult - mai puțin de 0,5%. Acest medicament este eficient atunci când este administrat cu tetacină prin metoda prin inhalare. Se absoarbe rapid și circulă în sânge pentru o lungă perioadă de timp. În plus, tetacina este utilizată pentru a trata gangrena gazoasă. Inhibă acțiunea ionilor de zinc și cobalt, care sunt activatori ai enzimei lecitinaze, care este o toxină de gangrenă gazoasă.
Legarea substanțelor toxice cu tetacină într-un complex de chelați slab toxic și benefic, care nu se descompune și se elimină ușor din organism prin secreții, asigură detoxifierea și nutriția minerală echilibrată. Aproape în spatele structurii și depozitului de pre-
EDTA parathas - sare de sodiu-calciu a acidului dietilentriamină-pentaoctic (CaNa 3 DTPA) - pentacinăși sare de sodiu a acidului dietilentriaminpentafosfonic (Na 6 DTPP) - trimefa-cin. Pentacina este importantă pentru îndepărtarea radionuclizilor (tehnețiu, plutoniu, uraniu).

Sarea de sodiu a acidului (CaNa 2 EDTP) fosficina Este folosit cu succes pentru a îndepărta mercurul, plumbul, beriliul, manganul, actinidele și alte metale din organism. Complexele sunt foarte eficiente în îndepărtarea anumitor anioni toxici. De exemplu, tetraacetatul de etilendiamină la cobalt (II), care reacționează cu complexul de ligand mixt cu CN-, poate fi recomandat ca antidot pentru otrăvirea cu cianură. Un principiu similar stă la baza metodelor de îndepărtare a compușilor organici toxici, eliminarea pesticidelor și înlocuirea grupurilor funcționale cu atomi donatori creați înainte de interacțiunea cu complexonatul de metal.
Un medicament eficient succimer(Acid dimercaptosuccinic, acid dimercaptosuccinic, chemet). Leagă eficient aproape toate substanțele toxice (Hg, As, Pb, Cd), dar nu elimină elementele biogene (Cu, Fe, Zn, Co) din organism.
Complexonații de fosfor și inhibitori puternici ai formării cristalelor de fosfați și oxalați de calciu. Xidifonul, o sare de potasiu-sodiu a OEDF, este prescris ca medicament anti-calcificare pentru tratamentul bolilor cutanate. Difosfonații, în plus, în doze minime, cresc încorporarea calciului în țesutul chist, împiedicând ieșirea patologică din chisturi. OEDP și alți difosfonați previn diferite tipuri de osteoporoză, inclusiv osteodistrofia, parodontală
bine, distrugerea, precum și distrugerea chistului transplantat la animale. De asemenea, a fost descris efectul antiaterosclerotic al OEDF.
În Statele Unite, difosfonații scăzuti, Zocrema OEDF, sunt prescriși ca medicamente farmaceutice pentru tratamentul persoanelor și animalelor care suferă de cancer de chist metastatic. Prin reglarea penetrării membranelor, difosfonații facilitează transportul celulelor antitumorale în celulă și, de asemenea, tratamentul eficient al diferitelor boli oncologice.
Una dintre problemele actuale ale medicinei de urgență este necesitatea diagnosticării rapide a diferitelor boli. Sub acest aspect, de mare interes este o nouă clasă de medicamente care înlocuiesc cationii, eliminând astfel funcțiile sondei - magnetorelaxare radioactivă și etichete fluorescente. Ca componente principale ale radiofarmaceuticilor, se folosesc radioizotopi ai anumitor metale. Chelarea cationilor acestor izotopi cu complexoni face posibilă îmbunătățirea proprietăților lor toxicologice pentru organism, facilitarea transportului lor și asigurarea unor niveluri ridicate de concentrație în aceste și alte organe.
Aceste exemple pot epuiza cu greu toată varietatea formelor de complexonați utilizate în medicină. Astfel, sarea dipotasică a etilendiamină tetraacetat de magneziu vikorist este utilizată pentru reglare în loc de țesuturi în timpul patologiei. EDTA este depozitat într-un depozit de suspensii anticoagulante, care sunt folosite în timpul distribuției plasma sanguină, ca stabilizator pentru adenozin trifosfat în caz de glucoză ridicată în sânge, în timp ce luminează și păstrează lentilele de contact. Când se tratează pacienții reumatoizi, difosfonații sunt utilizați pe scară largă. Duhoarea este deosebit de eficientă ca agent anti-artritic la cei asociati cu medicamente antiinflamatoare.
7.12. COMPLEXE CU COMPLEXE DE MACROCICLISTA
Printre compușii complecși naturali, un loc aparte îl ocupă macrocomplexele pe bază de polipeptide ciclice, pentru a înlocui spațiile goale interne de dimensiuni mici, care conțin o serie de grupe de oxigen care leagă cationii acestor metale, inclusiv sodiu și potasiu, dimensiunile dintre care corespund dimensiunilor recipientului gol. Astfel de discursuri sunt prezente în biologie

Mic 7.2. Complex de valinomicină cu ion K+
Materialele cehe, asigură transportul ionilor prin membrane și sunt numite ionofori. De exemplu, valinomicina transportă ionul de potasiu prin membrană (Fig. 7.2).
Pentru ajutor cu o altă polipeptidă gramicidin A Transportul cationilor de sodiu are loc în spatele mecanismului releu. Această polipeptidă este pliată într-un „tub”, a cărui suprafață interioară este căptușită cu grupuri care conțin oxigen. Drept urmare, ieși
Așteptați mult timp pentru canalul hidrofil cu o tăietură mică, care indică dimensiunea ionului de sodiu. Ionii de sodiu care intră în canalul hidrofil de pe o parte sunt transferați de la unul la altul în grupele acide, similar cursei de releu prin canalul conducător de ioni.
De asemenea, molecula ciclică a polipeptidei are un gol molecular intern, în măsura în care un substrat de dimensiuni și geometrie diferite poate fi îndepărtat conform principiului unei chei și al unui lacăt. Spațiul gol al unor astfel de receptori interni este căptușit cu centri activi (endoreceptori). În funcție de natura ionului metalic, pot apărea interacțiuni necovalente (electrostatice, formarea de legături de apă, forțe van der Waals) cu metalele de bază și interacțiuni covalente cu metalele de bază. Drept urmare, ei se prefac supramolecule- asociații complexe care constau din două sau mai multe particule care sunt supuse simultan de forțe intermoleculare.
Cele mai răspândite macrocicluri tetradentate în natura vie sunt porfinele și cele apropiate acestora din spatele structurii corinoidului. Schematic, ciclul tetradentinic poate fi reprezentat într-un mod modern (Fig. 7.3), unde arcele înseamnă același tip de lănci de carbon care leagă atomii donatori de azot într-un ciclu închis; R1, R2, R3, P4-radicali carbohidraţi; M n+ este un ion metalic: în clorofilă ionul Mg 2+, în hemoglobină ionul Fe 2+, în hemocianină ionul Cu 2+, în vitamina B 12 (cobalamină) ionul C 3+.
Atomii donatori de azot sunt distribuiți de-a lungul marginilor pătratului (indicat de linia punctată). Duhoarea este puternic coordonată în spațiu. Tom
porfirinele și corinoidele formează complexe cu cationi de diferite elemente și urme de metale din sol. Așa e, ce Indiferent de dentarea ligandului, legăturile chimice și complexul sunt atribuite atomilor donor. Astfel, de exemplu, complecşi de mediu cu NH3, etilendiamină şi porfirină prezintă, totuşi, o configuraţie electronică pătrată sau similară. Mai mulți liganzi polidentați se leagă de ionii metalici mult mai puternic decât liganzii monodentați inferiori.

Mic 7.3. Macrociclu tetradentat
cu aceiaşi atomi donatori. Valoarea complecșilor de etilendiamină este cu 8-10 ordine de mărime mai mare, iar valoarea acelorași metale cu amoniacul este mai mică.
Se numesc complexe bioanorganice de ioni metalici cu proteine bioclustere - complexe de ioni metalici cu compuși macrociclici (Fig. 7.4).

Mic 7.4. Reprezentarea schematică a structurii bioclusterelor de diferite dimensiuni ale complexelor proteice cu ioni de elemente d. Tipuri de interacțiuni ale moleculelor de proteine. M n+ - ion metalic la centrul activ
Mijlocul bioclusterului este gol. Înainte vine un metal care interacționează cu atomii donatori ai grupărilor de legătură: OH - , SH - , COO - , -NH 2 , proteine, aminoacizi. Cel mai vizibil metalofer-
enzime (anhidrază carbonică, xantin oxidază, citocromi) și bioclustere, ale căror părți goale creează centri enzimatici care conțin Zn, Mo, Fe în general.
7.13. Complexe nucleare bogate
Complexe heterovalente și heteronucleare
Se numesc complexe care conțin un număr de atomi centrali ai unuia sau a diferitelor elemente Bogată nucleară. Posibilitatea de a crea complexe bogate-nucleare este determinată de faptul că anumiți liganzi se leagă de doi sau trei ioni metalici. Astfel de liganzi se numesc local Este clar local se numesc complexe. Situri monoatomice posibile, de exemplu:

Ei sunt victorioși în privința pariurilor electronice indivize care aparțin unuia și aceluiași atom. Rolul localităților poate fi schimbat liganzi bogați în atom.În astfel de locuri, perechile de electroni neîmpărtășiți care aparțin unor atomi diferiți sunt vikorizate. ligand poliatomic

A.A. Grіnberg și F.M. Au fost studiați local compușii de filenă, în care liganzii leagă compuși complecși ai aceluiași metal, dar în stadii diferite de oxidare. G. Taube chemându-i complexe de transfer de electroni. Am urmărit reacția de transfer de electroni între atomii centrali ai diferitelor metale. Studiile sistematice ale cineticii și mecanismului reacțiilor oxid-oxid au dus la descoperirea că transferul de electroni între două complexe are loc.
ieși prin locul legendar, care este lămurit. Schimbul de electroni între 2+ și 2+ are loc prin crearea complexului intermediar (Fig. 7.5). Transferul de electroni are loc prin ligandul site-ului clorurii, rezultând formarea complecșilor 2+; 2+.

Mic 7.5. Transferul unui electron la complexul nuclear bogat intermediar
Marea diversitate a complexelor polinucleare este eliminată prin selecția liganzilor organici pentru a înlocui un număr de grupuri donatoare. Soluția acestei soluții este dizolvarea grupărilor donor în ligand, ceea ce nu permite închiderea ciclurilor de chelare. Acesta nu este cazul dacă ligandul are capacitatea de a închide ciclul de chelare și de a acționa simultan ca unul local.
Prin principiul transferului de electroni, există metale de tranziție care prezintă o serie de etape de oxidare stabile. Acest lucru dă ionii titanului, penetrarea și mediul purtătorilor ideali de electroni. Totalitatea opțiunilor pentru crearea de complexe heteronucleare (HSC) și complexe heteronucleare (HNC) bazate pe Ti și Fe este prezentată în Fig. 7.6.
Reacţie

Reacția (1) se numește reacție încrucișată.În reacțiile de schimb, complecșii heterovalenti vor fi intermediari. Toate complexele posibile teoretic pot fi stabilite în mod eficient în minți diferite, așa cum demonstrează diversele fizico-chimice.

Mic 7.6. Formarea de complexe heterovalente și complexe heteronucleare pentru a înlocui Ti și Fe
metode. Pentru transferul cu succes al electronilor, reactivii implicați sunt localizați în țările din apropiere. Acesta se numește probabil principiul Franck-Condon. Transferul de electroni poate avea loc între atomii unui element de tranziție, care se află în diferite stadii de oxidare a HVA, sau diferite elemente ale HCA, a căror natură a centrelor metalice variază. Tsi poate fi calculat ca complexe de transfer de electroni. Sunt purtători puternici de electroni și protoni în sistemele biologice. Adăugarea și livrarea unui electron provoacă modificări în configurația electronică a metalului, fără a modifica structura complexului de depozit organic. Toate aceste elemente suferă un număr de etape de oxidare stabile (Ti +3 și +4; Fe +2 și +3; Cu +1 și +2). În opinia noastră, acestor sisteme li se acordă prin natură un rol unic în asigurarea rulării proceselor biochimice cu aport minim de energie. Înainte de reacțiile inverse, există reacții care au constante termodinamice și termochimice cuprinse între 10 -3 și 10 3 și cu valori mici ale ΔG o i E o proceselor În aceste minți, ieșirile și produșii de reacție pot fi prezenți la concentrații diferite. Atunci când le schimbăm într-un interval dat, procesul poate fi ușor inversat; prin urmare, în sistemele biologice, multe procese pot avea o natură covalentă (violentă). Sistemele pe bază de oxizi, care pândesc în depozitele lor, acoperă o gamă largă de potențiale, ceea ce le permite să interacționeze, ceea ce este însoțit de modificări moderate Δ G oі E°, cu o multitudine de substraturi.
Omogenitatea HVA și HYAC crește semnificativ dacă există dorința de a conține potențiali liganzi locali. molecule sau ioni (aminoacizi, hidroxiacizi, complexoni etc.) care leagă doi centri metalici. Posibilitatea delocalizării electronului în GVK are ca rezultat o scădere a energiei totale a complexului.
Numărul mai mare de opțiuni posibile pentru prepararea HVA și HYAK, în care natura centrelor metalice este diferită, poate fi văzut în Fig. 7.6. O descriere detaliată a creării GVK și HYAK și rolul lor în sistemele biochimice este revizuită în lucrarea lui O.M. Glebova (1997). Perechile oxid-hidroxid sunt slăbite structural unul la unu, astfel încât transferul devine posibil. Selectând diferite componente, puteți „mesteca” amestecul, care transferă electronul de la agentul de oxidare la agentul de oxidare. Cu o mișcare adecvată a particulelor, poate avea loc transferul de electroni prin mecanismul coloanei vertebrale. Ca un „coridor” puteți hidrata lanceta proteică și așa mai departe. Fiabilitate ridicată a transferului de electroni la tensiune de până la 100A. Întregul coridor poate fi completat cu aditivi (ion de metale, electroliți de fond). Acest lucru dezvăluie posibilități mari în managementul depozitului și autorităților GVK și GYAK. În Rusia, duhoarea joacă rolul unui fel de „cutie neagră” plină cu electroni și protoni. Ținând mobilierul deoparte, le puteți adăuga la alte componente sau vă puteți completa „rezervele”. Reversibilitatea reacțiilor din părțile lor permite un număr mare de participare la procesele ciclice. Electronii se deplasează de la un centru metalic la altul, oscilând între ei. Molecula complexului devine asimetrică și poate lua parte la procesele de formare de oxizi. GVK și HYAK participă activ la procesele de cologeneză din mediile biologice. Acest tip de reacție se numește reacții colaterale. Duhoarea a fost detectată în cataliza enzimatică, sinteza proteinelor și alte procese biochimice care însoțesc substanțele biologice. Aceasta include procese periodice de metabolism celular, diverse activități în țesutul cardiac, țesutul cerebral și procesele care au loc la nivelul sistemelor ecologice. p align="justify"> Un pas important în schimbul de discursuri este separarea apei de discursurile vii. Atomii se deplasează în starea de ionizare, iar întărirea electronilor lor intră în lancea activă și contribuie cu energia lor la crearea ATP. După cum am stabilit, complexele de titan sunt purtători activi atât de electroni, cât și de protoni. Rolul ionilor de titan în rolul lor în centrul activ al enzimelor precum catalaze, peroxidaze și citocromi este indicat de nivelul lor ridicat de complexare, formarea geometriei ionului coordonat, crearea de HVAC și HVAC-uri bogate în nuclee. stocare și putere diferite.informații despre funcția pH, concentrația elementului de tranziție Ti și complexul de stocare organică, ex relație de rugăciune. Această proprietate se manifestă prin selectivitatea crescută a complexului
în raport cu substraturi, produse ale proceselor metabolice, activarea legăturilor în complex (enzimă) și substrat pentru coordonarea suplimentară și modificarea formei substratului în conformitate cu forțele sterice ale centrului activ.
Transformările electrochimice din organism, asociate cu transferul de electroni, sunt însoțite de o modificare a etapei de oxidare a particulelor și o modificare a potențialului de oxidare al organismului. Un rol important în aceste transformări aparține complexelor bogate-nucleare GVK și GYAK. Sunt regulatori activi ai proceselor de radicali liberi, un sistem de utilizare a formelor active de acid, peroxid de apă, agenți oxidanți, radicali și participă la substraturile oxidate, precum și la menținerea homeostaziei antioxidante, la protejarea organismului în ID oxidative. stres. Acțiunea lor enzimatică asupra biosistemului este similară cu enzimele (citocrom, superoxid dismutază, catalază, peroxidază, glutation reductază, dehidrogenază). Toate acestea sunt de spus despre puterea antioxidantă ridicată a complexonaților elementului de tranziție.
7.14. MÂNARE ȘI RECEPȚIE PENTRU PREGĂTIREA AUTOVERIFICATĂ ÎNAINTE DE CLASURI ȘI EXAMENE
1. Înțelegerea problemelor complexe. Care este valoarea lor în comparație cu sărurile de calitate superioară și ce este mai bun în ele?
2. Adunați formulele compușilor complecși sub denumirile lor: dihidroxotetracloroplatinat de amoniu (IV), triammintrinnitrocobalt (III), dați caracteristicile acestora; indicați sfera de coordonare internă și externă; ionul central și stadiul oxidării sale: liganzi, tăria și densitatea lor; natura legăturilor. Scrieți nivelul de disociere în solul apos și virus pentru o stabilitate constantă.
3. Puterea exaltată a reacțiilor complexe, disocierea, persistența complexelor, puterea chimică a complexelor.
4. Cum se caracterizează reacția complexelor din pozițiile termodinamice și cinetice?
5. Ce complexe amino vor fi mai semnificative, tetraamino-cupru inferior (II) și care vor fi mai puțin semnificative?
6. Dirijarea aplicaţiilor complexelor macrociclice create cu ioni de metale; ionii elementelor d.
7. Prin ce semn ar trebui aduse complexele la chelare? Concentrați-vă pe utilizarea formulărilor complexe chelate și nechelate.
8. În aplicarea glicinatului de miere, dați o înțelegere a efectelor complexelor interne. Scrieți formula structurală a complexonatului de magneziu cu acid etilendiaminotetraoctic sub formă de sodiu.
9. Schițați un fragment structural al oricărui complex polinuclear.
10. Dați semnificația complexelor polinucleare, heteronucleare și hetero-strike. Rolul metalelor de tranziție este bine înțeles. Rolul biologic al acestor componente.
11. Ce tipuri de legături chimice se formează în compușii complecși?
12. Revedeți principalele tipuri de hibridizare a orbitalilor atomici care pot apărea la atomul central din complex. Care este geometria complexului, în funcție de tipul de hibridizare?
13. Provenind din forma electronică a atomilor elementelor blocuri s-, p- și d, stabiliți relația cu complexarea și locul lor în chimia complexelor.
14. Dați valorile complexonilor și complexonatelor. Găsiți aplicațiile celor mai mari cercetări în biologie și medicină. Introduceți principiile termodinamice pe care se bazează terapia de chelare. Suspensie de complexonați pentru neutralizarea și eliminarea xenobioticelor din organism.
15. Priviți principalele tipuri de perturbare a homeostaziei liganzilor metalici în corpul uman.
16. Ajustați capturile compușilor biocomplexi pentru a îndepărta metalul, cobaltul și zincul.
17.Aplică procese concurente pentru participarea hemoglobinei.
18. Rolul ionilor metalici în enzime.
19. Explicați de ce pentru cobalt în complexe cu liganzi de pliere (polidentat) stadiul de oxidare stabil este +3, iar în sărurile elementare precum halogenuri, sulfați, nitrați, stadiul de oxidare este +2?
20. Pentru cupru, etapele caracteristice de oxidare sunt +1 și +2. Cum poate cuprul să catalizeze reacțiile prin transferul de electroni?
21. Cum poate cataliza zincul reacțiile de oxid?
22. Care este mecanismul de eliminare a mercurului?
23. Adăugați acid și bază în reacție:
AgN03 + 2NH3 = NO3.
24. Explicați de ce, ca medicament medicinal, se utilizează sarea de potasiu-sodiu a acidului hidroxietiliden difosfonic, și nu OEDP.
25. Cum afectează ionii metalici care intră în depozitul compartimentelor biocomplexelor transportul electronilor în organism?
7.15. TESTE
1. Etapa de oxidare a atomului central din ionul complex 2- mai scump:
a) -4;
b) +2;
la 2;
d)+4.
2. Cel mai stabil ion complex:
a) 2-, Kn = 8,5 x10 -15;
b) 2-, Kn = 1,5 x10 -30;
c) 2-, Kn = 4x10 -42;
d) 2-, Kn = 1x10 -21.
3. Soluția conține 0,1 mol de PtCl44NH3. Reacționând cu AgNO3, acesta dizolvă 0,2 mol de precipitat de AgCl. Dați discursului de ieșire o formulă de coordonare:
a)Cl;
b) CI3;
c) CI2;
d) CI4.
4. Pe măsură ce complexele create ca rezultat prind contur sp 3 d 2-gi- bridizare?
1) tetraedru;
2) pătrat;
4) bipiramida trigonală;
5) liniară.
5. Selectați o formulă pentru prepararea sulfatului de pentaamină clorocobalt (III):
a) Na 3 ;
6) [CoCI2(NH3)4]CI;
c) Până la 2 [C(SCN) 4];
d)SO4;
e) [C(N 2 Pro) 6 ] C1 3 .
6. Ce liganzi sunt polidentați?
a) C1 -;
b) H20;
c) etilendiamină;
d) NH3;
e) SCN - .
7. Agenți de formare a complexului:
a) perechi atom-donor de electroni;
c) ion atomit-acceptor al perechilor de electroni;
d) ioni de atomi-donatori de perechi de electroni.
8. Cele mai mici elemente care creează complexe sunt:
la fel de; c) d;
b) p; d) f
9. Ligandi – tse:
a) molecule donatoare de perechi de electroni;
b) ioni-acceptori ai perechilor de electroni;
c) molecule şi ioni-donatori de perechi de electroni;
d) molecule ion-acceptatoare ale perechilor de electroni.
10. Legături în sfera de coordonare internă a complexului:
a) schimb covalent;
b) donor-acceptor covalent;
c)ionna;
d) Vodneva.
11. Cel mai frumos complex va fi:
Principala reacție de substituție în compușii apoși - schimbul de molecule de apă (22) - a fost studiată pentru un număr mare de ioni metalici (Fig. 34). Schimbul de molecule de apă în sfera de coordonare a ionului metalic cu cea mai mare parte a moleculelor de apă, care este sursa, are loc foarte rapid pentru majoritatea metalelor și, prin urmare, viteza unei astfel de reacții ar putea fi determinată prin metoda principală de relaxare. Metoda se aplică sistemelor de fluide deteriorate, de exemplu, schimbări bruște de temperatură. Datorită minții noi (temperaturi mai ridicate), sistemul nu mai este supus schimbării. Apoi, fluiditatea setării nivelului dispare. Puteți schimba temperatura trăgând 10 -8 sec, atunci puteți controla fluiditatea reacției, care necesită mai mult de o oră pentru finalizare 10 -8 sec.
De asemenea, este posibil să se măsoare fluiditatea substituției moleculelor de apă coordonate în diverși ioni metalici cu liganzi SO 2- 4, S 2 O 3 2-, EDTA etc. (26). Fluiditatea unei astfel de reacții
se află în concentrația ionului metalic hidratat și nu se află în concentrația ligandului de intrare, ceea ce permite o comparație de ordinul întâi pentru a descrie fluiditatea acestor sisteme (27). În multe cazuri, viteza reacției (27) pentru un ion metalic dat nu depinde de natura ligandului de intrare (L), fie de molecula de H 2 O, fie de ionul SO 4 2-, S 2 O 3 2 - sau EDTA.
Datorită precauției, precum și faptului că viteza acestui proces nu include concentrația ligandului de intrare, este posibil să se permită reacției să se desfășoare în funcție de mecanismul în care se află cea mai mare parte a etapei de descompunere a reactia.'limba dintre ionul metalic si apa. Este clar că este posibil să ieși, apoi coordonează rapid liganzii care sunt în apropiere.
La departament În 4 părți ale capitolului s-a remarcat că ionii metalici hidratați mai puternic încărcați, cum ar fi Al 3+ și Sc 3+, schimbă mai mult molecule de apă, ionii inferiori M 2+ și M +; Acest lucru ne permite să presupunem că în această etapă, ceea ce înseamnă fluiditatea întregului proces, defalcarea ligamentelor joacă un rol important. Descoperirile identificate în aceste investigații nu sunt reziduale, dar sugerează că în reacțiile de substituție a ionilor metalici hidratați, procesele S N 1 sunt importante.
Evident, cei mai activi compuși complecși sunt cobaltul (III). Stabilitatea lor, ușurința de pregătire și reacția foarte precisă le fac deosebit de potrivite pentru cultivarea cinetică. Unele dintre cercetările asupra acestor complexe au fost efectuate inclusiv în surse de apă, uitându-se în primul rând la reacțiile acestor complexe cu moleculele sursei - apă. S-a constatat că moleculele de amoniac sau amine, coordonate de ionul Co(III), sunt complet înlocuite cu molecule de apă, ceea ce înseamnă că sunt luate în considerare substituțiile altor liganzi, și nu aminelor.
S-a determinat fluiditatea reacției de tip (28) și s-a constatat că complexul de cobalt este de ordinul întâi (X este unul dintre mulți anioni posibili).
Deci, deoarece în câmpurile de apă concentrația de H 2 O este aproximativ aceeași ca înainte 55,5 M, nu este posibil să se determine efectul modificării concentrației moleculelor de apă asupra fluidității reacției. Nivelul de fluiditate (29) și (30) pentru producția de apă nu este determinat experimental, deoarece este pur și simplu echivalent cu k" = k". Cu toate acestea, din cauza vitezei de reacție, este imposibil de spus dacă H2O ia parte la etapă, ceea ce înseamnă viteza procesului. Este necesar să se furnizeze reacția mecanismului S N 2 prin înlocuirea ionului X cu o moleculă de H 2 O și a mecanismului S N 1, care transmite disocierea inițială din adăugarea ulterioară a moleculei de H 2 O. dar excluderea acesteia cu cu ajutorul altor date experimentale.
Dezvoltarea acestei sarcini poate fi realizată prin două tipuri de experimente. Lichiditatea hidrolizei (înlocuirea unui ion Cl – pe moleculă de apă) transă- + Aproximativ de 10 3 ori mai multă fluiditate decât hidroliza 2+. O creștere a încărcăturii complexului duce la întărirea legăturilor metal-ligand și, prin urmare, la galvanizarea rupturii acestor legături. Acest lucru are ca rezultat, de asemenea, greutatea liganzilor de intrare și ușurința reacției de substituție. Deoarece s-a dezvăluit o schimbare a fluidității datorită încărcăturii crescute a complexului, atunci în această fază are loc un proces disociativ mai puternic (S N 1).
O altă modalitate de a demonstra baza pentru o serie de complexe similare tratate cu hidroliză transă- +. În aceste complexe, molecula de etilendiamină este înlocuită cu diamine similare, în care atomii de carbon și atomii de apă sunt înlocuiți cu grupări CH3. Complexele care înlocuiesc diamina reacţionează cu complexul inferior de etilendiamină. Înlocuirea atomilor de apă cu grupări CH3 crește sarcina ligandului, ceea ce face mai dificilă atacarea atomului de metal cu un alt ligand. Aceste tranziții sterice sporesc reacția mecanismului S N 2. Prezența liganzilor voluminosi în apropierea atomului de metal contribuie la procesul disociativ, fragmentele unuia dintre liganzii îndepărtați reduc acumularea lor în atomul de metal lu. Fluiditatea crescută observată a hidrolizei complexelor cu liganzi voluminoase este o dovadă bună că reacția se desfășoară prin mecanismul S N 1.
De asemenea, ca urmare a studiilor numerice ale complexelor de acidoamină de Co(II), a fost relevat că înlocuirea grupărilor acide cu molecule de apă este un proces inerent disociativ. Legarea atomului de cobalt - ligandul se va lega la o anumită valoare critică, mai întâi moleculele inferioare de apă vor începe să intre în complex. În complexele care poartă o sarcină de 2+ și mai mare, rupând legătura, cobaltul este un ligand și mai dificil, iar intrarea moleculelor de apă începe să joace un rol important.
S-a constatat că înlocuirea grupării acid (X -) din complexul cobalt(III) cu o altă grupă, molecula inferioară H 2 O, (31) trece prin molecula substituită.
comerciantul cu amănuntul - conduce cu un înlocuitor imediat pentru un nou grup Y (32).
Astfel, în multe reacții cu complecși de cobalt(III), viteza de reacție (31) este mai mare decât viteza de hidroliză (28). În plus, ionul hidroxil este perturbat de alți reactivi atunci când reacţionează cu aminele Co(III). Vinul reacționează foarte repede cu complecșii de amine la cobalt(III) (de aproximativ 10 6 ori mai rapid, apă mai mică) în funcție de tipul de reacție hidroliza principală (33).
S-a descoperit că această reacție este de ordinul întâi datorită substituției ligandului OH - (34). O ordine de reacție complet diferită și viteza reacției ne permit să presupunem că ionul OH este un reactiv nucleofil eficient în raport cu complecșii Co(III) și că reacția se desfășoară prin mecanismul S N 2 prin conexiunea perineală a soluției.
Cu toate acestea, puterea OH poate fi explicată printr-un alt mecanism [relația (35), (36)]. În reacția (35), complexul 2+ se comportă ca un acid (după Brønsted), dând complexul +, care este є amido-(răzbunare)-semibază, care este 2+ acidă.
Apoi reacția continuă prin mecanismul S N 1 (36) cu crearea unui intermediar cu cinci coordonate, care reacţionează apoi cu moleculele iniţiatorului pentru a conduce la produsul final al reacţiei (37). Acest mecanism de reacție este în concordanță cu fluiditatea reacției de ordin diferit și este similar cu mecanismul S N 1. Fragmentele reacției din etapa care produce fluiditate includ baza asociată cu complexul cob om - acid, apoi acest mecanism i se dă denumirea S N 1СВ.
Prin urmare, care dintre aceste mecanisme explică cel mai bine precauțiile experimentale este și mai important. Cu toate acestea, există dovezi suplimentare care susțin ipoteza nr. 1CB. Cele mai bune argumente pentru mecanismul acestui mecanism sunt următoarele: complexele octaedrice Co(III) încep să reacționeze prin mecanismul disociativ S N 1 și nu există argumente comune pentru care ionul OH este responsabil de procesul S N 2. Are S-a stabilit că ionul hidroxil - un reactiv nucleofil slab în reacțiile de la Pt(II), și aceasta pare a fi reacția fără cauză la Co(III). Reacțiile cu reacții de cobalt(III) în medii neapoase sunt o dovadă excelentă a creării de compuși intermediari cu cinci coordonate, care sunt transmise prin mecanismul S N 1 SV.
Dovezile rămase sunt că, datorită prezenței legăturilor N - H în complexul Co(III), acesta reacționează complet cu ionii OH -. Acest lucru, desigur, face important ca, pentru viteza reacției, puterea acido-bazică a complexului să fie importantă pentru puterea nucleofilă a VIN." Pentru a opri orice alt mecanism posibil, trebuie să efectuați un experiment subtil.
În prezent, s-a observat reacția de substituție a unui număr mare de emisfere octaedrice. De îndată ce mecanismele lor de reacție sunt examinate, procesul disociativ se intensifică cel mai adesea. Acest rezultat nu este necontroversat, deoarece șase liganzi lasă puțin spațiu în apropierea atomului central pentru adăugarea altor grupări. Doar câteva aplicații sunt vizibile dacă joncțiunea de intervenție cu șapte coordonări a fost identificată sau a fost injectat un ligand care va fi utilizat. Prin urmare, mecanismul S N 2 nu poate fi complet inversat, așa cum este posibil în cazul unei reacții de substituție în complexe octaedrice.
Din punct de vedere mental, reacțiile chimice ale complexelor includ schimbul, oxidarea, izomerizarea și liganzii coordonați.
Disocierea primară a complexelor în sferele interne și externe înseamnă depășirea reacției de schimb de ioni externi:
Xm+mNaY = Ym+mNaX.
Componentele sferei interne a complexelor pot lua parte la procesele metabolice care implică atât liganzi, cât și agenți de complexare. Pentru a caracteriza reacția de substituție a liganzilor sau a ionului metalic central, terminologia dezvoltată de K. Ingold pentru reacțiile compușilor organici (Fig. 42), nucleofile S N și electrofilă S E substituție:
Z + Y = z + X S N
Z + M" = z + M S E .
Mecanismul reacției de substituție este împărțit (Fig. 43) în asociativ ( S N 1 și SE 1 ) și disociative ( S N 2 și SE 2 ), care sunt afectate de faza de tranziție cu un număr de coordonare crescut și scăzut.
Actualizarea mecanismului de reacție la asociativ sau disociativ este importantă prin realizarea experimentală a identificării intermediarului cu o modificare sau creștere a numărului de coordonare. În legătură cu aceasta, mecanismul reacției este adesea judecat pe baza datelor indirecte despre creșterea concentrației de reactivi asupra fluidității reacției, modificarea formei geometrice a produsului de reacție etc.
Pentru a caracteriza fluiditatea reacției de substituție a liganzilor în complexe, laureat Nobel s-a născut în 1983. R. Taube (Fig. 44) a definit cu atenție termenii „labil” și „inert” atunci când reacția de substituție a liganzilor este mai mică de 1 minut. Termenii labili sau inerți sunt caracteristici cineticii reacției de substituție a ligandului și nu trebuie confundați cu caracteristicile termodinamice ale stabilității sau instabilității complexelor.
Labilitatea și inerția complecșilor depind de natura ionului de complexare și a liganzilor. Similar cu teoria câmpului ligand:
1. Complexe octaedrice 3 d metale de tranziție cu distribuție de valență ( n -1) d electroni pe sigma*(de exemplu ) Pufă laboratorul MO.
4- (t 2g 6 e g 1) + H2O= 3- + CN -.
Mai mult, cu cât valoarea energiei de stabilizare a complexului de către câmpul cristalin este mai mică, atunci labilitatea acestuia este mai mare.
2. Complexe octaedrice 3 d metale de tranziție cu sigma puternică* Cu pufoase de ex orbitali și distribuție egală a valenței ( n -1) d electroni prin orbital t 2 g (t 2 g 3, t 2 g 6) inert.
[Co III (CN) 6] 3- (t 2 g 6 e g 0 ) + H 2 O =
[Cr III (CN) 6] 3- (t 2 g 3 e g 0) + H 2 O =
3. Plan-pătrat și octaedric 4 d și 5 d metale de tranziție care nu transferă electroni în sigma* Puf up MO inert.
2+ + H20 =
2+ + H20 =
Infuzia naturii liganzilor asupra vitezei reacției de substituție a liganzilor în cadrul modelului „perfuzie reciprocă de liganzi”. Să rezumăm modelul influxului reciproc de liganzi, formulat în 1926. I.I. Conceptul Chernyaevym de trans-flux (Fig. 45) - „labilitatea ligandului în complex constă în natura ligandului trans-împrăștiat” - și generează un număr de liganzi trans-împrăștiați: CO, CN -, C 2 H 4 > PR 3, H - > CH 3 -, SC (NH 2) 2 > C 6 H 5 -, NO 2 -, I -, SCN - > Br -, CI - > py , NH3, OH-, H20.
Conceptul de trans-flow ne-a permis să stabilim reguli empirice:
1. regula lui Peyronie- în prezența amoniacului sau aminelor pe tetracloroplatinat ( II ) potasiul iese prima configurație cis de diclorodiaminplatină:
2 - + 2NH3 = cis - + 2CI -.
Reacția se desfășoară în două etape și ligandul clor produce un flux trans mare, apoi înlocuirea unui alt ligand clorură cu amoniac are ca rezultat crearea de cis-[ Pt (NH3)2Cl2]:
2 - + NH3 = -
NH3 = cis -.
2. regula lui Jergensen - când acidul diclorohidronic reacţionează cu clorura de tetramină de platină ( II ) sau rezultate similare pot fi obținute din trans-configurarea dicloro-aminoplatină:
[Pt(NH3)4]2+ + 2HCI = trans-[Pt(NH3)2CI2] + 2NH4CI.
Este posibil să se introducă o serie de trans-infuzii de liganzi, înlocuind o altă moleculă de amoniac cu un ligand clorură până la trans-[ Pt (NH3)2CI2].
3. Reacția cu tiouree a lui Kurnakov - diferiți produși ai reacției tiomonului cu izomerii geometrici trans-[ Pt (NH 3 ) 2 Cl 2 ] și cis-[ Pt (NH 3 ) 2 Cl 2 ]:
cis - + 4Tio = 2 + + 2CI - + 2NH3 .
Natura diferită a produselor de reacție de legare cu trans-influx ridicat de tiouree. Prima etapă a reacției este înlocuirea liganzilor de clorură de tiouree cu trans-cis-[ Pt (NH 3 ) 2 ( Thio ) 2 ] 2+ :
trans-[Pt (NH 3) 2 Cl 2 ] + 2 Thio = trans-[ Pt (NH 3) 2 (Tio) 2 ] 2+
cis - + 2Thio = cis - 2+.
În cis-[Pt (NH3)2 (Tio ) 2 ] 2+ două molecule de amoniac sunt în poziție trans până când tioureea este supusă unei substituții ulterioare, ceea ce duce la constipație 2+ :
cis - 2+ + 2Tio = 2+ + 2NH3.
În trans-[Pt (NH3)2 (Thio ) 2 ] 2+ două molecule de amoniac cu o mică trans-infuzie sunt extinse în poziţia trans unu la unu şi, prin urmare, nu sunt înlocuite cu tiouree.
Modelele trans-flow au fost descoperite de I.I. Înnegrim reacția de substituție a liganzilor în complexe de platină pătrat-planare ( II ). S-a demonstrat în continuare că trans-infuzia de liganzi apare și în complexele altor metale ( Pt(IV), Pd(II), Co(III), Cr(III), Rh(III), Ir(III) )) și alte forme geometrice. Adevărat, seria de liganzi trans-splitting pentru diferite metale variază foarte mult.
Urma indică faptul că trans-injecția este efect cinetic- cu cat trans-infuzia acestui ligand este mai mare, cu atat fluiditatea in inlocuirea altui ligand care se afla anterior in trans-pozitie este mai mare.
Comanda cu efect cinetic trans-influx, la mijloc XX stolіttya A.A. Grinberg și Yu.M. Kukushkin a determinat capacitatea de stocare a ligandului trans-influent L la ligandul care se află înainte în poziţia cis L . Astfel, investigarea fluidității reacției de substituție Cl- amoniac în complexe de platină ( II):
[PtCl4] 2- + NH3 = [PtNH3CI3] - + CI - K = 0,42. 10 4 l/mol. h
[PtNH3CI3] - + NH3 = cis-[Pt (NH3)2Cl2] + CI -K = 1,14. 10 4 l/mol. h
trans-[ Pt (NH 3 ) 2 Cl 2 ] + NH 3 = [ Pt (NH 3 ) 3 Cl ] + + Cl - K = 2,90. 10 4 l/mol. h
a arătat că prezența a una sau două molecule de amoniac în cis-poziționat față de ligand de clorură, care este înlocuit, duce la o creștere consistentă a fluidității reacției. Acest efect cinetic a fost numit cis-influx. În acest moment, efectele cinetice ale infuziei naturii liganzilor asupra fluidității reacției de substituție a liganzilor (infuzii trans și cis) sunt înțelese în conceptul juridic. influxul reciproc de liganzi.
Teoretic, efectul influxului reciproc de liganzi este strâns legat de dezvoltarea fenomenului de legături chimice în compuși complecși. La 30's Rock XX stolіttya A.A. Grinberg și B.V. Nekrasovim analizează trans-influxul în cadrul modelului de polarizare:
1. Trans-infuzia caracteristică a complexelor, ionul central al cărui metal are o polarizabilitate ridicată.
2. Activitatea trans a liganzilor este determinată de valoarea energetică a polarizării reciproce a ligandului și a ionului metalic. Pentru un ion metalic dat, trans-injectarea ligandului este determinată de polarizarea și poziția sa față de ionul central.
Modelul de polarizare este în concordanță cu datele experimentale pentru complecși cu liganzi anionici simpli, cum ar fi ionii de halogenură.
Născut în 1943 A.A. Greenberg a presupus că trans-activitatea liganzilor este conectată cu autoritățile lor finale. Schimbarea densității electronilor de la ligandul trans-activ la metal modifică sarcina efectivă a ionului la metal, rezultând o slăbire a legăturii chimice cu ligandul trans-activ.
Dezvoltarea fenomenului de trans-infuzie este asociată cu marea trans-activitate a liganzilor pe bază de molecule organice nesaturate, asemănătoare etilenei în [ Pt(C2H4)CI3 ] - . Cu gândul la Chatta și Orgela (Fig. 46), aceasta este legată depi-interacțiunea dativă a unor astfel de liganzi cu metalul și mecanismul asociativ al reacției de substituție a liganzilor trans-rotati. Coordonarea cu ionul metalic al ligandului atacator Z duce la crearea unui intermediar trigonal-bipiramidal cu cinci coordonate cu diviziuni rapide suplimentare ale ligandului care merge, X. Crearea unui astfel de intermediar coincidepi-interacțiunea ligand dativ-ligand metal Y , care modifică densitatea electronică a metalului și reduce energia de activare a stării de tranziție cu înlocuirea lichidă suplimentară a ligandului X.
Comanda 3 p acceptori (C2H4, CN-, CO ...) liganzi care creează o legătură chimică ligand dativ-metal, trans-influx mare șisliganzi donatori: H-, CH3-, C2H5- ... Trans-infuzia unor astfel de liganzi este indicată de interacțiunea donor-acceptor dintre ligand X și metal, care îi reduce densitatea de electroni și slăbește legăturile dintre metal și ligand care sunt prezente. Y.
Astfel, poziția liganzilor într-un număr de activități trans este indicată de o puternică sigma- donatori pi-autoritățile liganzilor - sigma- donator pi-puterea acceptor a ligandului va forța trans-influxul acestuia, decipi-donator – slăbi. Care dintre aceste interacțiuni ligand-metal de stocare este importantă în fluxul trans pentru a judeca pe baza evoluțiilor chimice cuantice ale etapei electronice a stării de tranziție a reacției.