VIŇACHENNYA
Surma- padesátý první prvek periodické tabulky. Označeno – Sb z latinského „stibium“. Vystřídáno v páté třetině, skupina VA. Naneste na kovy. Základní nabití je stále 51.
Surma se v přírodě vyskytuje v kombinaci se surmacy - ve vzhledu surmacy glitter]6 nebo antimonitu, Sb 2 S 3 . Bez ohledu na to, že místo surmy v zemské kůře je velmi malé, surma existuje již dlouhou dobu. To je vysvětleno šířkou povahy vážné blaženosti a snadností odstranění tohoto předpokladu.
V nejlepším případě surma vytváří stříbrno-bílé krystaly (obr. 1), které vytvářejí kovový třpyt a mají tloušťku 6,68 g/cm 3 . Přestože vypadá jako kov, krystalická surma má drsnost a je mnohem účinnější při vedení tepla a elektrického proudu než nižší primární kovy. Krém z krystalického antimonu v důsledku jiných a alotropních modifikací.
Malý 1. Surma. Vnější vzhled.
Atomová a molekulární hmotnost surmi
Vidnosná molekulová hmotnost rechoviny(M r) je číslo, které ukazuje, kolikrát je hmotnost dané molekuly větší než 1/12 hmotnosti atomu uhlíku a atomová hmotnost prvku(A r) - kolikrát průměrná hmotnost atomů chemického prvku přesahuje 1/12 hmotnosti atomu uhlíku?
Fragmenty surmy se objevují ve formě monoatomárních molekul Sb, jejichž hodnoty atomové a molekulární hmotnosti splývají. Smradlavé zdražují o 121 760,-.
Izotopy surmi
Zdá se, že v přírodě může mít antimon dva stabilní izotopy: 121 Sb (57,36 %) a 123 Sb (42,64 %). Jejich hmotnostní čísla dosáhnou 121 a 123. Jádro atomu k izotopu surmium 121 Sb obsahuje padesát jedna protonů a sedmdesát neutronů a izotop 123 Sb má stejný počet protonů a sedmdesát dva neutronů.
Existují unikátní nestabilní izotopy surmium s hmotnostními čísly od 103 do 139 a také více než dvacet jaderných izomerů, mezi nimiž je nejdéle žijící izotop 125 Sb s dobou rychlého rozpadu ivnim 2,76 roku.
Ioni surmi
Na aktuální energetické úrovni atomu surmium je pět elektronů, které jsou valenční:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 3 .
Prostřednictvím války chemických interakcí se pak surma vzdává svých valenčních elektronů. Je jejich dárcem a mění se v kladně nabitý iont a přijímá elektrony z jiného atomu. Je to jejich akceptor a je přeměněn na záporně nabitý iont:
Sb 0 -3e → Sb 3+;
Sb 0 -5e → Sb 5+;
Sb 0 +3e → Sb 3-.
Molekula a atom surmi
V reálném světě se surma tvoří jako monoatomické molekuly Sb. Podívejme se na dynamiku síly, která charakterizuje atom a molekulu surmi:
Plovoucí surmi
Antimon se zavádí do slitiny, aby získala tvrdost. Slitina, která je kombinována s antimonem, olovem a malým množstvím cínu se nazývá Drukhar metal a používá se k přípravě písma Drukar. Tato slitina antimonu a olova (5 až 15 % Sb) se používá k výrobě desek olověných baterií, plechů a trubek pro chemický průmysl.
Aplikujte na řešení problémů
ZADNÍK 1
Surma
Surma-A; a.[Peršan. surma - metal]
1. Chemický prvek (Sb), modrobílý kov (v technologii se vyskytuje v různých slitinách, jinými slovy). Tavírna Surmi. Spojení surmi se sirkou.
2. Za starých časů: barva pro černé vlasy, briv, viy. Přineste, nakreslete obočí surmou. Hledejte na obličeji surmi.
◁ Surmyanii, -a, -oe (1 číslice). S-tá ruda. Slitina S-i. S. blisk(Minerál olověně šedé barvy, který je podobný surmě a sirce).
surma(lat. Stibium), chemický prvek V. skupiny periodického systému. Toho je dosaženo modifikací. Primární surma (jak se sir říká) – modrobílé krystaly; tloušťka 6,69 g/cm 3 t teplota tání 630,5°C. Ve větru se nemění. Nejdůležitějším minerálem je antimonit (surmian blisk). Složka slitin na bázi olova a cínu (baterie, kov, ložiska atd.), materiály vodičů.
SurmaSurma (lat. Stibium), Sb, (čti „stibium“), chemický prvek s atomovým číslem 51, atomová hmotnost 121,75. Přírodní antimon se skládá ze dvou stabilních izotopů: 121 Sb (hmotnostní rozdíl 57,25 %) a 123 Sb (42,75 %). Rotováno skupinou VA v 5. periodě periodické tabulky. Elektronická konfigurace externí koule 5 s 2
p 3
. Stupně oxidace +3, +5, zřídka -3 (valence III, V). Poloměr atomu je 0,161 nm. Iontový poloměr Sb 3+ 0,090 nm (koordinační čísla 4 a 6), Sb 5+ 0,062 nm (6), Sb 3-0,208 nm (6). Energie následné ionizace jsou 8,64, 16,6, 28,0, 37,42 a 58,8 eV. Elektronegativita podle Paulinga (div. Pauling Linus) 1,9.
Historické pozadí
Surma byla založena v zemích Skhod tři tisíce let před naším letopočtem. Latinský název prvku je spojen s minerálem „Stibi“, ze kterého se surma získávala ve starověkém Řecku. Ruské „surma“ je obdobou tureckého „surme“ – na černění obočí (prášek na černění obočí byl připraven s minerálem vážného lesku). Chernets Vasil Valentin v 15. století popsal proces vyřezávání surmi, slitiny a olova pro lití písma Drukar. Přírodní sirný antimon nazval vážnou horninou. Ve středním století se léčivě používaly přípravky ze surmi: nápoje surmi, víno, vitriman v miskách ze surmi (které vytvořily „kámen na zvracení“ K 1/2H 2 O).
Známý z přírody
Posun zemské kůry je 5 · 10 - 5 % hmotnosti. Nachází se v přírodě v původním stavu. Existuje přibližně 120 minerálů, které obsahují Sb, hlavní řadu, a vzhled sulfidu Sb 2 S 3 (surmian blisk, antimonit, stibnit). Produktem oxidace sulfidu kyselinou Sb 2 O 3 je bílá surmská ruda (valentinit a senarmontit). Surma se často vyskytuje v olověných, měděných a sireových rudách (tetraedrit Cu 12 Sb 4 S 13, jamesonit Pb 4 FeSb 6 S 14).
Otrimannya
Antimon se z taveného sulfidu Sb 2 S 3 odstraňuje z kapaliny:
Sb 2 S 3 +3Fe=2Sb+3FeS,
Vysrážený sulfid Sb 2 S 3 a přídavek extrahovaného oxidu uhličitého:
Sb 2 S 3 +5O 2 =Sb 2 O 4 + 3SO 2,
Sb204 +4C=2Sb+4CO. Čistá surma (99,9 %) se získává elektrolytickou rafinací. Antimon se získává také z olověných koncentrátů oddělených při zpracování polymetalických rud.
Fyzikální a chemické síly
Surma je stříbrnošedá s namodralým nádechem, ostrý nekov. Sira surma, Sb I, s romboedrickými otřepy ( A=0,45064 nm, a=57,1°), což znamená mimořádné mysli. Bod tání 630,5 °C, bod varu 1634 °C. Pevnost 6,69 g/cm3. Při 5,5 GPa přechází Sb I do kubické modifikace Sb II, při 8,5 GPa - hexagonální Sb III, nad 28 GPa - Sb IV.
Sulphur surma má kulovitou strukturu, kde je atom Sb pyramidálně spojen se třemi nádobami kolem koule (mezirozměrná vzdálenost 0,288 nm) a je spojen se třemi nejbližšími nádobami v další kouli (mezirozměrná vzdálenost 0,338 nm). Existují tři amorfní modifikace antimonu. Tuková surma se léčí reakcí kyselosti se vzácným stibinem SbH 3 a vmícháním malého množství chemicky vázané vody (div. VODÍK). Po zahřátí nebo vyčeření se žlutá surma změní na černou surmu (tloušťka 5,3 g/cm 3), která má výkon vodiče.
Při elektrolýze SbCl 3 vzniká v malém proudu Vibuchova surma, aby obsahovala malá množství chemicky vázaného chloru (při strouhání vibruje). Černá surma, když se zahřeje bez přístupu na 400 °C, a Vibukhova surma, když se rozemele, se přemění na kovovou síru surmu. Kovový antimon (Sb I) je vodič. Šířka oplocené zóny je 0,12 eV. Diamagnetické. Kovový antimon je při pokojové teplotě křupavý a na patě snadno rozemletý na prášek, nad 310 °C je plastický, stejně jako plastové monokrystaly antimonu vysoké čistoty.
Antimonidy reagují s některými kovy: antimonidem cínu SnSb, niklem Ni 2 Sb 3, NiSb, Ni 5 Sb 2 a Ni 4 Sb. Surma neinteraguje s kyselinou chlorovodíkovou, fluorovodíkovou a sírovou. Koncentrovaná kyselina dusičná se používá k rozpuštění degradované kyseliny beta-antimonové HSbO 3:
3Sb + 5HN03 = 3HSb03 + 5NO + H20.
Vzorec pro kyseliny antimonové je Sb 2 O 5 · n H 2 O. S koncentrovanou H 2 SO 4 surma reaguje s roztokem síranu surnatého Sb 2 (SO 4) 3:
2Sb + 6H2S04 = Sb2 (S04)3 + 3S02 + 6H20.
Surma je odolná vůči vzduchu do 600 °C. Při dalším zahřívání oxiduje na Sb 2 O 3:
4Sb + 302 = 2Sb203.
Surmium (III) oxid má amfoterní sílu a reaguje s loukami:
Sb203 + 6NaOH + 3H20 = 2Na3.
a kyseliny:
Sb203 + 6HCl = 2SbCl3 + 3H20
Když se Sb 2 O 3 zahřeje na 700 °C, kyselina tvoří oxid Sb 2 O 4:
2Sb203 + O2 = 2Sb204.
Tento oxid se okamžitě smíchá s Sb(III) a Sb(V). Jeho struktura má oktaedrická seskupení jedna ku jedné. Při opatrném zalévání kyselin antimonu se oxid antimonitý Sb 2 O 5 rozpustí:
2HSbO 3 = Sb 2 O 5 + H 2 O,
odhaluje kyselou sílu:
Sb 2 O 5 + 6NaOH = 2Na 3 SbO 4 + 3H 2 O,
a oxidovat:
Sb205 + 10HCl = 2SbCl3 + 2Cl2 + 5H20
Surmi soli se snadno hydrolyzují. Srážení hydroxosolí začíná při pH 0,5-0,8 pro Sb(III) a pH 0,1 pro Sb(V). Produkt hydrolýzy skladujte podle poměru sůl/voda a pořadí činidel:
SbCl3 + H20 = SbOCl + 2HCl,
4SbCl3 + 5H20 = Sb405Cl2 + 10HCl.
S fluorem (div. FLUOR) Surma převádí SbF 5 pentafluorid. Při interakci s kyselinou fluorovodíkovou HF vzniká silná kyselina H. Surma hoří, když se prášek přidá k Cl 2 se směsí SbCl 5 pentachloridu a SbCl 3 trichloridu:
2Sb + 5Cl2 = 2SbCl5, 2Sb + 3Cl2 = 2SbCl3.
S bromem (div. OKRAJ) a jód (div. IOD) Sb reaguje s origalogenidy:
2Sb + 3I2 = 2SbI3.
Při pití vody (div. SIRORORID) H 2 S na vodní hladině Sb(III) a Sb(V) vzniká oranžovočervený trisulfid Sb 2 S 3 nebo oranžový pentasulfid Sb 2 S 5, které interagují se sulfidem amonným (NH 4) 2 S:
Sb 2 S 3 + 3 (NH 4) 2 S = 2 (NH 4) 3 SbS 3,
Sb 2 S 5 + 3 (NH 4) 2 S = 2 (NH 4) 3 SbS 4.
piji vodu (div. VODÍK) stibinový plyn SbH 3 je viditelný na soli Sb:
SbCl3 + 4Zn + 5HCl = 4ZnCl2 + SbH3 + H2
Při zahřátí se stib rozloží na Sb a H2. Extrahujte organické sloučeniny ze surmi, podobné stibinu, například orymethylstibin Sb(CH 3) 3:
2SbCl3 + 3Zn(CH3)2 = 3ZnCl2 + 2Sb(CH3)3
Zastosuvannya
Surma je složka slitin na bázi olova a cínu (pro bateriové desky, drukarové fonty, ložiska, suchá síta pro práci s ionizačními válci, nádobí), na bázi mědi a zinku (pro umělecké odlévání). Čistí vikorystové ze surmu bojují za odstavení antimonidů od federálních úřadů. Vstupte do skladu skládacích syntetických léčivých přípravků. Při přípravě gumy používá vikorista sulfid surmium Sb 2 S 5 .
Fyziologické působení
Surma se redukuje na mikroelementy a v lidském těle je to 10 -6 % hmotnosti. Fyziologické a biochemické role, které jsou trvale přítomny v živých organismech, nejsou vysvětleny. Hromadí se ve štítné žláze, tlumí její funkci a způsobuje endemickou strumu. Když se však ponoří do bylinného traktu, surmi nekřičí, dochází zde k hydrolýze úlomků soli Sb(III) v důsledku tvorby nekvalitních produktů. Pil a sázky Sb způsobují krvácení z nosu, vážnou „horečku“, pneumosklerózu, poškozují kůži, ničí stavové funkce. Pro aerosoly surmi GDC v pracovní oblasti 0,5 mg/m 3 v atmosférickém vzduchu 0,01 mg/m 3 . GDC v půdě je 4,5 mg/kg, ve vodě 0,05 mg/l.
Encyklopedický slovník. 2009 .
Synonyma:Zajímalo by mě, co je „surma“ v jiných slovnících:
Surma, vi... Ruský verbální hlas
- (Perský Sourme). Kov, který je v přírodě kombinován s jasem; Vicorista v medicíně je jako zvracení. Slovník cizích slov, která se dostala do skladu ruského jazyka. Chudinov A.N., 1910. Surma antimon, kovově šedá barva; porazit PROTI. 6,7; … … Slovník cizích slov ruského jazyka
Surma, surmi, surmi, surm, surmi, surma, surma, surmi, surma, surma, surmi, surme, surmah (Dzherelo: „Paradigma A. A. Zaliznyaka je silně zdůrazněno“) ... Formy sliv
Surma, například Old. viraz: nafouklé obočí (Habakuk 259). W tur., kriminál. tat. sürmä surma vid sür farbuvati, tat. sørmä surma (R. 4, 829 a násl.); div. Mi TEL. 2,161; Räsänen, Neuphil. Mitt. 1946, str. 114; Zaionchkovsky, JР 19, 36; Etymologický slovník ruštiny od Maxe Vasmera
- (Symbol Sb), čistý kovový prvek páté skupiny periodické tabulky. Nejrozšířenější rudou je sulfid surmium, Sb2S3. Antimon se vikoruje v různých slitinách, zejména pro dodání tvrdosti olově, které se vikoruje v materiálech. Vědeckotechnický encyklopedický slovník
- (lat. Stibium) Sb, chemický prvek skupiny V periodické soustavy, atomové číslo 51, atomová hmotnost 121,75. Toho je dosaženo modifikací. Původní surma (tzv. pane) modrobílé krystaly; Tloušťka 6,69 g/cm3, teplota tání 630,5 °C. Na… … Velký encyklopedický slovník
Surma, surmi, množné číslo. ne, příteli. (perský surma metal). 1. Chemický prvek je tvrdý a šlachovitý stříbřitě bílý kov, tvrdnoucí. v různých slitinách od technika, od Drukarského reference pro přípravu gartu. 2. Ty samé, kvůli kterým jsi vypadal jako blázen. Tlumachny slovník...... Tlumachny slovník Ushakov
- (Farba, který je vítězem v kosmetice). Namalujte znak. Jméno tatarské, turecké, muslimské manželky. Slovníček pojmů… Slovníček zvláštních jmen
Surma chemický prvek (francouzsky antimoin, angl. antimon, něm. antimon, lat. stibium, symbol hvězdy - Sb, nebo Regulus antimonii; atomové číslo = 120, jako O = 16) - brilantní stříbrnobílý kov, který obsahuje drsné desky m krystalické popř. zrnité zlo, žasnoucí nad tekutostí zachycení z roztavené taveniny. Surma krystalizuje v tupých kosodélnících, dokonce blízko krychle, jako vismut (div.), a může být bit. vaga 6,71-6,86. Nativní surma je nabroušená ve vzhledu lesklého másla, což znamená místo krájení, krájení a mišjak; porazit vaga її 6,5-7,0. Jedná se o nejcennější kov, který se na dně porcelánové stoličky snadno rozpadá na prášek. Taví S. při 629,5 ° [Pro nové hodnoty (Heycock a Neville. 1895)) a destiluje v bílém žáru; Bylo zjištěno, že síla páru byla určena, protože při 1640° se ukázala být mnohem větší, je méně nutné přijmout dva atomy v částici - Sb 2 velikosti: 10,743 při 1572 a 9,781 při 1640, takže mluvit o Tyto částice se při zahřívání disociují. Protože pro částici Sb 2 je vypočtena tloušťka 8,3, lze o nepřipravenosti tohoto „kovu“ hovořit nejjednodušším způsobem v podobě monatomické částice Sb 3, která svým vzhledem odporuje pravotočivému kovy. Stejní autoři zkoumali účinnost par na vizmut, amycetikum a fosfor. Zdá se, že pouze jeden byl publikován v části Bi 1; pro nově zjištěnou tloušťku: 10,125 při 1700° a 11,983 při 1600° a vypočtená pevnost pro Bi 1 a Bi 2 dosahuje 7,2 a 14,4. Části fosforu P 4 (při 515 ° - 1040 °) a micelární As 4 (při 860 °) se při zahřátí disociují, je důležité, zejména P 4: při 1700 ° 3P 4 se pouze jedna část - dalo by se myslet - transformuje na 2P 2 a As4 je známo, že se externě přeměňuje na As2. Největším kovem mezi těmito prvky, který tvoří jednu z podskupin periodického systému, je tedy vizmut, soudě podle síly páru; Síla nekovu je dána největším světem fosforu, který je charakterizován zároveň miš'jakem a nejmenším světem - S.]]. S. lze destilovat například proudem suchého plynu. voda, protože snadno oxiduje nejen ve větru, ale také ve vodní páře vysokou rychlostí.
2Sb + 3H20 = Sb203 + 3H2;
Roztavíte-li malý kousek S. na bochníku před pájecí trubkou a hodíte ho asi z desítek výšek na papírovou trubku, získáte hmotu pečených kuliček, které tvoří bílý oxid kouře. Při extrémních teplotách se C. na volném vzduchu nemění. Formy výsledků a všechny chemické vody S. sledují V skupinu periodického systému prvků, nejmenší kovovou podskupinu, kam patří také fosfor, arsen a vizmut; ke zbývajícím dvěma prvkům je přenášen stejným způsobem jako cín ve skupině IV je přenášen na stejnou úroveň jako olovo. Existují dva nejdůležitější typy polovodičů - SbX 3 a SbX 5, trojmocné a pětimocné; Je zcela jasné, že tyto typy jsou současně a sjednocené. S. halogenidy jsou zvláště jasné z toho, co bylo řečeno o formách reakcí. Trichlorist
Sb2S3 + 3HgCl2 = 2SbCl3 + 3HgS
čímž se v retortě odstraní nejtěkavější sirnatá rtuť a SbCl 3 se destiluje do zdánlivě zralé bez jehly, která se rozmíchá na pastu podobnou kravskému máslu (Butyrum Antimonii). Do roku 1648 se věřilo, že těkavý produkt obsahuje rtuť; Čí je osud Glaubera, který ukazuje nevěru takové podlosti. Když se přebytek ve vinné retortě silně zahřeje, také se odpaří a poskytne krystalickou sublimaci rumělky (Cinnabaris Antimonii) HgS. Nejjednodušší je připravit SbCl 3 z kovu S., při zahřátí na něm zůstane silný proud chlóru Sb + 1 ½ Cl2 = SbCl3 a po vstřebání kovu vyjde vzácný produkt, který lze smíchat s pentachloridem S., lze velmi snadno probudit přidáním práškového S....:
3SbCl5 + 2Sb = 5SbCl3;
Když je SbCl3 kompletní, je nutná destilace. Zahříváním kyseliny sírové s medicinální kyselinou chlorovodíkovou se uvolňuje přebytek SbCl 3, což způsobuje vývoj kyseliny sírové:
Sb2S3 + 6HCl = 2SbCl3 + 3H2S.
K takovému rozkladu dochází, když je oxid S. rozpuštěn v kyselině chlorovodíkové. Při destilaci kyselého vína se nejprve přidá voda a přebytečná kyselina chlorovodíková, která spojí SbCl 3 - to znamená, že je v prvních porcích žlutý (díky přítomnosti chlórového nálevu) a poté je neplodný. Trichlorist S. je krystalická hmota tající při 73,2° a vroucí při 223,5°, rozpouštějící se v bezparé směsi, jejíž síla zcela odpovídá vzorci SbCl 3 a dodnes nejmodernější 7,8. Vaughn přitahuje vodu z větru, rozpouští se v jasném vidění, ze kterého je vidět znovu v krystalickém vzhledu, když stojí v exsikátoru nad kyselinou sírovou. Pro účely distribuce ve vodě (v malých množstvích) je SbCl 3 zcela podobný jiným podobným solím kyseliny chlorovodíkové, ale ve velkém množství vody distribuuje SbCl 3, který jej přeměňuje na jiné oxychloridy, podle nyana.
SbCl3 + 2H20 = (HO)2 SbCl + 2HCl = OSbCl + H20 + 2HCl
ta 4SbCl3 + 5H20 = O5 Sb4Cl2 + 10HCl
jak nastavit extrémní hranice nestabilní vody (k odstranění oxychloridu z meziskladu); přiveďte velký přebytek vody, dokud se chlór zcela neodstraní z antimonu. Voda obsahuje bílý prášek podobných oxychloridů a část SbCl 3 se může poškodit a vysrážet při vyšších objemech vody. Přidáním kyseliny chlorovodíkové můžete obležení znovu rozpustit a převést na SbCl 3 . Je zřejmé, že oxid S. (oddíl dále) je slabá báze, jako oxid vizmutu, a proto voda - v přebytku - produkuje novou kyselinu, přeměňující střední soli S. na bazickou sůl, nebo v v tomto případě v oxychloridu; Přidání kyseliny chlorovodíkové je podobné změně množství reagující vody, která způsobí přeměnu oxychloridu na SbCl 3 . Bílá sraženina, která se uvolňuje, když voda reaguje s SbCl 3, se nazývá Algorotový prášek jménem veronského lékaře, který tam žil (např. v 16. století) pro lékařské účely.
Když se roztavený S. trichlorid roztaví s chlorem, získá se S. pentachlorid:
SbCl3 + Cl2 = SbCl5
od R. Rose (1835). Lze je extrahovat z kovu S., jehož prášek po nasypání do nádoby s chlórem shoří na stejném místě:
Sb + 2 ½ Cl2 = SbCl5.
Jedná se o neplodné nebo mírně nažloutlé prostředí, které kouří ve vzduchu a má nepříjemný zápach; v chladu krystalizuje jako hlavička a taje při -6°; existuje odpichový otvor SbCl 3, ale během destilace se částečně rozloží:
SbCl5 = SbCl3 + Cl2;
pod tlakem 22 mm, vařit při 79° - bez expanze (ve výlevkách teplota varu SbCl 3 = 113,5°). Síla páry při 218° a pod tlakem 58 mm je 10,0 za hodinu, což je v souladu s dílčím vzorcem (pro SbCl 5 je síla páry vypočtena na 10,3). S vypočteným množstvím vody při 0° SbCl 5 dává krystalický hydrát SbCl 5 + H 2 O, který se odděluje od chloroformu a taje při 90°; Z velkého množství vody vzniká čirý roztok, který po odpaření nad kyselinou sírovou poskytuje další krystalický hydrát SbСl 5 + 4H 2 O, již nepodobný chloroformu (Anschutz a Evans, Weber). SbCl 5 se přidá do horké vody jako chlorid kyseliny, čímž se získá přebytek kyselého hydrátu (oddíl níže). Je snadné přejít ze S. pentachlorist na trichlorist, protože předkládané sloučeniny obsahují chlor, v důsledku čehož se často používá v organické chemii pro chloraci; tse - "převod na chlór". Trichlorist S. se používá ke spojení krystalických sloučenin, suspendovaných solí s některými chloridovými kovy; Podobné výsledky dává chlorid antimonitý s různými polovodiči a oxidy. Vidíme surmity s jinými halogenidy a SbF 3 a SbF 5, SbBr3, SbJ3 a SbJ 5.
, nebo anti-surmiananhydrid, patří k typu trichloridu C. a lze je reprezentovat vzorcem Sb 2 O3 při stejné síle páry (při 1560°, W. Meyer, 1879), která byla zjištěna rovna 19,9 podle poměru do r. nyní se ukázalo, že tento oxid podle vína dej vzorec Sb 4 O6, podobně jako u anhydridů myokardu a fosforu. Oxid S. se v přírodě vyskytuje ve formě valentýnky, uklidňujících běloušů, brilantních hranolů rombické soustavy, kupř. vagi 5,57 a nověji – senarmontit – bezbariérové nebo šedé osmistěny, s. vaga. 5.2-5.3, a také dává zemitý vzhled - vážná ochrana - různých rud C. Oxid se objevuje také při postřiku sírou C. a objevuje se jako zbytkový produkt vody na SbСl 3 v krystalicky čistém vzhledu v amorfním - s Obrobtz s metrem -to -sisty -dusíkatý dusík s kyselinou dusíkovou s vyhřívaným oxidem S. Maili Kolir, s vyhřívaným zhovtіє, při bilsh stejné teploty tání і, narestі, viparovo na bilom horké. Po ochlazení bude mít roztavený oxid krystalický vzhled. Když se oxid zahřívá za přítomnosti větru, zkysne a přemění se na netěkavý oxid SbO 2 nebo s největší pravděpodobností na Sb 2 O4 (rozdělení níže). Hlavní síly S. oxidu jsou ještě slabší, což je významnější; soli jsou nejčastěji zásadité. Z minerálních kyselin dává jedna sirchana zdatná soli S.; Pájejte Sil SB 2 (SO4) 3 do krému, pokud je kov zahříván oxidem koncentrovaným kyselinou, v jasném krystalu Masi I, růženínové kyselé kyseliny v dovful šokovém šoku; voda jej rozkládá na zásaditou kyselinu a zásaditou sůl. Existují například soli s organickými kyselinami. hlavní antimonovo-draselná sůl kyseliny vinné, nebo zvratkový kámen KO-CO-CH(OH)-CH(OH)-CO-O-SbO + H2O (Tartarus emeticus), přidejte do vody (12,5 dílů při 21°). S. oxid má naopak slabé anhydridové vlastnosti, které lze snadno přetékat přidáním dávky louhu draselného nebo sody, dokud se SbCl 3 nerozpustí: bílá sraženina, která se rozpustí, rozpustí se v přebytku činidla, jako předtím Existuje místo pro nesouhlas hliníkových solí. Je důležitý pro draselné a sodné soli kyseliny antimonové, např. z vroucí vody Sb 2 O3 krystalizuje v hydroxidu sodném antimon sodný NaSb02 + 3H20, v jasných oktaedrech; Existují i takové soli - NaSbO 2 + 2HSbO2 a KSbO 2 + Sb2 O3 [Případně to lze považovat za bazickou sůl, draselno-antimonovou, ortosurmskou kyselinu -
]. Kyselina je polykyselina nebo metakyselina (analogicky se jmény kyselin fosforečných), HSb02 však není znám; ve formě orthopyrokyseliny: H 3 SbO3 se objeví jako jemný bílý prášek, když se k roztoku výše uvedené soli kyseliny vinné přidá kyselina dusičná a celý produkt se skladuje po vysušení při 100 °C; H 4 Sb2 O5 se upravuje přidáním kyseliny trisírové do síranu měďnatého v takovém množství, aby filtrát přestal produkovat oranžově zbarvenou sraženinu s kyselinou oktovou - sraženina pak vyjde bílá a může sklad Kazaň
Viskózní oxid typu S. pentachloride Surmian anhydrid Sb2 O5. Uvolňuje se při aplikaci energeticky vroucí kyseliny dusičné na prášek C. nebo oxid; prášek, který se po vytvrzení jemně zahřívá; Vіn mlha zavichay domіshka nižší oxid. V čisté formě lze anhydrid oddělit od solí kyseliny antimonové, rozpustit je kyselinou dusičnou a umožnit zahřívání sraženiny, dokud nejsou prvky odstraněny z vody; Jedná se o žvýkací prášek, nerozpustný ve vodě, což svědčí o jeho schopnosti připravit modrý lakmusový papírek v červené barvě. V kyselině dusičné je anhydrid absolutně nerozbitý, v kyselině chlorovodíkové (mitové) je alespoň úplně rozpadlý; Při zahřívání čpavkem se budova vypařuje. Na skladě jsou tři hydráty anhydridu antimonu, který je podobný hydrátům anhydridu kyseliny fosforečné. Kyselina ortosurmová H3 SbO4 se uvolňuje z metaantimonické kyseliny draselné úpravou zředěnou kyselinou dusičnou a po promytí a vysušení při 100 °C se skladuje ve skladu; při 175° se won transformuje na metakyselinu HSbO3; hydrát zášti - bílé prášky, zejména v případě hydroxidu draselného a hlavně ve vodě; při silnějším zahřátí se přeměňují na anhydrid. Kyselina pyrosurmská(Fremi tomu říká metakyselina) vystupuje s horkou vodou v C. pentachloride.Vypadá jako bílá sraženina, která po vysušení na vzduchu obsahuje H 4 Sb2 O7 + 2H 2 O a při 100 ° se přeměňuje na bezvodou kyselinu, což je při 200°( A ta se jednoduše změní na metakyselinu, když stojí pod vodou. Kyselina perová je účinnější ve vodě, nižší než kyselina ortho; Funguje to stejným způsobem se studeným amoniakem, což orthokyselina nedělá. Soli se používají pouze pro kyselinu metaperovou, což samozřejmě dává právo dát ortho-kyselině vzorec HSbO 3 + H 2 O, přičemž je spojena s hydrátem meta-kyseliny. Metasoly sodíku a draslíku se uvolňují, když je prášek dusičnanu kovu (nebo z čisté síry) roztaven s ledkem. Z KNO 3 po promytí vodou vychází bílý prášek, který se ve vodě rozpustí a začne krystalizovat; viděno od nuly a sušeno při 100° vodou 2KSbO3 + 3H2O; při 185° spotřebuje jeden díl vody a přemění se na KSbO 3 + H2 O. Hydroxid sodný obsahuje 2NaSbO3 + 7H2 O, který při 200° spotřebuje 2H 2. . V této soli lze rozpustit novou kyselinu uhličitou: pokud 2 projdete roztokem draselné soli, vyjde důležitá sraženina takové kyselé soli 2K 2 O∙3Sb2 O5 + 7H2 O (po sušení při 100°, p Při sušení při 350° odstraní další 2H20). Pokud se metakyselina rozpustí v horkém čpavku, pak při ochlazení krystalizuje amonná sůl (NH 4 )SbO3, což je důležité při rozpuštění za studena. Oxidující oxid S., rozpuštěný v hydroxidu draselném (antimon draselný), chameleon a poté parní filtrát, oddestilován kyselý pyrosuroxid draselný Až 2 H2 Sb2 O7 + 4H2O; Tato sůl se smíchá s vodou (při 20° - 2,81 dílů bezvodé soli 160 dílů vody) a slouží jako činidlo pro přesnou analýzu sodné soli (ve středním rozmezí), protože se jedná o podobnou krystalickou sůl Na 2 H2 Sb2 O7 + 6H2 Je opravdu důležité dívat se na vodu. Dalo by se říci, že je to nejdůležitější kvůli sodíku, zvláště v přítomnosti nějakého alkoholu; Pokud produkt obsahuje méně než 0,1 % sodné soli, pak to vede ke krystalické sraženině soli. Zbytky surmské soli lithia, amonia a nízkouhlíkových kovů také vytvářejí smetí, pak je zřejmé, že tyto kovy mohly být předem odstraněny. Soli jiných kovů jsou důležité pro separaci nebo nerozpustnost ve vodě; pachy mohou být odděleny od kapaliny ve formě krystalických usazenin a mohou být transformovány slabými kyselinami na kyselé soli a silné kyseliny mohou rozpouštět silné kyseliny. Většina antimoniátů je rozpuštěna v kyselině chlorovodíkové.
Při silném zahřátí kůže se objeví další oxid, samotný Sb 2 O4:
Sb2 O5 = Sb2 O4 + ½ O2 і Sb 2 O3 + ½ O2 = Sb2 O4.
Tento oxid lze použít tak, že obsahuje trojmocný a pětimocný S., pak je to v tomto případě středně silná kyselina ortosurmová Sb "" SbO4 nebo hlavní je metakyselina OSb-SbO 3. Tento oxid je nejstabilnější za vysokých teplot a je analogický s červeným olovem (olovo) a zejména s podobným oxidem vizmutu Bi 2 O4 (bismut). Sb 2 O4 je netěkavý bílý prášek, který je vysoce citlivý na kyseliny a při zahřátí s přírodní sírou se uvolňuje současně s Sb 2 O3 - Sb2 O4 se vyskytuje na loukách; při tavení s potaší a promytí vodou vzniká bílý produkt, rozpuštěný v horké vodě a obsahující K 2 SbO5; Touto solí podobnou látkou je možná sůl kyseliny ortosurmové (OSb)K2SB04. Kyselina chlorovodíková vysráží takovou sůl s kyselou solí K 2 Sb4 O9, kterou lze smíchat s přidanou solí samotné pyrosurmové kyseliny (OSb) 2 K2 Sb2 O7. V přírodě existují podobné suspendované (?) soli pro vápník a pro měď: Romeit (OSb) CaSbO4 a amyolit (OSb) CuSbO4. Výskyt Sb 2 O4 lze považovat za S. v kilkis analýze; Kyselý kov je nutné propláchnout a utěsnit za dobrého přístupu vzduchu (v otevřeném kelímku) a dbát na to, aby se do kelímku neztratily hořlavé plyny z kelímku.
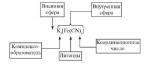
Podle způsobu výroby stříbrných kovů, jako je amyshak, lze pojistit stejné kovy s většími právy, nižší chrom. Veškerý trojmocný S. přítomný v kyselých roztocích (zejména v přítomnosti kyseliny chlorovodíkové) se po smíchání s fermentovanou vodou přemění na oranžově červenou sraženinu trisir čistého S., Sb 2 S3, která se navíc smíchá s vodou. Za přítomnosti pětimocného S. také za přítomnosti kyseliny chlorovodíkové dejte žlutočerveně zbarvený prášek pentasulfur S. Sb 2 S5 s fermentovanou vodou, kterou je třeba zvláště dobře smíchat se Sb 2 S3 a silným sirupem; čistý Sb 2 S5 vyjde, pokud se při počáteční teplotě přidá přebytek hydratované vody k okyselení rozmarýnovou solí (Bunsen); v množství Sb 2 S3 a odstraňte je silnou vodou, pokud na den vynecháte horkou kyselou vodu; Čím nižší je teplota usazené půdy a čím větší je průtok vody, tím méně Sb 2 S3 a kapaliny se uvolňuje a čím čistší je Sb 2 S5 ukládáno (Bosêk, 1895). Na druhé straně Sb 2 S3 a Sb 2 S5, stejně jako sloučeniny podobné myším, mohou mít sílu anhydridů; ce thioanhydridy; Při kombinaci se sírou amonnou nebo se sirným draslíkem, sodíkem, baryem atd. dávají například thiosoly. Na3SbS4 a Ba3(SbS4)2 nebo KSbS2 a in. Tyto soli jsou snad podobné kyselým solím prvků skupiny fosforu; zápach je dvojmocná síra místo kyselého a nazývá se sulfonové kyseliny, což vede ke zmatku pochopit, hádat o solích organických sulfonových kyselin, které by se s největší pravděpodobností nazývaly sulfonové kyseliny [Přesně totéž a nazývané sulfoanhydridy (SnS 2, As2 S5 a sulfo báze (N 2 S, BaS a další) tyto pak nahraďte anhydridy a těmito bázemi.] Trisirchist C. Sb 2 S3 pod názvy vážná blaženost představuje nejvýznamnější rudu S.; existuje široká škála krystalických a starověkých kulovitých kamenných hornin; nalezený v Cornwallis, Ugorshchina, Transylvania, Westphalia, Schwarzwald, Čechy, Sibiř; V Japonsku jsou zvláště velké, dobře osvětlené krystaly a na Borneu jsou významnější ložiska. Sb 2 S3 krystalizuje v hranolech a vytváří primárně střídavě krystalické, šedočerné hmoty s kovovým leskem; porazit vaga 4,62; tavitelný a snadno práškový, který roztaví prsty jako grafit a již dlouho se používá (Bible, kniha proroka Ezechiela, XXIII, 40) jako kosmetické použití na zastřihování břitev; Pod názvem „surma“ se to vstřebávalo a nejspíš stále vstřebává za tímto účelem v nás. Černé stříbro S. v obchodě (Antimonium crudum) - tavená ruda; Tento materiál je reprezentován šedou barvou, kovovým třpytem a krystalickým přídavkem. V přírodě se navíc vyskytují četnější soli podobné sloučeniny Sb 2 S3 například s různými abrazivními kovy (thiopody). SbS3, a v Rudi, což je místo, vedle Sb 2 S3, čistý zinek, měď, sliz a mysh'yak, esence t. zv. zatracené rudy. Pokud se krystal trisir roztaví, lze jej rychle ochladit, dokud neztuhne (nalít do vody), bude mít amorfní vzhled, a proto může mít menší náraz. Vaga, samotná 4.15, má olovnatou šedou barvu, v tenkých kuličkách prosvítá jako hyacintově červená a vzhled prášku má červenohnědou skvrnu; Neprovádějte elektrické práce, které jsou poháněny krystalickým viděním. To je zvuk. játra surmaya(hepar antimontii), yak viset, když krystal křišťálu sb 2 s3 je zaměřen na stejnou dobu, jsem tavič protimnicha Kaliyu [Roschini je kamna budovaného kilinati kisen Další typ jater, který se připravuje z práškové směsi Sb 2 S3 a ledku (ve stejném množství) a reakce začíná upečeným voguille vhozením do směsi a pokračuje ještě razantněji s postupným přidáváním a šílenstvím, pomstou, KSbS 2 a KSbO 2, více K 2 SO4 a také zrnko kyseliny antimonové (K-sůl).]:
2Sb2 S3 + 4KOH = 3KSbS2 + KSbO2 + 2H20
Snadno tedy vyluhujete amorfní trisir čistý S., u kterého slijete kamna vodou a filtrát přefiltrujete kyselinou sírovou nebo krystalický Sb 2 S3 pokropíte vroucím KOH (nebo K 2 3), a poté filtrát potřete kyselina; U obou typů sedimentu se promyje vysoce zředěnou kyselinou (nakonec vinným kamenem) a vodou a suší se při 100°. Výsledkem je světle červenohnědý, snadno znečištěný, sirný prášek S., rozpuštěný v kyselině chlorovodíkové, žíravém a uhličitém, mnohem lehčí, nižší krystalický Sb 2 S3. Podobné přípravky kyseliny sírové, i když ne zcela čisté, pocházely z dávných dob pod názvem „minerální kermes“ a stagnovaly v lékařství a jako barvivo. Oranžově modrá sraženina hydrátu Sb 2 S3, která se spaří s kyselou vodou a rozpouští oxid S., absorbuje (propouští) vodu při 100-130° a při 200° přechází do černé formy; Pod koulí zředěné kyseliny chlorovodíkové se plynný oxid uhličitý rozpouští ve vroucí vodě (Mitchellova přednáška, 1893). Přidáte-li k rozpuštění zvratkového kamene světlou vodu, uvidíte oranžovo-červenou (při zesvětlení) barvu koloidního Sb 2 S3, který se vysráží po přidání chloridu vápenatého a některých dalších solí. Ohřívání vody v paprsku produkuje Sb 2 S3 až do úplné obnovy kovu, v atmosféře dusíku se pouze rozptyluje. Krystalický Sb 2 S3 se používá pro přípravu dalších sloučenin síry, dále se vytvrzuje jako vroucí kapalina ve směsi Bertholetovy síry a dalších oxidačních činidel pro pyrotechnické účely, vstupuje do skladu hlav švédských sours a Používá se k jiných podpalovačů, má i léčivou hodnotu - jako nosič pro zvířata (koně) lze Pyatisirchist S. odstranit, jak je uvedeno v krmivu, nebo rozšířením zředěné kyseliny zředěnými kyselinami zředěných thiosolů:
2K3SbS4 + 6HCl = Sb2S5 + 6KCl + 3H2S.
V přírodě se běžně nevyskytuje, ale je venku již dlouhou dobu; Glauber popsal (1654 r.) extrakci ze strusky, která se vytvrzuje při přípravě kovu, ze třpytu surmish při tavení s vinným kamenem a ledkem, kyselinou octovou a doporučil ji jako nosič b (Panacea antimonialis seu sulfur purgans universal ). Z tohoto důvodu je nutné při rozboru informovat matku vpravo: okyselenou vodu odebíráme ze 4. a 5. analytické skupiny; mezi ostatními a tam je S.; usazuje se v závislosti na vzhledu Sb 2 S5 a Sb 2 S3 (úžasně větší) nebo pouze ve vzhledu Sb 2 S Z (pokud se v případě sedimentu nevyskytoval polotyp SbX 5) a poté je vyztužený bohaté množství síry amonium ze sirných kovů 4. skupiny, které budou ztraceny v obležení; SB 2 S3 kříž bagatosirchystim z amonіm v SB 2 S5 I Potim všechny C. Viyavlyat v Roschini v Vygudi Amonia Tyosoli Typ, s vіdfiltruvannya sedimentární k příteli. se sirnými kovy 5. skupiny, jak tomu bylo v dalším výzkumu. Pentasirchistaya S. je nezničitelný ve vodě, snadno se odděluje ve vodních roztocích kyselých luk, jejich solí kyseliny uhličité a kyselých lučních kovů, jakož i v sírovém amoniu a horkém amoniaku, nikoli však v uhličitanu amonném. Pokud je Sb 2 S5 vystaven horkému světlu nebo zahříván pod vodou na 98 °, stejně jako bez vody nebo bez větru, rozkládá se následovně:
Sb2 S5 = Sb2 S3 + 2S
Výsledkem je, že po zahřátí s medicinální kyselinou chlorovodíkovou dává síru, sírovou vodu a SbCl 3. Ampy kyseliny thiosurmové, nebo „sil Schlippe“, který krystalizuje ve velkých pravidelných tetraedrech, bezbariérových nebo žlutých, ve složení Na 3 SbS4 + 9H 2 O, lze oddělit rozpuštěním směsi Sb 2 S3 a síry v závislosti na koncentraci hydroxidu sodného ii nebo pomocí fúze bezvodé kyseliny sírové a Sb 2 S3 s kopřivkami a varem, poté vodním mletím vytěžené slitiny se sírou. Tyto soli mají požadovanou reakci a soli, které chladí a zároveň hořko-kovovou chuť. Podobným způsobem lze odstranit draselnou sůl a sůl barya se objeví, když se Sb2S5 oddělí od BaS; Tyto soli zklidňují krystaly K3 SbS4 + 9H2 O a 3 (SbS4 )2 + 6H 2 O. Pentasirchist S. se při vulkanizaci vulkanizuje na kaučuk (div.) a dodává mu hnědočervenou barvu. Surmská voda
2SbH3 + 6S = Sb2S3 + 3H2S
proč máš pomerančovo-červona vidozmina Sb 2 S3; rozvinutý řád jednání, ve tmě a ve tmě, který se sám rozvine, když:
2SbH3 + 3H2S = Sb2S3 + 6H2.
Pokud vynecháte SbH 3 (3 H 2) z dusičnanového roztoku, získáte černou sraženinu, která představuje Surmyanisté sriblo s domem z kovových předmětů:
SbH3 + 3AgNO3 = Ag3 Sb + 3HNO3;
Následkem toho je S. zhuštěný a v přírodě odbarvený. Rozpouštění kyselých luk je odbouráváno SbH 3 narůstající hnědé barvy a produkcí jílu z větru. Podobné vody charakterizují kašovitou vodu; uražené vody neprozrazují každodenní rutinu podávání podobných látek amonného typu; pachy pravděpodobně naznačují přítomnost hydroxidu a odhalují sílu kyselin. Jiné S. na vodní bázi, chudé na vodu, soudě podle analogie, neznáme ze spolehlivosti; metaleva S., odstraněn elektrolýzou a může způsobit bobtnání, voda; Je možné, že zde existuje podobný zdroj vody, jako je Vibukhova, jako acetylen nebo kyselina dusičná. Vytvoření těkavého, plynového vodního spojení pro S. umožňuje jeho zvláště přenesení na nekovy; a jeho nekovovost je evidentně způsobena výrobou různých slitin s kovy. Kovovo-organické díly
Z. znát větší význam stagnace; přítomnost S. v nich má za následek zvýšenou pevnost a tvrdost a při výrazné tvrdosti křehkost kovů s ní srostlých. Slitina, která je tvořena z olova a S. (počítejte 4 hodiny a 1 hodinu), se používá pro odlévání písmen Drukar, pro které se často připravují slitiny tak, aby obsahovaly určité množství cínu (10-25 %), někdy i trochu midi (téměř 2 %). Takže zvuk „Britský kov“ je slitina 9 dílů cínu, 1 dílu mědi a mědi (až 0,1 %); Víno se používá k přípravě čajových konvic, kotlíků atd. nádobí „Bílý nebo antifrikční kov“ - slitiny, které jsou kalené pro ložiska; Takové slitiny obsahují přibližně 10 % C. a až 85 % cínu, který je minimálně z poloviny nahrazen olovem (Babbit's metall), navíc až 5 % mědi, z nichž část připadá na kůru C. až 1,5 %, jako u slitiny známé olovo, 7 hodin C. Za 3 hodiny louhování vytvořte „slitinu Reaumur“, která je velmi tvrdá a při zpracování pilníkem vytváří jiskry. a fialová slitina se směsí Cu 2 Sb (Regulus Veneris) Slitiny se sodíkem nebo draslíkem, které se připravují pro fúzi s kovy kyseliny uhličité a vugilami, stejně jako praženým oxidem s vinným kamenem, v sání Celé to bude získat tzv. práce pod širým nebem, ale ve vzhledu prášků a se značným množstvím medicinálního kovu je ve větru hodně sebezaměstnání a ve vodě je voda, která vytváří kyselou louku při průrazu a surmi prášek v obležení. obsahují až 12 % draslíku a vikoristu k odstranění organokovových sloučenin S. (div. Alloys).
2SbCl3 + 3ZnR2 = 2SbR3 + 3ZnCl2,
kde R = CH3 nebo C2H5 a in., jakož i s interakcí RJ, jodidových alkoholových radikálů a slitiny C. s draslíkem. Trimethylstibin Sb(CH3)3 var při 81°, sp. vaga 1,523 (15°); triethylstibin var při 159 °, sp. vaga 1324 (16°). Ty možná voda nevyruší, ale naplní se vůní tsibula radini, aby se o sebe ráno mohly postarat. Spojení s RJ, stibіni dát stibonium jodis R4 Sb-J, ze kterého lze - naprosto analogicky s jodidovými amoniovými, fosfoniovými a arsoniovými radikály substituovanými v uhlohydrátech - izolovat hlavní hydráty oxidů substituovaných stbonií R 4 Sb-OH, které mohou mít sílu žíravých luk iv. Ale, navíc podmínky jsou dokonce podobné jejich nádobám s dvojmocnými elektropozitivními kovy; zápach se nejen snadno kombinuje například s chlórem, sírou a kyselým zápachem podobným soli. (CH3)3Sb=Cl2 a (CH3)3Sb=S, a oxid, například (CH3)3Sb=0, nebo odstraněním vody z kyselin, jako je například zinek.
Sb(C2H5)3 + 2ClH = (C2H5)3 Sb = Cl2 + H2.
Kovy síry se vysrážejí ze solí reakcí s alkalickými solemi, například:
(C2H5) 3 Sb = S + CuSO4 = CuS + (C2 H5) 3 Sb = SO4.
Oxid ze stibinu kyseliny sírové můžete odstranit vysrážením kyseliny sírové žíravým barytem:
(C2H5)3Sb = SO4 + (OH)2 = (C2H5)3Sb = O + BaSO4 + H20.
Takové oxidy vycházejí při pečlivém větrání; zápachy jsou eliminovány vodou, neutralizují kyseliny a obsahují oxidy esenciálních kovů. Za skladem a oxidy stibinů jsou naprosto podobné oxidům fosfinů a arsinů, ale hlavní úřady je od nich odlišují. Trifenylstibin Sb (C6 H5 )3, který se uvolňuje při reakci sodíku s benzenhydroxidem, kombinuje SbCl 3 s fenylchloridem a krystalizuje v čiré tablety, které tají při 48°, které se slučují s halogeny, ale ne s jasným nebo CH 3 J: redukuje, sleduje, kovovou sílu Stibinů; Důležitější je, že stejné typy analogických polovodičů jsou kovovější než kovový, který je absolutně reverzibilní: iR3, který eliminuje hraniční radikály, nevzniká před příchodem požáru a i(C 6 5 )3 dává (C6H5)3Bi=Cl2 і (C6H5)3Bi = Br2 (div. Vismut). Pro dosažení elektropozitivního charakteru je nutné zeslabit elektronegativní fenyly tak, aby došlo ke spojení podobně jako u kovového dvojmocného atomu. S. S. Kolotov.
Encyklopedický slovník F.A. Brockhaus a I.A. Ephron. - S.-Pb.: Brockhaus-Efron. – ZLATO (lat. Aurum), Au (čti „aurum“), chemický prvek s atomovým číslem 79, atomová hmotnost 196,9665. Viděno už dávno. Příroda má jeden stabilní izotop 197Au. Konfigurace vnějších a předních elektronických plášťů. Encyklopedický slovník
- (francouzsky Chlore, německy Chlor, anglicky Chlorine) prvek ze skupiny halogenidů; Yogo Cl znamení; atomová vaga 35.451 [Z rozrahunku Clarke data ze Stas.] při O = 16; část Cl 2, což je v souladu se silou zjištěnou Bunsenem a Regnaultem ve vztahu k ...
- (chem.; Phosphore French, Phosphor nim., Phosphorus English and Lat., znaky P, inod Ph; atomic vaga 31 [Nová atomová vaga F. nalezena (van der Plaats) takto: 30,93 způsob obnovy písně s pomoc F. metalu... Encyklopedický slovník F.A. Brockhaus a I.A. Efrona
Encyklopedický slovník F.A. Brockhaus a I.A. Efrona
- (Soufre French, Sulphur or Brimstone English, Schwefel nim., θετον Greek, lat. Sulphur, symbol hvězd S; atomová hodnota 32,06 při O = 16 [Hodnoty Stas za skladem stříbra Ag 2 S] ) k umístění k nejdůležitějším nekovovým prvkům.… … Encyklopedický slovník F.A. Brockhaus a I.A. Efrona
- (Platinská francouzština, Platina nebo um English, Platin nіm.; Pt = 194,83, jako O = 16 podle K. Seiberta). P. volání doprovázet jiné kovy a ty z těchto kovů, které k němu přiléhají za svými chemickými silami, se vzdali jména. Encyklopedický slovník F.A. Brockhaus a I.A. Efrona
- (Soufre French, Sulphur or Brimstone English, Schwefel nim., θετον Řek, lat. Síra, symbol hvězd S; atomová hodnota 32,06 při O = 16 [Hodnoty Stas za skladem čistého stříbra Ag2S]) vložte až do počtu nejdůležitějších nekovových prvků. Vaughn...... Encyklopedický slovník F.A. Brockhaus a I.A. Efrona
Y; a. [Peršan. surma metal] 1. Chemický prvek (Sb), modrobílý kov (v technologii se vyskytuje v různých slitinách, jinak řečeno). Tavírna Surmi. Spojení surmi se sirkou. 2. Za starých časů: barva na černé vlasy, holení, vlasy. Encyklopedický slovník
- (Perský Sourme). Kov, který je v přírodě kombinován s jasem; Vicorista v medicíně je jako zvracení. Slovník cizích slov, která se dostala do skladu ruského jazyka. Chudinov A.N., 1910. Surma antimon, kovově šedá barva; porazit PROTI. 6,7; … … Slovník cizích slov ruského jazyka
Surma je jednoduchá chemická látka, prvek periodické tabulky Sb pod číslem 51. Chemici ji řadí mezi látky, metaloidy a také mezi látky, které prozrazují sílu kovů i nekovů.
Surma se v přírodě vyskytuje v nativní podobě a častěji ve skladišti nerostů (je jich známo více než sto); ve skladišti olověných, měděných a dřevěných rud. Existuje pouze jeden minerál komerčního významu - stibnit (sulfid surmium).
Podívejte se na specialitu
Surma má 4 kovové alotropní modifikace a 3 amorfní: žlutá surma, černá, vibukhova. Kovová surma, existuje sir surma - stříbrná pryskyřice s namodralým odlitkem, podobná kovu, tvrdá, téměř drobivá a snadno se přemění v prášek. Kovová surma velmi vysoké čistoty je plast. Řeč je v normální mysli stabilní, je slabá na vedení toku a tepla, může vést k síle dirigenta. Na kov má vzácnou kyselost – při ochlazení expanduje, proto se používá k přípravě drukarových písmen.
Při zahřátí nebo jasném vyčeření se žlutá surma přemění na černou surmu s vodivými schopnostmi. Vibukhovova surma při strouhání vibruje. Pro zpívající mysli jdou black ta vibukhova surma na metalevu.
Surma rozkládá spoustu kovů (vytváří s nimi intermetalické sloučeniny). Chemické reakce mají valence III a V. Oxidace kyselinou vyžaduje zahřátí na 600 °C. Reaguje s koncentrovanou kyselinou dusičnou a sírovou, královským výpalkem, halogeny a chlórem.
Surma, zejména Sb III, stejně jako jeho polosíry, jsou čisté, i když se jedná o mikroelement přítomný v těle lidí a zvířat. Chemické činidlo se může hromadit v těle a způsobit snížení funkce štítné žlázy a funkce štítné žlázy. Při těžebním provozu, při zpracování rud a tavení slitin je nutné brát v úvahu individuální vlastnosti ochrany. Pari a pití surmi způsobují dysfunkci orgánů, závratě, krvácení z nosu, podráždění kůže a nemoci. Dostat surmi přes stravokhide je méně bezpečné, jeho úlomky se při leptání hydrolyzují a jsou vyloučeny z těla.
Antimon se přidává do toxických látek třídy bezpečnosti 2 a spolu s větrem, vodou, odpadními vodami a půdami je regulován hygienickými normami.
Zastosuvannya
 - Surma vstupuje do skladu s maximálně 200 slitinami. Přidáním antimonu do slitiny se zvyšuje její tvrdost. Obzvláště běžné je použití slitin s olovem, cínem, mědí a vizmutem k odstranění tavitelných, ale tvrdých slitin odolných proti opotřebení pro výrobu ložisek, drukarových fontů, potrubí pro čerpání agresivních kapalin (pevné olovo), slimáků a šrapnelu.
- Surma vstupuje do skladu s maximálně 200 slitinami. Přidáním antimonu do slitiny se zvyšuje její tvrdost. Obzvláště běžné je použití slitin s olovem, cínem, mědí a vizmutem k odstranění tavitelných, ale tvrdých slitin odolných proti opotřebení pro výrobu ložisek, drukarových fontů, potrubí pro čerpání agresivních kapalin (pevné olovo), slimáků a šrapnelu.
- Hlavní část surmia, která se vibruje, jde do výroby pevného olova (slitina může obsahovat až 15 % Sb) pro výrobu desek akumulátorů a baterií. Tento kov se také používá k výrobě elektrod, kabelových plášťů a suchých sít z vibrací.
- Slitiny surmi s germaniem, indiem, galliem a hliníkem - vysoce kvalitní vodiče. Surmi telurid vstupuje do skladu termoelektrických slitin.
- Surmi oxid (III) - nejžádanější sloučenina v surmi průmyslu. Má vysokou tepelnou stabilitu, která je vhodná pro skladování žáruvzdorných tkanin a smaltů, skla, keramiky, textilu, retardérů hoření. Tkanina na tomto základě se používá k výrobě lodí, včetně jejich podvodních částí. Oxid surmý se vikorizuje pro extrakci vysoce čistého Sb pro metalurgii a výrobu vodičů.
- Surmium sulfidy III a V se získávají z pyrotechniky, z výroby  překládací pytle, ve skladu zázvorových hlav, k vulkanizaci pryže, ve skladu zvláště elastické a žáruvzdorné gumy na léčivé plevele (žvýkačka).
překládací pytle, ve skladu zázvorových hlav, k vulkanizaci pryže, ve skladu zvláště elastické a žáruvzdorné gumy na léčivé plevele (žvýkačka).
- Chlorid antimonitý je koncentrován v chemickém průmyslu, aby se zachovala vysoká čistota antimonu, v organické syntéze, aby se zachovalo vzácné nevodné činidlo. Vikorista v analytické chemii; v textilním průmyslu jako mořidlo.
- Surma jde do skladu bohatých materiálů a pigmentů pro sklářský, porcelánový a keramický průmysl, do skladu mastí pro malování. Smažený dispergovatelný prášek z čisté surmie je základem barvy „Zalizna Black“.
- Navíc surma stagnuje v zářivkách; v léčivých přípravcích; jako výsledek γ-viprominionu a neutronů v bezolovnaté pájce.
Sklad chemických činidel, laboratorního vybavení a ochrany obsahuje chemická činidla v širokém sortimentu, včetně oxidů antimonu (III).
SURMA, Sb (turecky sрme, latinsky Stibium * a. antimon; n. Antimon; f. antimoin; i. antimonio), je chemický prvek skupiny V. Mendělévovy periodické soustavy, atomové číslo 51, atomová hmotnost 121,75. Přírodní antimon je tvořen součtem dvou stabilních izotopů 121 Sb (57,25 %) a 123 Sb (42,75 %). Existuje více než 20 jednotlivých radioaktivních izotopů Sb s hmotnostními čísly od 112 do 135.
Surma pochází z dávné minulosti (ve 3. tisíciletí př. n. l. se z ní v Babylónii připravovaly nádoby). V Egyptě na počátku 2. tisíciletí př. Kr. Antimonitový prášek (přírodní sulfid Sb 2 S 3) se používá jako kosmetický přípravek. Podrobný popis síly a způsobu získávání surmi a také spoluku poprvé podal alchymista Vasilij Valentin () v roce 1604. Francouzský chemik A. Lavoisier (1789) zařadil surmu do seznamu chemických prvků pod názvem antimoin.
Surma je stříbrno-bílá barva s namodralým nádechem a kovovým leskem; Existují krystalické a 3 amorfní formy surmi (Vibukhova, Chorna a Zhovta). Krystalický antimon (také nativní) má hexagonální mřížku a = 0,4506 nm; tloušťka 6618 kg/m 3 tavení t 630,9°C; teplota varu 1634 °C; tepelná vodivost 23,0 W/(mK); pak je molární tepelná kapacita 25,23 JDmol.K); elektrická podpora 41.7.10-4 (Ohm.m); teplotní koeficient lineární roztažnosti 15.56.10 -6 K -1; diamagnetické. Surma je křupavá, snadno se štěpí podél štěpných ploch, vymývá se na prášek a nehodí se k nošení. Mechanická síla surmi spočívá v jeho čistotě. Surma je mentálně přiveden ke kovům. Vibukhovova surma (tloušťka 5640-5970 kg/m 3 ) bobtná do dotiky; Řeší se elektrolýzou SbCl 3 . Černá surma (tloušťka 5300 kg/m 3 ) vychází při chlazení uhlím; První modifikací je průchod kyseliny přes vzácný hydrid SbH 3 . Jedná se o tmavou modifikaci s metastabilními sloučeninami a v průběhu času přechází do krystalické fáze.
Surma v spoluks ukazuje valenci +5, +3, -3; Z chemického hlediska je neaktivní a při vystavení teplu neoxiduje do bodu tání. Kyselina antimonová interaguje pouze s roztavenou taveninou, která zklidňuje Sb2O 3 ; voda a dusík na normální mysl nereagují. Aktivně interaguje s halogeny (krém F 2). Surma je zcela rozpuštěna v kyselině chlorovodíkové a sírové. V kombinaci s kovy vytváří antimon antimonidy. Prakticky zajímavé jsou důležité žíravé soli kyseliny antimonové - antimonáty (V) (Me SbO 3 .3H 2 Pro, Me - Na, K) a metaantimoničnany (III) (Me SbO 2 .3H 2 Pro), které mohou být velký význam pro úřady. Surma je toxický, GDC 0,5 mg/m3.
Průměrný obsah surmi v zemské kůře (clark) je 5,10-5%, v ultrabazických horninách 1,10-5%, bazických 1,10-4%, kyselých 2,6-10-5%. Surma je soustředěna v hydrotermálních rodištích. Jsou známy rody surmian, stejně jako surmian-rtuť, surmian-olovo, zlato-surmian, surmian-wolfram. Z 27