ლიგანდების ჩანაცვლების, დამატებისა და გამოყოფის რეაქციები, რომლებშიც იცვლება ლითონის კოორდინაციის სფერო.
ჩანაცვლების რეაქციებს აქვს მნიშვნელობის ფართო სპექტრი და მოიცავს ზოგიერთი ლიგანდის ჩანაცვლებას ლითონის კოორდინაციის სფეროში სხვებთან.
დისოციაციური (D) მექანიზმი. ორეტაპიანი პროცესი სასაზღვრო ფაზაში მიმდინარეობს შუალედური შუალედის მეშვეობით ქვედა კოორდინაციის ნომრით:
ML6<->+ L; + Y --» ML5Y
ასოციაციური (A) მექანიზმი. ორეტაპიანი პროცესი, რომელიც ხასიათდება დიდი საკოორდინაციო ნომრის მქონე შუალედურის შექმნით: ML6 + Y = ; =ML5Y+L
ურთიერთგაცვლის მექანიზმი (I). ამ მექანიზმს თან ახლავს გაცვლითი რეაქციების დიდი რაოდენობა. პროცესი ერთსაფეხურიანია და თან ახლავს დამტკიცებული შუალედური. გარდამავალ სადგურზე რეაქტიული რეაქცია და ჯგუფი, რომელიც დაკავშირებულია რეაქციის ცენტრთან, შედის უახლოეს კოორდინაციის სფეროში და რეაქციის დროს წარმოიქმნება ამა თუ იმ ჯგუფის არსებობა i, ორი ლიგანდის გაცვლა:
ML6 + Y = = ML5Y+L
შიდა მექანიზმი. ეს მექანიზმი ახასიათებს ლიგანდების ჩანაცვლების პროცესს მოლეკულურ დონეზე.
2. ლანთანიდების (Ln) სიმძლავრის თავისებურებები, რომლებიც დაკავშირებულია ლანთანიდის შეკუმშვის ეფექტთან. Spoluki Ln 3+: ოქსიდები, ჰიდროქსიდები, მარილები. ჟანგვის სხვა ეტაპები. გამოიყენეთ მაღალი ღირებულების ნაერთები Sm 2+, Eu 2+ და ოქსიდური ნაერთები Ce 4+, Pr 4+.
რუსეთში ატომური და იონური რადიუსების ერთფეროვანმა ცვლილებამ 4f ელემენტების რაოდენობამ გამოიწვია ლანთანიდის შეკუმშვის სახელი. ᲛᲔ. მიღწეულია, რომ მეოთხე (ჰაფნიუმი) და მეხუთე (ტანტალი) ჯგუფების 5d-გარდამავალი ელემენტების ლანთანიდების მიმდებარე ატომების რადიუსი პრაქტიკულად ტოლია მათი ელექტრონული ანალოგების რადიუსებს მეხუთე პერიოდიდან: ცირკონიუმი და ნიობიუმი. ეს აშკარაა და მნიშვნელოვანი 4d- და 5d ლითონების ქიმიას დიდი ძალა აქვს. კიდევ ერთი f-შეზღუდვა არის იტრიუმის იონური რადიუსის სიახლოვე მნიშვნელოვანი f ელემენტების რადიუსებთან: დისპროზიუმი, ჰოლმიუმი და ერბიუმი.
ყველა იშვიათი დედამიწა ქმნის სტაბილურ ოქსიდებს ჟანგვის სტადიაზე +3. სუნი არის ცეცხლგამძლე კრისტალური ფხვნილების სუნი, რომელიც მთლიანად შლის ნახშირორჟანგს და წყლის ორთქლს. ელემენტების უმეტესობის ოქსიდები ამოღებულია ჰიდროქსიდების, კარბონატების, ნიტრატების, ოქსალატების შეწვით ჰაერში 800-1000 °C ტემპერატურაზე.
ოქსიდების M2O3 და ჰიდროქსიდების M(OH)3 ხსნარი
მხოლოდ სკანდიუმის ჰიდროქსიდი არის ამფოტერული
ოქსიდები და ჰიდროქსიდები ადვილად იხსნება მჟავებში
Sc2O3 + 6HNO3 = 2Sc(NO3)3 + 3H2O
Y(OH)3 + 3HCl = YCl3 + 3H2O
წყალში ჰიდროლიზდება მხოლოდ სკანდიუმი
Cl3 ⇔ Cl2 + HCl
ყველა ჰალოგენიდი ამოღებულია ჟანგვის სტადიაზე +3. Usi არის ცეცხლგამძლე.
ფტორები ცუდად იშლება წყალთან ახლოს. Y(NO3)3 + 3NaF = YF3↓+ 3NaNO3
ზაგალნა ქიმია: ასისტენტი / ო.ვ.ჟოლნინი; თითო რედ. ვ.ა. პოპკოვა, ა.ვ.ჟოლნინა. – 2012. – 400 გვ.: ილ.
თავი 7. კომპლექსური კომპლექსები
თავი 7. კომპლექსური კომპლექსები
კომპლექსური ელემენტები სიცოცხლის ორგანიზატორები არიან.
K.B. Yatsimirsky
კომპლექსური კავშირები კავშირების ყველაზე დიდი და მრავალფეროვანი კლასია. ცოცხალ ორგანიზმებს აქვთ ბიოგენური ლითონების რთული ნაერთები ცილებთან, ამინომჟავებთან, პორფირინებთან, ნუკლეინის მჟავებთან, ნახშირწყლებთან და მაკროციკლურ ნაერთებთან. ცხოვრების ყველაზე მნიშვნელოვანი პროცესები რთული პროცედურებით მიმდინარეობს. ზოგიერთი მათგანი (ჰემოგლობინი, ქლოროფილი, ჰემოციანინი, ვიტამინი B 12 და ა.შ.) მნიშვნელოვან როლს ასრულებს ბიოქიმიურ პროცესებში. ბევრი სამკურნალო პრეპარატი შეიცავს ლითონის კომპლექსებს. მაგალითად, ინსულინი (თუთიის კომპლექსი), ვიტამინი 12 (კობალტის კომპლექსი), პლატინოლი (პლატინის კომპლექსი) და ა.შ.
7.1. ა. ვერნერის კოორდინაციის თეორია
ბუდოვას კომპლექსური კავშირები
როდესაც ნაწილაკები ურთიერთქმედებენ, ნაწილაკების ურთიერთკოორდინაცია ხელს უშლის, რაც შეიძლება ჩაითვალოს კომპლექსურ პროცესად. მაგალითად, იონების დატენიანების პროცესი აკვაკომპლექსების წარმოქმნით დასრულდება. კომპლექსის წარმოქმნის რეაქციებს თან ახლავს ელექტრონული წყვილების გადაცემა და იწვევს კომპლექსური წარმონაქმნის დადგენას მაღალი წესით, რთული (კოორდინაციის) რეაქციების შესახებ. რთული რეაქციების თავისებურებაა საკოორდინაციო რგოლის არსებობა, რომელიც პასუხისმგებელია დონორ-მიმღების მექანიზმზე:
რთულ ნახევრად ნახევრად ნახევრად ნახევრად ნახევრად ნახევრად ნახევრად ნახევრად ჩნდება როგორც კრისტალურ მდგომარეობაში, ისე დეტალურად, კერძოდ.
რომელთაგან არის ლიგანდების მიერ გამძაფრებული ცენტრალური ატომის არსებობა. რთული ნაერთები შეიძლება წარმოიქმნას უმაღლესი რიგის რთული მოლეკულებისგან, მარტივი მოლეკულებისგან, რომლებიც აშენებულია მსოფლიოში დამოუკიდებელ განვითარებამდე.

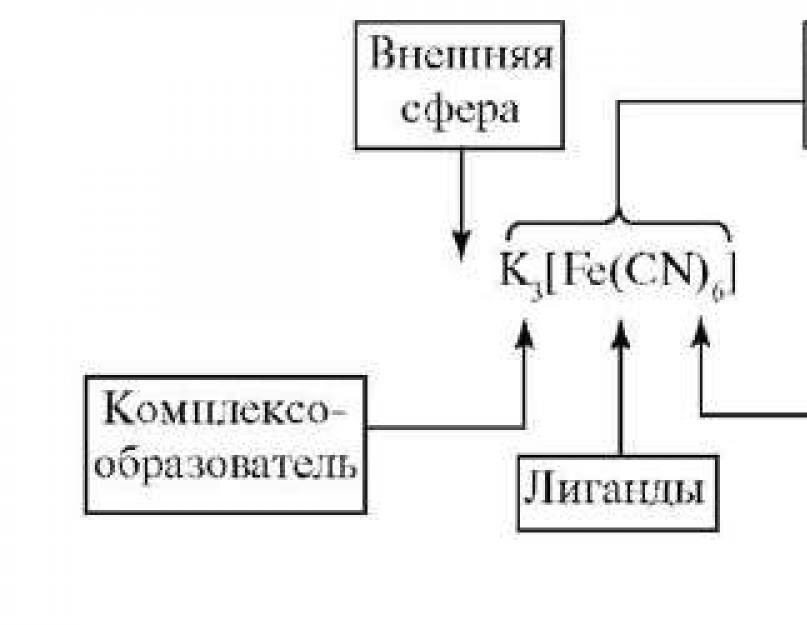
ვერნერის კოორდინაციის თეორიის მიღმა რთული გაგება იყოფა შიდაі გარე სფერო.ცენტრალური ატომი თავისი გაუცხოებული ლიგანდებით ქმნის კომპლექსის შიდა სფეროს. ისინი უნდა განთავსდეს კვადრატული მშვილდის მახლობლად. გადასაწყვეტია კომპლექსში გარე სფერო გახდეს და კვადრატული მკლავების უკან დაიწეროს. ცენტრალური ატომის ირგვლივ შერეულია ლიგანდების დიდი რაოდენობა, რაც მითითებულია საკოორდინაციო ნომერი(კჩ). კოორდინირებული ლიგანდების რაოდენობა ყველაზე ხშირად 6-დან 4-მდეა. ლიგანდი იკავებს კოორდინაციის ადგილის ცენტრალურ ატომს. კოორდინაციის დროს იცვლება ლიგანდების და ცენტრალური ატომის ძალა. ხშირად კოორდინირებული ლიგანდების აღმოჩენა შეუძლებელია სხვა ქიმიურ რეაქციებში, რომლებიც მათთვის დამახასიათებელია ბუნებაში. შიდა სფეროს უფრო მჭიდროდ დაკავშირებულ ნაწილებს ე.წ კომპლექსი (კომპლექსური იონი).ცენტრალურ ატომსა და ლიგანდებს შორის არის გრავიტაციული ძალები (კოვალენტური ბმა იქმნება გაცვლის ან (ან) დონორ-მიმღების მექანიზმით), ლიგანდებს შორის არის ფორმირების ძალები. ვინაიდან შიდა სფეროს მუხტი 0-ის ტოლია, გარე კოორდინაციის სფერო 0-ის ტოლია.
ცენტრალური ატომი (კომპლექსი)- ატომი ან იონი, რომელიც ცენტრალურ პოზიციას იკავებს კომპლექსურ კავშირში. კომპლექსერის როლი ყველაზე ხშირად არის ნაწილაკების ფორმირება, თავისუფალი ორბიტალების ფორმირება და ბირთვში დიდი დადებითი მუხტის დამატება, რომელიც შემდეგ შეიძლება გახდეს ელექტრონების მიმღები. ეს არის გარდამავალი ელემენტების კათიონები. ყველაზე ძლიერი კომპლექსური აგენტებია IB და VIIB ჯგუფების ელემენტები. იშვიათად კომპლექსური
არავითარ შემთხვევაში არ მოქმედებენ d-ელემენტების ნეიტრალური ატომები და არალითონების ატომები, როგორც სხვადასხვა სახის დაჟანგვა - . თავისუფალი ატომური ორბიტალების რაოდენობა, რომლებიც შეიძლება კომპლექსური იყოს, ნიშნავს მის კოორდინაციის რიცხვს. საკოორდინაციო რიცხვის მნიშვნელობა მრავალ ფაქტორზეა დამოკიდებული და დაკავშირებულია კომპლექსური იონის დაქვემდებარებულ მუხტთან:

ლიგანდი- ისინი ან მოლეკულებია, რომლებიც პირდაპირ კავშირშია კომპლექსურ აგენტთან და წარმოადგენენ ელექტრონული წყვილების დონორებს. ეს ელექტრონული სისტემები, რომლებიც შეიცავს უფასო და ფხვიერ ელექტრონულ ფსონებს, შეიძლება იყვნენ ელექტრონების დონორი, მაგალითად:
ნახევრად ელემენტები ავლენენ კომპლექსის შემქმნელ ძალას და მოქმედებენ როგორც ლიგანდები კომპლექსისთვის. ლიგანდები შეიძლება იყოს ატომები და მოლეკულები (ცილა, ამინომჟავები, ნუკლეინის მჟავები, ნახშირწყლები). სიბლანტის რაოდენობის გამო, რომლებიც სტაბილიზირებულია კომპლექსური ლიგანტების მიერ, ლიგანდები იყოფა მონო-, დი- და პოლიდენტატ ლიგანდებად.ყველაზე მრავალფეროვანი ლიგანდები (მოლეკულები და ანიონები) მონოდენტურია, რადგან ისინი ერთ ელექტრონულ წყვილს აბარებენ. სუსტ ლიგანდებს ემატება მოლეკულები ან იონები, რომლებიც წარმოადგენენ ორ ფუნქციურ ჯგუფს, რომლებიც მოქმედებენ როგორც ორი ელექტრონული წყვილის დონორი:

პოლიდენტატ ლიგანდებს შეიძლება დაემატოს 6-კბილიანი ეთილენდიამინტეტრაოციუმის მჟავა ლიგანდი:

კომპლექსური კავშირის შიდა სფეროში კანის ლიგანდის მიერ დაკავებული სივრცეების რაოდენობას ეწოდება ლიგანდის საკოორდინაციო ამნისტია (დენტი).ვონი მითითებულია ლიგანდის ელექტრონული წყვილების რაოდენობით, რომლებიც მონაწილეობენ ცენტრალურ ატომთან კოორდინაციის კავშირში.
რთული ნაერთების კრემი, საკოორდინაციო ქიმია აერთიანებს შეჩერებულ მარილებს, კრისტალების ჰიდრატებს, რომლებიც იშლება წყალში საწყობში, რომლებიც მყარ მდგომარეობაში ბევრ ფაზაში ხდება ანალოგიურად რთული, მაგრამ არა სტაბილური.
ყველაზე სტაბილური და მრავალფეროვანი კომპლექსები საწყობის უკან და მათში შემავალი ფუნქციები ასრულებენ d-ელემენტებს. განსაკუთრებით მნიშვნელოვანია გარდამავალი ელემენტების რთული ნაერთები: ნერწყვი, მანგანუმი, ტიტანი, კობალტი, სპილენძი, თუთია და მოლიბდენი. ბიოგენური s-ელემენტები (Na, K, Mg, Ca) კომპლექსური კომპლექსებია ციკლური სტრუქტურის ლიგანდებთან, რომლებიც ასევე მოქმედებს როგორც კომპლექსური აგენტი. Მთავარი ნაწილი რ-ელემენტები (N, P, S, Pro) წარმოადგენს კომპლექსური ნაწილაკების (ლიგანდების) აქტიურ აქტიურ ნაწილს, მათ შორის ბიოლიგანდებს. რომელსაც აქვს ბიოლოგიური მნიშვნელობა.
ასევე, კომპლექსური ფორმირების სტრუქტურა არის პერიოდული სისტემის ქიმიური ელემენტების ფარული ძალა, რომელთა სტრუქტურა იცვლება მიმდინარე თანმიმდევრობით: ვ> დ> გვ> ს.
7.2. პასუხისმგებლობა კომპლექსური დუმილის ძირითადი ნაწილების პასუხისმგებლობაზე
რთული კავშირის შიდა სფეროს მუხტი არის მუხტების ალგებრის ჯამი, რომელიც ქმნის მის ნაწილაკებს. მაგალითად, კომპლექსის მუხტის ღირებულება და ნიშანი განისაზღვრება მომავალი შეკვეთით. ალუმინის იონის მუხტი არის +3, ექვსი ჰიდროქსიდის იონის ჯამური მუხტი -6. ისე, კომპლექსის მუხტი უფრო მაღალია (+3) + (-6) = -3 და კომპლექსის ფორმულა არის 3-. რთული იონის მუხტი რიცხობრივად უდრის გარე სფეროს მთლიან მუხტს და ვრცელდება ნიშნის მიღმა. მაგალითად, K3 გარე სფეროს მუხტი არის +3. ასევე რთული იონის მუხტი კვლავ -3-ია. კომპლექსის მუხტი სიდიდით ტოლია და პროპორციულია რთული ნაერთის ყველა ნაწილაკების მუხტების ალგებრული ჯამის ნიშნისა. ისე, K 3-ში ნაერთის იონის მუხტი არის +3, რის გამოც რთული ნაერთის ნაწილაკების მთლიანი მუხტი იქნება (+3) + (-6) = -3.
7.3. კომპლექსური სპოლუკების ნომენკლატურა
ნომენკლატურის საფუძვლები ემყარება ვერნერის კლასიკურ ტრადიციებს. როგორც ჩანს, მათ წინ კომპლექსურ გაერთიანებულ მემბრანას კატიონი, შემდეგ კი ანიონი ეწოდება. როგორც არაელექტროლიტური ტიპი, მას ერთი სიტყვით უწოდებენ. რთული იონის სახელი იწერება ერთი სიტყვით.
ნეიტრალურ ლიგანდს იგივე ეწოდება, რაც მოლეკულას, ხოლო "o" ემატება ანიონურ ლიგანდებს. კოორდინირებული წყლის მოლეკულისთვის გამოიყენება აღნიშვნა "aqua-". კომპლექსის შიდა სფეროს ახალი ლიგანდების რაოდენობის აღსანიშნავად ლიგანდების სახელწოდების წინ პრეფიქსის სახით გამოიყენება ბერძნული ციფრები di-, tri-, tetra-, penta-, hexa-i და ა.შ. პრეფიქსი Monone არ არის ვიკორისტი. ლიგანდი ზედმეტად რეაგირებს აბეტკაზე. ლიგანდის სახელი განიხილება მთლიანობაში. ლიგანდის სახელის შემდეგ მოჰყვება ცენტრალური ატომის სახელი დაჟანგვის სტადიიდან, რომელიც მითითებულია რომაული ციფრებით მრგვალ მკლავებში. სიტყვა ამინუ (ორი „მ“) იწერება ზუსტად ამიაკუ. ამინების ამოსახსნელად მხოლოდ ერთი „მ“ ცხოვრობს.
C1 3 - ჰექსამინის კობალტის (III) ქლორიდი.
C1 3 - აკვაპენტამინის კობალტის (III) ქლორიდი.
Cl 2 - პენტამეთილამინის ქლოროკობალტის (III) ქლორიდი.
დიამინდიბრომოპლატინი (II).
ვინაიდან რთული იონი არის ანიონი, მისი ლათინური სახელი მთავრდება "am"-ით.
(NH 4) 2 - ამონიუმის ტეტრაქლოროპალადატი (II).
K – კალიუმის პენტაბრომოამინის პლატინატი (IV).
K 2 – კალიუმის ტეტრაროდანკობალტატი (II).
დასაკეცი ლიგანდის სახელი უნდა განთავსდეს მრგვალ თაღთან.
NO 3 - დიქლორო-დი-(ეთილენდიამინი) კობალტის (III) ნიტრატი.
Br - ბრომო-ტრის-(ტრიფენილფოსფინი) პლატინის (II) ბრომიდი.
ამ შემთხვევებში, როდესაც ლიგანდი აკავშირებს ორ ცენტრალურ იონს, მისი სახელის წინ გამოიყენება ბერძნული ასოμ.

ასეთ ლიგანდებს ე.წ ადგილობრივიდა დანარჩენის ზედაზღვევა.
7.4. ქიმიური კავშირი და BUDOV COMPLEX SPOLUK
რთული რეაქციების შექმნისას მნიშვნელოვან როლს თამაშობს დონორ-მიმღები ურთიერთქმედება ლიგანდსა და ცენტრალურ ატომს შორის. ელექტრონული წყვილის დონორი არის ლიგანდი. მიმღები არის ცენტრალური ატომი, რომელსაც აქვს თავისუფალი ორბიტალები. ლიგატი სველია და არ სკდება კომპლექსის მოტეხილობისას (არაიონოგენური) და ე.წ. კოორდინაცია
ბმების თანმიმდევრობით, π-ბმები იქმნება დონორ-აქცეპტორი მექანიზმის მიხედვით. როდესაც დონორი არის ლითონის იონი, რომელიც თავის დაწყვილებულ d-ელექტრონებს თმობს ლიგანდს, რაც იწვევს ენერგიულად ცარიელ ორბიტალებს. ასეთ კავშირებს დათარიღებულს უწოდებენ. სუნი ქრება:
ა) ვაკანტური p-ორბიტალების ლითონსა და d-or-bital-ს შორის გაცვლისთვის მეტალთან, რომელიც შეიცავს ელექტრონებს, რომლებიც არ შედიან σ-კავშირებში;
ბ) როდესაც ლიგანდის ვაკანტური d-ორბიტალები გადახურულია ლითონის შევსებულ d-ორბიტალებთან.
მისი მთავარი მნიშვნელობა არის ლეგანისა და ცენტრალური ატომის ორბიტალების გადახურვის ეტაპი. ცენტრალური ატომის ბმების სისწორე განსაზღვრავს კომპლექსის გეომეტრიას. ბმების პირდაპირობის ასახსნელად შემოტანილია ვიკორისტული ფენომენი ცენტრალური ატომის ატომური ორბიტალების ჰიბრიდიზაციის შესახებ. ცენტრალური ატომის ჰიბრიდული ორბიტალები წარმოიქმნება არათანაბარი ატომური ორბიტალების შერევის შედეგად, რის შედეგადაც ორბიტალების ფორმა და ენერგია ერთმანეთს იცვლება და იქმნება ახალი, მაგრამ განსხვავებული ფორმისა და ენერგიების ორბიტალები. ჰიბრიდული ორბიტალების რაოდენობა ყოველთვის უდრის გამომავალი ორბიტალების რაოდენობას. ჰიბრიდული ღრუბლები იზრდება ატომებში ერთი ტიპის მაქსიმალურ მანძილზე (ცხრილი 7.1).
ცხრილი 7.1.ატომური ორბიტალების ჰიბრიდიზაციის სახეები, კომპლექსური ფორმირება და სხვადასხვა რთული სტრუქტურების გეომეტრია

კომპლექსის სივრცითი სტრუქტურა განისაზღვრება ვალენტური ორბიტალების ჰიბრიდიზაციის ტიპისა და გაუზიარებელი ელექტრონული წყვილების რაოდენობით, რომლებიც შეესაბამება მის ვალენტურ ენერგეტიკულ დონეს.
შესაბამისად, ლიგანდსა და კომპლექსურ აგენტს შორის დონორ-მიმღები ურთიერთქმედების ეფექტურობა და მათთან შეკავშირების მნიშვნელობა (კომპლექსის სტაბილურობა) განისაზღვრება მათი პოლარიზებით, შემდეგ. ახლა გარდაქმნის მათ ელექტრონულ ჭურვებს გარე ინფუზიის ქვეშ. ამ სიმბოლოს მიხედვით, რეაგენტები იყოფა "ჟორსტკი"ან დაბალი პოლარიზებული, რომ "მიაკი" -მსუბუქი ველები - ფორმის. ატომის, მოლეკულის ან იონის პოლარობა დამოკიდებულია ელექტრონის სფეროების ზომასა და რაოდენობაზე. რაც უფრო მცირეა ელექტრონების რადიუსი ნაწილაკში, მით ნაკლებია ის პოლარიზებული. რაც უფრო მცირეა რადიუსი და რაც უფრო ნაკლები ელექტრონები აქვს ნაწილაკს, მით უფრო ძლიერია ის პოლარიზებული.
უხეში მჟავები რეაგირებს მიკრო (მყარი) კომპლექსების ლიგანდების (მყარი ფუძე) ელექტროუარყოფით ატომებთან, ხოლო რბილი მჟავები რეაგირებს ლიგანდების დონორ P, S და I ატომებთან, რომლებსაც აქვთ დაბალი ელექტრონეგატიურობა და vi წვენი. პოლარიზაცია, mіtsni (m' yaki) კომპლექსები. ჩვენ აქ ფრთხილად ვამჟღავნებთ კანონგარეშე პრინციპს „მოწონს მოწონება“.
მათი სიმკაცრის გამო ისინი პრაქტიკულად არ ქმნიან სტაბილურ კომპლექსებს ბიოსუბსტრატებთან, ხოლო ფიზიოლოგიურ გარემოში ისინი გვხვდება წყლის კომპლექსების სახით. Ca 2+ და Mg 2+ იონები ქმნიან მდგრად კომპლექსებს ცილებთან და, შესაბამისად, გვხვდება ფიზიოლოგიურ ნივთიერებებში როგორც იონურ, ისე შეკრულ მდგომარეობაში.
ისინი აერთიანებენ d- ელემენტებს ბიოსუბსტრატებთან (ცილებთან) და ბიოლოგიურ კომპლექსებთან. და რბილი მჟავები Cd, Pb, Hg ძალიან ტოქსიკურია. სუნი ქმნის მიტოზურ კომპლექსებს ცილებთან R-SH სულფჰიდრილის ჯგუფების მოსაშორებლად:
ციანიდის იონი ტოქსიკურია. რბილი ლიგანდი აქტიურად ურთიერთქმედებს d-მეტალებთან კომპლექსებში ბიოსუბსტრატებთან, აქტიურ ნარჩენებთან.
7.5. რთული გამოსვლების დისოციაცია. კომპლექსის სტაბილურობა. ლაბილური და ინერტული კომპლექსები
როდესაც რთული ნაერთები წყალში იხსნება, სუნი იშლება გარე და შიდა სფეროებში, ძლიერი ელექტროლიტების მსგავსი, რომელთა ფრაგმენტები იონოგენურად არის შეკრული, ძირითადად ელექტროსტატიკური ძალებით. ეს შეფასებულია, როგორც რთული რეაქციების პირველადი დისოციაცია.
რთული გაერთიანების მეორადი დისოციაცია არის შიდა სფეროს დაშლა მის კომპონენტებად. ეს პროცესი ხდება სუსტი ელექტროლიტების ნარევზე, შიდა სფეროს ფრაგმენტები დაკავშირებულია არაიონურად (კოვალენტური ბმა). დისოციაციას აქვს თანდათანობითი ხასიათი:

რთული ნახევარგამოყოფის შიდა სფეროს სტაბილურობის მკაფიოდ დასახასიათებლად ვიყენებთ გათანაბრების მუდმივას, რომელიც აღწერს შიდა დისოციაციას, ე.წ. კომპლექსის არასტაბილურობის მუდმივი(კნ). რთული ანიონისთვის, არასტაბილურობის მუდმივი ასე გამოიყურება:

რაც უფრო მცირეა Kn-ის მნიშვნელობა, მით უფრო სტაბილურია რთული კომუნიკაციის შიდა სფერო. ამ გზით ის ნაკლებად იშლება წყალში. დარჩენილ დროში შეცვალეთ Kn სიხისტის მუდმივის (Ku) მნიშვნელობების დახმარებით - მნიშვნელობა, Kn-ის დაბრუნება. რაც უფრო დიდია Ku-ს ღირებულება, მით უფრო სტაბილურია კომპლექსი.
სტაბილურობის მუდმივები იძლევა ლიგანდის გაცვლის პროცესების პირდაპირ პროგნოზირებას.
წყლიან კატეგორიაში ლითონის იონი ჩნდება აკვაკომპლექსების სახით: 2 + - ჰექსაკვატური რკინა (II), 2 + - ტეტრაწყლიანი სპილენძი (II). ჰიდრატირებული იონების ფორმულების დაწერისას, ჰიდრატაციის გარსის წყლის მოლეკულის კოორდინაცია არ არის მითითებული, მაგრამ შეიძლება გათვალისწინებული იყოს. ლითონის იონსა და ლიგანდს შორის კომპლექსის წარმოქმნა განიხილება, როგორც წყლის მოლეკულის ჩანაცვლების რეაქცია ამ ლიგანდთან შიდა კოორდინაციის სფეროში.
ლიგანდის გაცვლის რეაქციები მიმდინარეობს S N ტიპის რეაქციის მექანიზმით. Მაგალითად:
ცხრილი 7.2-ში მითითებული სტაბილურობის მუდმივების მნიშვნელობები მიუთითებს იმაზე, რომ კომპლექსური პროცესის დროს ხდება იონების მნიშვნელოვანი შებოჭვა წყალხსნარებში, რაც მიუთითებს ამ ტიპის რეაქციის ეფექტურობაზე, იონების, განსაკუთრებით პოლიდენტატური ლიგანდების შეკავშირებისთვის.
ცხრილი 7.2.ცირკონიუმის კომპლექსების გამძლეობა

იონგაცვლის რეაქციის შედეგად რთული რეაქციების შექმნა ხშირად არ არის კვაზიმყისიერი პროცესი. მაგალითად, როდესაც ნაერთი (III) ურთიერთქმედებს ნიტრილეტრიმეთილენფოსფონის მჟავასთან, წონასწორობა მყარდება 4 დამატების შემდეგ. კომპლექსების კინეტიკური მახასიათებლებისთვის გამოიყენება შემდეგი ცნებები: ლაბილური(შვიდიკო რეაგირებს) და ინერტული(მთლიანად რეაგირებს). ლაბილური კომპლექსები, G. Taube-ს წინადადებით, არის ისეთები, რომლებიც მთლიანად ცვლიან ლიგანდებს 1 წთ სიგრძით ოთახის ტემპერატურაზე და კონცენტრაციით 0,1 მ. აუცილებელია თერმოდინამიკური ცნებების მკაფიოდ გამიჯვნა [m ეროვნული (სტაბილური)/გერმანული. (არასტაბილური)] და კინეტიკური [ინერტული და ლაბილური] კომპლექსები.
ლაბილურ კომპლექსებში ლიგანდების ჩანაცვლება სწრაფად მიიღწევა და სწრაფად მყარდება გათანაბრება. ინერტულ კომპლექსებში ლიგანდის ჩანაცვლება უწყვეტად მიმდინარეობს.
ამრიგად, ინერტული კომპლექსი 2+ მჟავე გარემოში თერმოდინამიკურად არასტაბილურია: არასტაბილურობის მუდმივი 10 -6-ზე მეტია, ხოლო ლაბილური კომპლექსი 2 ძალიან სტაბილურია: სტაბილურობის მუდმივი 10 -30-ზე მეტია. ტაუბის კომპლექსების ლბილობა განპირობებულია ცენტრალური ატომის ელექტრონული სტრუქტურით. სიმძლავრის კომპლექსების ინერტულობა, ძირითადი რანგი, იონები დაუმთავრებელი d-ჭურვიდან. კომპლექსები Z, Cr ითვლება ინერტულად. ციანიდის კომპლექსები, რომლებიც მდიდარია კათიონებით გარე წყაროებიდან, s 2 p 6 ლაბილური.
7.6. ქიმიური ენერგეტიკული კომპლექსები
რთული შექმნის პროცესები დაფუძნებულია ყველა ნაწილაკების ძალაზე, რომელიც ქმნის კომპლექსს. რაც უფრო დიდია ლიგანდებსა და კომპლექსებს შორის კავშირების მნიშვნელობა, მით ნაკლებია ცენტრალური ატომისა და ლიგანდების ძალა და კომპლექსის თავისებურებები კიდევ უფრო ნაკლებად ვლინდება.
კომპლექსური რეაქციები ავლენს ქიმიურ და ბიოლოგიურ აქტივობას ცენტრალური ატომის (თავისუფალი ორბიტალების) კოორდინაციის დაუცველობისა და ლიგანდების თავისუფალი ელექტრონული წყვილის არსებობის გამო. ამ ტიპის კომპლექსს აქვს ელექტროფილური და ნუკლეოფილური ძალა, რომელიც ექვემდებარება ცენტრალური ატომისა და ლიგანდების ძალას.
აუცილებელია დაეყრდნოთ ჰიდრატირებული ჭურვის კომპლექსის ქიმიურ და ბიოლოგიურ აქტივობას. შექმნის პროცესი
არცერთი კომპლექსი არ მიედინება რთული სისტემის მჟავა-ტუტოვანი ძალაში. რთული მჟავების დაშლას თან ახლავს მჟავის ან ფუძის სიძლიერის გაზრდა. ამრიგად, როდესაც რთული მჟავები იხსნება მარტივიდან, H+ იონებთან შეკავშირების ენერგია მცირდება და მჟავის სიძლიერე მნიშვნელოვნად იზრდება. თუ გარე სფეროს აქვს OH - იონი, მაშინ ბმა კომპლექსურ კატიონსა და გარე სფეროს ჰიდროქსიდ იონს შორის იცვლება და კომპლექსის ძირითადი სიმძლავრე იზრდება. მაგალითად, სპილენძის ჰიდროქსიდი Cu(OH) 2 არის სუსტი, მნიშვნელოვანი ბაზა. ახალი ამიაკის ზემოქმედებისას იქმნება სპილენძის ამიაკი (OH) 2. მუხტის სიძლიერე 2+ Cu 2+-თან იცვლება, ბმა BIN იონებთან სუსტდება და (OH) 2 ითვლება ძლიერ ფუძედ. კომპლექსურ აგენტთან დაკავშირებული ლიგანდების მჟავა-ტუტოვანი ძალა უფრო ძლიერია, ვიდრე მათი დაბალი მჟავა-ტუტოვანი სიმძლავრე ველურში. მაგალითად, ჰემოგლობინი (Hb) ან ოქსიჰემოგლობინი (HbO 2) ავლენენ მჟავე ძალას ცილა-გლობინის ძლიერი კარბოქსილის ჯგუფების გაცვლისთვის, რომელიც არის ლიგანდი HHb ↔ H + + Hb - . ამავდროულად, ჰემოგლობინის ანიონი ცილის გლობინის ამინო ჯგუფისთვის აჩვენებს მთავარ ძალას და ეს გამოწვეულია CO 2 მჟავის ოქსიდით კარბამინოჰემოგლობინის ანიონის შემადგენლობით (HbCO 2 -): CO 2 + Hb - ↔ HbCO. 2 -.
კომპლექსები ავლენენ ჟანგვის ძალას ოქსიდზე დაფუძნებული კომპლექსური ნაერთების ურთიერთქმედების გამო, რომლებიც ქმნიან ჟანგვის სტაბილურ ეტაპებს. კომპლექსური პროცესი მნიშვნელოვნად ზრდის d-ელემენტების ჟანგვითი პოტენციალის მნიშვნელობებს. თუ კათიონების განახლებული ფორმა ქმნის სტაბილურ კომპლექსს ლიგანდთან, ქვედა ფორმა იჟანგება, მაშინ პოტენციალი იზრდება. პოტენციური მნიშვნელობის შემცირება ხდება, თუ სტაბილური კომპლექსი იქმნება დაჟანგული ფორმით.მაგალითად, ჟანგვის აგენტების გავლენის ქვეშ: ნიტრიტები, ნიტრატები, NO 2 H 2 O 2, ჰემოგლობინი გარდაიქმნება მეტემოგლობინში ცენტრალური ატომის დაჟანგვის შედეგად.
შოსტა ორბიტალური ვიკორისტოვია შექმნილ ოქსიჰემოგლობინში. ამ ორბიტალს იგივე ბედი აქვს, რაც ნახშირბადის მონოქსიდთან კავშირს. შედეგად იქმნება ნერწყვიდან მაკროციკლური კომპლექსი - კარბოქსიჰემოგლობინი. ეს კომპლექსი სტაბილურია 200-ჯერ, ხოლო ქვედა კომპლექსი ჰემში მჟავეა.

Პატარა 7.1.ჰემოგლობინის ქიმიური ტრანსფორმაცია ადამიანებში. სქემა წიგნიდან: Slesarev V.I. ცოცხალი არსებების ქიმიის საფუძვლები, 2000 წ
რთული იონების განათება აძლიერებს კომპლექსური იონების კატალიზურ აქტივობას. რიგ ეპიზოდებში აქტივობა იზრდება. ეს გამოწვეულია დიდი სტრუქტურული სისტემების განვითარებით, რაც იწვევს შუალედური პროდუქტების შექმნას და რეაქციის აქტივაციის ენერგიის შემცირებას. მაგალითად, თუ დაამატებთ Cu 2+ ან NH 3-ს H 2 Pro 2-ს, შეფუთვის პროცესი არ დააჩქარებს. კომპლექსი 2+-ის არსებობისას, რომელიც დამკვიდრებულია შუა ნაწილში, წყლის პეროქსიდის გამოყოფა 40 მილიონჯერ დააჩქარებს.
ასევე, ჰემოგლობინზე შეიძლება შევხედოთ რთული ნაერთების ძალას: მჟავა-ტუტოვანი, კომპლექსური და ოქსიდ-ფუძე.
7.7. კომპლექსური სპლუკების კლასიფიკაცია
არსებობს რთული ნაერთების კლასიფიკაციის მრავალი სისტემა, რომლებიც ეფუძნება სხვადასხვა პრინციპებს.
1. სიმღერის კლასამდე რთული შესრულების სტატუსისთვის:
რთული მჟავები H 2;
კომპლექსური საფუძვლები OH;
რთული მარილები K4.
2. ლიგანდის ბუნების მიხედვით: აკვა კომპლექსები, ამიომჟავები, აციდოკომპლექსები (როგორც ლიგანდები არის თავბრუდამხვევი მჟავების ანიონები, K 4; ჰიდროქსო კომპლექსები (როგორც ლიგანდები არის ჰიდროქსილის ჯგუფები, K 3); კომპლექსები მაკროციკლურ ლიგანდებთან, შუაში. ყველა დიაპაზონი შენის ცენტრალური ატომი.
3. კომპლექსის მუხტის ნიშნის მიხედვით: კატიონი - რთული კატიონი რთულ ნაერთში Cl 3; anionni – რთული ანიონი კომპლექსურ ნაერთში K; ნეიტრალური – კომპლექსის მუხტი უდრის 0-ს. გარე სფეროს კომპლექსური შეერთება არ მოქმედებს მაგ. ეს არის სიმსივნის საწინააღმდეგო პრეპარატის ფორმულა.
4. კომპლექსის შიდა სტრუქტურის მიხედვით:
ა) კომპლექსური აგენტის ატომების რაოდენობის მიხედვით: მონობირთვული- რთული ნაწილაკამდე არის კომპლექსური აგენტის ერთი ატომი, მაგალითად Cl 3; მდიდარი ბირთვული- რთული ნაწილის საწყობში არის კომპლექსის წარმომქმნელი აგენტის - ლიზოპროტეინის კომპლექსის ატომების რაოდენობა:

ბ) კომპლექსები იყოფა რამდენიმე ტიპის ლიგანდებად: მსგავსი (ერთლიგანდი),შეცვალეთ ერთი ტიპის ლიგანდი, მაგალითად 2 + და სხვადასხვა (სხვადასხვა ლიგანდები)- ორი ტიპის ლიგანდი ან მეტი, მაგალითად, Pt(NH 3) 2 Cl 2. კომპლექსი შეიცავს ლიგანდებს NH 3 და Cl - . რთული კომპლექსებისთვის, რომლებშიც სხვადასხვა ლიგანდების შიდა სფერო ხასიათდება გეომეტრიული იზომერიზმით, თუ, თუმცა, მასში ლიგანდების შიდა სფეროს შემადგენლობა განსხვავებულია.

რთული სტრუქტურების გეომეტრიული იზომერები განსხვავდება არა მხოლოდ ფიზიკური და ქიმიური გავლენის, არამედ ბიოლოგიური აქტივობის გამო. ცის-იზომერს Pt(NH 3) 2 Cl 2 აქვს მკაფიოდ გამოხატული სიმსივნის საწინააღმდეგო აქტივობა, ხოლო ტრანს-იზომერს არა;
გ) ლიგანდების სიმკვრივიდან გამომდინარე, რომლებიც ქმნიან მონობირთვულ კომპლექსებს, შეგიძლიათ იხილოთ ჯგუფები:
მონონუკლეარული კომპლექსები მონოდენტატური ლიგანდებით, მაგალითად 3+;
მონონუკლეარული კომპლექსები პოლიდენტატური ლიგანდებით. პოლიდენტატ ლიგანდებთან კომპლექსურ ნაერთებს ე.წ ქელატური სულფატები;
დ) რთული რეაქციების ციკლური და აციკლური ფორმები.
7.8. ჩელატის კომპლექსები. კომპლექსები. COMPLEXONATI
ციკლური სტრუქტურები, რომლებიც იქმნება ლითონის იონის დამატების შედეგად ორ ან მეტ დონორ ატომში, რომლებიც ბინადრობენ ქელატური აგენტის ერთ მოლეკულაში, ე.წ. ჩელატური ნაერთები.მაგალითად, სპილენძის გლიცინატი:

მათ აქვთ კომპლექსური აგენტი, თითქოს იცოდნენ ლიგანდის შუა ნაწილი, ლიგატებით, კლანჭებივით, ამიტომ სხვა თანაბარი გონების სუნი შეიძლება ჰქონდეს უფრო დიდი წინააღმდეგობა, დაბალი სიძლიერე, რათა ხელი არ შეუშალოს ციკლებს. ყველაზე სტაბილური ციკლები ისაა, რომელიც ხუთ ან ექვს ზოლში მიმდინარეობს.ეს წესი პირველად ჩამოაყალიბა L.A. ჩუგაევი. Საცალო
ქელატური კომპლექსის სტაბილურობა და მისი არაციკლური ანალოგის სტაბილურობა ე.წ ჩელატის ეფექტი.
როგორც ქელატაციური აგენტი, პოლიდენტატის ლიგანდები მოქმედებენ როგორც 2 ტიპის დაჯგუფება:
1) კოვალენტური პოლარული ბმების წარმოქმნამდე შექმნილი ჯგუფები გაცვლის რეაქციისთვის (პროტონის დონორები, ელექტრონული წყვილის მიმღებები) -CH 2 COOH, -CH 2 PO(OH) 2 -CH 2 SO 2 OH - მჟავე ჯგუფები (ცენტრები);
2) ჯგუფი-დონორები ელექტრონული წყვილი: ≡N, NH, C = O, -S-, -OH, - ძირითადი ჯგუფები (ცენტრები).
ვინაიდან ასეთი ლიგანდები არსებობენ კომპლექსის შიდა კოორდინაციის სფეროში და ანეიტრალებენ ლითონის იონის მუხტს, მათ ე.წ. შინაგანად რთული.მაგალითად, სპილენძის გლიცინატი. ვისი კომპლექსიც დღისით აქვს გარეგანი სფერო.
ორგანული ნაერთების დიდ ჯგუფს, რომლებიც განლაგებულია მოლეკულის ფუძესა და მჟავას ცენტრებში, ეწოდება კომპლექსები.ეს არის მდიდარი ძირითადი მჟავები. ქელატური ნაერთები, რომლებიც წარმოიქმნება კომპლექსების მიერ ლითონის იონებთან ურთიერთქმედებისას, ეწოდება კომპლექსურები,მაგალითად, მაგნიუმის კომპლექსონატი ეთილენდიამინტეტრაოქტის მჟავით:
წყლის მცენარეებში კომპლექსი არსებობს ანიონური ფორმით.
კომპლექსირება და კომპლექსირება არის ცოცხალი ორგანიზმების რთული ნაერთების მარტივი მოდელი: ამინომჟავები, პოლიპეპტიდები, ცილები, ნუკლეინის მჟავები, ფერმენტები, ვიტამინები და მდიდარი სხვა ენდოგენური ნაერთები.
ნინა აწარმოებს სინთეზური კომპლექსების დიდ ასორტიმენტს სხვადასხვა ფუნქციური ჯგუფით. ძირითადი კომპლექსების ფორმულები წარმოდგენილია ქვემოთ:


დიდი გონების კომპლექსებს შეუძლიათ წარმოქმნან განუყოფელი ელექტრონული წყვილი (გაყოფა) ლითონის იონთან (s-, p- ან d- ელემენტები) საკოორდინაციო კავშირის დასამყარებლად. შედეგად იქმნება სტაბილური ქელატის ტიპის ნახევარმყარი 4-, 5-, 6- ან 8-წევრიანი რგოლებით. რეაქცია ხდება pH ფართო დიაპაზონში. დამოკიდებულია pH-ზე, კომპლექსური აგენტის ბუნებაზე, მისი ურთიერთობა ლიგანდთან ქმნის სხვადასხვა მნიშვნელობისა და სიმძიმის კომპლექსებს. კომპლექსონატების წარმოქმნის ქიმია შეიძლება წარმოდგენილი იყოს ნატრიუმის მარილის EDTA (Na 2 H 2 Y ) ანალოგიით, რომელიც წყალში იშლება: Na 2 H 2 Y → 2Na + + H 2 Y 2- და H 2 Y 2 - იონი ურთიერთდაკავშირებულია ლითონის იონებთან, მიუხედავად ლითონის კატიონის დაჟანგვის სტადიისა, ყველაზე ხშირად ერთი ლითონის იონი ურთიერთქმედებს კომპლექსონის ერთ მოლეკულასთან (1:1). რეაქცია სწრაფად მიმდინარეობს (Cr>109).
კომპლექსები და კომპლექსონატები ავლენენ ამფოტერულ ძალას pH-ის ფართო დიაპაზონში, რომელიც მონაწილეობს დაჟანგვა-განახლების რეაქციებში, კომპლექსურობაში და ქმნის სხვადასხვა სიძლიერის რეაქციებს ლითონის დაჟანგვის სტადიის მიხედვით, მისი კოორდინაციის ღირებული გაჯერება, ელექტროფილური და ნუკლეოფილური ძალები. ეს ყველაფერი ნიშნავს დიდი რაოდენობის ნაწილაკების შებოჭვის უნარს, რაც საშუალებას აძლევს მცირე რაოდენობის რეაგენტებს შეასრულონ დიდი და მრავალფეროვანი ამოცანები.
კომპლექსონებისა და კომპლექსონატების გადაცემა სხვაგვარად შეუფერხებელია - არსებობს მცირე ტოქსიკურობა და ტოქსიკური ნაწილების გარდაქმნის უნარი.
დაბალი ტოქსიკური ან ბიოლოგიურად აქტიური. კომპლექსონატების დაშლის პროდუქტები არ გროვდება ორგანიზმში და არ არის მავნე. კომპლექსონატების მესამე თვისება არის მიკროელემენტების შერწყმის უნარი.
გაზრდილი აბსორბცია განპირობებულია იმით, რომ მიკროელემენტი შეყვანილია ბიოლოგიურად აქტიური ფორმით და აქვს მაღალი მემბრანული შეღწევადობა.
7.9. ფოსფორის ლითონის კომპლექსები - მიკრო და მაკროელემენტების კონვერტაციის ეფექტური ფორმა ბიოლოგიურად აქტიურ სადგამში და მოწინავე ბიოლოგიის მოდელი
Შინაარსი ბიოლოგიური აქტივობახვრელების ფართო წრის სუნი. ბიოლოგიურად აქტიური ნივთიერებების (BAS) ქვეშ ქიმიური ინფუზიის თვალსაზრისით, მიღებულია ნივთიერებების გაგება, რომლებსაც შეუძლიათ იმოქმედონ ბიოლოგიურ სისტემებზე, არეგულირებენ მათ სიცოცხლისუნარიანობას.
ასეთი თვისებების არსებობა ხშირად განიმარტება როგორც ბიოლოგიური აქტივობის არსებობა. რეგულაცია შეიძლება მოხდეს ამ და სხვა ეფექტების სტიმულაციის, ჩახშობის, განვითარების ეფექტში. ბიოლოგიური აქტივობის უკიდურესი გამოვლინება ბიოციდური მოქმედება,თუ მეტყველება-ბიოციდს საბოლოოდ შევიტან სხეულში დარჩენილი გინე. დაბალ კონცენტრაციებში, უმეტეს შემთხვევაში, ბიოციდები აწარმოებენ მასტიმულირებელ და არა ლეტალურ ეფექტს ცოცხალ ორგანიზმებზე.
ამ დროს საზოგადოების თვალში ასეთი გამოსვლების დიდი რაოდენობაა. ბიოლოგიურად აქტიური ნივთიერებების სტაგნაციის ხშირ შემთხვევაში მათი ეფექტურობა არასაკმარისია, ხშირად მაქსიმალური ეფექტურობით, სტაგნაცია კი ხშირად იწვევს გვერდით მოვლენებს, რაც შეიძლება გამოწვეული იყოს მოდიფიცირებული ბიოლოგიურად აქტიური ნივთიერებების შეყვანით.
ფოსფორის კომპლექსები ქმნიან რეაქციებს სხვადასხვა სიმძლავრით, ბუნების, ლითონის დაჟანგვის სტადიის, კოორდინაციის გაჯერების, შენახვისა და დამატენიანებელი გარსის მიხედვით. ეს ყველაფერი ნიშნავს კომპლექსონატების მრავალფუნქციურობას, სუბსტოქიომეტრული მოქმედების მათ უნიკალურ ბუნებას,
ჰალალის იონის მოქმედება უზრუნველყოფს ფართო გამოყენებას მედიცინაში, ბიოლოგიაში, ეკოლოგიაში და ხალხის მმართველობის სხვადასხვა სფეროში.
ლითონის იონის მიერ კოორდინირებული კომპლექსი განიცდის ელექტრონის სიმკვრივის გადანაწილებას. დონორ-მიმღები ურთიერთქმედების დროს გაუზიარებელი ელექტრონული წყვილის მონაწილეობის შედეგად ლიგანდის (კომპლექსის) ელექტრონის სიმკვრივე გადაადგილდება ცენტრალურ ატომში. ლიგანდზე უარყოფითი მუხტის შემცირება შეესაბამება რეაგენტების კულონური კონცენტრაციის ცვლილებას. ამრიგად, ლიგანდის კოორდინაცია ხელმისაწვდომი ხდება ნუკლეოფილური რეაგენტის შეტევისთვის, რაც იწვევს ელექტრონების ჭარბ ძალას რეაქციის ცენტრში. ელექტრონის ენერგიის ჩანაცვლება კომპლექსონიდან ლითონის იონზე იწვევს ნახშირბადის ატომის დადებითი მუხტის მნიშვნელოვან ზრდას და, შესაბამისად, ნუკლეოფილური რეაგენტის, ჰიდროქსილის იონის შეტევის შემცირებას. ფერმენტების ჰიდროქსილირებული კომპლექსი, რომელიც ახორციელებს ბიოლოგიურ სისტემებში მეტაბოლურ პროცესებს, ერთ-ერთ ცენტრალურ ადგილს იკავებს ორგანიზმში ფერმენტული მოქმედებისა და დეტოქსიკაციის მექანიზმში. ფერმენტსა და სუბსტრატს შორის მრავალპუნქტიანი ურთიერთქმედების შედეგად იქმნება ორიენტაცია, რომელიც უზრუნველყოფს აქტიური ჯგუფების სიახლოვეს აქტიურ ცენტრში და რეაქციის გადატანას ინტრამოლეკულურ რეჟიმში, რეაქციის დაწყებამდე და I გახდება გარდამავალის შექმნა, რომელიც უზრუნველყოფს FCM-ის ფერმენტულ ფუნქციას.ფერმენტის მოლეკულებს შეუძლიათ განიცადონ კონფორმაციული ცვლილებები. კოორდინაცია ქმნის დამატებით საფუძველს ცენტრალურ იონსა და ლიგანდს შორის ჟანგვითი ურთიერთქმედებისთვის, რის შედეგადაც მყარდება პირდაპირი კავშირი ჟანგვის აგენტსა და ლიგანდს შორის, რაც უზრუნველყოფს გარდამავალ ელექტრონებს. FCM გარდამავალი ლითონის კომპლექსებს შეიძლება ახასიათებდეს L-M, M-L, M-L-M ტიპის ელექტრონული გადასვლები, რომლებიც მონაწილეობენ ლითონის ორბიტალებში (M) და ლიგანდები (L), რომლებიც დაკავშირებულია კომპლექსთან დონორ-მიმღები ბმებით. კომპლექსები შეიძლება იყოს ადგილი, რომლის მეშვეობითაც მდიდარი ბირთვული კომპლექსების ელექტრონები ირხევიან ერთი და იგივე ელემენტის ცენტრალურ ატომებს შორის სხვადასხვა დაჟანგვის პირობებში. (ელექტრონისა და პროტონის გადაცემის კომპლექსები).კომპლექსები ნიშნავს ლითონის კომპლექსონატების მძლავრ თვისებებს, რაც იძლევა მაღალი ანტიოქსიდანტური, ადაპტოგენური და ჰომეოსტატიკური ფუნქციების შესრულების საშუალებას.
ასევე, კომპლექსები გარდაქმნის მიკროელემენტებს ორგანიზმისთვის მისაწვდომ ბიოლოგიურად აქტიურ ფორმად. სუნი მუდმივია,
უფრო კოორდინაციულად გაჟღენთილი ნაწილაკები, შეუქმნილი ბიოკომპლექსები და, შესაბამისად, დაბალი ტოქსიკური ფორმები. კომპლექსები კარგად მუშაობს, როდესაც ორგანიზმში მიკროელემენტების ჰომეოსტაზის დარღვევა ხდება. გარდამავალი ელემენტების იონები კომპლექსონატულ ფორმაში მოქმედებს სხეულში, როგორც ფაქტორი, რაც ნიშნავს უჯრედების მაღალ მგრძნობელობას მათი ნაწილების მიკროელემენტების მიმართ მაღალი კონცენტრაციის გრადიენტის, მემბრანული პოტენციალის შესაქმნელად. FCM-ის გარდამავალი ლითონების კომპლექსები იწვევს ბიორეგულატორულ ძალას.
FCM-ის საწყობში მჟავე და ფუძე ცენტრების არსებობა უზრუნველყოფს ამფოტერულ სიმძლავრეს და მათ მონაწილეობას მჟავა-ტუტოვანი ბალანსის შენარჩუნებაში (იზოჰიდრული მდგომარეობა).
კომპლექსონის შენახვაში ფოსფონური ჯგუფების რაოდენობის გაზრდის გამო იცვლება რთული და მცირე კომპლექსების შენახვა და განვითარება. ფოსფონური ჯგუფების გაზრდილი რაოდენობა ხელს უშლის დაბალი ხარისხის კომპლექსების წარმოქმნას უფრო ფართო pH დიაპაზონში, ანადგურებს მათი დაშლის სფეროს მჟავე რეგიონში. კომპლექსები იშლება 9-ზე ზემოთ pH-ზე.
კომპლექსური პროცესების განვითარებამ კომპლექსონებით საშუალება მისცა ბიორეგულატორების სინთეზის მეთოდების შემუშავებას:
გახანგრძლივებული ზრდის სტიმულატორები კოლოიდური-ქიმიური ფორმით - პოლიბირთვული ჰომო- და ჰეტეროკომპლექსური ტიტანის და ნერწყვის;
ზრდის სტიმულატორები წყლით მდიდარი ფორმებისთვის. ეს არის ტიტანის მრავალლიგანტური კომპლექსები, რომლებიც დაფუძნებულია კომპლექსონებზე და არაორგანულ ლიგანდებზე;
ზრდის ინჰიბიტორები - s-ელემენტების ფოსფორის კომპლექსონატები.
სინთეზური პრეპარატების ბიოლოგიური ეფექტი ზრდა-განვითარებაზე აჩვენა ქრონიკულ ექსპერიმენტებში მცენარეებზე, ცხოველებზე და ადამიანებზე.
ბიორეგულაცია- ახალი სამეცნიერო დირექტივის ფასი, რომელიც საშუალებას გაძლევთ პირდაპირ დაარეგულიროთ ბიოქიმიური პროცესების ინტენსივობა, რომელიც შეიძლება ფართოდ იქნას გამოყენებული მედიცინაში, ველურ ბუნებაში და სოფლის მეურნეობაში. იგი დაკავშირებულია ორგანიზმის ფიზიოლოგიური ფუნქციის განახლების მეთოდების შემუშავებასთან დაავადებებისა და ასაკობრივი პათოლოგიების პროფილაქტიკისა და მკურნალობის გზით. სირთულე და მათზე დაფუძნებული კომპლექსური მკურნალობა შეიძლება გავრცელდეს პერსპექტიულ ბიოლოგიურად აქტიურ მკურნალობაზე. ამ ბიოლოგიური აქტივობის ქრონიკულ ექსპერიმენტში შესწავლამ აჩვენა, თუ რა მოუტანა ქიმიამ ექიმებს.
მცოცავებს, აგრონომებსა და ბიოლოგებს აქვთ ახალი პერსპექტიული კონცეფცია, რომელიც საშუალებას აძლევს მათ აქტიურად იმოქმედონ ცოცხალ უჯრედებთან, დაარეგულირონ ცოცხალი ორგანიზმების საკვების მიწოდება, ზრდა და განვითარება.
სტაგნაციური კომპლექსონებისა და კომპლექსონატების ტოქსიკურობის გამოკვლევამ აჩვენა წამლების შემოდინების მზარდი გავრცელება სისხლის წარმომქმნელ ორგანოებში, არტერიული წნევა, მოუსვენრობა, სუნთქვის სიხშირე: არ აღინიშნა ღვიძლის ფუნქციის ცვლილება, არ არის გამოვლენილი ტოქსიკოლოგის მიერ, რომელზეც ყურადღებას გავამახვილებ. ქსოვილებისა და ორგანოების მორფოლოგია. კალიუმის მარილს OEDP-ს არ აქვს ტოქსიკურობა იმ დოზით, რომელიც 5-10-ჯერ აღემატება პრეპარატის დოზას (10-20 მგ/კგ) დამატებითი დოზით 181 დბ. შემდეგ, კომპლექსები მცირდება დაბალტოქსიკურ ნაერთებამდე. ისინი გამოიყენება როგორც სამკურნალო პრეპარატები ვირუსულ დაავადებებთან, მნიშვნელოვანი ლითონების და რადიოაქტიური ელემენტების დაქვეითების, კალციუმის ცვლის დარღვევის, ენდემური დაავადებების დროს და ორგანიზმში მიკროელემენტების ბალანსის დარღვევის დროს. ფოსფორის კომპლექსები და კომპლექსონატები არ არის მგრძნობიარე ფოტოლიზის მიმართ.
მსოფლიო პროგრესირებადი დაბინძურებაა მნიშვნელოვანი ლითონებით - ხალხის და სტაბილურად აქტიური გარემოსდაცვითი თანამდებობის პირის მთავრობის საქმიანობის პროდუქტებით. სუნი შეიძლება დაგროვდეს სხეულში. მათი ჭარბი რაოდენობა იწვევს ორგანიზმის ინტოქსიკაციას.
ლითონის კომპლექსები ინარჩუნებენ ლიგანდის (კომპლექსის) ქელატურ ეფექტს ორგანიზმში და აუცილებელია ლითონის ლიგანდის ჰომეოსტაზის მხარდასაჭერად. ინკორპორირებული მნიშვნელოვანი ლითონები სწრაფად განეიტრალება სხეულში და დაბალი რეზორბციის სიჩქარე ხელს უშლის ლითონების გადატანას ტროფიკულ შუბებში, რის შედეგადაც ხდება "ბიომინიზაცია" ისინი ტოქსიკურია, რაც განსაკუთრებით მნიშვნელოვანია ურალის რეგიონისთვის. მაგალითად, ტყვიის ძლიერი იონი შეიძლება მოიხსნას გამხსნელების მოცილებამდე, ხოლო ტყვიის მიკრომჟავას კომპლექსონატი ეთილენდიამინტეტრაოქტის მჟავასთან ერთად დაბალი ტოქსიკურია. აქედან გამომდინარე, მცენარეებისა და ცხოველების დეტოქსიკაცია მდგომარეობს სტაგნაციური ლითონის კომპლექსონატების არსებობაში. იგი ეფუძნება ორ თერმოდინამიკურ პრინციპს: მათ უნარს შექმნან მიკროსკოპული ბმები ტოქსიკურ ნაწილაკებთან, გარდაქმნას ისინი დაბალი ხარისხის ან წყალგამძლე ნაერთებად; მათი წარუმატებლობა ენდოგენური ბიოკომპლექსების განადგურებაში. ამასთან დაკავშირებით, მნიშვნელოვანია უშუალოდ გარემოსთან ბრძოლა და ეკოლოგიურად სუფთა პროდუქტების მოპოვება - მცენარეთა და ცხოველთა კომპლექსური თერაპიის ჩათვლით.
წარმონაქმნების შეყვანა იშვიათი ლითონების კომპლექსებით განხორციელდა ინტენსიური დამუშავების ტექნოლოგიით.
კარტოფილი კარტოფილის ბოლქვების მიკროელემენტების საწყობში. ბოლქვები შეიცავდა 105-116 მგ/კგ სალიზს, 16-20 მგ/კგ მანგანუმს, 13-18 მგ/კგ მიდის და 11-15 მგ/კგ თუთიას. თავსებადობა ტიპიურ მიკროელემენტებთან ბუნებრივი ქსოვილებისთვის. სტაგნაციიდან და ლითონის კომპლექსონატების სტაგნაციის გარეშე გამოზრდილი ბოლქვები ქმნიან პრაქტიკულად ახალ ელემენტარულ საწყობს. ჩელატების სტაგნაცია ხელს არ უშლის ბოლქვებში მნიშვნელოვანი ლითონების დაგროვებას. ნაკლები ხარისხის კომპლექსები, ქვედა ლითონის იონები, სორბირებულია ნიადაგით, მდგრადია მიკრობიოლოგიური შემოდინების მიმართ, რაც მათ საშუალებას აძლევს გაუმკლავდნენ ნიადაგის დაზიანებას რთულ პერიოდში. ეფექტი 3-4 წლის შემდეგ. სუნები საუკეთესოდ მიირთმევენ სხვადასხვა ორგანულ ქიმიკატებთან ერთად. კომპლექსში ლითონს აქვს დაბალი ტოქსიკურობა. ლითონებთან ფოსფორის კომპლექსები არ აღიზიანებს თვალის ლორწოვან გარსს და არ აღიზიანებს კანს. არ იყო გამოვლენილი სენსიბილიზებელი ძალა, ტიტანის კომპლექსონატების კუმულაციური ძალა არ იყო გამოხატული და ზოგ შემთხვევაში იყო ძალიან სუსტი. კუმულაციის კოეფიციენტი იგივე რჩება, როგორც 09-30, რაც მიუთითებს წამლების მიღებისას ქრონიკული უკმარისობის დაბალ პოტენციურ რისკზე.
ფოსფორის კომპლექსები დაფუძნებულია ფოსფორის კარბიდულ ბმებზე (C-P), რომლებიც ასევე გვხვდება ბიოლოგიურ სისტემებში. თქვენ შეხვალთ უჯრედის მემბრანების ფოსფონოლიპიდების, ფოსფონოგლიკანების და ფოსფოპროტეინების საწყობში. ლიპიდები, რომლებიც შლის ამინოფოსფონურ ნაერთებს, მდგრადია ფერმენტული ჰიდროლიზის მიმართ, უზრუნველყოფენ გარე უჯრედული მემბრანების სტაბილურობას და, შესაბამისად, ნორმალურ ფუნქციონირებას. პიროფოსფატების სინთეზური ანალოგები - დიფოს-ფონატი (P-S-P) ან (P-S-S-P) მაღალი დოზებით ანადგურებს კალციუმის მეტაბოლიზმს, ხოლო მცირე დოზებით ახდენს მის ნორმალიზებას. დიფოსფონატები ეფექტურია ჰიპერლიპემიისთვის და პერსპექტიულია ფარმაკოლოგიური თვალსაზრისით.
დიფოსფონატები, რომლებიც ცვლის P-C-P ობლიგაციებს ბიოსისტემების სტრუქტურული ელემენტებით. სუნები ბიოლოგიურად ეფექტური და პიროფოსფატების ანალოგებია. ნაჩვენებია, რომ დიფოსფონატები ეფექტური მეთოდებია სხვადასხვა დაავადებების სამკურნალოდ. დიფოსფონატები მინერალიზაციისა და კისტების რეზორბციის აქტიური ინჰიბიტორებია. კომპლექსები გარდაქმნის მიკროელემენტებს ორგანიზმისთვის ხელმისაწვდომ ბიოლოგიურად აქტიურ ფორმად, ქმნის სტაბილურ, მაღალ კოორდინირებულ ნაწილაკებს და არაბუნებრივი ბიოკომპლექსებს, ასევე დაბალტოქსიკურ ფორმებს. სუნი მიუთითებს უჯრედების მაღალ მგრძნობელობაზე მიკროელემენტების მიმართ, რომლებიც მონაწილეობენ მაღალი კონცენტრაციის გრადიენტის ფორმირებაში. დღევანდელი ძმები მონაწილეობენ მდიდარი ბირთვული ნახევრად ბირთვული ტიტანის ჰეტერონუკლერების შექმნაში -
ახალი ტიპის - ელექტრონებისა და პროტონების გადაცემის კომპლექსები, რომლებიც მონაწილეობენ მეტაბოლური პროცესების ბიორეგულაციაში, ორგანიზმის წინააღმდეგობას, ტოქსიკურ ნაწილაკებთან ბმების გადაწყვეტის უნარს, მათ მცირე ან უმნიშვნელო პირობებად გარდაქმნას კი, არ ფუჭდება. ენდოგენური კომპლექსები. ამიტომ ისინი სტაგნირებულია დეტოქსიკაციის, ორგანიზმიდან გამოდევნის, ეკოლოგიურად სუფთა პროდუქტების (კომპლექსური თერაპია) მოპოვებისთვის, ასევე ინდუსტრიაში არაორგანული მჟავების და მარილების სამრეწველო ნარჩენების რეგენერაციისა და გამოყენებისათვის.ბევრი პერსპექტიული ლითონია.
7.10. ლიგანდის ბირჟები და ლითონის ბირჟები
რივნოვაგი. ქელატოთერაპია
თუ სისტემაში არის რამოდენიმე ლიგანდი ერთი ლითონის იონით ან ლითონის იონების რაოდენობა ერთი ლიგანდით, რომლებიც შექმნილია რთული ნაერთების შექმნამდე, მაშინ თავს არიდებენ კონკურენტ პროცესებს: პირველ ტიპში ლიგანდების გაცვლა თანაბარია - კონკურენციის ლიგანდები. ლითონის იონისთვის, მეორე ტიპს აქვს მეტალის გაცვლის მეტოქეობა - კონკურენცია ლითონის იონებს შორის ლიგანდისთვის. მნიშვნელოვანი იქნება აყვანის კომპლექსის შექმნის პროცესი. მაგალითად, რუსეთში არის იონები: მაგნიუმი, თუთია, ნერწყვი (III), სპილენძი, ქრომი (II), ნერწყვი (II) და მანგანუმი (II). როდესაც ამ ხსნარში შეჰყავთ მცირე რაოდენობით ეთილენდიამინტეტრაოქტის მჟავა (EDTA), ხდება კონკურენცია ლითონის იონებს შორის და ნერწყვის კომპლექსთან (III) შეკავშირებას შორის, ღვინის დარჩენილი ნაწილი მცირდება EDTA-ით ყველაზე მეტად.ცნიის კომპლექსი.
სხეულში არის მუდმივი ურთიერთქმედება ბიომეტალებს (MB) და ბიოლიგანდებს (Lb) შორის, არსებითი ბიოკომპლექსების შექმნა და აღდგენა (MbLb):
ადამიანის სხეულში, ცხოველებსა და მცენარეებში არსებობს იმავე ტიპის ქსენობიოტიკების (უცხო ნივთიერებების) დაცვისა და მხარდაჭერის სხვადასხვა მექანიზმი, მათ შორის მნიშვნელოვანი ლითონების იონები. ისინი მნიშვნელოვანი ლითონებია, რომლებიც არ არის შეკრული კომპლექსში და მათი ჰიდროქსო კომპლექსები შეიცავს ტოქსიკურ ნაწილაკებს (Mt). ამ შემთხვევებში, გარდა ბუნებრივი ლითონის ლიგანდის ნარევისა, შეიძლება მოხდეს ახალი რევოლუცია, მნიშვნელოვანი უცხოური კომპლექსების შექმნით ლითონის ტოქსიკანტის (MtLb) ან ლიგანდ-ტოქსიკანტის (MbLt) დასაპირისპირებლად, რაც არ ინერვიულოთ.
აუცილებელი ბიოლოგიური ფუნქციები. როდესაც ეგზოგენური ტოქსიკური ნაწილაკები სხეულში შედიან, ხდება წონასწორობის ნაზავი და, შედეგად, პროცესების კონკურენცია. მნიშვნელოვანი იქნება ის პროცესი, რომელიც მივყავართ მაქსიმალური ყოვლისმომცველი შედეგის შექმნას:

ლითონის ლიგანდის ჰომეოსტაზის დარღვევა იწვევს მეტაბოლური პროცესის მოშლას, ფერმენტის აქტივობის დათრგუნვას, ისეთი მნიშვნელოვანი მეტაბოლიტების მოშლას, როგორიცაა ATP, უჯრედის მემბრანები, იონების კონცენტრაციის გრადიენტის მოშლა უჯრედში. ამიტომ, ცალმხრივი სისტემები იქმნება ამისთვის. ამ მეთოდთან მჭიდრო კავშირშია ქელატაციური თერაპია (კომპლექსური თერაპია).
ქელატაციური თერაპია არის ორგანიზმიდან ტოქსიკური ნაწილაკების მოცილების პროცესი, რომელიც ემყარება მათი s-ელემენტების კომპლექსონატების შელაციას. წამლებს, რომლებიც გამოიყენება ორგანიზმში შემავალი ტოქსიკური ნაწილაკების მოსაშორებლად, დეტოქსიკატორებს უწოდებენ.(Lg). ტოქსიკური ნაწილაკების ქელაცია ლითონის კომპლექსონატებთან (Lg) გარდაქმნის ტოქსიკურ მეტალის იონებს (Mt) არატოქსიკურ (MtLg) შეკავშირებულ ფორმებად, რომლებიც შესაფერისია მემბრანების მეშვეობით იზოლაციისა და შეღწევისთვის, ტრანსპორტირებისთვის და ორგანიზმიდან გამოდევნისთვის. სუნი ინარჩუნებს ქელატაციურ ეფექტს ორგანიზმში, როგორც ლიგანდისთვის (კომპლექსონი), ასევე ლითონის იონისთვის. ეს უზრუნველყოფს მეტალის ლიგანდის ჰომეოსტაზს ორგანიზმში. ამიტომ კომპლექსონატების გამოყენება მედიცინაში, ცხოველებსა და მცენარეებში უზრუნველყოფს ორგანიზმის დეტოქსიკაციას.
ქელატაციური თერაპიის ძირითადი თერმოდინამიკური პრინციპები შეიძლება ჩამოყალიბდეს ორ პოზიციაზე.
I. დეტოქსიკატორი (Lg) პასუხისმგებელია ახლად წარმოქმნილ იონ-ტოქსიკურ ნივთიერებებზე (Mt, Lt) ეფექტურად შებოჭვაზე, რომლებიც პასუხისმგებელნი არიან სხეულში არსებულ ქვედა ნაწილებზე:
II. დეტოქსიფიკატორი არ არის დამნაშავე სიცოცხლის აუცილებელი კომპლექსური მკურნალობის (MBLb) ჩანგრევაში; ნაერთები, რომლებიც შეიძლება შეიქმნას დეტოქსიკანტისა და ბიომეტალური იონების (MBLg) ურთიერთქმედებით, სავარაუდოდ ნაკლებად მნიშვნელოვანი იქნება, ვიდრე ორგანიზმში არსებული ნაერთები:
7.11. კომპლექსების და კომპლექსონატების დაკომპლექტება მედიცინაში
კომპლექსის მოლეკულები პრაქტიკულად არ ცნობენ გახლეჩვას ან ბიოლოგიურ შემადგენლობაში რაიმე ცვლილებას, რასაც დიდი ფარმაკოლოგიური მნიშვნელობა აქვს. კომპლექსები არ იშლება ლიპიდებში და ადვილად იხსნება წყალში, ამიტომ სუნი არ აღწევს და არ აღწევს უჯრედულ გარსებში და შესაბამისად: 1) არ გამოიყოფა ნაწლავებით; 2) კომპლექსური აგენტების შეწოვა შესაძლებელია მხოლოდ მათი ინექციით (თუ პენიცილამინი არ მიიღება შინაგანად); 3) კომპლექსები სხეულში ცირკულირებენ ძირითადად პოსტკლინიკურ სივრცეში; 4) სხეულიდან ამოღება ხდება თავის წოდებით ნირკების მეშვეობით. ეს პროცესი სწრაფად ტარდება.
სიტყვებს, რომლებიც ბიოლოგიურ სტრუქტურებზე შემოდინების კვალს ტოვებს და ქიმიური რეაქციების შედეგად ფოთლებს ააქტიურებს, ე.წ. ანტიდოტები.
ერთ-ერთი პირველი ანტიდოტი, რომელიც გამოიყენება ქელატაციურ თერაპიაში, არის ბრიტანული ანტი-ლუიზიტი (BAL). ამ დროს დააყენეთ ერთეული:
ეს პრეპარატი ეფექტურად შლის ფერფლს, ვერცხლისწყალს, ქრომს და ბისმუტს ორგანიზმიდან. ყველაზე ფართოდ გამოყენებული ნაერთებია თუთიის, კადმიუმის, ტყვიის და ვერცხლისწყლის კომპლექსები და კომპლექსები. მათი ფორმულირება ეფუძნება სამკურნალო კომპლექსების შექმნას ლითონის იონებით, ამ იონების ქვედა კომპლექსები ცილების, ამინომჟავების და ნახშირწყლების ნახშირწყლოვანი ჯგუფებით. ტყვიის მოსაშორებლად გამოიყენეთ პრეპარატები EDTA-ზე დაფუძნებული. როდესაც ორგანიზმში წამლების დიდი დოზები შეჰყავთ, ისინი უსაფრთხო არ არის, რადგან სუნის ფრაგმენტები კალციუმს უკავშირდება, რაც მრავალი ფუნქციის დარღვევას იწვევს. ტომი გაჩერდება ტეტაცინი(CaNa 2 EDTA), რომელიც გამოიყენება ტყვიის, კადმიუმის, ვერცხლისწყლის, ნიტრიის, ცერიუმის და სხვა იშვიათი დედამიწის ლითონებისა და კობალტის მოსაშორებლად.

1952 წელს თეტაცინის პირველი კლინიკური დანერგვის შემდეგ, ეს პრეპარატი ფართოდ გამოიყენება პროფესიული დაავადებების კლინიკაში და აღარ არის აუცილებელი ანტიდოტი. თეტაცინის მოქმედების მექანიზმი ძალიან მარტივია. იონ-ტოქსიკური ნივთიერებები ხელს უშლის კალციუმის იონის კოორდინაციას თეტაცინთან არსებითი შემკვრელების მჟავასთან და EDTA-სთან შეკავშირებაში. კალციუმის იონი, თავის მხრივ, იცვლება ნატრიუმის ორი იონებით, რომლებიც დაკარგულია:

თეტაცინი ორგანიზმში შეჰყავთ 5-10% დოზით, რაც ეფუძნება ფიზიოლოგიურ მიზეზებს. ამრიგად, ცერებრალური ინექციის შემდეგ 1,5 წლის შემდეგაც კი, სხეული კარგავს თეტაცინის შეყვანილი დოზის 15%-ს, 6 წლის შემდეგ - 3%-ს და 2-ზე მეტის შემდეგ - 0,5%-ზე ნაკლებს. ეს პრეპარატი ეფექტურია თეტაცინთან ერთად ინჰალაციის მეთოდით მიღებისას. ის სწრაფად შეიწოვება და დიდი ხნის განმავლობაში ცირკულირებს სისხლში. გარდა ამისა, ტეტაცინი გამოიყენება გაზის განგრენის სამკურნალოდ. ის აფერხებს თუთიისა და კობალტის იონების მოქმედებას, რომლებიც წარმოადგენენ ლეციტინაზას ფერმენტის აქტივატორებს, რომელიც წარმოადგენს გაზის განგრენის ტოქსინს.
ტოქსინების შეერთება თეტაცინთან დაბალტოქსიკურ და სასარგებლო ქელატის კომპლექსში, რომელიც არ იშლება და ადვილად გამოიყოფა ორგანიზმიდან სეკრეციის გზით, უზრუნველყოფს დეტოქსიკაციას და დაბალანსებულ მინერალურ კვებას. სტრუქტურისა და საწყობის უკან დახურვა წინასწარ
EDTA parathas - დიეთილენტრიამინ-პენტაოქტის მჟავას ნატრიუმ-კალციუმის მარილი (CaNa 3 DTPA) - პენტაცინიდა დიეთილენტრიამინპენტაფოსფონის მჟავას ნატრიუმის მარილი (Na 6 DTPP) - ტრიმეფა-ცინი.პენტაცინი მნიშვნელოვანია რადიონუკლიდების მოცილებისთვის (ტექნეტიუმი, პლუტონიუმი, ურანი).

ეთილენდიამინის დიიზოპროპილფოსფონის მჟავას ნატრიუმის მარილი (CaNa 2 EDTP) ფოსფიცინიიგი წარმატებით გამოიყენება ორგანიზმიდან ვერცხლისწყლის, ტყვიის, ბერილიუმის, მანგანუმის, აქტინიდების და სხვა ლითონების მოსაშორებლად. კომპლექსები ძალიან ეფექტურია გარკვეული ტოქსიკური ანიონების მოსაშორებლად. მაგალითად, ეთილენდიამინის ტეტრააცეტატი კობალტამდე (II), რომელიც რეაგირებს შერეული ლიგანდის კომპლექსთან CN-თან, შეიძლება რეკომენდებული იყოს ციანიდით მოწამვლის ანტიდოტად. მსგავსი პრინციპი საფუძვლად უდევს ტოქსიკური ორგანული ნაერთების მოცილების მეთოდებს, პესტიციდების აღმოფხვრას და ფუნქციური ჯგუფების ჩანაცვლებას დონორი ატომებით, რომლებიც შექმნილია ლითონის კომპლექსონატთან ურთიერთქმედების წინ.
ეფექტური პრეპარატი სუკიმერი(დიმერკაპტოსაქცინის მჟავა, დიმერკაპტოსუკცინის მჟავა, ქმემეტი). ის ეფექტურად აკავშირებს თითქმის ყველა ტოქსიკურ ნივთიერებას (Hg, As, Pb, Cd), მაგრამ არ შლის ბიოგენურ ელემენტებს (Cu, Fe, Zn, Co) ორგანიზმიდან.
ფოსფორის კომპლექსონატები და კალციუმის ფოსფატების და ოქსალატების კრისტალური წარმოქმნის ძლიერი ინჰიბიტორები. Xydiphon, OEDF-ის კალიუმ-ნატრიუმის მარილი, ინიშნება როგორც კალციფიკაციის საწინააღმდეგო საშუალება კანის დაავადებების სამკურნალოდ. გარდა ამისა, დიფოსფონატები მინიმალურ დოზებში ზრდიან კალციუმის შეყვანას ცისტის ქსოვილში, რაც ხელს უშლის პათოლოგიურ გამოსვლას კისტებიდან. OEDP და სხვა დიფოსფონატები ხელს უშლიან სხვადასხვა სახის ოსტეოპოროზის, მათ შორის ოსტეოდისტროფიას, პაროდონტს.
კარგად, განადგურება, ისევე როგორც ცხოველებში გადანერგილი კისტის განადგურება. ასევე აღწერილია OEDF-ის ანტიათეროსკლეროზული ეფექტი.
შეერთებულ შტატებში დაბალი დიფოსფონატები, Zocrema OEDF, ინიშნება ფარმაცევტულ პრეპარატებად იმ ადამიანებისა და ცხოველების სამკურნალოდ, რომლებსაც აწუხებთ მეტასტაზური კისტა. მემბრანებში შეღწევადობის რეგულირებით დიფოსფონატები ხელს უწყობენ უჯრედში სიმსივნის საწინააღმდეგო უჯრედების ტრანსპორტირებას და ასევე სხვადასხვა ონკოლოგიური დაავადებების ეფექტურ მკურნალობას.
გადაუდებელი მედიცინის ერთ-ერთი აქტუალური პრობლემაა სხვადასხვა დაავადების სწრაფი დიაგნოსტიკის აუცილებლობა. ამ ასპექტში დიდი ინტერესია წამლების ახალი კლასი, რომელიც ცვლის კატიონებს, რითაც აცილებს ზონდის ფუნქციებს - რადიოაქტიური მაგნიტორალაქსაცია და ფლუორესცენტური ეტიკეტები. როგორც რადიოფარმაცევტული საშუალებების ძირითადი კომპონენტები, გამოიყენება გარკვეული ლითონების რადიოიზოტოპები. ამ იზოტოპების კათიონების ქელაცია კომპლექსონებთან შესაძლებელს ხდის ორგანიზმისთვის მათი ტოქსიკოლოგიური თვისებების გაძლიერებას, მათი ტრანსპორტირების გაადვილებას და კონცენტრაციის მაღალ დონეს ამ და სხვა ორგანოებში.
ეს მაგალითები ძნელად ამოწურავს მედიცინაში გამოყენებული კომპლექსონატების მრავალფეროვან ფორმას. ამრიგად, ეთილენდიამინის ტეტრააცეტატის მაგნიუმის ვიკორისტის დიკალიუმის მარილი გამოიყენება რეგულაციისთვის პათოლოგიის დროს ქსოვილებში ნაცვლად. EDTA ინახება ანტიკოაგულანტების სუსპენზიების საწყობში, რომლებიც გამოიყენება სისხლის პლაზმის განაწილებისას, როგორც ადენოზინტრიფოსფატის სტაბილიზატორი სისხლში მაღალი გლუკოზის შემთხვევაში, აფერადებს და ინარჩუნებს კონტაქტურ ლინზებს. რევმატოიდული პაციენტების მკურნალობისას ფართოდ გამოიყენება დიფოსფონატები. სუნი განსაკუთრებით ეფექტურია, როგორც ართრიტის საწინააღმდეგო აგენტი მათში, რომლებიც დაკავშირებულია ანთების საწინააღმდეგო საშუალებებთან.
7.12. კომპლექსები მაკროციკლირების კომპლექსებით
ბუნებრივ კომპლექსურ ნაერთებს შორის განსაკუთრებული ადგილი უკავია ციკლურ პოლიპეპტიდებზე დაფუძნებულ მაკროკომპლექსებს, რათა ჩაანაცვლოს მცირე ზომის შიდა ცარიელი სივრცეები, რომლებიც შეიცავს ჟანგბადის უამრავ ჯგუფს, რომლებიც აკავშირებენ ამ ლითონების კატიონებს, მათ შორის ნატრიუმს და კალიუმს, ზომები. რომელთაგან შეესაბამება ცარიელი ტარის ზომებს. ასეთი გამოსვლები გვხვდება ბიოლოგიაში

Პატარა 7.2.ვალინომიცინის კომპლექსი K+ იონთან ერთად
ჩეხური მასალები, უზრუნველყოფენ იონების ტრანსპორტირებას მემბრანებში და ე.წ იონოფორები.მაგალითად, ვალინომიცინი ახორციელებს კალიუმის იონის ტრანსპორტირებას მემბრანის გასწვრივ (ნახ. 7.2).
სხვა პოლიპეპტიდის დასახმარებლად გრამიციდინი ანატრიუმის კათიონების ტრანსპორტირება ხდება სარელეო მექანიზმის უკან. ეს პოლიპეპტიდი იკეცება "მილაკში", რომლის შიდა ზედაპირი გაფორმებულია ჟანგბადის შემცველი ჯგუფებით. შედეგად, გადით გარეთ
დიდხანს დაელოდეთ ჰიდროფილურ არხს მცირე ჭრილით, რაც მიუთითებს ნატრიუმის იონის ზომაზე. ნატრიუმის იონები, რომლებიც შედიან ჰიდროფილურ არხში ერთი მხრიდან, გადადიან ერთიდან მეორეზე მჟავე ჯგუფებში, იონური გამტარი არხის მეშვეობით სარელეო რბოლის მსგავსად.
ასევე, პოლიპეპტიდის ციკლურ მოლეკულას აქვს შიდა მოლეკულური სიცარიელე, იმდენად, რამდენადაც შესაძლებელია სხვადასხვა ზომისა და გეომეტრიის სუბსტრატის ამოღება გასაღებისა და საკეტის პრინციპის მიხედვით. ასეთი შინაგანი რეცეპტორების ცარიელი სივრცე გაფორმებულია აქტიური ცენტრებით (ენდორეცეპტორები). ლითონის იონის ბუნებიდან გამომდინარე, შეიძლება მოხდეს არაკოვალენტური ურთიერთქმედება (ელექტროსტატიკური, წყლის ბმების ფორმირება, ვან დერ ვაალის ძალები) ფუძე ლითონებთან და კოვალენტური ურთიერთქმედება ძირითად ლითონებთან. შედეგად, ისინი თავს იჩენენ სუპრამოლეკულები- რთული ასოციაციები, რომლებიც შედგება ორი ან მეტი ნაწილაკისგან, რომლებიც ერთდროულად ექვემდებარება მოლეკულურ ძალებს.
ცოცხალ ბუნებაში ყველაზე გავრცელებული ტეტრადენტატური მაკროციკლებია პორფინები და მათთან ახლოს კორინოიდის სტრუქტურის უკან.სქემატურად, ტეტრადენტინის ციკლი შეიძლება წარმოდგენილი იყოს თანამედროვე სახით (ნახ. 7.3), სადაც რკალი ნიშნავს იგივე ტიპის ნახშირბადის შუბებს, რომლებიც აკავშირებს დონორის ატომებს აზოტთან დახურულ ციკლში; R1, R2, R3, P4 -ნახშირწყლების რადიკალები; M n+ არის ლითონის იონი: ქლოროფილში Mg 2+ იონი, ჰემოგლობინში Fe 2+ იონი, ჰემოციაინში Cu 2+ იონი, ვიტამინ B 12-ში (კობალამინი) C 3+ იონი.
აზოტის დონორი ატომები ნაწილდება კვადრატის კიდეების გასწვრივ (მითითებულია წერტილოვანი ხაზით). სუნი სასტიკად კოორდინირებულია სივრცეში. ტომ
პორფირინები და კორინოიდები ქმნიან კომპლექსებს სხვადასხვა ელემენტების კათიონებთან და ნიადაგის ლითონების კვალთან. მართალია, რა ლიგანდის დაკბილვის მიუხედავად, ქიმიური ბმები და კომპლექსი ენიჭება დონორ ატომებს.ასე, მაგალითად, მედიის კომპლექსები NH 3-ით, ეთილენდიამინისა და პორფირინით, თუმცა, კვადრატული ან მსგავსი ელექტრონული კონფიგურაცია. მეტი პოლიდენტატური ლიგანდები უფრო ძლიერად უკავშირდებიან ლითონის იონებს, ვიდრე ქვედა მონოდენტატური ლიგანდები.

Პატარა 7.3.ტეტრადენტატის მაკროციკლი
იგივე დონორი ატომებით. ეთილენდიამინის კომპლექსების ღირებულება 8-10 ბრძანებით მეტია, ხოლო ამავე ლითონების ღირებულება ამიაკით უფრო დაბალია.
ლითონის იონების ბიოორგანული კომპლექსები ცილებთან ე.წ ბიოკლასტერები -ლითონის იონების კომპლექსები მაკროციკლურ ნაერთებთან (ნახ. 7.4).

Პატარა 7.4. d-ელემენტების იონებით ცილოვანი კომპლექსების სხვადასხვა ზომის ბიოკლასტერების სტრუქტურის სქემატური წარმოდგენა. ცილის მოლეკულების ურთიერთქმედების სახეები. M n+ - მეტალის იონი აქტიურ ცენტრამდე
ბიოკლასტერის შუა ნაწილი ცარიელია. მანამდე მოდის ლითონი, რომელიც ურთიერთქმედებს შემაკავშირებელ ჯგუფების დონორ ატომებთან: OH - , SH - , COO - , -NH 2 , ცილები, ამინომჟავები. ყველაზე თვალსაჩინო მეტალოფერი -
ფერმენტები (კარბოანჰიდრაზა, ქსანტინოქსიდაზა, ციტოქრომები) და ბიოკლასტერები, რომელთა ცარიელი ნაწილები ქმნის ფერმენტულ ცენტრებს, რომლებიც შეიცავს ზოგადად Zn, Mo, Fe.
7.13. მდიდარი ბირთვული კომპლექსები
ჰეტეროვალენტური და ჰეტერონუკლეარული კომპლექსები
კომპლექსებს, რომლებიც შეიცავს ერთი ან სხვადასხვა ელემენტის ცენტრალურ ატომებს, ეწოდება ბირთვული მდიდარი.მდიდარი ბირთვული კომპლექსების შექმნის შესაძლებლობა განისაზღვრება იმით, რომ გარკვეული ლიგანდები უკავშირდებიან ლითონის ორ ან სამ იონს. ასეთ ლიგანდებს ე.წ ადგილობრივიᲜათელია ადგილობრივიკომპლექსებს უწოდებენ. ფუნდამენტურად შესაძლო მონოატომური ადგილები, მაგალითად:

ისინი გაიმარჯვებენ განუყოფელ ელექტრონულ ფსონებს, რომლებიც ეკუთვნის ერთსა და იმავე ატომს. შეიძლება შეიცვალოს ტერიტორიების როლი ატომით მდიდარი ლიგანდები.ასეთ ადგილებში ვიკორიზებულია გაუზიარებელი ელექტრონული წყვილები, რომლებიც სხვადასხვა ატომს ეკუთვნის. პოლიატომური ლიგანდი

ᲐᲐ. გრინბერგი და ფ.მ. ადგილობრივად იქნა შესწავლილი ფილენის ნაერთები, რომლებშიც ლიგანდები აკავშირებენ იმავე ლითონის რთულ ნაერთებს, მაგრამ დაჟანგვის სხვადასხვა სტადიაში. გ.ტაუბე უწოდებს მათ ელექტრონის გადაცემის კომპლექსები.ჩვენ მივყვეთ ელექტრონის გადაცემის რეაქციას სხვადასხვა ლითონების ცენტრალურ ატომებს შორის. ოქსიდ-ოქსიდის რეაქციების კინეტიკისა და მექანიზმის სისტემატურმა გამოკვლევამ განაპირობა აღმოჩენა, რომ მიმდინარეობს ელექტრონების გადაცემა ორ კომპლექსს შორის.
გასვლა ლეგენდარული ადგილიდან, რომელიც გასუფთავებულია. ელექტრონების გაცვლა 2+ და 2+ შორის ხდება შუალედური კომპლექსის შექმნის გზით (ნახ. 7.5). ელექტრონის გადაცემა ხდება ქლორიდის უბნის ლიგანდის მეშვეობით, რის შედეგადაც წარმოიქმნება კომპლექსები 2+; 2+.

Პატარა 7.5.ელექტრონის გადატანა შუალედურ მდიდარ ბირთვულ კომპლექსში
პოლინუკლეარული კომპლექსების დიდი მრავალფეროვნება აღმოიფხვრება ორგანული ლიგანდების შერჩევით, რათა ჩაანაცვლოს რიგი დონორი ჯგუფები. ამ ხსნარის გამოსავალი არის ლიგანდში დონორი ჯგუფების დაშლა, რაც არ იძლევა ქელაციური ციკლების დახურვის საშუალებას. ეს ასე არ არის, თუ ლიგანდს აქვს უნარი დახუროს ქელაციური ციკლი და ერთდროულად იმოქმედოს როგორც ლოკალური.
ელექტრონების გადაცემის პრინციპით, არსებობს გარდამავალი ლითონები, რომლებიც ავლენენ სტაბილურ ჟანგვის ეტაპებს. ეს აძლევს იონებს ტიტანს, ელექტრონების იდეალური სიმძლავრის მატარებლების შეღწევას და მედიას. Ti და Fe-ზე დაფუძნებული ჰეტერონუკლეარული კომპლექსების (HSC) და ჰეტერონუკლეარული კომპლექსების (HNC) შექმნის ვარიანტების მთლიანობა წარმოდგენილია ნახ. 7.6.
რეაქცია

რეაქცია (1) ეწოდება ჯვარედინი რეაქცია.გაცვლითი რეაქციების დროს, ჰეტეროვალენტური კომპლექსები იქნება შუალედური. ყველა თეორიულად შესაძლო კომპლექსი შეიძლება ეფექტურად ჩამოყალიბდეს სხვადასხვა გონებაში, რასაც მოწმობს სხვადასხვა ფიზიკურ-ქიმიური

Პატარა 7.6.ჰეტეროვალენტური კომპლექსების და ჰეტერონუკლეარული კომპლექსების ფორმირება Ti და Fe-ს ჩანაცვლებისთვის
მეთოდები. ელექტრონების წარმატებული გადაცემისთვის, ჩართული რეაგენტები განლაგებულია ახლომდებარე ქვეყნებში. ამას ალბათ ფრანკ-კონდონის პრინციპი ჰქვია. ელექტრონის გადაცემა შეიძლება მოხდეს ერთი გარდამავალი ელემენტის ატომებს შორის, რომლებიც იმყოფებიან HVA-ს დაჟანგვის სხვადასხვა სტადიაზე, ან HCA-ს სხვადასხვა ელემენტებს შორის, რომელთა ლითონის ცენტრების ბუნება განსხვავებულია. Tsi შეიძლება გამოითვალოს როგორც ელექტრონის გადაცემის კომპლექსები. ისინი ბიოლოგიურ სისტემებში ელექტრონებისა და პროტონების ძლიერი მატარებლები არიან. ელექტრონის დამატება და მიწოდება იწვევს ცვლილებებს ლითონის ელექტრონულ კონფიგურაციაში, ორგანული საწყობის კომპლექსის სტრუქტურის შეცვლის გარეშე.ყველა ეს ელემენტი გადის რამდენიმე სტაბილური დაჟანგვის ეტაპებს (Ti +3 და +4; Fe +2 და +3; Cu +1 და +2). ჩვენი აზრით, ამ სისტემებს ბუნებით ენიჭება უნიკალური როლი ბიოქიმიური პროცესების ბრუნვის უზრუნველსაყოფად მინიმალური ენერგიის შეყვანით. საპირისპირო რეაქციებამდე არის რეაქციები, რომლებსაც აქვთ თერმოდინამიკური და თერმოქიმიური მუდმივები 10-3-დან 103-მდე და ΔG o i-ის მცირე მნიშვნელობებით. ე ოპროცესები ამ გონებაში, გამოსავალი და რეაქციის პროდუქტები შეიძლება იყოს წარმოდგენილი სხვადასხვა კონცენტრაციით. მოცემულ დიაპაზონში მათი შეცვლისას პროცესი ადვილად შეიძლება შეიცვალოს; შესაბამისად, ბიოლოგიურ სისტემებში ბევრ პროცესს შეიძლება ჰქონდეს კოვალენტური (ძალადობრივი) ბუნება. ოქსიდზე დაფუძნებული სისტემები, რომლებიც იმალება მათ საწყობებში, მოიცავს პოტენციალების ფართო სპექტრს, რაც მათ ურთიერთქმედების საშუალებას აძლევს, რასაც თან ახლავს ზომიერი ცვლილებები Δ. გ ოі E°, სუბსტრატების სიმდიდრით.
HVA და HYAC-ის ჰომოგენურობა მნიშვნელოვნად იზრდება, თუ არსებობს პოტენციური ადგილობრივი ლიგანდების შემცველობის სურვილი. მოლეკულები ან იონები (ამინომჟავები, ჰიდროქსი მჟავები, კომპლექსები და ა.შ.), რომლებიც აკავშირებენ ლითონის ორ ცენტრს. GVK-ში ელექტრონის დელოკალიზაციის შესაძლებლობა იწვევს კომპლექსის მთლიანი ენერგიის შემცირებას.
HVA და HYAK-ის მომზადების შესაძლო ვარიანტების მეტი რაოდენობა, რომლებშიც ლითონის ცენტრების ბუნება განსხვავებულია, ჩანს ნახ. 7.6. GVK-ისა და HYAK-ის შექმნის დეტალური აღწერა და მათი როლი ბიოქიმიურ სისტემებში განხილულია O.M. გლებოვა (1997). ოქსიდ-ჰიდროქსიდის წყვილები სტრუქტურულად სუსტდება ერთი-ერთზე, ამიტომ ტრანსფერი შესაძლებელი ხდება. სხვადასხვა კომპონენტის შერჩევით შეგიძლიათ „დაღეჭოთ“ ნარევი, რომელიც ელექტრონს გადააქვს ჟანგვის აგენტიდან ჟანგვის აგენტზე. ნაწილაკების სათანადო მოძრაობით შეიძლება მოხდეს ელექტრონების გადატანა ზურგის მექანიზმის მეშვეობით. როგორც "დერეფანი" შეგიძლიათ ცილოვანი ლანცეტის დატენიანება და ა.შ. ელექტრონის გადაცემის მაღალი საიმედოობა ძაბვამდე 100A-მდე. მთელი დერეფანი შეიძლება დაემატოს დანამატებით (ლითონების იონი, ფონის ელექტროლიტები). ეს ავლენს დიდ შესაძლებლობებს საწყობის მენეჯმენტში და GVK-სა და GYAK-ის ხელისუფლებაში. რუსეთში სუნი თამაშობს ერთგვარი „შავი ყუთის“ როლს, რომელიც სავსეა ელექტრონებითა და პროტონებით. ავეჯს რომ არ იტოვებთ, შეგიძლიათ დაამატოთ ისინი სხვა კომპონენტებს ან შეავსოთ თქვენი „რეზერვები“. მათი ნაწილებიდან რეაქციების შექცევადობა ციკლურ პროცესებში დიდი რაოდენობით მონაწილეობის საშუალებას იძლევა. ელექტრონები გადადიან ერთი ლითონის ცენტრიდან მეორეში, რხევავენ მათ შორის. კომპლექსის მოლეკულა ხდება ასიმეტრიული და შეუძლია მონაწილეობა მიიღოს ოქსიდის წარმოქმნის პროცესებში. GVK და HYAK აქტიურ მონაწილეობას იღებენ ბიოლოგიურ მედიაში კოლოგენეზის პროცესებში. ამ ტიპის რეაქციას კოლატერალური რეაქციები ეწოდება.სუნი გამოვლინდა ფერმენტული კატალიზის, ცილების სინთეზისა და სხვა ბიოქიმიური პროცესების დროს, რომლებიც თან ახლავს ბიოლოგიურ ნივთიერებებს. ეს მოიცავს უჯრედული მეტაბოლიზმის პერიოდულ პროცესებს, სხვადასხვა აქტივობას გულის ქსოვილში, ტვინის ქსოვილში და პროცესებს, რომლებიც ხდება ეკოლოგიური სისტემების დონეზე. p align="justify"> მნიშვნელოვანი ნაბიჯი გამოსვლების გაცვლაში არის წყლის გამოყოფა ცოცხალი გამოსვლებისგან. ატომები გადადიან მაიონებელ მდგომარეობაში და მათი ელექტრონების გაძლიერება შედის აქტიურ შუბეში და ხელს უწყობს მათ ენერგიას ATP-ს შექმნაში. როგორც დავადგინეთ, ტიტანის კომპლექსები არიან როგორც ელექტრონების, ასევე პროტონების აქტიური მატარებლები. ტიტანის იონების როლი მათ როლში ფერმენტების აქტიურ ცენტრში, როგორიცაა კატალაზები, პეროქსიდაზები და ციტოქრომები, მიუთითებს მათი კომპლექსურობის მაღალი დონით, კოორდინირებული იონის გეომეტრიის ფორმირებით, მდიდარი ბირთვული HVAC-ების და HVAC-ების შექმნით. სხვადასხვა შენახვა და სიმძლავრე ინფორმაცია pH ფუნქციის, Ti გარდამავალი ელემენტის კონცენტრაციისა და ორგანული შენახვის კომპლექსის შესახებ, ლოცვითი ურთიერთობის შესახებ. ეს თვისება გამოიხატება კომპლექსის გაზრდილ სელექციურობაში
სუბსტრატებთან, მეტაბოლური პროცესების პროდუქტებთან მიმართებაში, კომპლექსში (ფერმენტში) და სუბსტრატში ბმების გააქტიურება დამატებითი კოორდინაციისთვის და სუბსტრატის ფორმის შეცვლა აქტიური ცენტრის სტერული ძალების შესაბამისად.
სხეულში ელექტროქიმიური გარდაქმნები, რომლებიც დაკავშირებულია ელექტრონების გადაცემასთან, თან ახლავს ნაწილაკების დაჟანგვის სტადიის ცვლილებას და ორგანიზმის დაჟანგვის პოტენციალის ცვლილებას. ამ გარდაქმნებში დიდი როლი ეკუთვნის მდიდარ ბირთვულ კომპლექსებს GVK და GYAK. ისინი არიან თავისუფალი რადიკალების პროცესების აქტიური რეგულატორები, მჟავას, წყლის პეროქსიდის, ჟანგვის აგენტების, რადიკალების აქტიური ფორმების გამოყენების სისტემა და მონაწილეობენ ჟანგვის სუბსტრატებში, აგრეთვე ანტი-ოქსიდაციური ჰომეოსტაზის შენარჩუნებაში, ორგანიზმის დაცვაში ჟანგვის საწინააღმდეგოდ. სტრესი.მათი ფერმენტული მოქმედება ბიოსისტემაზე მსგავსია ფერმენტების (ციტოქრომი, სუპეროქსიდდისმუტაზა, კატალაზა, პეროქსიდაზა, გლუტათიონ რედუქტაზა, დეჰიდროგენაზა). ეს ყველაფერი ნიშნავს გარდამავალი ელემენტის კომპლექსონატების მაღალ ანტიოქსიდანტურ ძალას.
7.14. კვება და მიღება თვითშემოწმებისთვის მომზადებისთვის გაკვეთილებისა და გამოცდების წინ
1. რთული პრობლემების გაგება. რა არის მათი ღირებულება მაღალი ხარისხის მარილებთან შედარებით და რა არის მათში უკეთესი?
2. დაამატეთ რთული ნაერთების ფორმულები მათი სახელწოდებით: ამონიუმის დიჰიდროქსოტეტრაქლოროპლატინატი (IV), ტრიამინტრინიტროკობალტი (III), მიეცით მათი მახასიათებლები; მიუთითეთ შიდა და გარე კოორდინაციის სფერო; ცენტრალური იონი და მისი დაჟანგვის ეტაპი: ლიგანდები, მათი სიძლიერე და სიმკვრივე; ობლიგაციების ბუნება. დაწერეთ დისოციაციის დონე წყალ ნიადაგში და ვირუსში მუდმივი სტაბილურობისთვის.
3. კომპლექსური რეაქციების ამაღლებული ძალა, დისოციაცია, კომპლექსების მდგრადობა, კომპლექსების ქიმიური ძალა.
4. როგორ ხასიათდება კომპლექსების რეაქცია თერმოდინამიკური და კინეტიკური პოზიციებიდან?
5. რომელი ამინოკომპლექსები იქნება უფრო მნიშვნელოვანი, დაბალი ტეტრაამინო-სპილენძი (II) და რომელი იქნება ნაკლებად მნიშვნელოვანი?
6. ლითონების იონებით შექმნილი მაკროციკლური კომპლექსების აპლიკაციების წარმართვა; d-ელემენტების იონები.
7. რა ნიშნით უნდა მივიყვანოთ კომპლექსები ქელაციამდე? ფოკუსირება რთული ქელატური და არაქელატური ფორმულირებების გამოყენებაზე.
8. თაფლის გლიცინატის გამოყენებისას გაეცანით შიდა კომპლექსურ ეფექტებს. დაწერეთ მაგნიუმის კომპლექსონატის სტრუქტურული ფორმულა ეთილენდიამინტეტრაოქტის მჟავასთან ნატრიუმის სახით.
9. დახაზეთ რაიმე პოლინუკლეარული კომპლექსის სტრუქტურული ფრაგმენტი.
10. მიეცით მრავალბირთვული, ჰეტერონუკლეარული და ჰეტერო-დარტყმითი კომპლექსების მნიშვნელობა. გარდამავალი ლითონების როლი კარგად არის გასაგები. ამ კომპონენტების ბიოლოგიური როლი.
11. რა სახის ქიმიური ბმები წარმოიქმნება რთულ ნაერთებში?
12. გადახედეთ ატომური ორბიტალების ჰიბრიდიზაციის ძირითად ტიპებს, რომლებიც შეიძლება მოხდეს კომპლექსის ცენტრალურ ატომში. როგორია კომპლექსის გეომეტრია, ჰიბრიდიზაციის სახეობიდან გამომდინარე?
13. s-, p- და d-ბლოკების ელემენტების ატომების ელექტრონული ფორმიდან გამომდინარე, დაადგინეთ კავშირი კომპლექსებასთან და მათ ადგილს კომპლექსების ქიმიაში.
14. მიეცით კომპლექსების და კომპლექსონატების მნიშვნელობები. იპოვნეთ უდიდესი კვლევის აპლიკაციები ბიოლოგიასა და მედიცინაში. წარმოადგინეთ თერმოდინამიკური პრინციპები, რომლებზეც დაფუძნებულია ქელატაციური თერაპია. კომპლექსონატების შეჩერება ორგანიზმიდან ქსენობიოტიკების გასანეიტრალებლად და აღმოსაფხვრელად.
15. შეხედეთ ადამიანის ორგანიზმში ლითონის ლიგანდების ჰომეოსტაზის დარღვევის ძირითად ტიპებს.
16. დაარეგულირეთ ბიოკომპლექსური ნაერთების კონდახი ლითონის, კობალტის და თუთიის მოსაშორებლად.
17. ჰემოგლობინის მონაწილეობის კონკურენტული პროცესების გამოყენება.
18. მეტალის იონების როლი ფერმენტებში.
19. ახსენით, რატომ არის კობალტის კომპლექსებში დასაკეცი ლიგანტებით (პოლდენტაციით) სტაბილური ჟანგვის ეტაპი +3, ხოლო ელემენტარულ მარილებში, როგორიცაა ჰალოგენები, სულფატები, ნიტრატები, ჟანგვის ეტაპი +2?
20. სპილენძისთვის დამახასიათებელი დაჟანგვის საფეხურებია +1 და +2. როგორ შეუძლია სპილენძს ელექტრონის გადაცემის რეაქციების კატალიზაცია?
21. როგორ შეუძლია თუთიას ოქსიდის რეაქციების კატალიზაცია?
22. როგორია ვერცხლისწყლის მოცილების მექანიზმი?
23. რეაქციაში დაამატეთ მჟავა და ფუძე:
AgNO 3 + 2NH 3 = NO 3.
24. ახსენით, რატომ გამოიყენება, როგორც სამკურნალო საშუალება, ჰიდროქსიეთილის დიფოსფონმჟავას კალიუმ-ნატრიუმის მარილი და არა OEDP.
25. როგორ მოქმედებს ბიოკომპლექსური განყოფილებების საწყობში შემავალი ლითონის იონები ორგანიზმში ელექტრონების ტრანსპორტირებაზე?
7.15. ტესტები
1. ცენტრალური ატომის დაჟანგვის ეტაპი კომპლექსურ იონში 2- უფრო ძვირი:
ა) -4;
ბ) +2;
2-ზე;
დ)+4.
2. ყველაზე სტაბილური რთული იონი:
ა) 2-, Kn = 8,5 x10 -15;
ბ) 2-, Kn = 1,5 x10 -30;
გ) 2-, Kn = 4x10 -42;
დ) 2-, Kn = 1x10 -21.
3. ხსნარი შეიცავს 0,1 მოლ PtCl 4 4NH 3. AgNO 3-თან რეაგირებისას ის ხსნის 0,2 მოლ AgCl ნალექს. მიეცით გამომავალ მეტყველებას კოორდინაციის ფორმულა:
ა)Cl;
ბ) Cl 3;
გ) Cl 2;
დ) Cl 4.
4. როგორც შედეგად შექმნილი კომპლექსები ყალიბდება sp 3 d 2-გი- bridization?
1) ტეტრაედონი;
2) კვადრატი;
4) ტრიგონალური ბიპირამიდა;
5) ხაზოვანი.
5. შეარჩიეთ ფორმულა პენტაამინის ქლოროკობალტის (III) სულფატის მოსამზადებლად:
ა) ნა 3 ;
6) [CoCl 2 (NH 3) 4] Cl;
გ) 2-მდე [C(SCN) 4];
დ)SO 4;
ე) [C(N 2 პრო) 6 ] C1 3 .
6. რომელი ლიგანდებია პოლიდენტატი?
ა) C1 -;
ბ) H 2 O;
გ) ეთილენდიამინი;
დ) NH 3;
ე) SCN - .
7. კომპლექსის წარმომქმნელი აგენტები:
ა) ატომ-დონორი ელექტრონული წყვილი;
გ) ელექტრონული წყვილების ატომური იონ-მიმღები;
დ) ატომური იონები-ელექტრონული წყვილების დონორები.
8. ყველაზე პატარა კომპლექსის შემქმნელი ელემენტებია:
ა)ს; გ) დ;
ბ) პ; დ) ვ
9. ლიგანდი – ცე:
ა) ელექტრონული წყვილის დონორი მოლეკულები;
ბ) ელექტრონული წყვილების იონ-მიმღები;
გ) ელექტრონული წყვილების მოლეკულები და იონ-დონორები;
დ) ელექტრონული წყვილების იონ-მიმღები მოლეკულები.
10. კომპლექსის შიდა კოორდინაციის სფეროს ბმულები:
ა) კოვალენტური გაცვლა;
ბ) კოვალენტური დონორ-აქცეპტორი;
გ)იონა;
დ) ვოდნევა.
11. ყველაზე ლამაზი კომპლექსი იქნება:
წყლის ნაერთებში ძირითადი ჩანაცვლების რეაქცია - წყლის მოლეკულების გაცვლა (22) - შესწავლილია ლითონის იონების დიდი რაოდენობით (ნახ. 34). წყლის მოლეკულების გაცვლა ლითონის იონის საკოორდინაციო სფეროში წყლის მოლეკულების უმეტესობასთან, რომელიც არის წყარო, მეტალების უმეტესობისთვის ძალიან სწრაფად მიმდინარეობს და, შესაბამისად, ასეთი რეაქციის სიჩქარე შეიძლება განისაზღვროს რელაქსაციის მთავარი მეთოდით. მეთოდი ვრცელდება დაზიანებულ სითხის სისტემებზე, მაგალითად, ტემპერატურის უეცარ ცვლილებებზე. ახალი გონების გამო (მაღალი ტემპერატურა), სისტემა აღარ ექვემდებარება ცვლილებას. შემდეგ დონის დაყენების სითხე ქრება. თქვენ შეგიძლიათ შეცვალოთ ტემპერატურა დაჭერით 10 -8 წმ, მაშინ შეგიძლიათ აკონტროლოთ რეაქციის სითხე, რომლის დასრულებას საათზე მეტი დრო სჭირდება 10 -8 წმ.
ასევე შესაძლებელია სხვადასხვა ლითონის იონებში კოორდინირებული წყლის მოლეკულების ჩანაცვლების სითხის გაზომვა ლიგანდებით SO 2- 4, S 2 O 3 2-, EDTA და ა.შ. (26). ასეთი რეაქციის სითხე
დევს ჰიდრატირებული ლითონის იონის კონცენტრაციაში და არ დევს შეყვანის ლიგანდის კონცენტრაციაში, რაც იძლევა პირველი რიგის შედარების საშუალებას ამ სისტემების სითხის აღსაწერად (27). ხშირ შემთხვევაში, რეაქციის სიჩქარე (27) მოცემული ლითონის იონისთვის არ არის დამოკიდებული შეყვანის ლიგანდის (L) ბუნებაზე, არც H 2 O მოლეკულაზე, არც SO 4 2- იონზე, S 2 O 3 2 - ან EDTA.
სიფრთხილის გამო, ისევე როგორც იმ ფაქტის გამო, რომ ამ პროცესის სიჩქარე არ შეიცავს შეყვანის ლიგანდის კონცენტრაციას, შესაძლებელია რეაქცია გაგრძელდეს იმ მექანიზმის მიხედვით, რომელშიც სტადიის უმეტესი ნაწილი მდგომარეობს რღვევაში. რეაქცია.ენა მეტალის იონსა და წყალს შორის. გასაგებია, რომ შესაძლებელია გამოსვლა, შემდეგ სწრაფად კოორდინაცია ლიგანდებს, რომლებიც ახლოს არიან.
განყოფილებაში თავის 4 ნაწილში აღინიშნა, რომ უფრო მაღალ დამუხტული ჰიდრატირებული ლითონის იონები, როგორიცაა Al 3+ და Sc 3+, მეტს ცვლის წყლის მოლეკულებს, ქვედა იონებს M 2+ და M +; ეს საშუალებას გვაძლევს ვივარაუდოთ, რომ ამ ეტაპზე, რაც ნიშნავს მთელი პროცესის სითხეს, ლიგატების დაშლა მნიშვნელოვან როლს ასრულებს. ამ გამოკვლევებში გამოვლენილი დასკვნები არ არის ნარჩენი, მაგრამ ისინი ვარაუდობენ, რომ ჰიდრატირებული მეტალის იონების ჩანაცვლებითი რეაქციების დროს S N 1 პროცესები მნიშვნელოვანია.
ცხადია, ყველაზე აქტიური რთული ნაერთებია კობალტი (III). მათი სტაბილურობა, მომზადების სიმარტივე და უაღრესად ზუსტი რეაქცია მათ განსაკუთრებით შესაფერისს ხდის კინეტიკური კულტივირებისთვის. ამ კომპლექსების ზოგიერთი კვლევა ჩატარდა ინკლუზიურად წყლის წყაროებში, უპირველეს ყოვლისა, განიხილებოდა ამ კომპლექსების რეაქციები წყაროს - წყლის მოლეკულებთან. აღმოჩნდა, რომ ამიაკის ან ამინების მოლეკულები, რომლებიც კოორდინირებულია Co(III) იონით, მთლიანად ჩანაცვლებულია წყლის მოლეკულებით, რაც ნიშნავს, რომ განიხილება სხვა ლიგანდების ჩანაცვლება და არა ამინები.
დადგინდა (28) ტიპის რეაქციის სითხე და დადგინდა, რომ კობალტის კომპლექსი არის პირველი რიგის (X არის ერთ-ერთი მრავალი შესაძლო ანიონიდან).
ასე რომ, რადგან წყლის მინდვრებში H 2 O კონცენტრაცია დაახლოებით იგივეა, რაც ადრე 55.5 მ, შეუძლებელია წყლის მოლეკულების კონცენტრაციის შეცვლის ეფექტის დადგენა რეაქციის სითხეზე. სითხის დონე (29) და (30) წყლის წარმოებისთვის ექსპერიმენტულად არ არის განსაზღვრული, რადგან ის უბრალოდ ექვივალენტურია k" = k". თუმცა, რეაქციის სიჩქარის გამო, შეუძლებელია იმის თქმა, იღებს თუ არა H 2 O მონაწილეობას სტადიაში, რაც ნიშნავს პროცესის სიჩქარეს. საჭიროა რეაქცია მივაწოდოთ S N 2 მექანიზმს X იონის H 2 O მოლეკულით და S N 1 მექანიზმის ჩანაცვლებით, რომელიც გადასცემს საწყის დისოციაციას H 2 O მოლეკულის შემდგომი მიმატებიდან. მაგრამ გამორიცხეთ იგი სხვა ექსპერიმენტული მონაცემების დახმარებით.
ამ ამოცანის განვითარება შეიძლება მიღწეული იყოს ორი ტიპის ექსპერიმენტით. ჰიდროლიზის სითხე (ერთი Cl-იონის ჩანაცვლება წყლის მოლეკულაზე) ტრანსი- + დაახლოებით 10 3-ჯერ მეტი სითხე, ვიდრე ჰიდროლიზი 2+. კომპლექსის მუხტის ზრდა იწვევს ლითონ-ლიგანდის ბმების გაძლიერებას და, შესაბამისად, ამ ობლიგაციების რღვევის გალვანიზაციას. ეს ასევე იწვევს შეყვანის ლიგანდების სიმძიმეს და ჩანაცვლების რეაქციის სიმარტივეს. ვინაიდან სითხის ცვლილება გამოვლინდა კომპლექსის გაზრდილი მუხტის გამო, ამ ფაზაში უფრო ძლიერი დისოციაციური პროცესი ხდება (S N 1).
კიდევ ერთი გზა ჰიდროლიზით დამუშავებული მსგავსი კომპლექსების სერიის საფუძვლის დასამტკიცებლად ტრანსი- +. ამ კომპლექსებში ეთილენდიამინის მოლეკულა ჩანაცვლებულია მსგავსი დიამინებით, რომლებშიც ნახშირბადის ატომები და წყლის ატომები ჩანაცვლებულია CH 3 ჯგუფებით. კომპლექსები, რომლებიც ცვლის დიამინს, რეაგირებენ ქვედა ეთილენდიამინის კომპლექსთან. წყლის ატომების CH 3 ჯგუფით ჩანაცვლება ზრდის ლიგანდის ტვირთს, რაც ართულებს ლითონის ატომზე სხვა ლიგანდით შეტევას. ეს სტერული გადასვლები აძლიერებს S N 2 მექანიზმის რეაქციას. მეტალის ატომთან მოცულობითი ლიგანდების არსებობა ხელს უწყობს დისოციაციურ პროცესს, ამოღებული ერთ-ერთი ლიგანდის ფრაგმენტები ამცირებს მათ დაგროვებას ლითონის ატომში lu. ნაყარი ლიგანდებით კომპლექსების ჰიდროლიზის დაფიქსირებული გაზრდილი სითხე არის კარგი მტკიცებულება იმისა, რომ რეაქცია მიმდინარეობს S N 1 მექანიზმით.
ასევე, Co(II) აციდოამინის კომპლექსების რიცხობრივი კვლევების შედეგად გამოვლინდა, რომ მჟავა ჯგუფების წყლის მოლეკულებით ჩანაცვლება არსებითად დისოციაციური პროცესია. ატომის შეერთება კობალტთან - ლიგანდი დაუკავშირდება გარკვეულ კრიტიკულ მნიშვნელობას, ჯერ წყლის ქვედა მოლეკულები დაიწყებენ კომპლექსში შესვლას. კომპლექსებში, რომლებიც ატარებენ 2+ და უფრო მაღალ მუხტს, არღვევს ბმას, კობალტი არის ლიგანდი კიდევ უფრო რთული და წყლის მოლეკულების შესვლა იწყებს მნიშვნელოვან როლს.
აღმოჩნდა, რომ კობალტის(III) კომპლექსში მჟავა ჯგუფის (X -) ჩანაცვლება სხვა ჯგუფით, ქვედა მოლეკულა H 2 O, (31) გადის ჩანაცვლებულ მოლეკულაში.
საცალო ვაჭრობა - ლიდერობს ახალი ჯგუფის Y (32) დაუყოვნებლივ ჩანაცვლებით.
ამრიგად, კობალტის(III) კომპლექსებთან მრავალ რეაქციაში, რეაქციის სიჩქარე (31) უფრო მაღალია, ვიდრე ჰიდროლიზის სიჩქარე (28). გარდა ამისა, ჰიდროქსილის იონი იშლება სხვა რეაგენტებით Co(III) ამინებთან ურთიერთობისას. ღვინო ძალიან სწრაფად რეაგირებს ამინის კომპლექსებთან კობალტთან (III) (დაახლოებით 10 6-ჯერ უფრო სწრაფად, დაბალი წყალი) რეაქციის სახეობიდან გამომდინარე. ძირითადი ჰიდროლიზი (33).
აღმოჩნდა, რომ ეს რეაქცია არის პირველი რიგის ლიგანდის OH - (34) ჩანაცვლების გამო. რეაქციის სრულიად განსხვავებული რიგი და რეაქციის სიჩქარე საშუალებას გვაძლევს ვივარაუდოთ, რომ OH იონი არის ეფექტური ნუკლეოფილური რეაგენტი Co(III) კომპლექსებთან მიმართებაში და რომ რეაქცია მიმდინარეობს S N 2 მექანიზმით ხსნარის პერინეალური კავშირის მეშვეობით.
თუმცა, OH-ის სიმძლავრე შეიძლება აიხსნას სხვა მექანიზმით [დაკავშირება (35), (36)]. რეაქციაში (35) კომპლექსი 2+ იქცევა როგორც მჟავა (ბრონსტედის შემდეგ), იძლევა კომპლექსს +, რომელიც არის є ამიდო-(შურისძიება)-ნახევრად ფუძე, რომელიც 2+ მჟავეა.
შემდეგ რეაქცია მიმდინარეობს S N 1 მექანიზმით (36) ხუთკოორდინატიანი შუამავლის შექმნით, რომელიც შემდეგ რეაგირებს წარმოშობის მოლეკულებთან და მივყავართ რეაქციის საბოლოო პროდუქტამდე (37). რეაქციის ეს მექანიზმი შეესაბამება სხვა რიგის რეაქციის სითხეს და მსგავსია S N 1 მექანიზმის. რეაქციის ფრაგმენტები იმ სტადიაში, რომელიც წარმოქმნის სითხეს, მოიცავს ფუძეს, რომელიც ასოცირდება cob კომპლექსთან om - მჟავასთან, შემდეგ ამ მექანიზმთან. ენიჭება აღნიშვნა S N 1СВ.
აქედან გამომდინარე, ამ მექანიზმებიდან რომელი ხსნის ყველაზე კარგად ექსპერიმენტულ სიფრთხილის ზომებს, კიდევ უფრო მნიშვნელოვანია. თუმცა, არსებობს დამატებითი მტკიცებულება, რომელიც მხარს უჭერს ჰიპოთეზას No1CB. ამ მექანიზმის მექანიზმის საუკეთესო არგუმენტები შემდეგია: ოქტაედრული Co(III) კომპლექსები იწყებენ რეაქციას S N 1 დისოციაციური მექანიზმის მეშვეობით და არ არსებობს საერთო არგუმენტები, თუ რატომ არის OH იონი პასუხისმგებელი S N 2-ის პროცესზე. დადგინდა, რომ ჰიდროქსილის იონი - სუსტი ნუკლეოფილური რეაგენტი Pt(II)-დან რეაქციებში და ეს, როგორც ჩანს, უმიზეზო რეაქციაა Co(III) მიმართ. კობალტის (III) რეაქციები არაწყლიან გარემოში არის შესანიშნავი მტკიცებულება ხუთკოორდინატიანი შუალედური ნაერთების შექმნის შესახებ, რომლებიც გადაცემულია S N 1 SV მექანიზმით.
დარჩენილი მტკიცებულება არის ის, რომ Co(III) კომპლექსში N - H ბმების არსებობის გამო, იგი მთლიანად რეაგირებს OH - იონებთან. ეს, რა თქმა უნდა, მნიშვნელოვანს ხდის, რომ რეაქციის სიჩქარისთვის კომპლექსის მჟავა-ტუტოვანი სიმძლავრე მნიშვნელოვანია VIN-ის ნუკლეოფილური სიმძლავრისთვის." ნებისმიერი სხვა შესაძლო მექანიზმის გამორთვისთვის საჭიროა დახვეწილი ექსპერიმენტის ჩატარება.
ამჟამად დაფიქსირდა დიდი რაოდენობით რვაწახნაგოვანი ნახევარსფეროების ჩანაცვლების რეაქცია. მათი რეაქციის მექანიზმების შესწავლისთანავე დისოციაციური პროცესი ყველაზე ხშირად ძლიერდება. ეს შედეგი არ არის უდავო, რადგან ექვსი ლიგანდი ტოვებს მცირე ადგილს ცენტრალურ ატომთან სხვა ჯგუფების დასამატებლად. მხოლოდ რამდენიმე აპლიკაცია ჩანს, თუ შვიდი კოორდინაციის შუალედური კვანძი იდენტიფიცირებულია ან შეყვანილია ლიგანდი, რომელიც გამოყენებული იქნება. აქედან გამომდინარე, S N 2 მექანიზმი არ შეიძლება მთლიანად შეიცვალოს ოქტაედრულ კომპლექსებში ჩანაცვლებითი რეაქციის შედეგად.
კომპლექსების ფსიქიკურ ქიმიურ რეაქციებში შედის გაცვლა, დაჟანგვა, იზომერიზაცია და კოორდინატული ლიგანდები.
კომპლექსების პირველადი დისოციაცია შიდა და გარე სფეროებში ნიშნავს გარე იონების გაცვლის რეაქციის გადაჭარბებას:
Xm+mNaY = Ym+mNaX.
კომპლექსების შიდა სფეროს კომპონენტებს შეუძლიათ მონაწილეობა მიიღონ მეტაბოლურ პროცესებში, რომელშიც მონაწილეობენ როგორც ლიგანდები, ასევე კომპლექსური აგენტები. ლიგანდების ან ცენტრალური ლითონის იონის ჩანაცვლების რეაქციის დასახასიათებლად, კ. ინგოლდის მიერ შემუშავებული ტერმინოლოგია ორგანული ნაერთების რეაქციებისთვის (ნახ. 42), ნუკლეოფილურის ნ და ელექტროფილური S E ჩანაცვლება:
Z + Y = z + X S N
Z + M" = z + M S E.
ჩანაცვლების რეაქციის მექანიზმი იყოფა (ნახ. 43) ასოციაციურ ( S N 1 და S E 1 ) და დისოციაციური ( S N 2 და S E 2 ), რომლებზეც გავლენას ახდენს გარდამავალი ფაზა გაზრდილი და შემცირებული კოორდინაციის რიცხვით.
რეაქციის მექანიზმის გაფართოება ასოციაციურზე ან დისოციაციურზე მნიშვნელოვანია შუალედურის იდენტიფიკაციის ექსპერიმენტული მიღწევით საკოორდინაციო რიცხვის ცვლილებით ან გაზრდით. ამასთან დაკავშირებით, რეაქციის მექანიზმი ხშირად განიხილება არაპირდაპირი მონაცემების საფუძველზე რეაგენტების კონცენტრაციის გაზრდის შესახებ რეაქციის სითხეზე, რეაქციის პროდუქტის გეომეტრიული ფორმის ცვლილების შესახებ და ა.შ.
კომპლექსებში ლიგანდების ჩანაცვლების რეაქციის სითხის დასახასიათებლად, 1983 წელს დაბადებული ნობელის პრემიის ლაურეატი. რ. ტაუბემ (ნახ. 44) ყურადღებით განსაზღვრა ტერმინები „ლაბილური“ და „ინერტული“, როდესაც ლიგანდების ჩანაცვლების რეაქცია 1 წუთზე ნაკლებია. ტერმინები ლაბილური ან ინერტული დამახასიათებელია ლიგანდის შემცვლელი რეაქციის კინეტიკისთვის და არ უნდა აგვერიოს კომპლექსების სტაბილურობის ან არასტაბილურობის თერმოდინამიკურ მახასიათებლებთან.
კომპლექსების მდგრადობა და ინერტულობა დამოკიდებულია კომპლექსური იონისა და ლიგანდების ბუნებაზე. ლიგანდის ველის თეორიის მსგავსი:
1. ოქტაედრული კომპლექსები 3დ გარდამავალი ლითონები ვალენტური განაწილებით ( n -1) დ ელექტრონები სიგმაზე*(მაგალითად ) Fluff MO lab.
4- (t 2g 6 e g 1) + H 2 O= 3- + CN -.
უფრო მეტიც, რაც უფრო მცირეა კომპლექსის სტაბილიზაციის ენერგიის მნიშვნელობა კრისტალური ველით, მით უფრო დიდია მისი მდგრადობა.
2. ოქტაედრული კომპლექსები 3დ გარდამავალი ლითონები ძლიერი სიგმით* ფუმფულა ე ორბიტალები და ვალენტობის თანაბარი განაწილება ( n -1) d ელექტრონები t 2 გ ორბიტალით (t 2 g 3, t 2 g 6) ინერტული.
[Co III (CN) 6] 3- (t 2 g 6 e g 0 ) + H 2 O =
[Cr III (CN) 6] 3- (t 2 g 3 e g 0) + H 2 O =
3. სიბრტყე-კვადრატი და ოქტაედარი 4დ და 5 დ გარდამავალი ლითონები, რომლებიც არ გადასცემენ ელექტრონებს სიგმაში* Fluff up MO ინერტული.
2+ + H 2 O =
2+ + H 2 O =
ლიგანდების ბუნების შეყვანა ლიგანდის შემცვლელი რეაქციის სიჩქარეზე „ლიგანდების ურთიერთინფუზიის“ მოდელის ფარგლებში. მოდით შევაჯამოთ ლიგანდების ორმხრივი შემოდინების მოდელი, ჩამოყალიბებული 1926 წელს. ი.ი. Chernyaevym ტრანს-ნაკადის კონცეფცია (ნახ. 45) - „კომპლექსში ლიგანდის სტაბილურობა მდგომარეობს ტრანს-გავრცელებულ ლიგანდის ბუნებაში“ - და წარმოქმნის უამრავ ტრანს-გავრცელებულ ლიგანდს: CO, CN -, C 2 H 4 > PR 3, H - > CH 3 -, SC (NH 2) 2 > C 6 H 5 -, NO 2 -, I -, SCN - > Br -, Cl - > py , NH 3 , OH - , H 2 O .
ტრანს-ნაკადის კონცეფცია საშუალებას გვაძლევს დაგვედგინა ემპირიული წესები:
1. პეირონის წესი- ტეტრაქლოროპლატინატზე ამიაკის ან ამინების არსებობისას ( II ) კალიუმი გამოდის პირველი დიქლოროდიამინეპლატინის ცის-კონფიგურაციის:
2 - + 2NH 3 = cis - + 2Cl -.
რეაქცია ორ ეტაპად მიმდინარეობს და ქლორიდის ლიგანდი წარმოქმნის დიდ ტრანს-ნაკადს, შემდეგ სხვა ქლორიდის ლიგანდის ამიაკით ჩანაცვლება იწვევს ცის-[ Pt (NH 3 ) 2 Cl 2 ]:
2 - + NH 3 = -
NH 3 = cis -.
2. ჯერგენსენის წესი - როდესაც დიქლოროჰიდრონის მჟავა რეაგირებს პლატინის ტეტრამინ ქლორიდთან ( II ) ან მსგავსი შედეგების მიღება შესაძლებელია დიქლორო-ამინეპლატინის ტრანს-კონფიგურაციიდან:
[Pt(NH 3) 4] 2+ + 2 HCl = ტრანს-[Pt (NH 3) 2 Cl 2] + 2 NH 4 Cl.
შესაძლებელია ლიგანდების ტრანსინფუზიის სერიის შემოღება, ამიაკის სხვა მოლეკულის ჩანაცვლება ქლორიდის ლიგანდით, სანამ ტრანს-[ Pt (NH 3 ) 2 Cl 2].
3. კურნაკოვის თიორეის რეაქცია - თიომონის რეაქციის სხვადასხვა პროდუქტები გეომეტრიულ იზომერებთან ტრანს-[ Pt (NH 3 ) 2 Cl 2 ] და cis- [ Pt ( NH 3 ) 2 Cl 2 ]:
ცის - + 4Thio = 2 + + 2Cl - + 2NH3.
რეაქციის პროდუქტების განსხვავებული ბუნება, რომელიც დაკავშირებულია თიორეის მაღალ ტრანს-ნაკადთან. რეაქციის პირველი ეტაპი არის თიოურას ქლორიდის ლიგანდების ჩანაცვლება ტრანს-ცის-[ Pt (NH 3) 2 (თიო) 2] 2+:
ტრანს-[Pt (NH 3) 2 Cl 2 ] + 2 თიო = ტრანს-[ Pt (NH 3) 2 (თიო) 2 ] 2+
cis - + 2Thio = cis - 2+.
ცის-[Pt (NH 3) 2-ში (თიო ) 2 ] 2+ ამიაკის ორი მოლეკულა ტრანს პოზიციაშია მანამ, სანამ თიოურა არ განიცდის შემდგომ ჩანაცვლებას, რაც იწვევს ყაბზობას 2+ :
ცის - 2+ + 2თიო = 2+ + 2NH 3.
ტრანს-[Pt (NH 3) 2-ში (თიო ) 2 ] 2+ ამიაკის ორი მოლეკულა მცირე ტრანს-ინფუზიით გაფართოვდა ტრანს პოზიციაში ერთი-ერთზე და ამიტომ არ იცვლება თიორეით.
ტრანს-ნაკადის ნიმუშები აღმოაჩინა ი.ი. ჩვენ ვაშავებთ ლიგანდების ჩანაცვლების რეაქციას კვადრატულ პლატინის პლატინის კომპლექსებში ( II ). ასევე ნაჩვენებია, რომ ლიგანდების ტრანსინფუზია ასევე ხდება სხვა ლითონების კომპლექსებში ( Pt(IV), Pd(II), Co(III), Cr(III), Rh(III), Ir(III) )) და სხვა გეომეტრიული ფორმები. მართალია, ტრანს-გაყოფის ლიგანდების სერია სხვადასხვა ლითონებისთვის ძალიან განსხვავდება.
კვალი მიუთითებს, რომ ტრანსინექცია არის კინეტიკური ეფექტი- რაც უფრო დიდია ამ ლიგანდის ტრანს-ინფუზია, მით მეტია სითხის სითხე სხვა ლიგანდის ჩანაცვლებისას, რომელიც ადრე ტრანს-პოზიციაში იყო.
შეკვეთა კინეტიკური ეფექტით ტრანს-ინფლუქსი, შუაში XX stolіttya A.A. გრინბერგი და იუ.მ. კუკუშკინმა განსაზღვრა ტრანს-გავლენიანი ლიგანდის შენახვისუნარიანობალ ლიგანდს, რომელიც მანამდე ცის პოზიციაშიალ . ამრიგად, ჩანაცვლების რეაქციის სითხის გამოკვლევა Cl- ამიაკი პლატინის კომპლექსებში ( II):
[PtCl 4 ] 2- + NH 3 = [ PtNH 3 Cl 3 ] - + Cl - K = 0.42. 10 4 ლ/მოლ. თ
[PtNH 3 Cl 3 ] - + NH 3 = cis- [Pt (NH 3 ) 2 Cl 2 ] + Cl - K = 1.14. 10 4 ლ/მოლ. თ
ტრანს-[ Pt (NH 3 ) 2 Cl 2 ] + NH 3 = [ Pt (NH 3 ) 3 Cl ] + + Cl - K = 2.90. 10 4 ლ/მოლ. თ
აჩვენა, რომ ამიაკის ერთი ან ორი მოლეკულის არსებობა ცის-ში განლაგებულია ქლორიდის ლიგანდთან, რომელიც ჩანაცვლებულია, იწვევს რეაქციის სითხის თანმიმდევრულ ზრდას. ეს კინეტიკური ეფექტი დასახელდა cis-influx. ამ დროს ლიგანდების ბუნების ინფუზიის კინეტიკური ზემოქმედება ლიგანდების ჩანაცვლების რეაქციის სითხეზე (ტრანს- და ცის-ინფუზიები) გასაგებია იურიდიულ კონცეფციაში. ლიგანდების ორმხრივი შემოდინება.
თეორიულად, ლიგანდების ორმხრივი შემოდინების ეფექტი მჭიდრო კავშირშია კომპლექსურ ნაერთებში ქიმიური ბმების ფენომენის განვითარებასთან. 30-იან როკზე XX stolіttya A.A. გრინბერგი და ბ.ვ. ნეკრასოვიმი უყურებს ტრანს-ნაკადს პოლარიზაციის მოდელის ფარგლებში:
1. ტრანსინფუზიური დამახასიათებელი კომპლექსებისთვის, რომლის ცენტრალურ იონს აქვს მაღალი პოლარიზება.
2. ლიგანდების ტრანს აქტივობა განისაზღვრება ლიგანდის და ლითონის იონის ურთიერთპოლარიზაციის ენერგეტიკული ღირებულებით. მოცემული ლითონის იონისთვის ლიგანდის ტრანსინექცია განისაზღვრება მისი პოლარიზაციისა და ცენტრალური იონიდან მდებარეობით.
პოლარიზაციის მოდელი შეესაბამება ექსპერიმენტულ მონაცემებს მარტივი ანიონური ლიგანტების მქონე კომპლექსებისთვის, როგორიცაა ჰალოგენური იონები.
დაიბადა 1943 წელს ᲐᲐ. გრინბერგმა გამოთქვა ვარაუდი, რომ ლიგანდების ტრანსაქტიურობა დაკავშირებულია მათ საბოლოო ავტორიტეტებთან. ელექტრონის სიმკვრივის ტრანსაქტიური ლიგანდიდან მეტალზე გადატანა ცვლის იონის ეფექტურ მუხტს მეტალზე, რაც იწვევს ტრანსაქტიურ ლიგანდთან ქიმიური კავშირის შესუსტებას.
ტრანსინფუზიის ფენომენის განვითარება დაკავშირებულია ლიგანდების დიდ ტრანსაქტივობასთან, რომლებიც დაფუძნებულია არაგაჯერებულ ორგანულ მოლეკულებზე, ეთილენის მსგავსი [ Pt(C2H4)Cl3 ] - . ჩატასა და ორგელას აზრზე (სურ. 46) ამას უკავშირდებაპი-ასეთი ლიგანდების დატიური ურთიერთქმედება მეტალთან და ტრანს-როტაციული ლიგანდების ჩანაცვლებითი რეაქციის ასოციაციური მექანიზმი. კოორდინაცია შემტევი ლიგანდის მეტალის იონთანზ მივყავართ ხუთკოორდინატიანი ტრიგონალურ-ბიპირამიდული შუალედურის შექმნამდე ლიგანდის შემდგომი სწრაფი დაყოფით, რომელიც მიდის X. ასეთი შუალედურის შექმნა ემთხვევა.პი-დატივი ლიგანდი-ლითონის ლიგანდის ურთიერთქმედებაი , რომელიც ცვლის ლითონის ელექტრონის სიმკვრივეს და ამცირებს გარდამავალი მდგომარეობის აქტივაციის ენერგიას ლიგანდ X-ის შემდგომი თხევადი ჩანაცვლებით.
შეკვეთა 3 გვმიმღებები (C 2 H 4 , CN - , CO ...) ლიგანდები, რომლებიც ქმნიან დატიურ ლიგანდ-მეტალის ქიმიურ კავშირს, მაღალ ტრანს-შემოდინებას დასდონორი ლიგანდები: H - , CH 3 - , C 2 H 5 - ... ასეთი ლიგანდების ტრანსინფუზიაზე მიუთითებს დონორ-მიმღები ურთიერთქმედება X ლიგანდსა და ლითონს შორის, რაც ამცირებს მის ელექტრონის სიმკვრივეს და ასუსტებს კავშირებს მეტალსა და ლიგანდს შორის, რომელიც არსებობს.ი.
ამრიგად, ლიგანდების პოზიცია მთელ რიგ ტრანს-აქტივობებში მითითებულია ძლიერი სიგმა-დონორები პი-ლიგანდების ავტორიტეტები - სიგმა-დონორი პი-ლიგანდის მიმღები ძალა აიძულებს მის ტრანს-შემოდინებას, ასე რომპი-დონორი - დასუსტება. ამ შესანახი ლიგანდი-ლითონის ურთიერთქმედებებიდან რომელია მნიშვნელოვანი ტრანს-ნაკადში, რათა ვიმსჯელოთ რეაქციის გარდამავალი მდგომარეობის ელექტრონული ეტაპის კვანტურ-ქიმიურ განვითარებაზე.