(primul electron)
(în spatele lui Pauling)
| eu | 53 |
| 126,90447 | |
| 5s 2 5p 5 | |
| Iod | |
Iod, iod(din greacă ιώδης, iodes - „violet”) - un element al subgrupului principal al acestui grup, a cincea perioadă a tabelului periodic al elementelor chimice D. I. Mendelev, cu număr atomic 53. Indicat prin simbolul I (lat. Iodum). Un nemetal activ din punct de vedere chimic aparține grupului halogen. Iod lichid simplu (număr CAS: 7553-56-2) pentru minți normale - cristale de culoare negru-gri cu sclipici violet metalic, elimină cu ușurință vaporii violet care emană un miros înțepător. Molecula de reuvin este diatomică (formula I2).
În medicină și biologie acest discurs se numește iod(de exemplu, „diviziunea iodului”), sunt folosite denumirile tabelului periodic și literatura chimică iod.
Istorie
Iodul a fost deschis 1811 r. Courtois la cenușa algelor marine, din 1815 r. Gay-Lussac a început să-l considere un element chimic.
Simbol element J bv înlocuiri cu eu Aparent recent, în anii 50 ai secolului XX.
Cunoscut din natură
O cantitate mare de ioduri se găsește în apa de mare. Se găsește în natură și sub formă liberă, ca un mineral, iar astfel de descoperiri se găsesc singure - în izvoarele termale ale Vezuviului și pe insulă. Vulcano (Italia). Rezervele de ioduri naturale sunt estimate la 15 milioane de tone, 99% din rezerve sunt situate în Chile și Japonia. În prezent, aceste țări au o producție intensivă de iod, de exemplu, Atacama Minerals din Chile pompează peste 720 de tone de iod în râu.
Sursa pentru producția industrială de iod în Rusia este apele de foraj cu nafta, în timp ce în țările străine, care nu conțin nașteri de nafta, se formează alge marine, precum și apele mame ale salpetrului chilian (sodiu), care crește foarte mult producția de iod dintr-o astfel de sare.
Puterea fizică
Vaporii prezintă o culoare violet caracteristică, la fel ca în compușii organici nepolari, de exemplu, în benzen, dar sunt înlocuiți cu o culoare maro în alcoolul polar. Iodul la temperatura camerei produce cristale violet închis cu o strălucire slabă. Când este încălzit la presiunea atmosferică, vinul se sublimează (vibrează), transformându-se în vapori de culoare violetă; la răcire, iodul se cristalizează, lăsând o stare rară. Această coajă este folosită pentru a purifica iodul din gospodăriile nevolatile.
Putere chimică
Din punct de vedere chimic, adăugați iod activ, chiar și cu mai puțin clor și brom.
- Când este ușor încălzit energetic, iodul reacționează cu metalele, creând ioduri:
- Iodul reacționează cu apa numai atunci când este încălzit și nu reacționează cu apa cu iod:
- Iod elementar – oxidant, mensch puternic, scade clor și brom. Hidrogenul H 2 S, Na 2 S 2 O 3 și alți aditivi îl reînnoiesc la ion I -:
- Când apa este perturbată, iodul reacționează adesea cu ea:
Zastosuvannya
Medicament
Promovată pe scară largă în medicina alternativă (neoficială), această afirmație fără recunoaștere ca medic este slab susținută și este adesea însoțită de diverse afirmații publicitare.
Div. de asemenea
Producția de baterii
Iodul este folosit ca electrod pozitiv (oxidant) în bateriile cu litiu-iod pentru vehiculele electrice.
Fuziune cu laser
Acești compuși organici de iod sunt utilizați pentru producerea de lasere cu gaz de înaltă energie pe atomii de iod treziți (cercetări în domeniul fuziunii termonucleare cu laser și al industriei).
Industria radioelectronică
În restul stâncilor, apa care se mișcă brusc se va turna pe iod din partea generatoarelor rare de afișaj cu cristale.
Dinamica producției de iod
Toxicitate
Iodul este o substanță toxică. Doza letală este de 2-3 g Afectează nivelul de acid azotic și sistemul cardiovascular. Când inhalați vapori de iod, apar dureri de cap, tuse, diaree și, eventual, un picior umflat. Dacă intră în contact cu membrana mucoasă a ochilor, are ca rezultat lacrimare, alb în ochi și roșeață. Dacă ajunge la mijloc, provoacă slăbiciune severă, dureri de cap, vărsături, diaree, înveliș maro pe limbă, durere la inimă și creșterea frecvenței pulsului. O zi mai târziu, focurile încep să ardă, iar sângele apare pe câmpul de luptă. Dacă nu o tratezi după 2-3 zile, poate duce la complicații și la apariția miocarditei. Fără să ne bucurăm, vine sfârșitul letal.
Iod (eu 2 ) se găsește în grupa a 7-a a tabelului periodic D.I. Mendelev în subgrupul halogenilor. Pe de altă parte, atomul de iod conține 1 electron nepereche nu se pierde până când învelișul de gaz inert este complet. Ca urmare a razei mari a atomului, iodul prezintă o putere excepțională, indiferent de faptul că se află în subgrupa halogenului. Electronul extern este situat departe de nucleu, deci este mai ușor pentru iodul să-l adauge, dar este mai ușor pentru el să ajungă la sine. Prin urmare, iodul acționează ca un substitut.
Puterea fizică a iodului.
Iod cu cristale de o culoare strălucitoare gri-negru.
Puterea chimică a iodului.
Iodul nu reacționează cu majoritatea nemetalelor, ci reacționează doar cu metalele atunci când este încălzit și cu atât mai mult. De exemplu, toți ceilalți halogeni reacționează cu saliva pentru a produce o sare trivalentă. FeHal 3 , Și iodul este doar 2x valență:
Fe + eu 2 = FeI 2,
Reacția cu apa se desfășoară după cum urmează:
H 2 + eu 2 = 2 BUNĂ,
Reacția este inversă și endotermă.
Obsesia pentru Yoda.
Iodul este îndepărtat din laborator pentru reacția:
MnO2 + 4HI = MnI2 + I2 + 2H2O.
Iodul este un element chimic comun. Dar majoritatea oamenilor nu sunt familiarizați cu consumul de alcool, care este o problemă pentru medicină. Adesea vorbim despre problemele din organism atunci când glanda tiroidă este bolnavă. Puțini oameni sunt conștienți de proprietățile fizice și chimice ale iodului. Și asta pentru a adăuga un element unic care este disponibil pe scară largă în natură și important pentru viața umană.
Este posibil să se evite influența chimică a iodului, de exemplu, prezența amidonului în produse. În plus, sunt promovate multe metode populare de extragere a microelementelor pentru tratamentul multor oameni. Toată lumea trebuie să știe ce fel de putere există.
Zagalny caracteristic iodului
Este necesar să adăugați un microelement activ care ajunge la nemetale. În tabelul periodic, grupul de halogeni este format din clor, brom și fluor. Iodul este indicat prin simbolul I și are numărul de serie 53. Denumirea acestui microelement a fost preluată din secolul al XIX-lea prin culoarea violetă a perechii. Chiar și iodul de nucă este interpretat ca „violet, violet”.
Așa a fost dezvăluit iodul. Chimistul Bernard Courtois, care lucrează la fabrică din producția de salpetru, a descoperit această substanță foarte repede. Balena a întors eprubeta cu acid sulfuric și a înmuiat-o într-o înghițitură de alge, care a fost apoi folosită pentru a extrage salitrul. În acest caz, s-a văzut gaz care avea o culoare violetă. Acest lucru l-a lovit pe Bernard Courtois și a început să creeze un nou element. Așa că la începutul secolului al XIX-lea a devenit cunoscut despre iod. La mijlocul secolului al XX-lea, chimiștii au început să numească acest element „iod”, deși avea un sens mai larg.
Puterea chimică a iodului
Sincer, pentru a depune mărturie despre activitatea reacțiilor chimice ale acestui element, nu spune nimic unei persoane obișnuite. Doar cei care înțeleg chimia vor înțelege că vor ajuta să-și descrie autoritățile chimice. Acesta este cel mai activ element dintre toate nemetalele. Iodul poate reacționa cu alte substanțe, acizi solubilizanți și compuși rari și letali. Vreau cei mai puțin activi halogeni.
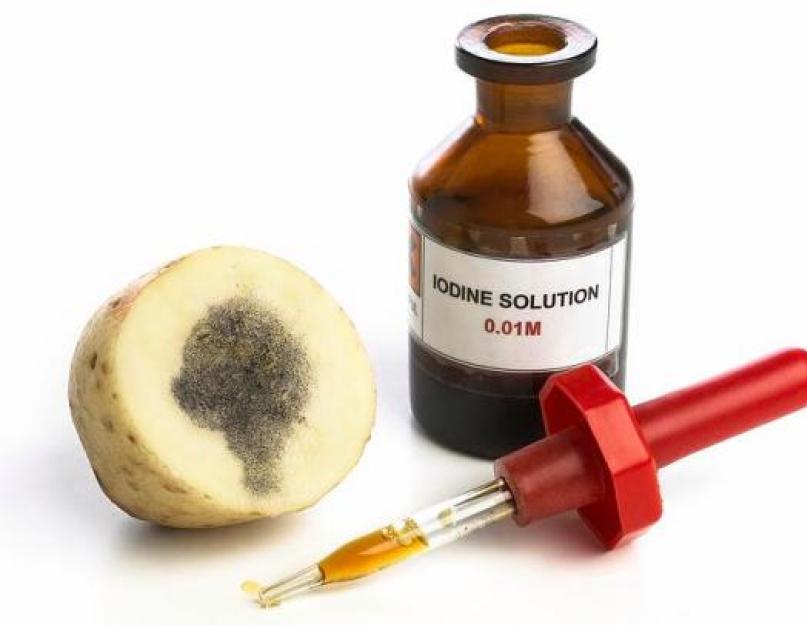
Pe scurt, puterea chimică a iodului poate fi văzută din reacția sa. Cu diferite metale, iodul reacționează la o încălzire ușoară, la care se formează iodurile. Mai ales iodură, potasiu și sodiu. Reacționează mai rar cu apa și se combină cu alte elemente. Vinul conține azot, aciditate, amoniac și uleiuri esențiale. Cu toate acestea, puterea chimică a iodului este cea mai mare în reacția sa cu amidonul. Când se adaugă la amestec pentru a îndepărta amidonul, duhoarea devine albastră.

Puterea fizică
Dintre toate microelementele, iodul este important pentru persoanele foarte sensibile. Majoritatea oamenilor nu știu despre trăsăturile sale speciale. Efectele fizice și chimice ale iodului sunt studiate pe scurt la școală. Practic, acest element pare a fi un izotop cu o masă de 127. Este cel mai important dintre toți halogenii. Și, de asemenea, iod radioactiv 125, care iese în timpul descompunerii uraniului. În medicină, se găsesc mai des izotopi individuali ai acestui element cu o masă de 131 și 133.
Toți halogenii conțin numai iod, care este solid în mod natural. De asemenea, puteți vedea cristale violet închis sau negre sau plăci cu sclipici metalic. Duhoarea are un miros caracteristic slab, bun pentru șocuri electrice și particule similare cu grafitul. Într-un astfel de sistem, acest microelement este puternic dezintegrat în apă și apoi este ușor transformat într-o stare asemănătoare gazului. Vinul se poate transforma in vapori violet chiar si la temperatura camerei. Aceste proprietăți fizice și chimice ale iodului sunt folosite pentru a le îndepărta. Încălzirea microelementului sub presiune și apoi răcirea acestuia îl curăță din casă. Iodul se dizolvă în alcool, glicerină, benzen, cloroform sau carbon sulfuric, acid alcoolic sau ridiche violetă.

Jerela Yoda
Indiferent de importanța acestui microelement pentru multe funcții de viață ale organismelor, iodul este greu de identificat. Scoarța terestră conține mai puține elemente rare, mai mici. Cu toate acestea, este important de menționat că iodul este larg distribuit în natură, cu fragmente găsite în cantități mici în lumea actuală. Concentrațiile vinurilor sunt în principal în apa de mare, alge, sol și alte plante și creaturi.
Puterea chimică a iodului se explică prin faptul că nu diferă ca aspect, darămite ca formă. Cel mai adesea este obținut din solul de alge marine și din producția de nitrat de sodiu. Astfel, iodul se găsește în Chile și Japonia, care este lider în acest tip de element. În plus, poate fi extras din apele multor lacuri sărate sau ape nafte.
Iodul intră în corpul uman din alimente. Este prezent în sol și alge. Ale în regiunea noastră există o gamă largă de soluri bogate în iod. De aceea, iodul este bun cel mai adesea. Pentru a preveni bolile cauzate de lipsa de iod, elementul este adăugat dintr-o varietate de produse alimentare.

Rolul său în vitalitatea organismului
La aceste microelemente se adaugă iod, care participă la multe procese biologice. În cantități mici există vin în cele bogate. Dar organismele vii sunt și mai importante. Iodul este absorbit în timpul producției de hormoni tiroidieni în glanda tiroidă. Mirosurile reglează procesele de viață ale corpului. Când există o lipsă de iod la o persoană, glanda tiroidă devine mai mare și apar diverse patologii. Duhoarea se caracterizează prin scăderea productivității, slăbiciune, dureri de cap, scăderea memoriei și a dispoziției.
Zastosuvannya în medicină
Cea mai mare adaos este 5% alcool și iod. Folosiți-l pentru a dezinfecta pielea din jurul urechilor. Dacă nu luați un antiseptic agresiv, va trebui totuși să amestecați pulpa cu iod și amidon, de exemplu, Betadine, Yox sau Iodinol. Utilizați adesea puterea sterilă a iodului pentru a calma durerea în mușchi sau patologia articulațiilor, îndepărtați rețeaua de iod după injectare.

Zastosuvannya la industrie
Acest microelement este, de asemenea, de mare importanță în industrie. Datorită condițiilor chimice speciale, iodul poate fi extras din diferite plante. De exemplu, criminologii îl folosesc pentru a identifica urmele de degete pe suprafețele de hârtie. Extrageți pe scară largă iodul din lămpile cu halogen ușoare. Este folosit în fotografie, industria filmului și prelucrarea metalelor. Și, în același timp, acest microelement a început să fie utilizat în afișajele de cristal rare, în crearea sticlei colorate, precum și în domeniul fuziunii termonucleare cu laser.

Probleme pentru oameni
Indiferent de importanța iodului în procesele vieții, în multe cazuri este toxic pentru oameni. O doză de 3 g din acest amestec duce la o afectare gravă a sistemului cardiovascular. La început, o persoană se simte slăbită, are dureri de cap, suferă de amețeli și are o frecvență cardiacă crescută. Dacă inhalați vapori de iod, provoacă umflarea membranelor mucoase, căptușeala ochilor și umflarea piciorului. Fără tratament, este cauzată de iod până la moarte.
Iod (nume banal – iod; din greaca veche ἰώδης – „violet (violet)”) – element din grupa a 17-a a tabelului periodic al elementelor chimice (după vechea clasificare – element al subgrupului principal al grupei VII), perioada a cincea , cu număr atomic 53. Indicat prin simbolul I (lat. Iodum). Un nemetal activ din punct de vedere chimic aparține grupului halogen.
Iod lichid simplu (număr CAS: 7553-56-2) pentru minți normale - cristale de culoare negru-gri cu sclipici violet metalic, elimină cu ușurință vaporii violet care emană un miros înțepător. Molecula de reuvin este diatomică (formula I2).
Istorie
iod a fost deschis 1811 r. Courtois la cenușa algelor marine, din 1815 r. Gay-Lussac a început să-l considere un element chimic.
Nume și denumire
Numele elementului a fost propus de Gay-Lussac și seamănă cu cel grecesc. ἰώδης, ιώο-ειδης (lit. „asemănător violetei”), care este asociat cu culoarea pariului, care a fost descoperit de chimistul francez Bernard Courtois, încălzind trandafirul mamă de cenușă de alge marine din acidul oxidat concentrat. În medicină și biologie, acest element și substanță simplă sunt adesea numite iod, de exemplu, „iod distilat”, care este similar cu vechea versiune a numelui care a fost folosit în nomenclatura chimică până la mijlocul secolului al XX-lea.
În nomenclatura chimică actuală, vikoryst se numește iod. Același concept apare în multe alte limbi, de exemplu, germană: limba comună este Jod și Iod corect din punct de vedere terminologic. În același timp, prin schimbarea numelui elementului în anii 1950, Uniunea Internațională de Chimie Globală și Aplicată a înlocuit simbolul elementului J cu I.
Puterea fizică
Iodul pentru mințile cele mai avansate este un lichid solid de negru-sulf, cu o strălucire metalică și un miros specific. Vaporii prezintă o culoare violetă caracteristică, la fel ca în compușii organici nepolari, de exemplu, în benzen, dar sunt înlocuiți cu o culoare maro în alcoolul polar. Iodul la temperatura camerei produce cristale violet închis cu o strălucire slabă. Când este încălzit la presiunea atmosferică, vinul se sublimează (vibrează), transformându-se în vapori de culoare violetă; la răcire, iodul se cristalizează, lăsând o stare rară. Această coajă este folosită pentru purificarea iodului din gospodăriile nevolatile.
Putere chimică
Iodul este adăugat la grupul de halogeni.
Dizolv un număr de acizi: iodhidric (HI), iod (HIO), iod (HIO 2), iod (HIO 3), iod (HIO 4).
Din punct de vedere chimic, adăugați iod activ, chiar și cu mai puțin clor și brom.
1. Cu metale, iodul, când este ușor încălzit, reacţionează energetic, creând ioduri:
Hg + I 2 = HgI 2
2. Iodul reacționează cu apa numai atunci când este încălzit și nu reacționează cu iodură de hidrogen:
I2 + H2 = 2HI
3. Iod atomic – oxidant, mai puțin puternic, scade clor și brom. Hidrogenul H 2 S, Na 2 S 2 O 3 și alți aditivi îl reînnoiesc la ion I -:
I2 + H2S = S + 2HI
4. Când apa este perturbată, iodul reacționează adesea cu ea:
I 2 + H 2 O ↔ HI + HIO, pK = 15,99
Pisica a fluturat și a fluturat coada. Acesta nu este un basm despre puiul Ryaba, dar Istoria descoperirii iodului. A fost descoperit la o fabrică din Paris care transformă azotatul de sodiu în nitrat de potasiu. Primul era în plin, iar celălalt era insuficient.
Reconstituirea s-a făcut cu ajutorul cenușii suplimentare, care se pierde din cauza scuipatului de alge. Metoda Vinayshli din 1808 rock, dar ei nu cunoșteau secretul. Nu știam ce este pisica, ofițerii roboti au urmărit-o după ea. transferat două vase - din acid sulfuric și săruri în exces de fermentație.
Aburi violete zburau în vânt. Fabrica Tsebachiv vlasnik Bernard Kurt. După ce am făcut eu câteva teste, apoi am transmis informațiile altora. Husă – în 1814, lumea a aflat despre întemeierea unui nou element. Nim devenirea iod.
Proprietățile chimice și fizice ale iodului
Puternic Yoda obumovlenі yogo roztashuvannyam u. Element de asigurare până la grupa 7. Conține halogeni – cele mai active nemetale. În iod, de exemplu, învelișul de electroni este ușor de polarizat.
Nu este important ca ea să fie separată în spațiu. Acest lucru permite cationilor altor elemente să pătrundă într-un atom nemetal, până la 127. „Oaspeții” din învelișul de electroni îi schimbă, făcând iodul cel mai covalent dintre toți halogenii.
Mai simplu spus, un element poate forma legături mai diferite cu alți atomi. Iodul este adesea polarizat pozitiv. Acest atom este cel mai activ. Îi poți vedea culoarea, aceeași violetă.
Atom la iod intrări în tabelul periodic – un exemplar natural. Acesta este un izotop stabil cu masa atomică 127. Alți atomi cu numerele 125, 129, 131 au fost extrași individual.

Kozhen de la ei - iod radioactiv. Izotopii produc transferuri beta și gama și sunt utilizați în medicină. Îndepărtați iodul radioactiv din produsele cu uraniu. Deci reactoarele nucleare servesc drept laboratoare.
Standard iodul este posibil consumă majoritatea nemetalelor și aproximativ 40% metale. Cei nobili, și nu numai alții, nu reacționează la cel de-al 53-lea element. Interacțiunea este imposibilă, la fel ca cu carbonul, aciditatea și toate gazele inerte.
chi iodȘtii, când te conectezi, poți suna pentru ajutor. Elementul pur poate fi defalcat. Jodite, atunci, vorbește cu jumătate de inimă cu atomi de luncă și luncă-pământ, rozchinni. Se pare că al 53-lea element apare în apă atunci când este foarte încălzit.
Rozchin iod ușor de îndepărtat dacă utilizați materie organică. Utilizați glicerină, carbon sulfuric sau carbon clorurat. Deoarece este un retailer fără acrișoare, se poate îmbogăți cu cele mov. Deoarece radini conține atomi și aciditate, extrageți iod.
În formă pură, la temperatura camerei, iodul este violet-negru. Blisk rechovini metaleviy, moara de agregare -. Mirosul este puternic – până la 5 g pe centimetru cub.

Cristalele sunt formate din molecule, fiecare cu 2 atomi. La instalația asemănătoare gazului, temperatura depășește 183 de grade. Scapă de Yoda Rareori posibil chiar și dincolo de 114 pe scara Celsius.
Zastosuvannya iod
Săruri la iod vikorist la industria înjurăturii. Limbajul despre farurile și lămpile auto cu efecte speciale. Efectul principal este utilizarea filtrelor pentru a evita schimbările de lumină. Apele știu cât de important este să le neutralizeze din când în când.
Acest proces de a numi Polaroid și, în primul rând, a devenit un beneficiu pentru mistica fotografică. Autorul puzzle-ului este englezul William Talbot. A fost un chimist și fizician proeminent al secolului al XIX-lea.
Secolul 21 este guvernat de tehnologiile digitale. Tim nu trebuie să elimine fotografia negativă din doză pentru a obține soiul de iod. Combinat cu gelatina, dă o emulsie care poate fi folosită pentru a acoperi căptușeala căptușelii. Lumina dispare de la suprafață și începe vederea. Mai multă lumină - mai mult metal. Așa iese imaginea.
Stagnarea iodului cunoștințe din metalurgie. Elementele combinate ajută la menținerea metalelor de înaltă puritate. Atunci când trasează calea termică, industriașii extrag, de exemplu, vanadiu și zirconiu. Aceste elemente refractare sunt esențiale pentru aliajele rachete și materialele reactoarelor nucleare.
În rulmenți de automobile puteți găsi și iod. Yakiy ai nyomu simt? Elementul este adăugat în ulei. Este recomandat pentru titan și oțel inoxidabil. Prelucrarea permite pieselor să arate de 50 de ori mai atractiv decât standard. Acest lucru se întâmplă în ciuda faptului că există mai puțin de 1-2% iod în mastilă.

Fără al 53-lea element, medicina este de neconceput. Iod în organism controlează funcționarea glandei tiroide, producția de hormoni TSH, T3 și T4. Dacă elementul lipsește, se dezvoltă o gușă, care poate duce la cancer.
În acest caz, corpul nu poate produce singur vorbirea. Iodul trebuie obținut inclusiv din piele, suplimente alimentare și medicamente. Restul sunt ușor de ghicit” Iodomarin».
Ei ar trebui să spună celui nenăscut, mai ales în locuri departe de mări. În astfel de zone, de regulă, există o deficiență de 53 de elemente, care sunt situate în principal în apropierea apelor oceanelor și a apelor acestora.
Una dintre evoluțiile rămase ale medicamentelor iod albastru. Înainte de a adăuga amidon, acesta își schimbă culoarea pentru uscare suplimentară. Amidonul, ca atare, neutralizează efectul alcoolului și al altor „aditivi” inutile. Medicii permit chiar și acest elixir pentru decongestionarea internă. clătire cu iod. Vreau ca restul să se blocheze și să se înțeleagă sare, sifon, iod.
Baie cu iod permise atât în forme stabile cât și radioactive. Deci, izotopul 131 este folosit pentru a reînnoi funcția glandei tiroide. Procedurile sunt strict standardizate, fragmentele de iod radioactiv în exces pot provoca cancer.
Vidobutok iod
Cât iod vezi pantofi pe râu? Aproape 30 de mii de tone. Rezervele mondiale ale elementului sunt estimate la aproximativ 15.000.000 de tone. Cei mai mulți dintre ei sunt recrutați la spolukah yoda. La o persoană cu aspect curat, venele se estompează rar.
Ceea ce este încă relevant este metoda de a vedea pâraiele din acumulări naturale - algele. O tonă de varec uscat are 5 kilograme iod.