După cum știți deja, prin utilizarea unei metode ascunse de îndepărtare a acizilor carboxilici se poate oxida alcaldehida la un nivel similar.
În industrie, acest proces se realizează folosind aciditate suplimentară în prezența catalizatorilor.
Analizând formula de bază a acizilor carboxilici, se poate observa că molecula conține două părți - un radical carbohidrat (alchil) și o grupare funcțională.
yaku se numește carboxilic. Denumirea grupei funcționale este similară cu numele carbonilului >C=0 și hidroxil -OH.
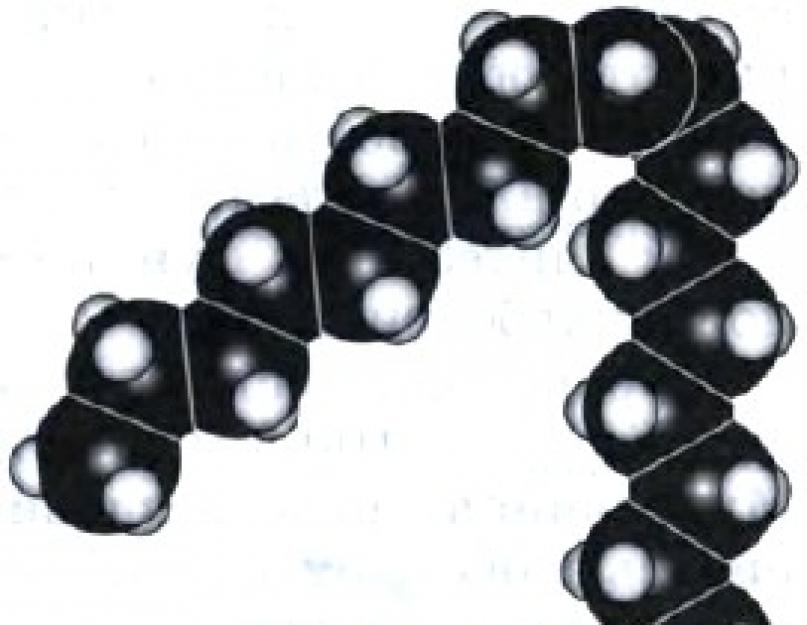
Clasa de acizi carboxilici este extrem de diversă. Aceasta include unul și doi acizi bazici, nesaturați și aromatici. Aceste subclase de acizi carboxilici fac obiectul predării în școli și orele de științe naturale. Nu știm prea multe despre doi acizi nesaturați: 3 17 H 33 COOH - acid oleic (conțin o legătură într-o moleculă) (Fig. 50) și 3 17 H 31 COOH - acid linoleic (conțin două legături într-o moleculă) legături ) . Acești acizi se numesc acizi grași, iar acum, evident, ați realizat de ce avem atâta reverență pentru acești acizi - au miros a grăsimilor rare.

Mic 50.
Model la scară al moleculei de acid oleic
Cu toate acestea, să ne întoarcem la acizii carboxilici monobazici învecinați. Seria omoloagă a acestor acizi începe cu semiconductor, care nu corespunde în totalitate substanței induse, - murashina sau acidul metanoic
Aparent, carboxilul din molecula sa se leagă nu cu un radical carbohidrat, ci cu un atom de apă, ca carbonilul aldehidei formice (Fig. 51).

Mic 51.
Modelul moleculei de acid fornic (acid metanoic):
Evident, denumirile de acizi și aldehide similare sunt identice.
Cei care formează acid formic sunt împărțiți în molecule ale altor acizi carboxilici monobazici reprezintă particularitățile proprietăților lor chimice. Vona intră într-o reacție de „oglindă de absorbție”, similară cu aldehidele, lăsând molecula sa cu sinteza a două grupe funcționale: carbonil și carboxil.
Acidul Murashina este un acid pur cu miros înțepător (punct de fierbere = 100,8 ° C), bun în apă. Acidul lui Murashin a dispărut! Dacă intră în contact cu pielea, provoacă iritații. Este păcat că puteți vedea furnici, purpuriu, diferite tipuri de meduze și acest acid (Fig. 52).

Mic 52.
Pentru a răzbuna acidul murashic, a face rău:
1 – meduze; 2 – se presara; 3 - murah
Acidul formic are un efect dezinfectant și, prin urmare, este cunoscut că este utilizat în industria alimentară, a cărnii de porc și farmaceutică, precum și în medicină. Cremă și vicorist la pregătirea țesăturilor și a hârtiei (Fig. 53).

Mic 53.
Stagnarea acidului formic:
1 – industria shkiryana; 2 - producția de țesături; 3 - medicament
Otstova, sau etanova, acid

(Mal. 54) - această câmpie sterp cu un miros înțepător caracteristic, se amestecă cu apa în orice bazine. Clasele de apă ale acidului ottovoy sunt vândute sub denumirea de „table otset” (3-5% din ozchin), „ottovoy esentsiya” (70-80% din ozchin) și sunt utilizate pe scară largă în industria alimentară.

Mic 54.
Modelul moleculei de acid octic (etanoic):
1 - Kulyastrizhnev; 2 - scară
Acidul otoic este un bun distribuitor de compuși organici bogați care se îngheață în timpul cultivării, în producția de piele și în industria lacurilor (Fig. 55). În plus, acidul otic este produsul de ieșire pentru producerea unei game largi de compuși organici importanți din punct de vedere tehnic: fibre în bucăți, substanțe chimice organice, pelicule și fotocombustibili etc. esență.

Mic 55.
Stadificarea acidului otic:
1 – conserve; 2 – producerea fibrelor bucata, textile; 3 – condimente până la iaurt; 4-8 - producția de compuși organici (pesticide 4, lacuri 5, farb 6, fototopii 7, lipici 8)
Odată cu creșterea masei moleculare apoase într-o serie omoloagă de acizi carboxilici monobazici învecinați, grosimea lor, punctul de fierbere și punctul de topire cresc, iar dizolvarea apei se modifică.
Toți acizii carboxilici sunt numiți și acizi grași (ai ghicit) și substanțe solide. Acesta, de exemplu, este acidul palmitic 15 H 31 COOH (Fig. 56, 1) și acidul stearic C 17 H 35 COOH (Fig. 56, 2).

Mic 56.
Modele la scară ale moleculelor:
1 – acid palmitic; 2 - acid stearic
Proprietățile chimice ale acizilor carboxilici sunt determinate de apartenența lor la tipul de acizi din soare. Similar acizilor anorganici, acizii carboxilici sunt electroliți, deși mai slabi și, prin urmare, se disociază invers:
Soluțiile apoase de acizi carboxilici modifică prepararea indicatorilor.
Cu o creștere a radicalului carbohidrați, este necesară o etapă diferită de disociere electrolitică.
Ca și acizii anorganici, acizii carboxilici interacționează cu metale, oxizi bazici și amfoteri, baze, hidroxizi amfoteri și săruri.
Astfel, acizii formici interacționează cu metalele, care stau în seria electrochimică a tensiunilor până la apă:

Acești acizi reacționează cu oxizii bazici și amfoteri cu săruri dizolvate - formiați și acetați:
În mod similar, acizii formici interacționează cu baze și hidroxizi amfoteri:
Acești acizi reacţionează cu sărurile acizilor slabi. Reacțiile continuă până la final, când se stabilește un asediu sau un gaz:
Acizii organici, după cum știți deja, suferă o reacție de esterificare cu alcooli, care creează eteri complecși, cum ar fi secara.

Cuvinte noi și înțelegere
- Grupa carboxil.
- Acizi carboxilici. Acizi carboxilici monobazici limită.
- Acizi carboxilici nesaturați: oleic și linoleic.
- Murashina ta otstova acid.
- Puterea acizilor carboxilici: interacțiuni cu metale, oxizi bazici și amfoteri, baze, hidroxizi amfoteri și săruri.
- Formiati si acetati.
- Reacția de esterificare. Eter pliabil
- Stagnarea acizilor carboxilici.
Mâncare și mâncare
1. Ce cuvinte se numesc acizi carboxilici monobazici de limită?
Acizii carboxilici monobazici limită sunt compuși organici, molecule care conțin o grupă carboxil și sunt prezenți într-un radical carbohidrat.
2. Priviți tranziția multor modificări la iac în aplicarea modificărilor proprietăților fizice ale acizilor carboxilici într-o serie omoloagă.
Pe măsură ce masa molară crește, punctul de topire și punctul de fierbere crește, iar grosimea rășinii crește. Primii nouă reprezentanți ai seriei omoloage sunt ridicoli, al zecelea este un discurs ferm.
3. Ce puteri sunt dăunătoare acizilor anorganici și carboxilici? Confirmați-vă răspunsul cu reacții similare.
4. Ce reacții pot apărea cu acizii oleic și linoleic ca compuși organici nesaturați? Cum numim aceste reacții? Notează valoarea lor egală. 
5. Formula structurală a acidului formic poate fi scrisă în acest fel. Ei bine, acest acid va avea o funcție dublă. Cum o pot numi? Ce fel de reacție, caracteristică altor acizi, dă acidul murashic?
6. Notați reacția care poate fi folosită pentru a efectua următoarele transformări: 
7. Cum declanșează râul acțiunea înțepătoare a stropitoarelor și a celulelor meduzelor? Cum să elimini durerea cauzată de observarea acestor organisme?
Acțiunea de milă se țipă cu pielea de găină de acid. Pentru a calma durerea din zonă, este necesar să o tratați cu bicarbonat de sodiu pentru a neutraliza acidul.
8. 250 g de vapnyak au fost dizolvate în acid ottovy pentru a conține 20% din casă și s-au îndepărtat 33,6 l (n.s.) de dioxid de carbon. Cum ar trebui produs teoretic volumul de dioxid de carbon? 
9. Regina Cleopatra, la plăcerea medicului de la curte, a demontat cea mai mare perlă cunoscută de bijutieri, iar apoi a acceptat eliminarea taxelor pentru o duzină de ore. Cum a reacționat Cleopatra? Cum ai obținut legătura?
Cleopatra a creat reacția dintre acidul otic și carbonatul de calciu. Perlele se formează singure. Rezultatul a fost un amestec de dioxid de carbon, acetat de calciu și apă. Eu însumi am băut acetat de calciu.
10. S-au folosit 200 g de hidroxid de sodiu 4% pentru a neutraliza 10,6 g de acid formic și acizi otici. Dizolvați părțile vrac ale acizilor la sfârșitul zilei. 
ACIZI CARBOXILICI
Acizii carboxilici sunt numiți derivați de carbohidrați care conțin una sau câteva grupe carboxil.
Numărul de grupări carboxil caracterizează bazicitatea acidului.
În funcție de numărul de grupe carboxilice, acizii carboxilici sunt împărțiți în acizi carboxilici monobazici (conținând o grupă carboxil), dibazici (conținând două grupări carboxil) și acizi bogati bazici.
Datorită tipului de radical legat de grupul carboxilic, acizii carboxilici sunt împărțiți în limită, nesaturați și aromatici. Acizii limită și nesaturați sunt combinați sub denumirea legală de acizi din seria alifatică sau grasă.
Acizi carboxilici monobazici
1.1 Serii omoloage și nomenclatură
Seria omoloagă de acizi carboxilici monobazici de limită (aceștia se numesc acizi grași) începe cu acidul formic

Formula pentru serii omoloage
Nomenclatura IUPAC vă permite să păstrați pentru mulți acizi denumirile lor banale, care ar indica în natură ce fel de acid a fost găsit, de exemplu, mucus, ottovo, butiric, valeriană etc.
Pentru compușii complecși, denumirile de acizi sunt combinate cu denumirile de carbohidrați cu același număr de atomi de carbon ca și molecula de acid, cu completare adăugată. -ova acele cuvinte acid. Acidul Murashic H-COOH se numește acid metanoic, acidul otic CH 3 -COOH se numește acid etanoic etc.
Astfel, acizii sunt considerați derivați ai carbohidraților, dintre care unul este transformat în carboxil:

Când denumirile acizilor sunt combinate cu o nomenclatură rațională, ei sunt considerați a fi acizi otici similari, în molecula cărora atomii de apă sunt înlocuiți cu radicali, de exemplu, acidul trimetiloctic (CH 3) 3 C - COOH.
1.2 Proprietățile fizice ale acizilor carboxilici
Numai din poziții pur formale se poate vedea gruparea carboxil ca o combinație de funcții carbonil și hidroxil. De fapt, influxul lor reciproc de unul la unul este de așa natură încât le schimbă complet puterea.
Polarizarea legăturii C=0, care este primară pentru carbonil, crește puternic datorită contracției suplimentare a vaporilor de electroni liberi de la atomul părinte la aciditatea grupării hidroxil:

În cele din urmă, există importanța slăbirii legăturii O-H în hidroxil și ușurința separării unui atom de apă de apariția unui proton (H +). Apariția unei densități electronice reduse (δ+) pe atomul de carbon carboxil central duce, de asemenea, la constrângerea electronilor σ ai legăturii C-C la gruparea carboxil și la apariția (ca în aldehide și cetone) soție a puterii electronice (δ+). ) pe atomii de acid α-carb.
Toți acizii carboxilici au o reacție acidă (detectată de indicatori) și creează săruri cu hidroxizi, oxizi și carbonați ai metalelor și cu metale active:
Acizii carboxilici, cel mai adesea în plantele apoase, sunt disociați cu acizi mici și slabi, ceea ce înseamnă că sunt furnizați unor acizi precum acidul clorhidric, acidul azotic și acidul sulfuric. Astfel, atunci când un mol este dizolvat în 16 litri de apă, stadiul de disociere a acidului formic este 0,06, cel al acidului otic este 0,0167, în timp ce acidul clorhidric cu o astfel de disociere diluată este mai puțin complet disociat.
Pentru majoritatea acizilor carboxilici monobazici rK A = 4,8, deși acidul formic are o valoare pKa mai mică (aproximativ 3,7), ceea ce se explică prin prezența efectului donator de electroni al grupărilor alchil.
În acizii minerali anhidri, acizii carboxilici reacţionează cu acidul pentru a forma carbocationi:

Prezența densității electronilor într-o moleculă de acid carboxilic nedisociat, așa cum s-a menționat mai sus, reduce densitatea electronilor pe atomul de hidroxil și o promovează pe acidul carbonil. Această distrugere crește și mai mult în acizii anionici:

Rezultatul este întărirea exterioară a sarcinilor din anion, care există de fapt în forma A - rezonanță cu anionul carboxilat.
Primii doi sunt reprezentanți ai unui număr de acizi carboxilici - materie uscată, care se amestecă cu apa în toate relațiile. Acizii, în care moleculele conțin de la cinci până la nouă atomi de carbon (precum și acidul izobutiric) sunt acizi uleioși, distribuția lor în apă este mică.
Acizii mari (tip 10) sunt solide care sunt practic insolubile în apă; atunci când sunt distilate, duhoarea se dezvoltă în mintea obișnuită.
Murashina și acidul propionic emană un miros înțepător; Membrii din mijloc ai rândului au un miros neplăcut și nu există miros acid.

Proprietățile fizice ale acizilor carboxilici indică o etapă semnificativă de asociere în urma formării legăturilor de apă. Acizii dizolvă legăturile apoase, iar fragmentele legăturii O-H sunt foarte polarizate. În plus, acizii carboxilici formează în mod natural legături de apă la nivelul atomului de oxigen al dipolului carbonil, ceea ce poate duce la electronegativitate. Într-adevăr, în forme solide și rare, acizii carboxilici apar în principal sub formă de dimeri ciclici: 
Astfel de structuri dimerice sunt păstrate într-o stare asemănătoare gazului în plantele nepolare.
Putere chimică
Acizii se caracterizează prin trei tipuri de reacții: înlocuirea unui ion cu o grupare carboxil (dizolvarea sărurilor); cu participarea grupării hidroxil (care implică esteri de pliere, halogenuri, anhidride acide); înlocuirea apei cu radicali.
Soluție de săruri. Acizii carboxilici dizolvă ușor sărurile atunci când interacționează cu metalele, oxizii acestora, cu baze sau baze, cu prezența amoniacului sau aminelor:
Sărurile acizilor carboxilici sunt utilizate pe scară largă în regatul poporului. Sunt folosiți ca catalizatori, stabilizatori ai materialelor polimerice, la prepararea farbs etc.
Crearea de eteri pliante. Cu alcooli și acizi dau eteri pliați:

Soluție de halogenuri. Când halogenurile acide reacţionează cu fosforul sau SOC1 2, halogenurile acide sunt eliberate:

Halogenurile sunt substanțe foarte reactive care sunt utilizate pentru diferite sinteze.
Soluție de anhidride acide. Când două molecule de acizi carboxilici sunt combinate cu o moleculă de apă (în prezența hidroxizilor aposi P 2 Pro 5 și 1), se formează o anhidridă de acid carboxilic:

Anhidridele acide, precum halogenurile acide, sunt de asemenea reactive; duhoarea se formează în lichide subțiri cu apă activă, care dizolvă acizii chimici și acidul puternic:

Halogenarea acizilor carboxilici. Atomii de apă din radicalii carbohidrați din acizi au o reacție similară cu atomii de apă din alcani. Vinovații devin atomi de apă, separați de atomul -carboxilic (legați direct cu carboxil). Astfel, când clorul și bromul reacționează în prezența purtătorilor de halogen (PC1 3, 1 2 și 1) pe acizii carboxilici sau pe clorurile lor acide, are loc înlocuirea atomilor de apă α în sine:

Acțiunile oxidanților. Acizii carboxilici monobazici sunt, prin urmare, rezistenți la oxidare. Acidul Murashic (până la 2 i H 2 Pro) și acizii cu un al treilea atom de carbon în poziția α sunt ușor oxidați. Cand cei ramasi sunt oxidati ies -hidroxiacizi:

În organismele vii, acizii carboxilici monobazici sunt, de asemenea, oxidați în mod natural, iar atomul de acid este întotdeauna plasat în poziția β. Deci, de exemplu, în corpul pacienților cu diabet zaharat, acidul butiric se transformă în acid β-hidroxibutiric:
Concentrația cetonelor Distilarea uscată a sărurilor de calciu și bariu ale acizilor carboxilici (cremă de acid formic) se efectuează până când se formează cetonele. Astfel, la distilarea acetatului de calciu, extras din CaCO3 și CH3COOH, se creează dimetilcetonă, la distilarea propionat de calciu - dietilcetonă:

Crearea amidelor. Când sărurile acidului de amoniu sunt încălzite, se eliberează amide:
Satisfacția în carbohidrați. La topirea sărurilor acizilor carboxilici cu metale de luncă (piroliza), are loc divizarea lancei de carbon și decarboxilarea, în urma căreia se creează un tip de carbohidrat din radicalul carbohidrat al acidului, de exemplu:
Cei mai importanți reprezentanți
Acidul Murashina - un mediu steril, cu un miros înțepător. Cu un acid puternic este oxidat la acid carbonic. În natură, acidul formic este abundent în acidul formic observat, în sucul de mărar și în sudoarea animalelor. Folosiți acidul formic în prepararea textilelor, a pieilor tăbăcite, în medicină, în diverse sinteze organice.
Acidul otoic - un mediu steril, cu un miros înțepător. Apa Rozchin (70 - 80 %) acidul otoic se numește esență ottovoy, iar rozmarinul apos 3-5% se numește table otst.
Acidul otoic este consumat pe scară largă în natură. Este situat în tăieturile, transpirația, fiarele și pieile de creaturi, păduri. Se vindecă cu acid fermentat oxidativ pentru a elimina alcoolul (vin, bere etc.).
Este utilizat pe scară largă în industria chimică pentru producerea de compuși de acetat, arpaș, eteri pliați, acetonă, anhidridă octală, săruri etc. În industria alimentară, acidul otic este distilat pentru conservarea produselor, iar esterul acidului otoic este utilizat în industria cofetăriei.
Acid olic Este o țară cu un miros neplăcut. Se amestecă aspectul de eter pliat în untul de vacă. În țara liberă vei fi într-o armată amară.
2. Acizi carboxilici dibazici
Formula este omoloagă cu o serie de acizi dibazici învecinați ![]()
Butts poate fi folosit de:

Acizii dibazici învecinați sunt solide cristaline. Similar cu ceea ce se presupunea anterior pentru acizii monobazici, acizii dibazici adiacenți cu un număr impar de atomi de carbon se topesc la o temperatură mai mare și omologii mai mici cu un număr nepereche de atomi de carbon. Diferența acizilor cu un număr nepereche de atomi de carbon în apă este sinonimă cu diferența dintre acizii cu un număr nepereche de atomi de carbon, iar odată cu creșterea în vârstă, diferența dintre acizii din apă se modifică.
Acizii dibazici sunt disociați succesiv:
Duhoarea este puternică din cauza acizilor monobazici. Nivelul de disociere al acizilor dibazici scade odată cu creșterea greutății lor moleculare.
Molecula de acizi dibazici conține două grupe carboxil, care le dau două rânduri de altele similare, de exemplu, săruri medii și acide, eteri medii și acizi:

Când sunt încălziți, acizii oxalic și malonic scuipă ușor CO 2:
Acizii dibazici cu patru sau cinci atomi de carbon în moleculă, cum ar fi acizii succinic și glutaric, atunci când sunt încălziți, separă elementele apei și dau anhidride ciclice interne:

3. Acizi carboxilici nesaturați
Un depozit de acizi monobazici nesaturați cu o sublegatură poate fi exprimat prin formula formală C n H 2 n -1 COOH. Pe lângă compușii bifuncționali, aceștia au reacții caracteristice, cum ar fi acizi și olefine. Acizii α.β-nesaturați deseori depășesc acizii grași prin excelență, iar fragmentele ligamentului subțesut, care sunt situate lângă gruparea carboxil, le sporesc puterea acidă.
Acid acrilic Cel mai simplu acid monobazic nesaturat
Oleinova, acizi linoleic și linolenic.
Acidul oleic 3 17 H 33 COOH sub formă de eter de glicerol este extrem de răspândit în natură. Această budova este exprimată prin formula
Acidul oleic este un lichid pur, uleios, formând apă, la rece este dur în partea cristalină și se topește la 14 °C. În vânt, lichidul se oxidează rapid.
Molecula de acid oleic conține doi atomi de halogen: 
În prezența catalizatorilor, de exemplu, Ni, acidul oleic adaugă doi atomi de apă, transformându-se în acid stearic.
Acidul oleic este un izomer cis (toți acizii naturali nesaturați cu greutate moleculară mare sunt de obicei clasificați în seria cis).
Acizii Linoleva Z 17 H 31 COOH și linolenic Z 17 H 29 COOH sunt și mai nesaturați, acid oleic inferior. Apariția eterilor pliați cu glicerină gliceride- duhoarea uleiului de cânepă și a uleiului de cânepă:

Molecula de acid linoleic are două subligamente. Poți veni aici cu multă apă și halogen. Molecula de acid linoleic are trei sublegături, care adaugă șase atomi de apă și halogen. Acizii ofensivi, care adaugă apă, trec în acid stearic.
Acid sorbic
Există două combinații, una cu cealaltă și cu gruparea carboxil a legăturii de legare, care are o configurație trans; Este un conservant minunat pentru multe produse alimentare: conserve de legume, brânză, margarină, fructe, pește și produse din carne.
Acizi maleic și fumaric. Cei mai simpli acizi dibazici care înlocuiesc legăturile de etilenă au doi izomeri structurali:

În plus, pentru alți acizi există două configurații posibile:

Acidul fumaric se găsește în multe plante: este frecvent întâlnit în special la ciuperci. Acidul maleic nu a fost găsit în natură.
Acizii ofensatori trebuie îndepărtați atunci când sunt încălziți acid malic (oxisuccinic):
Când este încălzit bine și cu grijă, iese acid fumaric; Când acidul malic este încălzit mai puternic, acidul maleic iese atunci când este distilat.
Atât acidul fumaric, cât și cel maleic, atunci când sunt reînnoiți, dau același acid burshtinic.
Acizi carboxilici Numiți compușii care conțin o grupare carboxil:
Acizii carboxilici se dizolvă:
- acizi carboxilici monobazici;
- acizi dibazici (dicarboxilici) (2 grupe UNS).
Este important să separați acizii carbonici:
- alifatic;
- aliciclic;
- aromatice.
Aplicați acizi carboxilici.


Obsesia acizilor carboxilici.
1. Oxidarea alcoolilor primari cu permanganat de potasiu și dicromat de potasiu:

2. Hidroliza carbohidraților substituiți cu halogen, care reduce 3 atomi de halogen la un atom de carbon:
3. Absorbția acizilor carboxilici din cianuri:
Când este încălzit, nitrilul se hidrolizează cu acetat de amoniu:
Când se acidulează, acidul scapă:
4. Variația reactivilor Grignard:
5. Hidroliza eterilor pliați:
6. Hidroliza anhidridelor acide:
7. Metode specifice de obținere a acizilor carboxilici:
Acidul Murashic iese atunci când oxidul de carbon (II) este încălzit cu hidroxid de sodiu sub un menghină:
Acidul otoic este afectat de oxidarea catalitică a butanului și aciditatea:
Acidul benzoic este îndepărtat din oxidarea omologilor monosubstituiți prin împărțirea permanganatului de potasiu:
Reacția lui Canniziaro. Benzaldehida se tratează cu hidroxid de sodiu 40-60% la temperatura camerei.

Puterea chimică a acizilor carboxilici.
În apă, acizii carboxilici se disociază:

Rivnavaga a fost distrus puternic spre stânga, deoarece acizii carboxilici sunt slabi.
Avocații adaugă aciditate ca urmare a efectului inductiv. Astfel de intercesori atrag puterea electronică a venelor și provoacă un efect inductiv negativ (-I). Extrageți agentul de îngroșare electronic până când aciditatea acidului crește. Înlocuitorii donatori de electroni creează o sarcină inductivă pozitivă.

1. Conversia sărurilor. Reacția cu oxizi bazici, săruri ale acizilor slabi și metale active:

Acizii carboxilici sunt slabi, deoarece Acizii minerali sunt îndepărtați din următoarele săruri:
2. Soluție de derivați funcționali ai acizilor carboxilici:
3. Eteri de pliere atunci când sunt încălziți cu acid și alcool în prezența acidului sulfuric - reacție de esterificare:
4. Conversia amidelor, nitrililor:
3. Puterea acizilor este influențată de prezența unui radical carbohidrat. Deoarece reacția are loc în prezența fosforului roșu, produsul rezultat este distrus:
4. Reacția de acceptare.

8. Decarboxilarea. Reacția se realizează prin topirea pajiștii din metalul celulozic al acidului carboxilic:
9. Acidul dibazic se desparte ușor CO2 cand este incalzit:
Materiale suplimentare pe tema: Acizi carboxilici.
Calculatoare de chimie |
|
| Chimie online pe site-ul nostru pentru cel mai înalt nivel de succes. | |
Majoritatea zilei tuturor este aceeași. Și majoritatea oamenilor știu ce sta la baza ei. Ce există din punct de vedere chimic? În ce alte serii apar aceste caracteristici? Să încercăm să ne uităm la valoarea nutritivă și să identificăm acizii carboxilici monobazici învecinați. Cel mai adesea, nu numai corpul, ci și alte părți ale corpului stagnează în viața de zi cu zi, iar acești acizi fac parte din piele.
Clasa acizilor carboxilici: caracteristici inflamabile
Din punctul de vedere al științei chimiei, în care clasă sunt moleculele de oxigen care conțin o anumită grupare de atomi - o grupare funcțională carboxil. Asta arată ca COOH. Astfel, formula generală pentru toți acizii carboxilici monobazici învecinați arată astfel: R-COOH, unde R este un radical care poate include mulți atomi de carbon.
Este evident în ce măsură această clasă poate fi atribuită în același mod. Acizii carboxilici sunt molecule organice de oxigen care conțin una sau mai multe grupe funcționale - COOH - grupări carboxil.
Cele care sunt plasate înaintea acizilor se explică prin slăbirea atomului de apă din carboxil. Puterea electronică este distribuită inegal, deoarece kisinul este cel mai electronegativ din grup. Ca rezultat, legătura O-H devine puternic polarizată, iar atomul devine și mai solubil în apă. Se desparte ușor atunci când intră în interacțiuni chimice. Prin urmare, acizii din indicatori similari dau următoarea reacție:

În loc de apă atomică, acizii carboxilici dezvăluie oxizi de putere. Cu toate acestea, prezența altor atomi le permite să se implice și să ia parte la multe alte interacțiuni.
Clasificare
Puteți vedea o serie de semne de bază care împart grupările de acid carboxilic. Prima este natura unui radical. În spatele acestui factor se poate observa:
- Acizi aliciclici. Stoc: henna.
- Mai aromat. fund: benzoin.
- Alifatic. Stoc: otstova, acrilic, shchavleva și altele.
- Heterociclic. Exemplu: nicotina.
Dacă vorbim despre legături dintr-o moleculă, atunci putem vedea și două grupuri de acizi:

De asemenea, clasificarea poate include o serie de grupuri funcționale. Deci, vedem astfel de categorii.
- Monobază - doar un grup COOH. Stoc: murashina, stearic, butanic, valeriana si altele.
- Binar- evident, două grupe -COOH. Stoc: shchavleva, malonova și altele.
- Bogat de bază- lamaie, lapte si altele.
Istoria descoperirilor
Viticultura a înflorit din cele mai vechi timpuri. Și, aparent, unul dintre produsele sale este acidul octic. Istoria popularității acestei clase datează din timpul lui Robert Boyle și Johann Glauber. Cu toate acestea, natura chimică a acestor molecule nu a fost discutată de mult timp.
Multă vreme, părerile vitaliștilor au fost într-o stare de panică, deoarece au început să înțeleagă posibilitatea de a crea materie organică fără substanțe vii. Deja în 1670, D. Rey a început să identifice cel mai mare reprezentant al său - metanul sau acidul formic. După ce sorbi vinul, se încălzește într-un balon cu ciuperci vii.
Lucrările ulterioare ale lui Berzelius și Kolbe au arătat fezabilitatea sintetizării acestor compuși din substanțe anorganice (prin distilarea vugille de lemn). Drept urmare, tatăl a fost îndepărtat. În acest fel, au fost injectați acizi carboxilici (putere fizică, budova) și au fost utilizați pentru descoperirea tuturor celorlalți reprezentanți ai compușilor alifatici scăzut.
Puterea fizică
Toți reprezentanții lor au primit rapoarte astăzi. Pentru fiecare dintre ele, este posibil să se cunoască caracteristicile tuturor parametrilor, inclusiv stagnarea în industrie și expunerea la natură. Să aruncăm o privire la ce sunt acizii carboxilici și ceilalți parametri ai lor.
Ei bine, putem numi o serie de parametrii caracteristici principali.
- Deoarece un număr mare de atomi de carbon din lancus sunt absorbiți din călcâi, acesta miroase ascuțit, sfărâmicios și letargic. Mai mult de cinci – substanțe uleioase importante, chiar mai mult – substanțe solide, asemănătoare parafinei.
- Grosimea primilor doi reprezentanți depășește unul. Rashta se întinse după apă.
- Temperatura de fierbere: cu cât temperatura este mai mare, cu atât temperatura este mai mare. Cu cât structura este mai joasă, cu atât este mai joasă.
- Punctul de topire: se află la nivelul mai multor atomi de carbon în lance. Băieții au mulți bani, iar băieții nepereche au mult mai puțini.
- Pe lângă apă se mai bine.
- Realizarea racordurilor speciale de apă.

Astfel de trăsături sunt explicate prin simetria lui Budova și, prin urmare, prin Budova planetelor cristaline și prin importanța lor. Deoarece moleculele sunt simple și structurate, ele sunt mai eficiente în producerea acizilor carboxilici. Puterea fizică a acestor forțe permite identificarea galusilor și modalitățile de vikorizare a acestora în industrie.
Putere chimică
Așa cum am vrut să spunem, acești acizi pot dezvălui puterea masacrului. Reacțiile implicate sunt importante pentru sinteza industrială a compușilor bogați. În mod semnificativ, cele mai importante proprietăți chimice care pot fi detectate de acidul carboxilic monobazic.
- Disocierea: R-COOH = RCOO - + H +.
- Prezintă interacțiuni cu oxizii bazici, precum și hidroxizii acestora. Există interacțiune cu metale simple conform schemei standard (deși cu cele care stau în apropierea tensiunii).
- Ca bază se folosesc acizi tari (anorganici).
- Este recomandabil să bei până la alcoolul inițial.
- O reacție specială este esterificarea. Această interacțiune are loc cu alcoolii și formarea unui produs de pliere - eterul.
- Reacția este decarboxilare, când o moleculă de dioxid de carbon este eliberată din molecula de dioxid de carbon.
- Este posibil să interacționeze cu halogenuri ale elementelor precum fosforul și sulful.

Evident, acizii carboxilici sunt foarte bogati. Puterile fizice, precum și cele chimice, sunt destul de diferite. Pe de altă parte, trebuie remarcat că în spatele puterii unui acid, toate moleculele organice sunt slabe față de colegii lor anorganici. Constantele lor de disociere nu depășesc valoarea de 4,8.
Modalități de a elimina
Există o serie de metode de bază prin care acizii carboxilici limită pot fi îndepărtați.
1. În laborator, testați pentru oxidare:
- alcooli;
- aldehide;
- alchine;
- alchilbenzeni;
- distrugerea alchenelor.
2. Hidroliza:
- eteri pliante;
- nitrili;
- amide;
- trihaloalcani.
4. In industrie sinteza are loc datorita oxidarii carbohidratilor cu un numar mare de atomi de carbon in lance. Procesul are loc în mai multe etape, având ca rezultat eliberarea de produse secundare non-personale.
5. Conțin acizi (acid antic, octova, acid butiric, acid valerian etc.) în moduri specifice, acid vicoric și ingrediente naturale.
Principalii compuși ai acizilor carboxilici limitrofi: săruri
Sărurile acizilor carboxilici sunt substanțe importante în industrie. Duhoarea iese ca urmare a interacțiunii celorlalți cu:
- metale;
- oxizi bazici;
- pajişti;
- hidroxizi amfoteri.

Deosebit de importante sunt cele care se formează între metalele de bază, sodiu și potasiu, și acizii de limită superioară – palmitic, stearic. Chiar și produsele unei astfel de interacțiuni sunt dulci, rare și dure.
Mila
Deci, dacă vorbim despre o reacție similară: 2C 17 H 35 -COOH + 2Na = 2C 17 H 35 COONa + H 2,
Produsul care se prelucrează este stearat de sodiu - care, datorită naturii sale, este inițial foarte bun și este folosit pentru o sănătate bună.
Dacă înlocuiți acidul cu acid palmitic, iar metalul cu potasiu, veți obține palmitat de potasiu - care este rareori bun pentru mâinile tale. Prin urmare, se poate afirma cu tărie că sărurile acizilor carboxilici sunt substanțe cu adevărat importante de natură organică. Această producție industrială și răutate este pur și simplu colosală în amploarea sa. Odată ce îți dai seama câtă iubire se irosește pe pielea oamenilor de pe Pământ, este greu de înțeles amploarea acesteia.
Eteri ai acizilor carboxilici
Există un grup special de cuvinte care are un loc în clasificarea discursurilor organice. Aceste clase sunt create prin reacția acizilor carboxilici cu alcoolii. Denumirile unor astfel de interacțiuni sunt reacții de esterificare. Aspectul întunecat poate fi văzut de colegii tăi:
R, -COOH + R"-OH = R, -COOR" + H20.
Produsul conține doi radicali și este un ester pliabil. Evident, ca rezultat al reacției, acidul carboxilic, alcoolul, eterul compus și apa au experimentat modificări semnificative. Astfel, moleculele de apă și acid ajung la forma unui cation și formează o legătură cu gruparea hidroxo, care este combinată cu alcoolul. Prin război, se formează o moleculă de apă. Gruparea, care și-a pierdut acidul, capătă un radical în alcool, care stabilizează molecula esterului pliat.

De ce sunt aceste reacții atât de importante și în ce industrie sunt importante produsele lor? Totul din dreapta este că eterii pliați sunt vikorişti:
- aditivi alimentari;
- aditivi aromatici;
- componenta de depozit a parfumului;
- lucrători cu amănuntul;
- componente de lacuri, farb, materiale plastice;
- medicamente și multe altele.
Se înțelege că eforturile lor ar trebui să fie ample pentru a-și îndeplini obligațiile de producție și industrie.
Acid etanoic (octova)
Acesta este un acid carboxilic monobazic din seria alifatică, care este unul dintre cele mai produse pe scară largă din întreaga lume. Formula її – CH 3 COOH. Ea dă o asemenea amploare autorităților ei. Și sferele lor sunt extrem de largi.
- Vaughn este un aditiv grub sub codul E-260.
- Este folosit în industria alimentară pentru conservare.
- Este nevoie în medicină de sinteza substanțelor medicinale.
- Componentă pentru demontarea compartimentelor din spate.
- Rozchinnik.
- Participant la procesul de drukarstva, producție textilă.
- O componentă esențială în reacțiile de sinteza chimică a substanțelor non-personale.
În cazul a 80% din amestec, se obișnuiește să se numească esență otovoy, iar dacă o diluați la 15%, atunci obțineți doar un otset. Acidul 100% pur se numește krizhana ottovo.
Acidul Murashina
Cel mai mare și mai simplu reprezentant al acestei clase. Formula este UNSC. De asemenea, un aditiv grub sub codul E-236. Produsele noastre naturale:
- murahi ta bjoli;
- kropiva;
- ace;
- fructe
Principalul galusi vikoristannya:
Tot în chirurgie, acidul vicoric este folosit ca antiseptic.