Metallning koordinatsion sohasi o'zgarib turadigan ligandlarni almashtirish, qo'shish va ajratish reaktsiyalari.
Oʻrin almashish reaksiyalari keng koʻlamli ahamiyatga ega boʻlib, metall koordinatsion sferadagi baʼzi ligandlarni boshqalar bilan almashtirishni oʻz ichiga oladi.
Dissotsiativ (D) mexanizm. Chegara bosqichidagi ikki bosqichli jarayon pastroq koordinatsion raqamga ega bo'lgan oraliqdan o'tadi:
ML6<->+ L; + Y --» ML5Y
Assotsiativ (A) mexanizm. Katta koordinatsion raqamga ega bo'lgan oraliq yaratish bilan tavsiflangan ikki bosqichli jarayon: ML6 + Y = ; =ML5Y+L
O'zaro almashish mexanizmi (I). Bu mexanizmdan so'ng ko'p miqdordagi almashinuv reaktsiyalari sodir bo'ladi. Jarayon bir bosqichli va tasdiqlangan vositachi bilan birga keladi. O'tish stantsiyasida reaktiv va reaktsiya markaziga ulangan guruh eng yaqin koordinatsiya sohasiga kiradi va reaktsiya davomida u yoki bu guruhning mavjudligi i, ikkita ligand almashinuvi hosil bo'ladi:
ML6 + Y = = ML5Y+L
Ichki mexanizm. Bu mexanizm molekulyar darajadagi ligandlarni almashtirish jarayonini tavsiflaydi.
2. Lantanidlar (Ln) kuchining xususiyatlari, lantanidlarni siqish ta'siri bilan bog'liq. Spoluki Ln 3+: oksidlar, gidroksidlar, tuzlar. Oksidlanishning boshqa bosqichlari. Yuqori qiymatli birikmalar Sm 2+, Eu 2+ va oksidli birikmalar Ce 4+, Pr 4+ qo'llang.
Rossiyada bir qator 4f elementlar uchun atom va ion radiuslarining monoton o'zgarishi lantanid siqilish nomiga olib keldi. I. To'rtinchi (gafniy) va beshinchi (tantal) guruhlarning 5d-o'tish elementlarining lantanidlariga tutashgan atomlarning radiuslari deyarli beshinchi davrdagi elektron analoglari: sirkoniy va niobiyning radiuslariga teng ekanligiga erishish mumkin. Bu aniq va muhim 4d va 5d metallarining kimyosi juda ko'p kuchga ega. Yana bir f-cheklov - itriyning ion radiusining muhim f-elementlar radiuslariga yaqinligi: disprosiy, holmiy va erbiy.
Barcha noyob tuproqlar +3 oksidlanish bosqichida barqaror oksidlarni hosil qiladi. Hidi karbonat angidrid va suv bug'ini butunlay olib tashlaydigan refrakter kristalli kukunlardan iborat. Aksariyat elementlarning oksidlari gidroksidlar, karbonatlar, nitratlar, oksalatlarni havoda 800-1000 ° S haroratda qovurish orqali chiqariladi.
M2O3 oksidlari va M(OH)3 gidroksidlarining eritmasi
Faqat skandiy gidroksid amfoterdir
Oksidlar va gidroksidlar kislotalarda oson eriydi
Sc2O3 + 6HNO3 = 2Sc(NO3)3 + 3H2O
Y(OH)3 + 3HCl = YCl3 + 3H2O
Suvda faqat skandiy gidrolizlanadi
Cl3 ⇔ Cl2 + HCl
Barcha halogenidlar +3 oksidlanish bosqichida chiqariladi. Usi o'tga chidamli.
Ftoridlar suv yaqinida yomon parchalanadi. Y(NO3)3 + 3NaF = YF3↓+ 3NaNO3
Zagalna kimyosi: assistent / O. V. Zholnin; boshiga ed. V. A. Popkova, A. V. Jolnina. – 2012. – 400 b.: kasal.
7-bob. KOMPLEKS KOMPLEKSLAR
7-bob. KOMPLEKS KOMPLEKSLAR
Murakkab elementlar hayot tashkilotchilaridir.
K. B. Yatsimirskiy
Murakkab ulanishlar eng katta va eng xilma-xil ulanishlar sinfidir. Tirik organizmlarda biogen metallarning oqsillar, aminokislotalar, porfirinlar, nuklein kislotalar, uglevodlar va makrosiklik birikmalar bilan murakkab birikmalari mavjud. Hayotning eng muhim jarayonlari murakkab protseduralar orqali amalga oshiriladi. Ulardan ba'zilari (gemoglobin, xlorofill, gemosiyanin, vitamin B 12 va boshqalar) biokimyoviy jarayonlarda muhim rol o'ynaydi. Ko'pgina dorivor preparatlar tarkibida metall komplekslari mavjud. Masalan, insulin (sink kompleksi), vitamin 12 (kobalt kompleksi), platinol (platina kompleksi) va boshqalar.
7.1. A.VERNERNING KOORDINASYON NAZARIYASI
Budova murakkab aloqalari
Zarrachalar o'zaro ta'sirlashganda, zarrachalarning o'zaro muvofiqlashuviga to'sqinlik qilinadi, buni kompleks hosil qilish jarayoni deb hisoblash mumkin. Masalan, ionlarning hidratsiyasi jarayoni akvakomplekslarning hosil bo'lishi bilan yakunlanadi. Kompleks hosil bo'lish reaksiyalari elektron juftlarning ko'chishi bilan kechadi va kompleks hosil bo'lishning yuqori darajada, murakkab (koordinatsion) reaktsiyalar haqida o'rnatilishiga olib keladi. Murakkab reaktsiyalarning o'ziga xos xususiyati donor-akseptor mexanizmi uchun javobgar bo'lgan muvofiqlashtiruvchi aloqaning mavjudligi:
Murakkab yarimsemiklar yarimsemiklar deb ataladi, ular ham kristall holatda, ham batafsil, xususan, ko'rinadi.
shundan ligandlar bilan o'tkirlashgan markaziy atomning mavjudligi. Murakkab birikmalar yuqori tartibli murakkab molekulalardan, oddiy molekulalardan tortib dunyoda mustaqil rivojlanishgacha hosil bo'lishi mumkin.

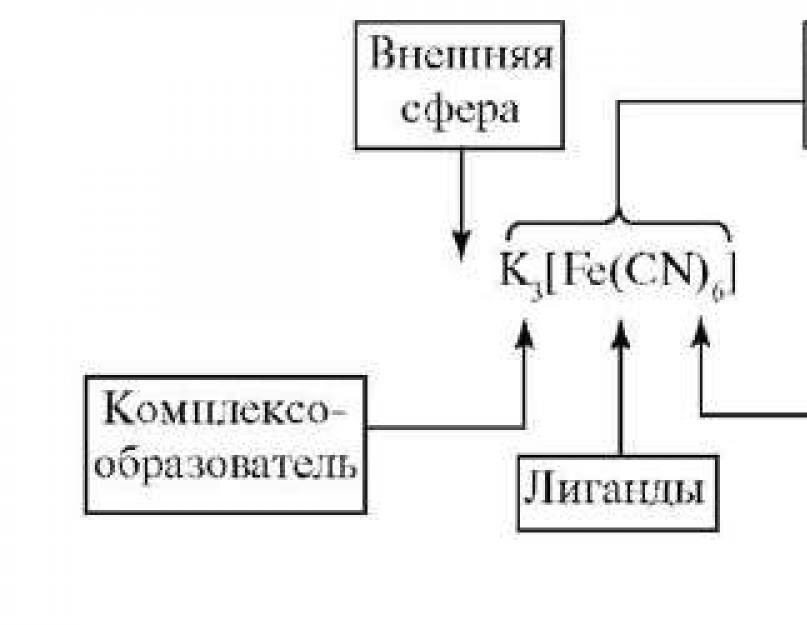
Vernerning koordinatsiya nazariyasi orqasida murakkab tushuncha bo'linadi ichkiі tashqi soha. Markaziy atom o'zining begona ligandlari bilan kompleksning ichki sferasini tashkil qiladi. Ular kvadrat kamon yaqinida joylashtirilishi kerak. Qaror kompleksdagi tashqi sohaga aylanish va kvadrat qo'llarning orqasida yozishdir. Markaziy atom atrofida ko'p sonli ligandlar aralashadi, bu ko'rsatilgan muvofiqlashtirish raqami(Kch). Koordinatsion ligandlar soni ko'pincha 6 dan 4 gacha. Ligand koordinatsion maydonning markaziy atomini egallaydi. Koordinatsiya jarayonida ligandlarning ham, markaziy atomning ham vakolatlari o'zgaradi. Ko'pincha muvofiqlashtirilgan ligandlarni tabiatda ular uchun xos bo'lgan boshqa kimyoviy reaktsiyalarda aniqlab bo'lmaydi. Ichki sohaning bir-biriga yaqinroq bo'lgan qismlari deyiladi kompleks (murakkab ion). Markaziy atom va ligandlar o'rtasida tortishish kuchlari (kovalent bog'lanish almashinuv yoki (yoki) donor-akseptor mexanizmi orqali hosil bo'ladi), ligandlar o'rtasida hosil bo'lish kuchlari mavjud. Ichki sferaning zaryadi 0 ga teng bo'lgani uchun tashqi koordinatsiya sferasi 0 ga teng.
Markaziy atom (kompleks)- murakkab bog'lanishda markaziy o'rinni egallagan atom yoki ion. Komplekslovchining roli ko'pincha zarrachalarni hosil qilish, erkin orbitallarni hosil qilish va yadroga katta musbat zaryad qo'shishdan iborat bo'lib, keyinchalik ular elektron qabul qiluvchilarga aylanishi mumkin. Bu o'tish elementlarining kationlari. Eng kuchli komplekslashtiruvchi moddalar IB va VIIIB guruhlari elementlari hisoblanadi. Kamdan-kam hollarda murakkab
Hech qanday holatda d-elementlarning neytral atomlari va metall bo'lmaganlar atomlari turli xil oksidlanish turlari sifatida harakat qilmaydi - . Komplekslanishi mumkin bo'lgan erkin atom orbitallari soni uning koordinatsion raqamini bildiradi. Koordinatsion raqamning qiymati ko'plab omillarga bog'liq va kompleks hosil qiluvchi ionning subordinatsiyali zaryadiga bog'liq:

Ligandi- Ular kompleks hosil qiluvchi bilan bevosita bog'langan molekulalar va elektron juft donorlardir. Erkin va bo'sh elektron pul tikishlarini o'z ichiga olgan ushbu elektron tizimlar elektron donorlar bo'lishi mumkin, masalan:
Yarim elementlar kompleks yaratuvchi kuchlarni ochib beradi va kompleks uchun ligand vazifasini bajaradi. Ligandlar atomlar va molekulalar (oqsillar, aminokislotalar, nuklein kislotalar, uglevodlar) bo'lishi mumkin. Kompleks hosil qiluvchi ligandlar tomonidan barqarorlashadigan yopishqoqlik soniga ko'ra, ligandlar mono-, di- va polidentat ligandlarga bo'linadi. Eng xilma-xil ligandlar (molekulalar va anionlar) monodentatdir, chunki ular bitta elektron juft beradi. Kuchsiz ligandlarga molekulalar yoki ionlar qo'shiladi, ular ikkita elektron juft donor sifatida ishlaydigan ikkita funktsional guruhni ifodalaydi:

Polidentat ligandlari 6 dentatli etilendiamintetraotsik kislota ligandlari bilan to'ldirilishi mumkin:

Murakkab birikmaning ichki sferasida teri ligandlari egallagan bo'shliqlar soni deyiladi ligandning muvofiqlashtirish amnistiyasi (dentity). Von markaziy atom bilan koordinatsion aloqada ishtirok etadigan ligandning elektron juftlari soni bilan ko'rsatiladi.
Murakkab birikmalar kremi, koordinatsion kimyo ombordagi suvda parchalanadigan, qattiq holatda ko'p fazalarda bir xil darajada murakkab bo'ladigan, ammo barqaror bo'lmagan to'xtatilgan tuzlarni, kristallgidratlarni birlashtiradi.
Ombor orqasidagi eng barqaror va xilma-xil komplekslar va ular o'z ichiga olgan funktsiyalar d-elementlar tomonidan amalga oshiriladi. Ayniqsa, o'tish elementlarining murakkab birikmalari muhim ahamiyatga ega: tupurik, marganets, titanium, kobalt, mis, sink va molibden. Biogen s-elementlar (Na, K, Mg, Ca) siklik tuzilishga ega ligandlar bilan kompleks komplekslar, shuningdek, kompleks hosil qiluvchi vosita sifatida ishlaydi. Asosiy qism R-Elementlar (N, P, S, Pro) kompleks hosil qiluvchi zarralar (ligandlar), jumladan, bioligandlarning faol faol qismidir. Bu biologik ahamiyatga ega.
Shuningdek, murakkab shakllanish tuzilishi davriy tizimning kimyoviy elementlarining yashirin kuchi bo'lib, ularning tuzilishi joriy tartibda o'zgaradi: f> d> p> s.
7.2. KOMPLEKS JIMINING ASOSIY QISMLARINING TO'LQIYoTI O'ZBEKISTON IQTISODIYoTI
Murakkab bog'lanishning ichki sferasi zaryadi uning zarralarini hosil qiluvchi zaryadlar algebrasining yig'indisidir. Masalan, kompleksning zaryadining qiymati va belgisi yaqinlashib kelayotgan buyurtma bilan belgilanadi. Alyuminiy ionining zaryadi +3, oltita gidroksid ionining umumiy zaryadi -6 ga teng. Xo'sh, kompleksning zaryadi yuqori (+3) + (-6) = -3 va kompleks uchun formula 3-. Kompleks ionning zaryadi son jihatdan tashqi sferaning umumiy zaryadiga teng va belgidan tashqariga chiqadi. Masalan, K3 tashqi sharning zaryadi +3 ga teng. Shuningdek, kompleks ionning zaryadi hamon -3 ga teng. Kompleksning zaryadi kattaligi bo'yicha teng va kompleks birikmaning barcha zarralari zaryadlarining algebraik yig'indisining belgisiga proportsionaldir. Demak, K 3 da birikma ionining zaryadi +3 ga teng, kompleks birikma zarralarining umumiy zaryadi (+3) + (-6) = -3 bo'lib qoladi.
7.3. KOMPLEKS SPOLUKLARNING NOMENKLATURASI
Nomenklatura asoslari Vernerning klassik anʼanalariga asoslanadi. Ko'rinib turibdiki, ulardan oldin murakkab birlashgan membrana kation, keyin esa anion deb ataladi. Elektrolitik bo'lmagan tur sifatida u bir so'z bilan ataladi. Murakkab ionning nomi bir so'z bilan yoziladi.
Neytral ligand molekula bilan bir xil deb ataladi va anion ligandlariga "o" qo'shiladi. Muvofiqlashtirilgan suv molekulasi uchun "aqua-" belgisi qo'llaniladi. Kompleksning ichki sferasidagi yangi ligandlar sonini ko'rsatish uchun ligandlar nomidan oldin di-, tri-, tetra-, penta-, heksa-i va boshqalar yunon raqamlari prefiks sifatida ishlatiladi. Monone prefiksi vikorist emas. Ligandi abetka uchun haddan tashqari javob berdi. Ligandning nomi bir butun sifatida qaraladi. Ligand nomidan keyin belgilangan oksidlanish bosqichidagi markaziy atom nomi keladi, bu dumaloq qo'llarda rim raqamlari bilan ko'rsatilgan. Aminu so'zi (ikkita "m" bilan) aynan amiaku deb yozilgan. Ominlarni hal qilish uchun faqat bitta "m" yashaydi.
C1 3 - geksamin kobalt (III) xlorid.
C1 3 - akvapentamin kobalt (III) xlorid.
Cl 2 - pentametilammin xlorokobalt (III) xlorid.
Diammindibromoplatin (II).
Murakkab ion anion bo'lgani uchun uning lotincha nomi "am" bilan tugaydi.
(NH 4) 2 - ammoniy tetrakloropaladat (II).
K - kaliy pentabromoammin platinat (IV).
K 2 - kaliy tetrarodankobaltat (II).
Katlanadigan ligandning nomi dumaloq kamar yaqinida joylashtirilishi kerak.
NO 3 - dikloro-di-(etilendiamin) kobalt (III) nitrat.
Br - bromo-tris-(trifenilfosfin) platina (II) bromid.
Bunday hollarda, ligand ikkita markaziy ionni bog'laganda, uning nomidan oldin yunoncha harf ishlatiladiμ.

Bunday ligandlar deyiladi mahalliy va qolganlarini ortiqcha sug'urta qilish.
7.4. KIMYOVIY ALOQA VA BUDOV KOMPLEKSI SPOLUK
Murakkab reaksiyalarni yaratishda ligand va markaziy atom o'rtasidagi donor-akseptor o'zaro ta'sirlari muhim rol o'ynaydi. Elektron juftining donori liganddir. Akseptor - bu erkin orbitallarga ega bo'lgan markaziy atom. Bog'lam nam bo'lib, kompleks buzilganda (ionogen bo'lmagan) yorilib ketmaydi va deyiladi. muvofiqlashtirish
Bog'lanish tartibida donor-akseptor mexanizmiga ko'ra p-bog'lar hosil bo'ladi. Donor metall ioni bo'lsa, u o'zining juftlashgan d-elektronlarini ligandga beradi, bu esa energiya jihatidan bo'sh orbitallarga olib keladi. Bunday ulanishlar sanali deb ataladi. Xushbo'y hidlar yo'qoladi:
a) metall va d-bital orasidagi bo'sh bo'lgan p-orbitallarni s-bog'larga kirmagan elektronlarni o'z ichiga olgan metallga almashtirish uchun;
b) ligandning bo'sh d-orbitallari metallning to'ldirilgan d-orbitallari bilan qoplanganda.
Uning asosiy ahamiyati - legan va markaziy atom orbitallarining bir-biriga yopishish bosqichidir. Markaziy atomning bog'lanishlarining to'g'riligi kompleksning geometriyasini belgilaydi. Bog'larning to'g'ridan-to'g'riligini tushuntirish uchun markaziy atomning atom orbitallarining gibridlanishi haqidagi vikoristik hodisalar kiritiladi. Markaziy atomning gibrid orbitallari teng bo'lmagan atom orbitallarining aralashishi natijasida hosil bo'ladi, buning natijasida orbitallarning shakli va energiyasi o'zaro o'zgaradi va yangi, lekin har xil shakl va energiyadagi orbitallar hosil bo'ladi. Gibrid orbitallar soni har doim chiqish orbitallari soniga teng. Gibrid bulutlar atomlarda bir turdagi maksimal masofada o'sadi (7.1-jadval).
7.1-jadval. Atom orbitallarining gibridlanish turlari, kompleks hosil bo'lishi va turli murakkab tuzilmalarning geometriyasi

Kompleksning fazoviy tuzilishi valentlik orbitallarining gibridlanish turi va uning valentlik energiya darajasiga mos keladigan taqsimlanmagan elektron juftlarining soni bilan belgilanadi.
Ligand va kompleks hosil qiluvchi agent o'rtasidagi donor-akseptor o'zaro ta'sirining samaradorligi, shuning uchun ular bilan bog'lanishning qiymati (kompleksning barqarorligi) ularning qutblanishi bilan belgilanadi, keyin. endi tashqi infuzion ostida ularning elektron qobiqlarini o'zgartiradi. Ushbu belgiga ko'ra reaktivlar quyidagilarga bo'linadi "zhorstki" yoki past polarizatsiyalangan, ya'ni "myaki" - engil maydonlar - shaklli. Atom, molekula yoki ionning qutbliligi elektron sharlar hajmi va soniga bog'liq. Zarrachadagi elektronlar radiusi qanchalik kichik bo'lsa, u shunchalik kam qutblangan bo'ladi. Zarrachaning radiusi qanchalik kichik bo'lsa va elektronlar qancha kam bo'lsa, u shunchalik kuchli qutblanadi.
Qattiq kislotalar mikro (qattiq) komplekslarning ligandlarining (qattiq asoslari) elektron manfiy O, N, F atomlari bilan, engil kislotalar esa ligandlarning elektron manfiyligi va vi sharbati past bo'lgan donor P, S va I atomlari bilan reaksiyaga kirishadi. qutblanish, mítsni (m' yaki) komplekslari. Biz bu erda qonundan tashqari "yoqishni yoqtirish" tamoyilini namoyish qilishdan ehtiyot bo'lamiz.
Qattiqligi tufayli ular amalda biosubstratlar bilan barqaror komplekslar hosil qilmaydi va fiziologik muhitda ular suv komplekslari shaklida uchraydi. Ca 2+ va Mg 2+ ionlari oqsillar bilan barqaror komplekslar hosil qiladi va shuning uchun ham ion, ham bog'langan holatda fiziologik moddalarda topiladi.
Ular d-elementlarni biosubstratlar (oqsillar) va biologik komplekslar bilan birlashtiradi. Yumshoq kislotalar Cd, Pb, Hg juda zaharli. Hidlar R-SH sulfhidril guruhlarini olib tashlash uchun oqsillar bilan mitotik komplekslarni hosil qiladi:
Sianid ioni zaharli hisoblanadi. Yumshoq ligand biosubstratlar, faol qoldiqlar bilan komplekslarda d-metallar bilan faol ta'sir o'tkazadi.
7.5. MURAKKAL NUTQLARNING DISOCIATION. KOMPLEKS BARQARORLIGI. LABIL VA INERT KOMPLEKSLAR
Murakkab birikmalar suvda eritilganda, hid kuchli elektrolitlarga o'xshash tashqi va ichki sferalarga parchalanadi, ularning bo'laklari ionogen, asosan elektrostatik kuchlar bilan bog'lanadi. Bu murakkab reaksiyalarning birlamchi dissotsiatsiyasi sifatida baholanadi.
Murakkab birlashmaning ikkilamchi dissotsiatsiyasi ichki sferaning uning tarkibiy qismlariga parchalanishidir. Bu jarayon kuchsiz elektrolitlar aralashmasida sodir bo'ladi, ichki sfera bo'laklari noionik (kovalent bog'lanish) bog'lanadi. Dissotsiatsiya bosqichma-bosqich xarakterga ega:

Murakkab yarimparchalanish davrining ichki sohasining barqarorligini aniq tavsiflash uchun biz ichki dissotsiatsiyani tavsiflovchi tenglashtirish konstantasidan foydalanamiz. kompleksning beqarorligi konstantasi(Kn). Murakkab anion uchun beqarorlik konstantasi quyidagicha ko'rinadi:

Kn qiymati qanchalik kichik bo'lsa, murakkab aloqaning ichki sohasi shunchalik barqaror bo'ladi. Shu tarzda u suvda kamroq dissotsiyalanadi. Qolgan vaqt ichida Kn ni qattiqlik doimiysi (Ku) qiymatlari yordamida almashtiring - qiymat, Kn ning qaytishi. Ku qiymati qanchalik katta bo'lsa, kompleks barqarorroq bo'ladi.
Barqarorlik konstantalari ligand almashinuvi jarayonlarini bevosita bashorat qilish imkonini beradi.
Suvli toifada metall ioni akvakomplekslar shaklida namoyon bo'ladi: 2 + - hexaquatic temir (II), 2 + - tetraaquatic mis (II). Gidratlangan ionlarning formulalarini yozishda hidratsiya qobig'ining suv molekulasining koordinatsiyasi ko'rsatilmaydi, lekin hisobga olinishi mumkin. Metall ioni va ligand o'rtasida kompleks hosil bo'lishi suv molekulasining ichki koordinatsiya sferasida ushbu ligand bilan almashinishi reaktsiyasi sifatida qaraladi.
Ligand almashinuvi reaksiyalari S N tipidagi reaksiya mexanizmi orqali boradi. Masalan:
7.2-jadvalda ko'rsatilgan barqarorlik konstantalarining qiymatlari kompleks hosil qilish jarayonida suvli moddalarda ionlarning sezilarli darajada bog'lanishini ko'rsatadi, bu ushbu turdagi reaktsiyaning samaradorligini ko'rsatadi. ionlarni, ayniqsa polidentat ligandlarni bog'lash uchun.
7.2-jadval. Zirkonyum komplekslarining chidamliligi

Ion almashinuvi reaktsiyasi natijasida murakkab reaktsiyalarning yaratilishi ko'pincha yarim lahzali jarayon emas. Masalan, (III) birikma nitriletrimetilenfosfon kislotasi bilan o’zaro ta’sirlashganda 4 marta qo’shilgandan keyin muvozanat o’rnatiladi. Komplekslarning kinetik xarakteristikalari uchun quyidagi tushunchalar qo'llaniladi: labil(Shvidko reaksiyaga kirishadi) va inert(To'liq javob beradi). Labile komplekslar, G.Taube taklifiga ko'ra, xona haroratida uzunligi 1 min va konsentratsiyasi 0,1 M bo'lgan ligandlarni to'liq almashtiradiganlardir. Termodinamik tushunchalarni aniq ajratish kerak [m Milliy (barqaror) / nemis. (beqaror)] va kinetik [inert va labillik] komplekslar.
Labil komplekslarda ligandlarni almashtirishga tez erishiladi va tenglashtirish tez o'rnatiladi. Inert komplekslarda ligandlarni almashtirish uzluksiz davom etadi.
Shunday qilib, kislotali muhitdagi inert kompleks 2+ termodinamik jihatdan beqaror: beqarorlik konstantasi 10 -6 dan ortiq, labil kompleks 2 esa juda barqaror: barqarorlik konstantasi 10 -30 dan yuqori. Taube komplekslarining labilligi markaziy atomning elektron tuzilishi bilan bog'liq. Quvvat komplekslarining inertligi, asosiy darajasi, tugallanmagan d-qobig'idan ionlar. Z, Cr komplekslari inert hisoblanadi. Tashqi manbalardan kationlarga boy siyanid komplekslari s 2 p 6 labil.
7.6. KIMYOVIY ENG KOMPLEKSLARI
Kompleks yaratish jarayonlari kompleksni yaratuvchi barcha zarralarning kuchiga asoslanadi. Ligandlar va komplekslar orasidagi bog'larning ahamiyati qanchalik katta bo'lsa, markaziy atom va ligandlarning kuchi shunchalik kam namoyon bo'ladi va kompleksning o'ziga xos xususiyatlari ham kamroq namoyon bo'ladi.
Murakkab reaktsiyalar markaziy atomning (erkin orbitallarning) koordinatsion bo'lmaganligi va ligandlarning erkin elektron juftlarining mavjudligi tufayli kimyoviy va biologik faollikni ochib beradi. Ushbu turdagi komplekslar elektrofil va nukleofil kuchga ega bo'lib, markaziy atom va ligandlarning vakolatlariga bo'ysunadi.
Hidratlangan qobiq majmuasining kimyoviy va biologik faolligiga tayanish kerak. Yaratilish jarayoni
Komplekslarning hech biri murakkab tizimning kislota-asos kuchiga oqmaydi. Murakkab kislotalarning erishi kislota yoki asosning kuchayishi bilan birga keladi. Shunday qilib, murakkab kislotalar oddiylardan eritilganda, H+ ionlari bilan bog'lanish energiyasi kamayadi va kislotaning kuchi sezilarli darajada oshadi. Agar tashqi sferada OH - ion bo'lsa, u holda kompleks kation va tashqi sferaning gidroksid ioni orasidagi bog'lanish o'zgaradi va kompleksning asosiy quvvati ortadi. Masalan, mis gidroksid Cu(OH) 2 zaif, muhim asosdir. Yangi ammiak ta'sirida mis ammiak (OH) 2 hosil bo'ladi. Cu 2+ bilan 2+ zaryadning kuchi o'zgaradi, BIN ionlari bilan bog'lanish zaiflashadi va (OH) 2 kuchli asos hisoblanadi. Kompleks tuzuvchi bilan bog'liq bo'lgan ligandlarning kislota-asos kuchi tabiatda ularning quyi kislota-asos kuchidan kuchliroq bo'ladi. Masalan, gemoglobin (Hb) yoki oksigemoglobin (HbO 2) HHb ↔ H + + Hb - ligand bo'lgan oqsil-globinning kuchli karboksil guruhlari almashinuvi uchun kislotali kuchni namoyon qiladi. Shu bilan birga, globin oqsilining amino guruhi uchun gemoglobin anioni asosiy kuchni ko'rsatadi va bu karbaminohemoglobin anioni (HbCO 2 -) tarkibiga ega bo'lgan CO 2 kislota oksidi bilan bog'liq: CO 2 + Hb - ↔ HbCO 2 -.
Komplekslar barqaror oksidlanish bosqichlarini yaratadigan oksidga asoslangan kompleks birikmalarining o'zaro ta'siri tufayli oksidlanish kuchini namoyish etadi. Murakkablanish jarayoni d-elementlarning oksidlanish potentsiallarining qiymatlarini sezilarli darajada oshiradi. Agar kationlarning yangilangan shakli ligand bilan barqaror kompleks hosil qilsa, pastki shakli oksidlanadi, keyin potentsial kuchayadi. Potensial qiymatning pasayishi barqaror kompleks oksidlangan shakl tomonidan yaratilgan bo'lsa sodir bo'ladi. Masalan, oksidlovchi moddalar: nitritlar, nitratlar, NO 2 H 2 O 2 ta'sirida gemoglobin markaziy atomning oksidlanishi natijasida methemoglobinga aylanadi.
Yaratilgan oksigemoglobindagi Shosta orbital vikoristovaya. Bu orbital uglerod oksidi bilan bog'lanish bilan bir xil taqdirga ega. Natijada, tupurikdan makrosiklik kompleks - karboksigemoglobin hosil bo'ladi. Bu kompleks 200 marta barqaror, pastki kompleks esa yarim kislotali.

Kichik 7.1. Odamlarda gemoglobinning kimyoviy o'zgarishi. Kitobdan sxema: Slesarev V.I. Tirik mavjudotlar kimyosi asoslari, 2000 yil
Kompleks ionlarning yoritilishi kompleks hosil qiluvchi ionlarning katalitik faolligini oshiradi. Bir qator epizodlarda faollik kuchayadi. Bu oraliq mahsulotlarning paydo bo'lishiga va reaktsiyaning faollashuv energiyasining pasayishiga olib keladigan ajoyib tizimli tizimlarning rivojlanishi bilan bog'liq. Misol uchun, agar siz H 2 Pro 2 ga Cu 2+ yoki NH 3 qo'shsangiz, qadoqdan chiqarish jarayoni tezlashmaydi. O'rta qismda o'rnatilgan 2+ kompleksi mavjud bo'lganda, suv peroksidining chiqishi 40 million marta tezlashadi.
Shuningdek, gemoglobinda murakkab birikmalarning kuchiga qarash mumkin: kislota-asos, kompleks hosil qilish va oksid-asos.
7.7. KOMPLEKS SPLUKLAR TASNIFI
Murakkab birikmalarni tasniflash uchun turli xil printsiplarga asoslangan bir qator tizimlar mavjud.
1. Qo‘shiqchilik sinfigacha bo‘lgan murakkab ijro holati uchun:
Murakkab kislotalar H 2;
Murakkab asoslar OH;
Murakkab tuzlar K4.
2. Ligandning tabiatiga ko‘ra: akvakomplekslar, amiokislotalar, atsidokomplekslar (ligandlar bosh aylanuvchi kislotalarning anionlari sifatida K 4 ; gidroksokomplekslar (ligandlar gidroksil guruhlari bo‘lgani uchun K 3 ) ); o‘rtasida makrosiklik ligandli komplekslar. barcha diapazonlar scheni markaziy atom.
3. Kompleksning zaryad belgisiga ko'ra: kation - kompleks birikmadagi kompleks kation Cl 3; anionni – K kompleks birikmadagi kompleks anion; neytral - kompleksga zaryad 0 ga teng. Tashqi sohaning murakkab ulanishi, masalan, ta'sir qilmaydi. Bu o'smaga qarshi dori formulasi.
4. Kompleksning ichki tuzilishiga ko'ra:
a) kompleks hosil qiluvchi atomlar soniga qarab: bir yadroli- Kompleks zarrachadan oldin kompleks hosil qiluvchining bitta atomi bor, masalan Cl 3; boy yadro- murakkab qismning omborida kompleks hosil qiluvchi vosita - lizoprotein kompleksining bir qator atomlari mavjud:

b) komplekslar bir necha turdagi ligandlarga bo'linadi: o'xshash (yagona ligand), Bir turdagi ligandlarni almashtiring, masalan, 2 + va har xil (turli xil ligandlar)- ikki yoki undan ortiq turdagi ligandlar, masalan, Pt(NH 3) 2 Cl 2. Kompleks tarkibida NH 3 va Cl - ligandlari mavjud. Turli ligandlarning ichki sferasi geometrik izomeriya bilan xarakterlanadigan murakkab komplekslar uchun, agar, ammo, undagi ligandlarning ichki sferasi tarkibi turlicha bo'lsa.

Murakkab tuzilmalarning geometrik izomerlari nafaqat fizik va kimyoviy ta'sirlar, balki biologik faollik tufayli ham farqlanadi. Sis-izomer Pt(NH 3) 2 Cl 2 aniq o'simtaga qarshi faollikka ega, trans-izomer esa yo'q;
v) monoyadroli komplekslarni hosil qiluvchi ligandlarning zichligiga qarab quyidagi guruhlarni ko'rish mumkin:
Bir yadroli komplekslar monodentat ligandlari bilan, masalan, 3+;
Polidentat ligandlari bo'lgan bir yadroli komplekslar. Polidentat ligandlari bo'lgan murakkab birikmalar deyiladi xelatlangan sulfatlar;
d) murakkab reaksiyalarning siklik va asiklik shakllari.
7.8. XELAT KOMPLEKSLARI. Komplekslar. KOMPLEKSONATI
Xelatlovchi moddaning bir molekulasida joylashgan ikkita yoki undan ortiq donor atomlarga metall ionining qoʻshilishi natijasida hosil boʻlgan siklik tuzilmalar deyiladi. xelatli birikmalar. Masalan, mis glitsinat:

Ular bir murakkab agenti bor, ular ligandlari bilan, tirnoqlari kabi, ligamentlari o'rta bilgan, shuning uchun boshqa teng aqli uchun hidi ko'chadan xalaqit bermaslik uchun, ko'proq qarshilik, past kuch bo'lishi mumkin. Eng barqaror tsikllar besh yoki olti chiziqda sodir bo'lgan tsikllardir. Bu qoida birinchi marta L.A. Chugaev. Chakana savdo
Xelat kompleksining barqarorligi va uning siklik bo'lmagan analogining barqarorligi deyiladi xelat ta'siri.
Xelatlovchi vosita sifatida polidentat ligandlar 2 turdagi guruh vazifasini bajaradi:
1) almashinuv reaktsiyasi uchun kovalent qutbli bog'lanishlar hosil bo'lgunga qadar yaratilgan guruhlar (proton donorlari, elektron juft qabul qiluvchilar) -CH 2 COOH, -CH 2 PO(OH) 2 -CH 2 SO 2 OH - kislotali guruhlar (markazlar);
2) elektron juftlarning guruh-donorlari: ≡N, NH, C = O, -S-, -OH, - asosiy guruhlar (markazlar).
Bunday ligandlar kompleksning ichki koordinatsion sferasida mavjud bo'lganligi va metall ionining zaryadini neytrallashtirganligi sababli, ular deyiladi. ichki murakkab. Masalan, mis glitsinat. Kimning kompleksi kun davomida tashqi sferaga ega.
Molekulaning asos va kislota markazlarida joylashgan organik birikmalarning katta guruhi deyiladi komplekslar. Bular asosli kislotalardir. Metall ionlari bilan o'zaro ta'sirlashganda kompleksonlar tomonidan hosil bo'ladigan xelatli birikmalar deyiladi komplekslar, masalan, etilendiamintetraoktik kislota bilan magniy kompleksonati:
Suv o'simliklarida kompleks anion shaklda mavjud.
Komplekslanish va komplekslanish tirik organizmlarning murakkab birikmalarining oddiy modelidir: aminokislotalar, polipeptidlar, oqsillar, nuklein kislotalar, fermentlar, vitaminlar va boshqa boy endogen birikmalar.
Nina turli funktsional guruhlarga ega bo'lgan sintetik komplekslarning katta assortimentini ishlab chiqaradi. Asosiy komplekslarning formulalari quyida keltirilgan:


Katta aqllar majmualari metall ioni (s-, p- yoki d-elementlar) bilan muvofiqlashtiruvchi aloqani o'rnatish uchun bo'linmagan elektron juftlarni (bo'linish) hosil qilishi mumkin. Natijada 4, 5, 6 yoki 8 a'zoli halqali barqaror xelat tipidagi yarim qattiq moddalar hosil bo'ladi. Reaktsiya keng pH diapazonida sodir bo'ladi. PH ga, kompleks hosil qiluvchining tabiatiga, ligand bilan aloqasiga qarab, har xil ahamiyatga ega va jiddiylikdagi komplekslarni hosil qiladi. Kompleks birikmalarning hosil bo'lish kimyosini suvda dissotsiatsiyalanadigan natriy tuzi EDTA (Na 2 H 2 Y) bilan o'xshashlik bilan ifodalash mumkin: Na 2 H 2 Y → 2 Na + + H 2 Y 2- va H 2 Y 2 - ion metall ionlari bilan o'zaro metall kationining oksidlanish bosqichidan qat'i nazar, ko'pincha bitta metall ioni kompleksonning bir molekulasi bilan o'zaro ta'sir qiladi (1:1). Reaksiya tez boradi (Cr>109).
Komplekslar va kompleksonatlar keng pH diapazonida amfoter quvvatni namoyon qiladi, ular oksidlanish-yangilanish reaktsiyalarida, kompleks hosil bo'lishda ishtirok etadi va metallarning oksidlanish bosqichiga, uning koordinatsiyasining qimmatli to'yinganligiga, elektrofil va nukleofil kuchlariga qarab turli xil kuchlarga ega bo'lgan reaktsiyalar hosil qiladi. Bularning barchasi ko'p sonli zarrachalarni bog'lash qobiliyatini anglatadi, bu esa kam sonli reagentlar katta va turli xil vazifalarni bajarishga imkon beradi.
Komplekslar va kompleksonatlarning uzatilishi aks holda to'siqsiz - toksiklik kam va toksik qismlarni aylantirish qobiliyati mavjud.
kam toksik yoki biologik faol. Komplekslarning parchalanish mahsulotlari tanada to'planmaydi va zararli emas. Komplekslarning uchinchi xususiyati ularning mikroelementlarni birlashtirish qobiliyatidir.
So'rilishning ortishi mikroelementning biologik faol shaklda kiritilganligi va membranadan yuqori kirishi bilan bog'liq.
7.9. FOSFOR METAL KOMPLEKSLARI - MIKRO-VA MAKROELEMENTLARNI BIOLOGIK FAOL STANDA AYLANISHNING SAMARALI SHAKLI VA ILG'AR BIOLOGIYA MODELI.
Kontseptsiya biologik faollik Keng doiradagi teshiklarni hidlaydi. Biologik faol moddalar (BAS) ostida kimyoviy infuziya nuqtai nazaridan, biologik tizimlarga ta'sir eta oladigan, ularning hayotiyligini tartibga soluvchi moddalarni tushunish qabul qilinadi.
Bunday xususiyatlarning mavjudligi ko'pincha biologik faollikning mavjudligi sifatida talqin qilinadi. Tartibga solish bu va boshqa ta'sirlarni rag'batlantirish, bostirish, rivojlantirish ta'sirida yuzaga kelishi mumkin. Biologik faollikning haddan tashqari namoyon bo'lishi biosidal ta'sir, agar men nihoyat nutq-biotsidni qolgan jinning tanasiga kiritsam. Ko'p hollarda past konsentratsiyalarda biotsidlar tirik organizmlarga o'ldiradigan emas, balki ogohlantiruvchi ta'sir ko'rsatadi.
Ayni paytda jamoatchilik e'tiborida bunday chiqishlar juda ko'p. Ko'p hollarda biologik faol moddalarning turg'unligi, ularning samaradorligi etarli emas, ko'pincha maksimal darajadan uzoq bo'lgan samaradorlik bilan va turg'unlik ko'pincha o'zgartirilgan biologik faol moddalarni kiritish natijasida yuzaga kelishi mumkin bo'lgan nojo'ya ta'sirlarga olib keladi.Ikatoriv.
Fosfor komplekslari tabiatga, metall oksidlanish bosqichiga, koordinatsion to'yinganlikka, saqlash va hidratsiya qobig'iga qarab turli kuchlarga ega bo'lgan reaktsiyalar hosil qiladi. Bularning barchasi kompleksonatlarning ko'p funksiyaliligini, ularning substoxiometrik ta'sirining o'ziga xos xususiyatini,
Halol ionining ta'siri tibbiyot, biologiya, ekologiya va xalq xo'jaligining turli sohalarida keng qo'llanilishini ta'minlaydi.
Metall ioni bilan muvofiqlashtirilganda kompleks elektron zichligi qayta taqsimlanishiga uchraydi. Donor-akseptor ta'sirida taqsimlanmagan elektron juftining ishtiroki natijasida ligandning (kompleks) elektron zichligi markaziy atomga siljiydi. Liganddagi manfiy zaryadning kamayishi reaktivlarning kulon kontsentratsiyasining o'zgarishiga to'g'ri keladi. Shuning uchun ligandning koordinatsiyasi nukleofil reagent tomonidan hujumga kirishishi mumkin bo'lib, bu reaktsiya markazida ortiqcha elektron quvvatini keltirib chiqaradi. Elektron quvvatini kompleksondan metall ioniga almashtirish uglerod atomining musbat zaryadini sezilarli darajada oshishiga va shuning uchun nukleofil reagent, gidroksil ionining hujumini kamaytirishga olib keladi. Biologik tizimlardagi metabolik jarayonlarni katalizlovchi gidroksillangan fermentlar kompleksi organizmdagi fermentativ ta'sir va detoksifikatsiya mexanizmida markaziy o'rinlardan birini egallaydi. Ferment va substrat o'rtasidagi ko'p nuqtali o'zaro ta'sir natijasida faol markazdagi faol guruhlarning yaqinligini va reaktsiyaning molekulyar rejimga o'tishini ta'minlaydigan yo'nalish hosil bo'ladi, bu reaktsiya boshlanishiga qadar va FCM ning fermentativ funktsiyasini ta'minlaydigan o'tishning yaratilishi I bo'ladi. Ferment molekulalari konformatsion o'zgarishlarga duch kelishi mumkin. Koordinatsiya markaziy ion va ligand o'rtasidagi oksidlovchi o'zaro ta'sir uchun qo'shimcha asoslarni yaratadi, buning natijasida oksidlovchi vosita va ligand o'rtasida o'tish elektronlarini ta'minlaydigan to'g'ridan-to'g'ri aloqa o'rnatiladi. FCM o'tish metall komplekslari metall orbitallarida (M) ishtirok etadigan L-M, M-L, M-L-M tipidagi elektron o'tishlari va kompleks bilan donor-akseptor bog'lari bilan bog'langan ligandlar (L) bilan tavsiflanishi mumkin. Komplekslar turli oksidlanish sharoitlarida bir xil elementlardan birining markaziy atomlari orasida boy yadroli komplekslarning elektronlari tebranish joyi bo'lib xizmat qilishi mumkin. (elektron va proton uzatish komplekslari). Komplekslar yuqori antioksidant, adaptogen va gomeostatik funktsiyalarni ta'minlaydigan metall kompleksonatlarning kuchli xususiyatlarini anglatadi.
Shuningdek, komplekslar mikroelementlarni tanaga kirish mumkin bo'lgan biologik faol shaklga aylantiradi. Hidi doimiy,
ko'proq muvofiqlashtirilgan infuzion zarralar, yaratilmagan biokomplekslar va shuning uchun kam toksik shakllar. Organizmda mikroelement gomeostazi buzilganda komplekslar yaxshi ishlaydi. Kompleks shakldagi o'tish elementlarining ionlari organizmda yuqori konsentratsiyali gradient, membrana potentsialini yaratishda hujayralarning o'z qismlarining mikroelementlariga yuqori sezuvchanligini bildiruvchi omil sifatida ishlaydi. FCM ning o'tish metallarining komplekslari bioregulyatsiya kuchlariga olib keladi.
FCM omborida kislotali va asosli markazlarning mavjudligi amfoter quvvatni va ularning kislota-baz muvozanatini saqlashda ishtirok etishini ta'minlaydi (izohidrik holat).
Kompleksni saqlashda fosfonik guruhlar sonining ko'payishi tufayli kompleks va kichik komplekslarning saqlanishi va rivojlanishi o'zgaradi. Fosfonik guruhlarning ko'payishi kengroq pH diapazonida past darajali komplekslarning shakllanishiga to'sqinlik qiladi va ularning kislotali hududga erish sferasini yo'q qiladi. Komplekslar pH 9 dan yuqori bo'lganida parchalanadi.
Komplekslar bilan kompleks hosil qilish jarayonlarining rivojlanishi bioregulyatorlarni sintez qilish usullarini ishlab chiqishga imkon berdi:
Kolloid-kimyoviy shaklda uzoq muddatli o'sish stimulyatorlari - ko'p yadroli gomo- va heterokompleks titan va tupurik;
Suvga boy shakllar uchun o'sish stimulyatorlari. Bu titanium uchun komplekslar va noorganik ligandlar asosidagi ko'p ligandli komplekslar;
O'sish inhibitorlari - s-elementlarning fosfor komplekslari.
Sintetik preparatlarning o'sish va rivojlanishga biologik ta'siri o'simliklar, hayvonlar va odamlarda o'tkazilgan surunkali tajribalarda ko'rsatildi.
Bioregulyatsiya- tibbiyot, hayvonot dunyosi va qishloq xo'jaligida keng qo'llanilishi mumkin bo'lgan biokimyoviy jarayonlarning intensivligini bevosita tartibga solish imkonini beruvchi yangi ilmiy direktivaning narxi. Bu kasalliklar va keksa patologiyalarning oldini olish va davolash orqali tananing fiziologik funktsiyasini yangilash usullarini ishlab chiqish bilan bog'liq. Murakkablik va ularga asoslangan kompleks davolashni istiqbolli biologik faol davolash usullariga kengaytirish mumkin. Surunkali tajribada ushbu biologik faollikni o'rganish kimyo shifokorlar qo'liga nima olib kelganligini ko'rsatdi.
Creepers, agronomlar va biologlar tirik hujayralar bilan faol aloqada bo'lish, oziq-ovqat ta'minotini, tirik organizmlarning o'sishi va rivojlanishini tartibga solish imkonini beruvchi yangi istiqbolli kontseptsiyaga ega.
Turg'un kompleksonlar va kompleksonatlarning toksikligini o'rganish qon hosil qiluvchi organlarga dori vositalarining kirib borishi, arterial bosim, bezovtalik, nafas olish chastotasi ortib borayotganini ko'rsatdi: jigar faoliyatida o'zgarishlar qayd etilmagan, toksikolog tomonidan aniqlanmagan. to'qimalar va organlarning morfologiyasi. Kaliy tuzi OEDP 181 dB qo'shimcha dozada preparatning dozasidan (10-20 mg / kg) 5-10 baravar ko'p bo'lgan dozada toksiklikka ega emas. Keyinchalik, komplekslar kam toksik birikmalarga kamayadi. Ular virusli kasalliklar, muhim metallar va radioaktiv elementlarning kamayishi, kaltsiy almashinuvining buzilishi, endemik kasalliklarda va organizmdagi mikroelementlar muvozanatining buzilishida dorivor preparatlar sifatida ishlatiladi. Fosfor komplekslari va kompleksonatlar fotolizga moyil emas.
Dunyoning muhim metallar bilan tobora ifloslanishi kuzatilmoqda - hukumatning odamlar va doimiy faol ekologiya xodimi faoliyati mahsulotlari. Tanada hidlar to'planishi mumkin. Ularning ko'pligi tanaga mast bo'lishga olib keladi.
Metall komplekslar organizmdagi ligandning (kompleks) xelatlovchi ta'sirini saqlab qoladi va metall ligand gomeostazini qo'llab-quvvatlash uchun zarurdir. Birlashtirilgan muhim metallar organizmda tezda neytrallanadi va past rezorbsiya darajasi metallarni trofik lansetlarga o'tkazishga to'sqinlik qiladi, natijada "biominizatsiya" Ular toksikdir, bu ayniqsa Ural mintaqasi uchun muhimdir. Misol uchun, qo'rg'oshinning kuchli ioni erituvchilar chiqarilgunga qadar olib tashlanishi mumkin va qo'rg'oshinning etilendiamintetraoktik kislota bilan mikro kislota kompleksonati kam toksikdir. Shuning uchun o'simliklar va hayvonlarning detoksifikatsiyasi turg'un metall kompleksonatlarning mavjudligida yotadi. U ikkita termodinamik tamoyilga asoslanadi: ularning zaharli zarrachalar bilan mikroskopik aloqalar hosil qilish, ularni past navli yoki suvga chidamli birikmalarga aylantirish qobiliyati; Ularning endogen biokomplekslarni yo'q qila olmasligi. Shu munosabat bilan atrof-muhitga to‘g‘ridan-to‘g‘ri qarshi kurashish, ekologik toza mahsulotlarni, jumladan, o‘simlik va hayvonlarni kompleks davolashni olib borish muhim ahamiyatga ega.
O'simtalarni noyob metallar komplekslari bilan quyish intensiv ekstraktsiya texnologiyasidan foydalangan holda amalga oshirildi.
kartoshkani kartoshka piyozchalarining mikroelementlar omboriga. Lampochkalarda 105-116 mg/kg saliz, 16-20 mg/kg marganets, 13-18 mg/kg midi va 11-15 mg/kg rux bor edi. Tabiiy matolar uchun odatiy mikroelementlar bilan muvofiqligi. Turg'unlikdan va metall kompleksonatlarning turg'unligisiz o'stirilgan lampalar amalda yangi elementar omborni tashkil qiladi. Xelatlarning turg'unligi lampalardagi muhim metallarning to'planishiga to'sqinlik qilmaydi. Kamroq darajadagi komplekslar, pastroq metall ionlari, tuproq tomonidan so'riladi, mikrobiologik oqimga chidamli bo'lib, qiyin paytlarda tuproqning shikastlanishini bartaraf etishga imkon beradi. 3-4 yildan keyin ta'sir qiladi. Xushbo'y hidlarni turli xil organik kimyoviy moddalar bilan iste'mol qilish yaxshidir. Kompleks tarkibidagi metall past toksiklikka ega. Metallar bilan fosfor komplekslari ko'zning shilliq qavatini bezovta qilmaydi va terini bezovta qilmaydi. Sensibilizatsiya kuchi aniqlanmadi, titan kompleksonatlarining kümülatif kuchi ifoda etilmadi va ba'zi hollarda u juda zaif edi. Kumulyatsiya koeffitsienti 09-30 bilan bir xil bo'lib qoladi, bu dori vositalari bilan surunkali buzilishning past potentsial xavfini ko'rsatadi.
Fosfor komplekslari biologik tizimlarda ham uchraydigan fosfor karbid bog'lariga (K-P) asoslangan. Siz hujayra membranalarining fosfonolipidlari, fosfonoglikanlar va fosfoproteinlari omboriga kirasiz. Aminofosfonik birikmalarni olib tashlaydigan lipidlar fermentativ gidrolizga chidamli bo'lib, tashqi hujayra membranalarining barqarorligini va shuning uchun normal ishlashini ta'minlaydi. Pirofosfatlarning sintetik analoglari - difos-fonat (P-S-P) yoki (P-S-S-P) yuqori dozalarda kaltsiy almashinuvini buzadi va kichik dozalarda ular uni normallashtiradi. Difosfonatlar giperlipemiya uchun samarali va farmakologik nuqtai nazardan istiqbolli.
P-C-P aloqalarini biotizimlarning strukturaviy elementlari bilan almashtiradigan difosfonatlar. Hidlar biologik jihatdan samarali va pirofosfatlarning analoglari. Difosfonatlar turli kasalliklarni davolashning samarali usullari ekanligi isbotlangan. Difosfonatlar mineralizatsiya va kist rezorbsiyasining faol inhibitörleridir. Komplekslar mikroelementlarni organizm uchun qulay bo'lgan biologik faol shaklga aylantiradi, barqaror, yuqori darajada muvofiqlashtirilgan zarralar va g'ayritabiiy biokomplekslarni, shuningdek, kam toksik shakllarni yaratadi. Xushbo'y hid hujayralarning mikroelementlarga yuqori sezuvchanligini ko'rsatadi, yuqori konsentratsiyali gradient hosil bo'lishida ishtirok etadi. Hozirgi birodarlar boy yarim yadroli titan heteronuklearlarini yaratishda ishtirok etadilar -
yangi turdagi - metabolik jarayonlarning bioregulyatsiyasida ishtirok etadigan elektronlar va protonlarni o'tkazish uchun komplekslar, tananing qarshiligi, zaharli zarrachalar bilan bog'lanishlarni hal qilish, ularni kichik yoki kichik sharoitlarga aylantirish, buzmaslik. endogen komplekslar. Shuning uchun ular zaharsizlantirish, organizmdan chiqarib tashlash, ekologik toza mahsulotlarni ajratib olish (kompleks terapiya), shuningdek, sanoatda noorganik kislotalar va tuzlarning sanoat chiqindilarini qayta tiklash va utilizatsiya qilish uchun turg'unlik qiladi.Istiqbolli metallar juda ko'p.
7.10. LIGAND BIRJALARI VA METAL AYIRASHLARI
RIVNOVAGI. XELATERAPİYA
Agar tizimda kompleks birikmalar hosil bo'lgunga qadar yaratilgan bir metall ionli bir nechta ligandlar yoki bir ligandli bir qancha metall ionlari mavjud bo'lsa, u holda raqobatlashuvchi jarayonlardan qochish kerak: birinchi turdagi ligand almashinuvi teng - raqobat ligandlari. metall ioni uchun boshqa turdagi metall almashinadigan raqobat mavjud - ligand uchun metall ionlari o'rtasidagi raqobat. Muhimi, ishga qabul qilish kompleksini tashkil etish jarayoni. Masalan, Rossiyada ionlar mavjud: magniy, sink, tuprik (III), mis, xrom (II), tupurik (II) va marganets (II). Ushbu eritmaga oz miqdorda etilendiamintetraoktik kislota (EDTA) kiritilganda, metall ionlari va tupurik kompleksi (III) bilan bog'lanish o'rtasida raqobat mavjud bo'lib, sharobning qolgan qismi EDTA tomonidan eng katta darajada kamayadi.Tsniy kompleksi.
Organizmda biometallar (MB) va bioligandlar (Lb), muhim biokomplekslarni yaratish va tiklash (MbLb) o'rtasida doimiy o'zaro ta'sir mavjud:
Inson, hayvonlar va o'simliklar organizmida bir xil turdagi ksenobiotiklarni (begona moddalar), shu jumladan muhim metallarning ionlarini himoya qilish va qo'llab-quvvatlashning turli mexanizmlari mavjud. Ular kompleksga bog'lanmagan muhim metallar bo'lib, ularning gidroksokomplekslarida zaharli zarrachalar (Mt) mavjud. Bunday hollarda, tabiiy metall ligand aralashmasiga qo'shimcha ravishda, yangi inqilob sodir bo'lishi mumkin, bu esa metall toksikantiga (MtLb) yoki ligand-toksikantga (MbLt) qarshi turish uchun muhim xorijiy komplekslarni yaratishi mumkin, bu esa tashvishlanmaydi.
muhim biologik funktsiyalar. Ekzogen zaharli zarralar organizmga kirganda, muvozanat aralashmasi va natijada jarayonlar raqobati mavjud. Muhimi, eng keng qamrovli natijani yaratishga olib keladigan jarayon:

Metall ligand gomeostazining buzilishi metabolik jarayonning buzilishiga, ferment faolligining inhibe qilinishiga, ATP, hujayra membranalari kabi muhim metabolitlarning buzilishiga, hujayra tinasida ion konsentratsiyasi gradientining buzilishiga olib keladi. Shuning uchun uning uchun parcha-parcha tizimlar yaratiladi. Bu usul bilan chambarchas bog'liq xelat terapiyasi (kompleks terapiya).
Xelat terapiyasi - bu organizmdan zaharli zarralarni olib tashlash jarayoni bo'lib, ularning s-elementlarining kompleksonatlarini xelyatsiya qilishga asoslangan. Tanadagi zaharli zarralarni olib tashlash uchun ishlatiladigan dorilar detoksifikatsiya qiluvchi vositalar deb ataladi.(Lg). Zaharli zarrachalarning metall kompleksonatlari (Lg) bilan xelatlanishi zaharli metall ionlarini (Mt) toksik bo'lmagan (MtLg) bog'langan shakllarga aylantiradi, ular membranalar orqali izolyatsiya va kirib borish, tashish va tanadan chiqarib yuborish uchun mos keladi. Hidlar ligand (komplekson) uchun ham, metall ioni uchun ham organizmdagi xelatlovchi ta'sirni saqlaydi. Bu tanadagi metall ligand gomeostazini ta'minlaydi. Shuning uchun kompleksonatlarni tibbiyotda, hayvonlarda va o'simliklarda qo'llash tananing detoksifikatsiyasini ta'minlaydi.
Xelat terapiyasining asosiy termodinamik tamoyillari ikkita pozitsiyada shakllantirilishi mumkin.
I. Detoksifikatsiya qiluvchi (Lg) organizmda mavjud bo'lgan quyi moddalar uchun javob beradigan yangi yaratilgan ion-toksikantlarni (Mt, Lt) samarali bog'lash uchun javobgardir:
II. Detoksifikatsiya qiluvchi vosita hayotning zaruriy murakkab muolajalarini (MBLb) buzishda aybdor emas; Detoksikant va biometal ionlarining (MBLg) o'zaro ta'siri natijasida hosil bo'lishi mumkin bo'lgan birikmalar organizmda mavjud bo'lganlarga qaraganda kamroq ahamiyatga ega:
7.11. TIBBIYOTDA KOMPLEKSONLAR VA KOMPLEKSONATLARNING KADROLARI
Kompleks molekulalari ajralishni yoki biologik tarkibdagi o'zgarishlarni deyarli tan olmaydi, bu katta farmakologik ahamiyatga ega. Komplekslar lipidlarda parchalanmaydi va suvda oson eriydi, shuning uchun hid hujayra membranalari orqali o'tmaydi yoki o'tmaydi, shuning uchun: 1) ichak orqali chiqarilmaydi; 2) kompleks hosil qiluvchi moddalarning so'rilishi faqat AOK qilinganida mumkin (agar penitsilamin ichkarida qabul qilinmasa); 3) komplekslar organizmda asosan postklinik bo'shliqda aylanadi; 4) tanadan olib tashlash nirklar orqali bosh darajasi bilan amalga oshiriladi. Bu jarayon tezda amalga oshiriladi.
Kimyoviy reaksiyalar orqali barglarning biologik tuzilmalarida oqim izlarini qoldiradigan va faolsizlantiruvchi so'zlar deyiladi. antidotlar.
Xelat terapiyasida qo'llaniladigan birinchi antidotlardan biri bu British Anti-Luisite (BAL). Bu vaqtda jihozni sozlang:
Ushbu preparat tanadan kul, simob, xrom va vismutni samarali ravishda olib tashlaydi. Eng ko'p ishlatiladigan birikmalar rux, kadmiy, qo'rg'oshin va simob komplekslari va komplekslarni o'z ichiga oladi. Ularning formulasi metall ionlari bilan dorivor komplekslarni, bu ionlarning quyi komplekslarini oqsillar, aminokislotalar va uglevodlarning uglevod guruhlari bilan yaratishga asoslangan. Qo'rg'oshinni olib tashlash uchun EDTA asosidagi preparatlardan foydalaning. Dori vositalarining katta dozalari tanaga kiritilganda, ular xavfsiz emas, chunki hid bo'laklari kaltsiy bilan bog'lanadi, bu esa ko'plab funktsiyalarning buzilishiga olib keladi. Tom to'xtab qoladi tetasin(CaNa 2 EDTA), qo'rg'oshin, kadmiy, simob, nitriy, seriy va boshqa noyob tuproq metallari va kobaltni olib tashlash uchun ishlatiladi.

1952 yilda tetasinning birinchi klinik joriy etilishidan buyon ushbu preparat kasbiy kasalliklar klinikasida keng qo'llanilgan va endi muhim antidot emas. Tetasinning ta'sir qilish mexanizmi juda oddiy. Ion-toksikantlar kislota va EDTA bilan muhim bog'lovchilarni bog'lashda kaltsiy ionini tetasin bilan muvofiqlashtirishga xalaqit beradi. Kaltsiy ioni, o'z navbatida, yo'qolgan ikkita natriy ioniga almashtiriladi:

Thetacin organizmga 5-10% dozada yuboriladi, bu fiziologik sabablarga asoslanadi. Shunday qilib, ichki miya in'ektsiyasidan keyin ham 1,5 yil o'tgach, tana tetasinning qabul qilingan dozasining 15% ni, 6 yildan keyin - 3% va 2 yildan keyin - 0,5% dan kamini yo'qotadi. Ushbu preparat tetasin bilan inhalatsiya usuli bilan qo'llanilganda samarali bo'ladi. U tez so'riladi va uzoq vaqt davomida qonda aylanadi. Bundan tashqari, tetasin gazli gangrenani davolash uchun ishlatiladi. Bu gaz gangrenasining toksini bo'lgan lesitinaz fermentini faollashtiruvchi rux va kobalt ionlarining ta'sirini inhibe qiladi.
Toksikantlarning tetasin bilan birikishi kam zaharli va foydali xelat kompleksi bo'lib, parchalanmaydi va sekretsiya orqali tanadan osongina chiqariladi, detoksifikatsiya va muvozanatli mineral oziqlanishni ta'minlaydi. Tuzilish va ombor orqasidan oldingi binoga yoping.
EDTA parathas - dietilentriamin-pentaoktik kislotaning natriy-kaltsiy tuzi (CaNa 3 DTPA) - pentasin va dietilentriaminepentafosfonik kislotaning natriy tuzi (Na 6 DTPP) - trimefa-sin. Pentasin radionuklidlarni (texnetiy, plutoniy, uran) olib tashlash uchun muhim ahamiyatga ega.

Etilendiamindiizopropilfosfonik kislotaning natriy tuzi (CaNa 2 EDTP) fosfitsin U tanadan simob, qo'rg'oshin, beriliy, marganets, aktinidlar va boshqa metallarni olib tashlash uchun muvaffaqiyatli qo'llaniladi. Komplekslar ma'lum toksik anionlarni olib tashlashda juda samarali. Masalan, CN- bilan aralash ligand kompleksi bilan reaksiyaga kirishadigan etilendiamin tetraatsetatdan kobaltga (II) siyanid bilan zaharlanish uchun antidot sifatida tavsiya etilishi mumkin. Xuddi shunday printsip zaharli organik birikmalarni olib tashlash, pestitsidlarni yo'q qilish va funktsional guruhlarni metall kompleksonat bilan o'zaro ta'sir qilishdan oldin yaratilgan donor atomlari bilan almashtirish usullari uchun asosdir.
Samarali dori suksimer(Dimerkaptosuksin kislotasi, dimerkaptosuksin kislotasi, chemet). U deyarli barcha toksik moddalarni (Hg, As, Pb, Cd) samarali bog'laydi, lekin biogen elementlarni (Cu, Fe, Zn, Co) tanadan olib tashlamaydi.
Fosfor kompleksonatlari va kaltsiy fosfatlar va oksalatlarning kristal shakllanishining kuchli inhibitörleri. Ksidifon, OEDF ning kaliy-natriy tuzi, teri kasalliklarini davolash uchun kalsifikatsiyaga qarshi dori sifatida buyuriladi. Difosfonatlar, qo'shimcha ravishda, minimal dozalarda, kaltsiyning kist to'qimalariga qo'shilishini kuchaytiradi, kistalardan patologik chiqishni oldini oladi. OEDP va boshqa difosfonatlar osteoporozning har xil turlarini, shu jumladan osteodistrofiyani, periodontal kasalliklarni oldini oladi.
yaxshi, yo'q qilish, shuningdek, hayvonlarda transplantatsiya qilingan kistni yo'q qilish. OEDF ning antiaterosklerotik ta'siri ham tasvirlangan.
Qo'shma Shtatlarda past difosfonatlar, Zocrema OEDF, metastatik kist saratoni bilan og'rigan odamlar va hayvonlarni davolash uchun farmatsevtik preparatlar sifatida buyuriladi. Membranalarning kirib borishini tartibga solib, difosfonatlar hujayradagi o'smaga qarshi hujayralarni tashishni, shuningdek, turli onkologik kasalliklarni samarali davolashni osonlashtiradi.
Shoshilinch tibbiy yordamning dolzarb muammolaridan biri turli kasalliklarni tezkor tashxislash zaruratidir. Shu nuqtai nazardan, kationlarning o'rnini bosuvchi, shu bilan probning funktsiyalarini - radioaktiv magnitorelaksatsiya va lyuminestsent belgilarini yo'q qiladigan yangi dorilar sinfi katta qiziqish uyg'otadi. Radiofarmatsevtikaning asosiy komponentlari sifatida ma'lum metallarning radioizotoplari ishlatiladi. Ushbu izotoplar kationlarining kompleksonlar bilan xelatlanishi ularning organizm uchun toksikologik xususiyatlarini oshirishga, tashishni osonlashtirishga va shu va boshqa organlarda yuqori konsentratsiyani ta'minlashga imkon beradi.
Ushbu misollar tibbiyotda ishlatiladigan kompleksonatlarning barcha xilma-xil shakllarini zo'rg'a tugatadi. Shunday qilib, etilendiamin tetraasetat magnezium vikoristning dipotassium tuzi patologiya vaqtida to'qimalarda o'rniga tartibga solish uchun ishlatiladi. EDTA qon plazmasini taqsimlashda ishlatiladigan antikoagulyant suspenziyalar omborida, qonda yuqori glyukoza bo'lgan taqdirda adenozin trifosfat stabilizatori sifatida, kontakt linzalarni oqartiruvchi va saqlagan holda saqlanadi. Romatoid bemorlarni davolashda difosfonatlar keng qo'llaniladi. Xushbo'y hid, ayniqsa, yallig'lanishga qarshi dorilar bilan bog'liq bo'lganlarda artritga qarshi vosita sifatida samarali bo'ladi.
7.12. MAKROSIKLIK KOMPLEKSLARI BILAN KOMPLEKSLAR
Tabiiy kompleks birikmalar orasida siklik polipeptidlar asosidagi makrokomplekslar alohida o'rin egallaydi, ular kichik o'lchamdagi ichki bo'sh bo'shliqlarni o'z ichiga oladi, ular tarkibida ushbu metallarning kationlarini, shu jumladan natriy va kaliyni bog'laydigan bir qator kislorod guruhlari mavjud. bo'sh idishning o'lchamlariga mos keladi. Bunday nutqlar biologiyada mavjud

Kichik 7.2. K+ ioni bilan valinomitsin kompleksi
Chexiya materiallari, membranalar orqali ionlarni tashishni ta'minlaydi va deyiladi ionoforlar. Masalan, valinomitsin kaliy ionini membrana orqali tashiydi (7.2-rasm).
Boshqa polipeptid bo'yicha yordam uchun gramitsidin A Natriy kationlarini tashish rele mexanizmi orqasida sodir bo'ladi. Ushbu polipeptid "naycha" ichiga o'ralgan bo'lib, uning ichki yuzasi kislorod o'z ichiga olgan guruhlar bilan qoplangan. Natijada, tashqariga chiqing
Natriy ionining hajmini ko'rsatadigan kichik kesma bilan hidrofilik kanalni uzoq vaqt kuting. Hidrofil kanalga bir tomondan kirgan natriy ionlari ion o'tkazuvchi kanal orqali o'rni bo'ylab bir-biridan ikkinchisiga kislotali guruhlarga o'tadi.
Shuningdek, polipeptidning siklik molekulasi kalit va qulf printsipiga ko'ra turli o'lchamdagi va geometriyadagi substratni olib tashlash mumkin bo'lgan darajada ichki molekulyar bo'shliqqa ega. Bunday ichki retseptorlarning bo'sh joyi faol markazlar (endoretseptorlar) bilan qoplangan. Metall ionining tabiatiga qarab, asosiy metallar bilan kovalent bo'lmagan o'zaro ta'sirlar (elektrostatik, suv bog'larining hosil bo'lishi, van der Vaals kuchlari) va asosiy metallar bilan kovalent o'zaro ta'sirlar sodir bo'lishi mumkin. Natijada, ular o'zlarini da'vo qilishadi supramolekulalar- molekulalararo kuchlar tomonidan bir vaqtning o'zida bo'ysunadigan ikki yoki undan ortiq zarralardan tashkil topgan murakkab assotsiatsiyalar.
Tirik tabiatda eng keng tarqalgan tetradentat makrotsikllari porfinlar va ularga yaqin bo'lgan korinoid tuzilishi orqasida joylashgan. Sxematik ravishda tetradentin siklini zamonaviy tarzda ifodalash mumkin (7.3-rasm), bu erda yoylar donor atomlarini azot bilan yopiq tsiklda bog'laydigan bir xil turdagi uglerod nayzalarini anglatadi; R 1, R 2, R 3, P 4 -karbongidrat radikallari; M n+ metall ioni: xlorofillda Mg 2+ ioni, gemoglobinda Fe 2+ ioni, gemosiyaninda Cu 2+ ioni, vitamin B 12 (kobalamin)da C 3+ ioni.
Azotga donor atomlari kvadratning chetlari bo'ylab taqsimlanadi (nuqta chiziq bilan ko'rsatilgan). Hidi kosmosda qattiq muvofiqlashtirilgan. Tom
porfirinlar va korinoidlar turli elementlarning kationlari va tuproq metallarining izlari bilan komplekslar hosil qiladi. To'g'ri, nima Ligandning tishlanishidan qat'i nazar, kimyoviy bog'lanishlar va kompleks donor atomlarga biriktiriladi. Shunday qilib, masalan, NH 3, etilendiamin va porfirinli ommaviy axborot vositalarining komplekslari kvadrat yoki shunga o'xshash elektron konfiguratsiyani ko'rsatadi. Ko'proq polidentat ligandlar metall ionlari bilan quyi monodentat ligandlarga qaraganda ancha kuchli bog'lanadi.

Kichik 7.3. Tetradentat makrosikl
bir xil donor atomlari bilan. Etilendiamin komplekslarining qiymati 8-10 daraja kattaroq, ammiak bilan bir xil metallarning qiymati esa pastroq.
Metall ionlarining oqsillar bilan bioanorganik komplekslari deyiladi bioklasterlar - makrosiklik birikmalar bilan metall ionlarining komplekslari (7.4-rasm).

Kichik 7.4. d-elementlar ionlari bilan turli o'lchamdagi oqsil komplekslarining bioklasterlari tuzilishining sxematik tasviri. Protein molekulalarining o'zaro ta'siri turlari. M n+ - faol markazga metall ioni
Bioklasterning o'rtasi bo'sh. Undan oldin bog'lovchi guruhlarning donor atomlari bilan o'zaro ta'sir qiluvchi metall keladi: OH - , SH - , COO - , -NH 2 , oqsillar, aminokislotalar. Eng ko'zga ko'ringan metallofer -
fermentlar (karbonat angidraz, ksantin oksidaza, sitoxromlar) va bioklasterlar, ularning bo'sh qismlari Zn, Mo, Fe ni o'z ichiga olgan ferment markazlarini yaratadi.
7.13. Boy yadro komplekslari
Geterovalent va geterovalent komplekslar
Bir yoki turli elementlarning bir qancha markaziy atomlarini o'z ichiga olgan komplekslar deyiladi Yadroga boy. Boy yadroli komplekslarni yaratish imkoniyati ma'lum ligandlarning ikki yoki uchta metall ionlari bilan bog'lanishi bilan belgilanadi. Bunday ligandlar deyiladi mahalliy Tushunarli mahalliy komplekslar deyiladi. Asosiy mumkin bo'lgan monoatomik saytlar, masalan:

Ular bir va bir xil atomga tegishli bo'linmagan elektron garovlar bo'yicha g'alaba qozonadilar. Mahalliylarning rolini o'zgartirish mumkin atomga boy ligandlar. Bunday joylarda turli atomlarga tegishli bo'lmagan elektron juftlari vikorizatsiya qilinadi. ko'p atomli ligand

A.A. Grinberg va F.M. Filen birikmalari mahalliy sharoitda o'rganildi, ularda ligandlar bir xil metallning murakkab birikmalarini bog'laydi, ammo oksidlanishning turli bosqichlarida. G. Taube ularni chaqirmoqda elektron uzatish komplekslari. Biz turli metallarning markaziy atomlari orasidagi elektron o'tish reaktsiyasini kuzatdik. Oksid-oksid reaktsiyalarining kinetikasi va mexanizmini tizimli o'rganish ikki kompleks o'rtasida elektron almashinuvi davom etishini aniqlashga olib keldi.
tozalangan afsonaviy joy orqali chiqish. 2+ dan 2+ gacha bo'lgan elektronlar almashinuvi oraliq kompleksni yaratish orqali sodir bo'ladi (7.5-rasm). Elektron o'tishi xlorid uchastkasi ligand orqali sodir bo'ladi, natijada komplekslar 2+ hosil bo'ladi; 2+.

Kichik 7.5. Elektronning oraliq boy yadro kompleksiga o'tishi
Ko'p yadroli komplekslarning xilma-xilligi bir qator donor guruhlarni almashtirish uchun organik ligandlarni tanlash orqali yo'q qilinadi. Bu eritmaning eritmasi liganddagi donor guruhlarning erishi bo'lib, bu xelyatsiya sikllarining yopilishiga yo'l qo'ymaydi. Agar ligand xelatsiya siklini yopish va bir vaqtning o'zida mahalliy sifatida harakat qilish qobiliyatiga ega bo'lsa, bunday emas.
Elektron uzatish printsipiga ko'ra, bir qator barqaror oksidlanish bosqichlarini ko'rsatadigan o'tish metallari mavjud. Bu titanga ionlar, elektronlarning ideal quvvat tashuvchilari kirib borishi va muhitini beradi. Ti va Fe ga asoslangan heteronuklear komplekslarni (HSC) va geteroyadroviy komplekslarni (HNC) yaratish variantlari to'plami rasmda keltirilgan. 7.6.
Reaktsiya

Reaktsiya (1) deyiladi o'zaro reaktsiya. Almashinuv reaksiyalarida geterovalent komplekslar oraliq moddalar bo'ladi. Nazariy jihatdan mumkin bo'lgan barcha komplekslarni turli xil fizik-kimyoviy tadqiqotlar tasdiqlaganidek, turli xil onglarda samarali tarzda o'rnatilishi mumkin.

Kichik 7.6. Ti va Fe o'rnini bosadigan geterovalent komplekslar va geterovalent komplekslarning hosil bo'lishi
usullari. Elektronlarning muvaffaqiyatli o'tkazilishi uchun ishtirok etadigan reagentlar yaqin mamlakatlarda joylashgan. Bu, ehtimol, Frank-Kondon printsipi deb ataladi. Elektron uzatish HVA oksidlanishining turli bosqichlarida bo'lgan bitta o'tish elementining atomlari yoki metall markazlarining tabiati o'zgarib turadigan HCA ning turli elementlari o'rtasida sodir bo'lishi mumkin. Tsi elektron uzatish komplekslari sifatida hisoblanishi mumkin. Ular biologik tizimlarda elektron va protonlarning kuchli tashuvchilari. Elektronni qo'shish va etkazib berish organik ombor majmuasining tuzilishini o'zgartirmasdan, metallning elektron konfiguratsiyasida o'zgarishlarga olib keladi. Bu elementlarning barchasi bir qator barqaror oksidlanish bosqichlaridan o'tadi (Ti +3 va +4; Fe +2 va +3; Cu +1 va +2). Bizning fikrimizcha, bu tizimlarga tabiatan minimal energiya sarfi bilan biokimyoviy jarayonlarning aylanishini ta'minlashda o'ziga xos rol berilgan. Teskari reaksiyalardan oldin termodinamik va termokimyoviy konstantalari 10 -3 dan 10 3 gacha bo'lgan va DG o i ning kichik qiymatlari bo'lgan reaktsiyalar mavjud. E o jarayonlar Bunday fikrlarda chiqishlar va reaktsiya mahsulotlari turli konsentratsiyalarda mavjud bo'lishi mumkin. Ularni ma'lum diapazonda o'zgartirganda, jarayon osonlikcha orqaga qaytarilishi mumkin, shuning uchun biologik tizimlarda ko'p jarayonlar kovalent (zo'ravon) xususiyatga ega bo'lishi mumkin. O'z omborlarida yashiringan oksidga asoslangan tizimlar keng potentsiallarni qamrab oladi, bu ularga o'zaro ta'sir qilish imkonini beradi, bu esa o'rtacha o'zgarishlar D bilan birga keladi. G oі E°, substratlarning boyligi bilan.
Potentsial mahalliy ligandlarni o'z ichiga olish istagi mavjud bo'lsa, HVA va HYAC ning bir xilligi sezilarli darajada oshadi. ikkita metall markazni bog'laydigan molekulalar yoki ionlar (aminokislotalar, gidroksi kislotalar, kompleksonlar va boshqalar). GVKda elektronni delokalizatsiya qilish imkoniyati kompleksning umumiy energiyasini pasayishiga olib keladi.
Metall markazlarning tabiati har xil bo'lgan HVA va HYAK ni tayyorlashning mumkin bo'lgan ko'proq variantlarini rasmda ko'rish mumkin. 7.6. GVK va HYAK ning yaratilishi va ularning biokimyoviy tizimlardagi rolining batafsil tavsifi O.M ishida ko'rib chiqilgan. Glebova (1997). Oksid-gidroksid juftlari tizimli ravishda birma-bir zaiflashadi, shuning uchun uzatish mumkin bo'ladi. Turli komponentlarni tanlab, siz aralashmani "chaynashingiz" mumkin, bu esa elektronni oksidlovchi vositadan oksidlovchiga o'tkazadi. Zarrachalarning to'g'ri harakati bilan elektronlarning orqa miya mexanizmi orqali o'tishi mumkin. "Yo'lak" sifatida siz oqsil lansetini va hokazolarni namlashingiz mumkin. 100A gacha bo'lgan kuchlanishga elektron uzatishning yuqori ishonchliligi. Butun koridor qo'shimchalar bilan to'ldirilishi mumkin (metall ionlari, fon elektrolitlari). Bu omborni boshqarish va GVK va GYAK organlarida katta imkoniyatlarni ochib beradi. Rossiyada hid elektronlar va protonlar bilan to'ldirilgan o'ziga xos "qora quti" rolini o'ynaydi. Mebelni chetga surib, ularni boshqa komponentlarga qo'shishingiz yoki "zahiralarni" to'ldirishingiz mumkin. Reaksiyalarning ularning qismlaridan qaytarilishi tsiklik jarayonlarda ko'p miqdorda ishtirok etish imkonini beradi. Elektronlar bir metall markazdan ikkinchisiga o'tadi, ular orasida tebranadi. Kompleks molekulasi assimetrik bo'lib, oksid hosil qilish jarayonlarida ishtirok etishi mumkin. GVK va HYAK biologik muhitda kologeniya jarayonlarida faol ishtirok etadi. Bunday reaksiyalar kollateral reaksiyalar deb ataladi. Hidi fermentativ kataliz, oqsil sintezi va biologik moddalar bilan birga kechadigan boshqa biokimyoviy jarayonlarda aniqlangan. Bunga hujayra metabolizmining davriy jarayonlari, yurak to'qimalarida, miya to'qimalarida va ekologik tizimlar darajasida sodir bo'ladigan jarayonlarda turli xil faoliyatlar kiradi. p align="justify"> Nutq almashishda muhim qadam suvni tirik nutqlardan ajratishdir. Atomlar ionlashtiruvchi holatga o'tadi va ularning elektronlarining kuchayishi nafas olish tizimiga kiradi va ularning energiyasini ATP yaratishga hissa qo'shadi. Biz aniqlaganimizdek, titanium komplekslari elektron va protonlarning faol tashuvchilari hisoblanadi. Titan ionlarining katalazalar, peroksidazalar va sitoxromlar kabi fermentlarning faol markazidagi roli ularning yuqori darajadagi murakkablashuvi, muvofiqlashtirilgan ion geometriyasining shakllanishi, boy yadroli HVAC va HVAClarning yaratilishi bilan ko'rsatiladi. turli xil saqlash va quvvat.pH funktsiyasi, o'tish elementi Ti konsentratsiyasi va organik saqlash kompleksi, sobiq ibodat munosabatlari haqida ma'lumot. Bu xususiyat kompleksning ortib borayotgan selektivligida namoyon bo'ladi
substratlarga, metabolik jarayonlarning mahsulotlariga nisbatan, faol markazning sterik kuchlariga muvofiq substratning shaklini qo'shimcha muvofiqlashtirish va o'zgartirish uchun kompleks (ferment) va substratdagi bog'lanishlarni faollashtirish.
Tanadagi elektrokimyoviy o'zgarishlar, elektronlarni uzatish bilan bog'liq, zarrachalarning oksidlanish bosqichining o'zgarishi va organizmning oksidlanish potentsialining o'zgarishi bilan birga keladi. Bu o'zgarishlarda GVK va GYAKga boy yadroviy komplekslar katta rol o'ynaydi. Ular erkin radikal jarayonlarning faol regulyatorlari, kislota, suv peroksidi, oksidlovchi moddalar, radikallarning faol shakllaridan foydalanish tizimi va oksidlangan substratlarda ishtirok etadilar, shuningdek, oksidlanishga qarshi gomeostazni saqlashda, tanani ID oksidlanishdan himoya qilishda ishtirok etadilar. stress. Ularning biotizimga fermentativ ta'siri fermentlarga (sitoxrom, superoksid dismutaza, katalaza, peroksidaza, glutationreduktaza, dehidrogenaza) o'xshaydi. Bularning barchasi o'tish elementi kompleksonatlarining yuqori antioksidant kuchi haqida gapiradi.
7.14. Darslar va imtihonlar oldidan o'z-o'zini tekshirish uchun ovqat va qabul
1. Murakkab masalalar haqida tushuncha. Yuqori sifatli tuzlar bilan solishtirganda ularning qiymati nimada va ularda nima yaxshiroq?
2. Ularning nomlari ostidagi kompleks birikmalarning formulalarini qo‘shing: ammoniy dihidroksotetrakloroplatinat (IV), triammintrinnitrokobalt (III), ularning xarakteristikalarini bering; ichki va tashqi muvofiqlashtirish sohasini ko'rsatish; markaziy ion va uning oksidlanish bosqichi: ligandlar, ularning kuchi va zichligi; obligatsiyalarning tabiati. Doimiy barqarorlik uchun suvli tuproq va virusdagi dissotsiatsiya darajasini yozing.
3. Murakkab reaksiyalarning yuksak quvvati, komplekslarning dissotsiatsiyasi, doimiyligi, komplekslarning kimyoviy kuchi.
4. Komplekslarning reaksiyasi termodinamik va kinetik holatdan qanday xarakterlanadi?
5. Qaysi amino komplekslarning ahamiyati kattaroq, tetraamino-mis (II) pastroq bo'ladi va qaysi biri kamroq ahamiyatga ega?
6. Metallar ionlari bilan yaratilgan makrosiklik komplekslarni qo'llashga yo'naltirish; d-elementlarning ionlari.
7. Komplekslarni qanday belgi bilan xelatga keltirish kerak? Murakkab xelatli va xelatsiz formulalardan foydalanishga e'tibor bering.
8. Asal glitsinatni qo'llashda ichki kompleks ta'siri haqida tushuncha bering. Natriy holidagi etilendiamintetraoktik kislota bilan magniy kompleksonatning tuzilish formulasini yozing.
9. Har qanday ko‘p yadroli kompleksning struktura bo‘lagini chizing.
10. Ko‘p yadroli, geteroyadroli va geterozarbali komplekslarning ma’nosini ayting. O'tish metallarining roli yaxshi tushuniladi. Ushbu komponentlarning biologik roli.
11. Kompleks birikmalarda qanday turdagi kimyoviy bog‘lanishlar hosil bo‘ladi?
12. Kompleksdagi markaziy atomda sodir bo'lishi mumkin bo'lgan atom orbitallarining gibridlanishining asosiy turlarini qayta ko'rib chiqing. Gibridlanish turiga qarab kompleksning geometriyasi qanday?
13. s-, p- va d-blok elementlari atomlarining elektron shaklidan kelib chiqib, kompleks hosil qilish bilan bog'liqligini va ularning komplekslar kimyosida tutgan o'rnini aniqlang.
14. Komplekslar va komplekslar qiymatlarini keltiring. Biologiya va tibbiyotdagi eng katta tadqiqotlarning ilovalarini toping. Xelat terapiyasi asos bo'lgan termodinamik tamoyillar bilan tanishtiring. Organizmdan ksenobiotiklarni zararsizlantirish va yo'q qilish uchun kompleksonatlarni to'xtatib turish.
15. Inson organizmida metall ligand gomeostazining buzilishining asosiy turlarini ko'rib chiqing.
16.Metal, kobalt va sinkni olib tashlash uchun bio-kompleks birikmalarining ko'tlarini sozlang.
17.Gemoglobin ishtiroki uchun raqobat jarayonlarini qo'llang.
18. Metall ionlarining fermentlardagi roli.
19. Nima uchun kobalt uchun burmali ligandli (polidentat) komplekslarda barqaror oksidlanish bosqichi +3, galoidlar, sulfatlar, nitratlar kabi elementar tuzlarda oksidlanish bosqichi +2 ga teng ekanligini tushuntiring?
20. Mis uchun xarakterli oksidlanish bosqichlari +1 va +2. Qanday qilib mis elektron o'tkazish reaktsiyalarini katalizlaydi?
21. Rux oksid reaksiyalarini qanday katalizlaydi?
22. Simobni olib tashlash mexanizmi qanday?
23. Reaksiyaga kislota va asos qo‘shing:
AgNO 3 + 2NH 3 = NO 3.
24. Nima uchun dorivor preparat sifatida OEDP emas, gidroksietiliden difosfonik kislotaning kaliy-natriy tuzi ishlatilishini tushuntiring.
25. Biokompleks bo'limlari omboriga kiradigan metall ionlari organizmdagi elektronlarni tashishga qanday ta'sir qiladi?
7.15. TESTLAR
1. Kompleks ion 2-dagi markaziy atomning oksidlanish bosqichi qimmatroq:
a) -4;
b) +2;
2 da;
d)+4.
2. Eng barqaror kompleks ion:
a) 2-, Kn = 8,5 x10 -15;
b) 2-, Kn = 1,5 x10 -30;
c) 2-, Kn = 4x10 -42;
d) 2-, Kn = 1x10 -21.
3. Eritmada 0,1 mol PtCl 4 4NH 3 mavjud. AgNO 3 bilan reaksiyaga kirishib, 0,2 mol AgCl cho'kmasini eritadi. Chiqish nutqiga muvofiqlashtirish formulasini bering:
a) Cl;
b) Cl 3;
c) Cl 2;
d) Cl 4.
4. Natijada yaratilgan komplekslar shakllanganligi sababli sp 3 d 2-gi- kelinlik?
1) tetraedr;
2) kvadrat;
4) trigonal bipiramida;
5) chiziqli.
5. Pentaammin xlorokobalt (III) sulfatini tayyorlash uchun formulani tanlang:
a) Na 3 ;
6) [CoCl 2 (NH 3) 4] Cl;
c) 2 gacha [C(SCN) 4];
d) SO 4;
e) [C(N 2 Pro) 6 ] C1 3 .
6. Qaysi ligandlar polidentatdir?
a) C1 -;
b) H 2 O;
c) etilendiamin;
d) NH 3;
e) SCN - .
7. Kompleks hosil qiluvchi moddalar:
a) atom-donor elektron juftlari;
v) elektron juftlarning atomit ion-akseptori;
d) atomit ionlari-elektron juftlarining donorlari.
8. Eng kichik kompleks yaratuvchi elementlar:
a)lar; c) d;
b) p; d) f
9. Ligandi - tse:
a) elektron juft donor molekulalar;
b) elektron juftlarning ion-akseptorlari;
v) elektron juftlarning molekulalari va ion-donorlari;
d) elektron juftlarning ion-akseptor molekulalari.
10. Kompleksning ichki muvofiqlashtirish sohasidagi aloqalar:
a) kovalent almashinuv;
b) kovalent donor-akseptor;
c) ion;
d) Vodneva.
11. Eng chiroyli kompleks quyidagilar bo'ladi:
Suvli birikmalardagi asosiy almashtirish reaksiyasi - suv molekulalarining almashinuvi (22) ko'p miqdordagi metall ionlari uchun o'rganilgan (34-rasm). Metall ionining koordinatsion sohasidagi suv molekulalarining manba bo'lgan suv molekulalarining asosiy qismi bilan almashinuvi ko'pchilik metallar uchun juda tez sodir bo'ladi va shuning uchun bunday reaktsiya tezligini asosiy gevşeme usuli bilan aniqlash mumkin edi. Usul shikastlangan suyuqlik tizimlariga, masalan, haroratning keskin o'zgarishiga taalluqlidir. Yangi aqllar (yuqori haroratlar) tufayli tizim endi o'zgartirilmaydi. Keyin darajani sozlashning suyuqligi yo'qoladi. Haroratni tortish orqali o'zgartirishingiz mumkin 10-8 sek, keyin siz reaktsiyaning suyuqligini nazorat qilishingiz mumkin, buning uchun bir soatdan ko'proq vaqt talab etiladi 10-8 sek.
Turli metall ionlaridagi muvofiqlashtirilgan suv molekulalarining SO 2- 4, S 2 O 3 2-, EDTA va boshqalar ligandlari bilan almashinish suyuqligini ham oʻlchash mumkin. (26). Bunday reaksiyaning suyuqligi
gidratlangan metall ionining kontsentratsiyasida yotadi va kirish ligand konsentratsiyasida yotmaydi, bu esa ushbu tizimlarning suyuqligini tavsiflash uchun birinchi darajali taqqoslash imkonini beradi (27). Ko‘p hollarda berilgan metall ioni uchun reaksiya tezligi (27) kirish ligandning (L) tabiatiga, na H 2 O molekulasiga, na SO 4 2- ioniga, S 2 O 3 2 ga bog‘liq emas. - yoki EDTA.
Ehtiyotkorlik tufayli, shuningdek, ushbu jarayonning tezligi kirish ligand kontsentratsiyasini o'z ichiga olmaydi, reaktsiyaning ko'p bosqichlari parchalanish mexanizmiga ko'ra davom etishiga ruxsat berish mumkin. reaksiya."Metal ioni va suv o'rtasidagi til. Chiqib ketish mumkinligi aniq, keyin tezda yaqin atrofdagi ligandlarni muvofiqlashtiradi.
Kafedrada Bobning 4 qismida ko'proq zaryadlangan gidratlangan metall ionlari, masalan, Al 3+ va Sc 3+, suv molekulalarini ko'proq almashtiradi, M 2+ va M + ionlarini kamaytiradi; Bu bizga butun jarayonning suyuqligini anglatuvchi ushbu bosqichda ligamentlarning parchalanishi muhim rol o'ynashini taxmin qilish imkonini beradi. Ushbu tadqiqotlarda aniqlangan topilmalar qoldiq emas, lekin ular gidratlangan metall ionlarini almashtirish reaktsiyalarida S N 1 jarayonlarining muhimligini ko'rsatadi.
Shubhasiz, eng faol kompleks birikmalar kobaltdir (III). Ularning barqarorligi, tayyorlash qulayligi va yuqori aniqlikdagi reaktsiyasi ularni kinetik etishtirish uchun ayniqsa mos qiladi. Ushbu komplekslar bo'yicha tadqiqotlarning bir qismi suv manbalarida, birinchi navbatda, ushbu komplekslarning manba - suv molekulalari bilan reaktsiyalarini ko'rib chiqdi. Ko(III) ioni bilan muvofiqlashtirilgan ammiak yoki aminlar molekulalari butunlay suv molekulalari bilan almashinishi aniqlandi, ya'ni aminlar emas, balki boshqa ligandlarning o'rnini bosish ko'rib chiqiladi.
(28) turdagi reaksiyaning suyuqligi aniqlandi va kobalt kompleksi birinchi tartibli ekanligi aniqlandi (X ko'p mumkin bo'lgan anionlardan biridir).
Shunday qilib, suv maydonlarida H 2 O konsentratsiyasi avvalgidek taxminan bir xil 55,5 M, suv molekulalarining konsentratsiyasini o'zgartirishning reaksiyaning suyuqligiga ta'sirini aniqlash mumkin emas. Suv ishlab chiqarish uchun suyuqlik darajasi (29) va (30) eksperimental ravishda aniqlanmaydi, chunki u oddiygina k" = k" ga ekvivalentdir. Biroq, reaksiya tezligi tufayli H 2 O bosqichda ishtirok etadimi yoki yo'qligini aytish mumkin emas, bu jarayonning tezligini anglatadi. Reaksiyani S N 2 mexanizmiga X ionini H 2 O molekulasi va H 2 O molekulasining keyingi qo'shilishidan dastlabki dissotsiatsiyani uzatuvchi S N 1 mexanizmi bilan almashtirish orqali ta'minlash kerak, lekin uni istisno qiling. boshqa eksperimental ma'lumotlarning yordami.
Bu vazifani ishlab chiqishga ikki turdagi tajribalar orqali erishish mumkin. Gidrolizning likvidligi (suv molekulasida bitta Cl-ionning almashinishi) trans- + Gidroliz 2+ dan taxminan 10 3 baravar ko'p suyuqlik. Kompleks zaryadining oshishi metall-ligand bog'larining kuchayishiga va shuning uchun bu bog'larning yorilishining galvanizatsiyasiga olib keladi. Bu shuningdek, kirish ligandlarining og'irligiga va almashtirish reaktsiyasining qulayligiga olib keladi. Kompleks zaryadining ko'payishi tufayli suyuqlikning o'zgarishi aniqlanganligi sababli, bu bosqichda yanada kuchli dissotsiativ jarayon sodir bo'ladi (S N 1).
Gidroliz bilan ishlangan bir qator o'xshash komplekslar uchun asosni isbotlashning yana bir usuli trans- +. Ushbu komplekslarda etilendiamin molekulasi o'xshash diaminlar bilan almashtiriladi, ularda uglerod atomlari va suv atomlari CH 3 guruhlari bilan almashtiriladi. Diamin o'rnini bosuvchi komplekslar pastki etilendiamin kompleksi bilan reaksiyaga kirishadi. Suv atomlarini CH 3 guruhlari bilan almashtirish ligandning yukini oshiradi, bu esa metall atomiga boshqa ligand bilan hujum qilishni qiyinlashtiradi. Bu sterik o'tishlar S N 2 mexanizmining reaksiyasini kuchaytiradi.Metal atomi yaqinida katta hajmli ligandlarning mavjudligi dissotsiatsiya jarayoniga yordam beradi, olib tashlangan ligandlardan birining bo'laklari ularning metall atomida to'planishini kamaytiradi lu. Katta hajmli ligandlarga ega komplekslarning gidrolizlanishining kuzatilgan o'sish suyuqligi reaktsiyaning S N 1 mexanizmi orqali borishining yaxshi dalilidir.
Shuningdek, Co(II) ning atsidoamin komplekslarini sonli tadqiq qilish natijasida kislota guruhlarining suv molekulalari bilan almashinishi tabiatan dissotsiativ jarayon ekanligi aniqlandi. Atomning kobalt bilan bog'lanishi - ligand ma'lum bir kritik qiymatga bog'lanadi, birinchi navbatda pastki suv molekulalari kompleksga kira boshlaydi. 2+ va undan yuqori zaryadga ega bo'lgan komplekslarda bog'ni uzish, kobalt ligandni yanada qiyinlashtiradi va suv molekulalarining kirishi muhim rol o'ynay boshlaydi.
Aniqlanishicha, kobalt(III) kompleksidagi kislota guruhining (X -) boshqa guruhga almashtirilishi, quyi molekula H 2 O, (31) almashtirilgan molekula orqali o‘tadi.
chakana sotuvchi - yangi Y guruhiga zudlik bilan almashtiriladigan etakchi (32).
Shunday qilib, kobalt (III) komplekslari bilan ko'p reaktsiyalarda reaktsiya tezligi (31) gidroliz tezligidan (28) yuqori bo'ladi. Bundan tashqari, gidroksil ioni Co(III) aminlar bilan reaksiyaga kirishganda boshqa reagentlar tomonidan buziladi. Sharob amin komplekslari bilan kobalt (III) ga juda tez reaksiyaga kirishadi (taxminan 10 6 marta tezroq, suv kamroq) reaksiya turiga qarab. asosiy gidroliz (33).
Bu reaksiya OH - (34) ligandning almashinishi hisobiga birinchi tartibli ekanligi aniqlandi. Reaksiyaning mutlaqo boshqacha tartibi va reaksiya tezligi OH ioni Co(III) komplekslarga nisbatan samarali nukleofil reagent bo‘lib, reaksiya S N 2 mexanizmi bo‘yicha eritma perineal birikma orqali boradi, deb taxmin qilish imkonini beradi.
Biroq, OH ning kuchini boshqa mexanizm bilan izohlash mumkin [munosabat (35), (36)]. Reaksiyada (35) kompleks 2+ o'zini kislota kabi tutadi (Brønsteddan keyin), kompleks + beradi, ya'ni ê amido-(qasos)-yarim asos, 2+ kislotali.
Keyin reaksiya S N 1 mexanizmi (36) bo'yicha besh koordinatali vositachining yaratilishi bilan davom etadi, so'ngra reaktsiyaning yakuniy mahsulotiga (37) olib keladigan boshlang'ich molekulalari bilan reaksiyaga kirishadi. Bu reaksiya mexanizmi boshqa tartibdagi reaksiyaning suyuqligi bilan mos keladi va S N 1 mexanizmiga o'xshaydi.Oquvchanlikni hosil qiluvchi bosqichdagi reaksiya bo'laklariga kob kompleksi bilan bog'langan asos kiradi om - kislota, keyin bu mexanizm. S N 1SV belgisi berilgan.
Shu sababli, ushbu mexanizmlardan qaysi biri eksperimental ehtiyot choralarini yaxshiroq tushuntiradi, bundan ham muhimroqdir. Biroq, 1CB gipotezasini tasdiqlovchi qo'shimcha dalillar mavjud. Bu mexanizm mexanizmining eng yaxshi argumentlari quyidagilardir: oktaedral Co(III) komplekslari S N 1 dissotsiativ mexanizmi orqali reaksiyaga kirisha boshlaydi va S N 2 jarayoni uchun OH ioni nima uchun javobgar ekanligi haqida umumiy dalillar mavjud emas. Gidroksil ioni Pt(II) dan reaksiyalarda kuchsiz nukleofil reagent ekanligi aniqlandi va bu Co(III) ga sababsiz reaksiyaga oʻxshaydi. Suvsiz muhitda kobalt (III) reaktsiyalari bilan reaktsiyalar S N 1 SV mexanizmi orqali uzatiladigan besh koordinatali oraliq birikmalar hosil bo'lishining ajoyib dalilidir.
Qolgan dalil shundan iboratki, Co(III) kompleksida N - H bog'lari borligi sababli u OH - ionlari bilan to'liq reaksiyaga kirishadi. Bu, albatta, reaktsiya tezligi uchun kompleksning kislota-asos kuchi VIN ning nukleofil kuchi uchun muhimligini muhim qiladi." Boshqa mumkin bo'lgan mexanizmni o'chirish uchun siz nozik tajriba o'tkazishingiz kerak.
Hozirgi vaqtda ko'p sonli oktaedral yarim sharlarning almashtirish reaktsiyasi kuzatilgan. Ularning reaktsiya mexanizmlari tekshirilishi bilanoq, dissotsiatsiya jarayoni ko'pincha kuchayadi. Bu natija munozarali emas, chunki oltita ligand boshqa guruhlarni qo'shish uchun markaziy atom yaqinida kam joy qoldiradi. Agar yettita muvofiqlashtiruvchi intervension birikma aniqlangan yoki ishlatiladigan ligand kiritilgan bo'lsa, faqat bir nechta ilovalar ko'rinadi. Shuning uchun S N 2 mexanizmini oktaedral komplekslarda o'rinbosarlik reaktsiyasi natijasida to'liq qaytarib bo'lmaydi.
Komplekslarning aqliy kimyoviy reaktsiyalariga almashinuv, oksidlanish, izomerlanish va koordinatali ligandlar kiradi.
Komplekslarning ichki va tashqi sferalarga birlamchi dissotsiatsiyasi tashqi ionlar almashinuvi reaktsiyasining ustunligini anglatadi:
Xm+mNaY = Ym+mNaX.
Komplekslarning ichki sohasi komponentlari ligandlar va kompleks hosil qiluvchi moddalar ishtirokidagi metabolik jarayonlarda ishtirok etishi mumkin. Ligandlar yoki markaziy metall ionini almashtirish reaktsiyasini tavsiflash uchun K. Ingold tomonidan ishlab chiqilgan terminologiya organik birikmalar reaktsiyalari (42-rasm), nukleofil. S N va elektrofil SE almashtirish:
Z + Y = z + X S N
Z + M" = z + M S E.
Almashtirish reaksiyasining mexanizmi (43-rasm) assotsiativ ( S N 1 va S E 1 ) va dissotsiativ ( S N 2 va S E 2 ), koordinatsiya sonining ko'payishi va kamayishi bilan o'tish bosqichidan ta'sirlangan.
Reaktsiya mexanizmini assotsiativ yoki dissotsiativga oshirish, koordinatsion sonning o'zgarishi yoki ortishi bilan oraliq identifikatsiyaga eksperimental ravishda erishish orqali muhimdir. Shu munosabat bilan reaktsiya mexanizmi ko'pincha reaktsiyaning suyuqligi bo'yicha reagentlar konsentratsiyasining oshishi, reaktsiya mahsulotining geometrik shaklining o'zgarishi va boshqalar to'g'risidagi bilvosita ma'lumotlar asosida baholanadi.
Komplekslardagi ligandlarni almashtirish reaktsiyasining ravonligini tavsiflash uchun 1983 yilda tug'ilgan Nobel mukofoti laureati. R. Taube (44-rasm) ligandlarning almashtirish reaktsiyasi 1 daqiqadan kam bo'lsa, "labil" va "inert" atamalarini diqqat bilan aniqladi. Labil yoki inert atamalari ligandlarni almashtirish reaksiyasining kinetikasiga xosdir va ularni komplekslarning barqarorligi yoki beqarorligining termodinamik xususiyatlari bilan aralashtirib yubormaslik kerak.
Komplekslarning labilligi va inertligi kompleks hosil qiluvchi ion va ligandlarning tabiatiga bog'liq. Ligand maydoni nazariyasiga o'xshash:
1. Oktaedral komplekslar 3 d valentlik taqsimotiga ega o'tish metallari ( n -1) d sigma uchun elektronlar*(masalan ) MO laboratoriyasini tozalang.
4- (t 2g 6 e g 1) + H 2 O= 3- + CN -.
Bundan tashqari, kristalli maydon tomonidan kompleksni barqarorlashtirish energiyasining qiymati qanchalik kichik bo'lsa, uning labilligi katta bo'ladi.
2. Oktaedral komplekslar 3 d kuchli sigma bilan o'tish metallari* Momiq bilan, masalan orbitallar va valentlikning teng taqsimlanishi ( n -1) d elektronlar t 2 g orbital (t 2 g 3, t 2 g 6) inert.
[Co III (CN) 6] 3- (t 2 g 6 e g 0 ) + H 2 O =
[Cr III (CN) 6] 3- (t 2 g 3 e g 0) + H 2 O =
3. Tekis-kvadrat va oktaedral 4 d va 5 d elektronlarni sigmaga o'tkazmaydigan o'tish metallari* MO inertligini oshiring.
2+ + H 2 O =
2+ + H 2 O =
Ligandlar tabiatining "ligandlarning o'zaro infuzioni" modeli doirasida ligandlarni almashtirish reaktsiyasi tezligiga infuzioni. 1926 yilda tuzilgan ligandlarning o'zaro oqimi modelini umumlashtiramiz. I.I. Trans-oqimning Chernyaevym tushunchasi (45-rasm) - "Kompleksdagi ligandning labilligi trans-spread ligandning tabiatiga bog'liq" - va bir qator trans-tarqalgan ligandlarni hosil qiladi: CO, CN -, C 2 H 4 > PR 3, H - > CH 3 -, SC (NH 2) 2 > C 6 H 5 -, NO 2 -, I -, SCN - > Br -, Cl - > py , NH 3, OH -, H 2 O.
Trans-flow tushunchasi bizga empirik qoidalarni o'rnatishga imkon berdi:
1. Peyroni qoidasi- tetraxlorplatinatda ammiak yoki aminlar mavjud bo'lganda ( II ) kaliy birinchi bo'lib dichlorodiaminplatinum cis-konfiguratsiyasi chiqadi:
2 - + 2NH 3 = cis - + 2Cl -.
Reaksiya ikki bosqichda davom etadi va xlorid ligand katta trans-oqim hosil qiladi, keyin boshqa xlorid ligandni ammiak bilan almashtirish natijasida cis-[ hosil bo'ladi. Pt (NH 3 ) 2 Cl 2 ]:
2 - + NH 3 = -
NH 3 = cis -.
2. Jergensen qoidasi - diklorhidron kislota platina tetramin xlorid bilan reaksiyaga kirishganda ( II ) yoki shunga o'xshash natijalarni dichloro-ammineplatinum trans-konfiguratsiyasidan olish mumkin:
[Pt(NH 3 ) 4 ] 2+ + 2 HCl = trans-[Pt (NH 3 ) 2 Cl 2 ] + 2 NH 4 Cl.
Boshqa ammiak molekulasini xlorid ligand bilan almashtirib, ligandlarning bir qator trans-infuziyasini kiritish mumkin. Pt (NH 3 ) 2 Cl 2].
3. Kurnakovning tiokarbamid reaktsiyasi - tiomonning trans-[ geometrik izomerlari bilan reaksiyasining turli mahsulotlari Pt (NH 3 ) 2 Cl 2 ] va cis-[ Pt (NH 3 ) 2 Cl 2 ]:
cis - + 4Tio = 2 + + 2Cl - + 2NH 3.
Tiokarbamidning yuqori trans-oqimi bilan bog'lanish reaktsiyasi mahsulotlarining har xil tabiati. Reaksiyaning birinchi bosqichi tiokarbamid xlorid ligandlarini trans-sis-[ bilan almashtirishdan iborat. Pt (NH 3 ) 2 (Tio ) 2 ] 2+ :
trans-[Pt (NH 3) 2 Cl 2 ] + 2 Tio = trans-[ Pt (NH 3) 2 (Tio) 2 ] 2+
cis - + 2Thio = cis - 2+.
In cis-[Pt (NH 3 ) 2 (Tio ) 2 ] 2+ ammiakning ikkita molekulasi tiokarbamid keyingi oʻrin almashguncha trans holatida boʻladi, bu esa ich qotishiga olib keladi. 2+ :
cis - 2+ + 2Thio = 2+ + 2NH 3 .
Trans-[Pt (NH 3 ) 2 (Tio ) 2 ] 2+ kichik trans-infuzionli ammiakning ikkita molekulasi trans holatiga birdan birga ko'chiriladi va shuning uchun tiokarbamid bilan almashtirilmaydi.
Trans-oqim naqshlarini I.I. Kvadrat tekislikli platina komplekslarida ligandlarni almashtirish reaksiyasini qoralaymiz ( II ). Bundan tashqari, ligandlarning trans-infuziyasi boshqa metallar komplekslarida ham sodir bo'lishi ko'rsatildi ( Pt(IV), Pd(II), Co(III), Cr(III), Rh(III), Ir(III) )) va boshqa geometrik shakllar. To'g'ri, turli metallar uchun trans-parchalanuvchi ligandlar qatori juda xilma-xildir.
Iz trans-in'ektsiya ekanligini ko'rsatadi kinetik ta'sir- bu ligandning trans-infuzioni qanchalik ko'p bo'lsa, ilgari trans-pozitsiyada bo'lgan boshqa ligandni almashtirishda suyuqlik shunchalik katta bo'ladi.
Kinetik ta'sir trans-influx bilan buyurtma, o'rtada XX stolíttya A.A. Grinberg va Yu.M. Kukushkin trans-influent ligandning saqlanishini aniqladi L oldin cis holatda bo'lgan ligandga L . Shunday qilib, almashtirish reaktsiyasining suyuqligini tekshirish Cl- platina komplekslaridagi ammiak ( II):
[PtCl 4 ] 2- + NH 3 = [ PtNH 3 Cl 3 ] - + Cl - K = 0,42. 10 4 l/mol. h
[PtNH 3 Cl 3 ] - + NH 3 = cis-[Pt (NH 3 ) 2 Cl 2 ] + Cl - K = 1.14. 10 4 l/mol. h
trans-[ Pt (NH 3 ) 2 Cl 2 ] + NH 3 = [ Pt (NH 3 ) 3 Cl ] + + Cl - K = 2.90. 10 4 l/mol. h
almashinadigan xlorid ligandga sis-joylashgan ammiakning bir yoki ikkita molekulasining mavjudligi reaksiya suyuqligining izchil oshishiga olib kelishini ko'rsatdi. Bu kinetik effekt deb nomlangan cis oqimi. Bu vaqtda yuridik tushunchada ligandlar tabiatini quyishning ligandlar almashinish reaksiyasining suyuqlikka (trans- va sis-infuziyalar) kinetik ta'siri tushuniladi. ligandlarning o'zaro oqimi.
Nazariy jihatdan ligandlarning oʻzaro kelishi taʼsiri kompleks birikmalarda kimyoviy bogʻlanish hodisasining rivojlanishi bilan chambarchas bogʻliq. 30-yillarda Rok XX stolíttya A.A. Grinberg va B.V. Nekrasovim polarizatsiya modeli doirasida trans-oqimga qaraydi:
1. Metallning markaziy ioni yuqori polarizatsiyaga ega bo'lgan komplekslarning trans-infuzion xarakteristikasi.
2. Ligandlarning trans faolligi ligand va metall ionining o'zaro qutblanishning energiya qiymati bilan belgilanadi. Berilgan metall ioni uchun ligandning transin'ektsiyasi uning qutblanishi va markaziy iondan joylashishi bilan aniqlanadi.
Polarizatsiya modeli oddiy anionli ligandlar, masalan, galoid ionlari bo'lgan komplekslar uchun eksperimental ma'lumotlarga mos keladi.
1943 yilda tug'ilgan A.A. Greenberg ligandlarning transaktivligi ularning yakuniy vakolatlari bilan bog'liq deb taxmin qildi. Elektron zichligini trans-aktiv liganddan metallga o'tkazish ionning metallga samarali zaryadini o'zgartiradi, natijada transaktiv ligand bilan kimyoviy bog'lanish zaiflashadi.
Trans-infuziya hodisasining rivojlanishi etilenga o'xshash to'yinmagan organik molekulalarga asoslangan ligandlarning katta transaktivligi bilan bog'liq. Pt(C2H4)Cl3 ] -. Chatta va Orgela fikrida (46-rasm), bu bilan bog'liqpi-bunday ligandlarning metall bilan dativ o'zaro ta'siri va trans-aylanuvchi ligandlarning o'rnini bosish reaktsiyasining assotsiativ mexanizmi. Hujum qiluvchi ligandning metall ioniga muvofiqlashtirish Z ketadigan ligandning keyingi qo'shilishi bilan besh koordinatali trigonal-bipiramidal oraliq hosil bo'lishiga olib keladi, X. Bunday oraliqning yaratilishi mos keladi.pi-dativ ligand-metall ligand o'zaro ta'siri Y , bu metallning elektron zichligini o'zgartiradi va ligand X ni keyingi suyuqlik bilan almashtirish bilan o'tish holatining faollashuv energiyasini kamaytiradi.
Buyurtma 3 p qabul qiluvchilar (C 2 H 4, CN - , CO ...) dativ ligand-metall kimyoviy bog'lanish hosil qiluvchi ligandlar, yuqori trans-oqim vasdonor ligandlar: H - , CH 3 - , C 2 H 5 - ... Bunday ligandlarning trans-infuziyasi X ligand va metall o'rtasidagi donor-akseptor o'zaro ta'siridan dalolat beradi, bu uning elektron zichligini kamaytiradi va mavjud bo'lgan metall va ligand o'rtasidagi bog'lanishlarni zaiflashtiradi. Y.
Shunday qilib, bir qator transaktivlikdagi ligandlarning holati kuchli sigma bilan ko'rsatiladi. donorlar pi-ligandlar organlari - sigma- donor pi-ligandning qabul qiluvchi kuchi uning trans oqimini majbur qiladi, shuning uchunpi-donor - zaiflash. Ushbu ligand-metall o'zaro ta'sirlarning qaysi biri trans oqimida reaksiyaning o'tish holatining elektron bosqichining kvant-kimyoviy ishlanmalari asosida hukm qilish uchun muhimdir.