CARBON, C (a. carbon; n. Kohlenstoff; f. carbone; i. carbono), - element chimic din grupa IV a sistemului periodic Mendelev, număr atomic 6, greutate atomică 12,041. Cărbunele natural este compus dintr-un amestec de 2 izotopi stabili: 12 C (98,892%) și 13 C (1,108%). Există, de asemenea, 6 izotopi radioactivi ai carbonului, dintre care cel mai important este izotopul 14, cu o perioadă de declin rapid de 5.73.10 3 roci (acest izotop în cantități mici se stabilește treptat în bilele superioare ale atmosferei ca urmare a nucleele de 14 N fiind perturbate de neutroni cosmici).
Vuglets este cunoscut de mult timp în urmă. Lemnul a fost folosit pentru reînnoirea metalelor din minereuri, iar diamantul a fost folosit pentru a reînnoi metalele din minereuri. Recunoașterea carbonului ca element chimic este asociată cu numele chimistului francez A. Lavoisier (1789).
Modificări și puterea cărbunelui
Există 4 modificări cristaline ale carbonului: grafit, diamant, carabină și lonsdaleit, care diferă puternic în puterea lor. Carbin este o bucată de diferite tipuri de carbon, care este o pulbere microcristalină de culoare neagră, a cărei structură cristalină se caracterizează prin prezența atomilor de carbon în formă de lance lungi, amestecați în paralel unul cu altul. Grosime 3230-3300 kg/m 3 capacitate termică 11,52 J/mol.K. Manifestări lonsdaleite în meteoriți și îndepărtari în bucăți; Structura și puterea sa fizică nu sunt încă stabilite. Pentru cărbune, acesta se caracterizează și printr-o structură cu o structură dezordonată - așa-numita. vugilla amorfă (funingine, coca, sat vugilla). Puterea fizică a cărbunelui „amorf” depinde în mare măsură de dispersia particulelor și de evidenta caselor.
Puterea chimică a cărbunelui
În semi-carbonii, etapa de oxidare este +4 (cea mai largă), +2 și +3. Pentru mințile cele mai avansate, cărbunele este inert din punct de vedere chimic; la temperaturi ridicate, este bogat în elemente care prezintă proprietăți puternice de hidratare. Activitatea chimică a carbonului variază în seria carbonului „amorf”, grafit, diamant; Membrul Tsich RICHNOVID VEGLEVA este reciproc la o temperatură de 300-500 ° C, 600-700 ° K 850-1000 ° Knneshni Dixis (CO 2) I Monoxida (CO) Vugveley. Dioxidul se dizolvă în apă cu o soluție de acid carbonic. Toate formele de carbon sunt rezistente la pajiști și acizi. Carbonul practic nu interacționează cu halogenii (cu excepția grafitului, care F 2 reacționează peste 900°C), așa că halogenii trebuie îndepărtați indirect. În mijlocul compușilor care conțin azot, apa cu cianură HCN (acidul cianhidric) și numeroșii săi derivați sunt de mare importanță practică. La temperaturi peste 1000 ° C, carbonul interacționează cu o varietate de metale care calmează carburile. Toate formele de carbon sunt inseparabile atât de sursele anorganice, cât și de cele organice.
Cea mai importantă putere a carbonului este capacitatea atomilor săi de a forma legături chimice importante între ei, precum și între ei și alte elemente. Capacitatea carbonului de a forma 4 legături de valență egale cu alți atomi de carbon permite formarea de schelete de carbon de diferite tipuri (liniare, nealiniate, ciclice); Aceste autorități explică însele rolul cărbunelui în existența tuturor organismelor organice și, într-adevăr, a tuturor organismelor vii.
Vuglets în natură
Cantitatea medie de carbon din scoarța terestră este de 2,3,10% (în masă); În acest caz, masa principală de carbon este concentrată în rocile sedimentare Girsky (1%), în timp ce în alte roci Girsky există concentrații mai mici și aproximativ aceleași (1-3,10%) ale acestui element. Vugolul se acumulează în partea superioară, unde prezența sa este asociată în principal cu lemnul viu (18%), lemnul (50%), vugills de piatră (80%), nafta (85%), antracitul (96%) și, de asemenea, cu dolomite. și vapnyaks. Există peste 100 de minerale în carbon, cu cea mai mare creștere în carbonat de calciu, magneziu și minerale (calcit CaCO3, dolomit (Ca, Mg)CO3 și siderit FeCO3). Acumularea carbonului în scoarța terestră este adesea asociată cu acumularea altor elemente care sunt absorbite de materia organică și apă, care se depun după îngropare pe fund, sub formă de semiforme nesemnificative. Cantități mari de dioxid de CO 2 sunt eliberate în atmosferă de pe Pământ în timpul activității vulcanice și în timpul arderii incendiilor organice. În atmosferă, CO 2 este absorbit de plante în timpul procesului de fotosinteză și este eliberat în apa de mare, formând cele mai importante canale ale ciclului carbonului Pământului. Cărbunele joacă un rol important în spațiu; Pe Soare, cărbunele ocupă locul 4 în ceea ce privește abundența după apă, heliu și acru, participând la procesele nucleare.
Zastosuvannya și vikoristannya
Cea mai importantă semnificație național-suverană constă în faptul că aproximativ 90% din toate sursele primare de energie generate de oameni provin din focul organic. Există o tendință de a folosi nafta ca combustibil pentru o varietate de industrii chimice. Rolul cel mai puțin important în stăpânirea poporului îl joacă cărbunele, un tip de carbonați (metalurgie, viața de zi cu zi, producția chimică), diamantele (bijuterii, tehnologie) și grafitul (tehnologia nucleară, creuzetele Omitsny de căldură, măsline, tipuri de uleiuri etc. . ). Activitatea izotopului 14 C în depozitele biogene este determinată de vârsta acestora (metoda de datare cu radiocarbon). 14 C este considerat pe scară largă ca un indicator radioactiv. Cel mai important este cel mai larg izotop 12 C - o a douăsprezecea parte din masa unui atom al acestui izotop este luată ca o masă atomică a elementelor chimice.
Wugilla
Z (Carboneum), Element chimic nemetalic din subgrupa IVA (C, Si, Ge, Sn, Pb) a sistemului periodic de elemente. Se găsește în natură sub formă de cristale precum diamantul (Fig. 1), grafit sau fullerenă și alte forme și este inclusă în depozitul de substanțe organice (lână, naftă, organisme animale și plante etc.) și anorganice (vapnyak). , sifon, etc. In.). Cărbunele este larg lărgit, dar în loc de el în scoarța terestră există doar 0,19% (div. și DIAMOND; FULEREN).
Vuglets este larg admirat pentru apariția unor discursuri simple. Pe lângă diamantele scumpe, care fac obiectul bijuteriilor, diamantele industriale au o importanță deosebită pentru producția de scule de șlefuit și tăiere. Satul cărbunelui și alte forme amorfe de cărbune sunt vindecate pentru depozitarea, purificarea, adsorbția gazelor în domeniile tehnologiei, unde se folosesc adsorbanții necesari de pe o suprafață decontaminată. Carburele, semi-carbon cu metale, precum și cu bor și siliciu (de exemplu, Al4C3, SiC, B4C) sunt tăiate cu duritate mare și vicorizate pentru a produce scule abrazive și tăietoare. Vuglets intră în depozitul de oțeluri și aliaje în uzina elementară și sub formă de carburi. Saturarea suprafeței bilelor de oțel cu carbon la temperaturi ridicate (cimentare) crește semnificativ duritatea suprafeței și rezistența la uzură.
de asemenea ALIE. În natură nu există forme diferite de grafit; faptele au fost tăiate bucată cu bucată; - forme amorfe (de exemplu, cocaina in satul Vugilla). Funinginea, pietrele vugille, negru de lampă, negru de acetilenă sunt create prin vărsarea carbohidraților atunci când acidul este pierdut. Astfel, cărbunele alb este produs prin sublimarea grafitului polilitic sub presiune redusă - prin limpezirea cristalină fină a foilor de grafit cu margini ascuțite.
Fundal istoric. Grafitul, diamantul și carbonul amorf provin din cele mai vechi timpuri. Se știe de mult timp că grafitul poate fi folosit pentru a marca alte materiale, iar numele „grafit” în sine este similar cu cuvântul grecesc care înseamnă „a scrie”, inventat de A. Werner în 1789. Istoria grafitului este confuză, este adesea confundată cu cuvinte care duc la puteri fizice externe similare, de exemplu, molibdenitul (sulfura de molibden), care este folosit de grafit timp de o oră. Printre alte denumiri, grafitul este cunoscut sub numele de „plumb negru”, „plumb de carbură”, „plumb argintiu”. În 1779, K. Scheele a stabilit că grafitul poate fi oxidat în prezența dioxidului de carbon. Diamantele au fost găsite pentru prima dată înghețate în India, iar în Brazilia, pietrele valoroase au devenit de valoare comercială în 1725; strămoșii din Pivdennya Africa a fost deschis în 1867. În secolul al XX-lea. Principalii producători de diamante sunt PAR, Zaira, Botswana, Namibia, Angola, Sierra Leone, Tanzania și Rusia. Diamantele bucăți, o tehnologie creată în anii 1970, sunt produse în scopuri industriale.
Alotropie. Deoarece unitățile structurale ale unui discurs (atomi pentru elemente monoatomice sau molecule pentru elemente poliatomice și elemente semi-atomice) se combină între ele în mai multe forme cristaline, care se numește alotropie. Carbonul are trei modificări alotropice - diamant, grafit și fullerene. În diamant, atomul de carbon conține 4 unități dispuse tetraedric, formând o structură cubică (Fig. 1, a). Această structură sugerează covalența maximă a legăturii și toți cei 4 electroni ai atomului de carbon din piele creează legături C-C de mare valoare. Structura are conductivitate electronică zilnică. Prin urmare, diamantul este tăiat datorită conductivității sale scăzute, conductibilității termice scăzute, durității ridicate; Aceasta este cea mai solidă dintre toate substanțele cunoscute (Fig. 2). Pentru a rupe legătura C-C (rezistența legăturii este de 1,54, raza covalentă este de 1,54/2 = 0,77) într-o structură tetraedrică necesită multă energie, astfel încât diamantul, cu duritate vinyatkovaya, se caracterizează prin temperaturi ridicate de topire (3550 °C). ).

O altă formă alotropică de carbon este grafitul, care este foarte susceptibil la formarea diamantelor. Grafitul este o substanță moale de culoare neagră, formată din cristale, ușor de bile și care are o conductivitate electrică ridicată (rezistență electrică 0,0014 Ohm*cm). Prin urmare, grafitul se întărește în lămpile cu arc și cuptoarele (Fig. 3), care necesită temperaturi ridicate. Grafitul de înaltă puritate este utilizat în reactoarele nucleare ca distribuitor de neutroni. Temperatura sa de topire atunci când menghina este mutată este de 3527° C. Când presiunea este presată, grafitul se sublimează (tranziția de la solid la gaz) la 3780° C.

Structura grafitului (Fig. 1, b) este un sistem de inele hexagonale condensate cu o legătură lungă de 1,42 (mult mai scurtă, mai mică în diamant) și în care atomul de carbon conține trei (și nu doar ca în diamant) covalente. legături Există trei legături, iar a patra legătură (3,4) este suficient de lungă pentru o legătură covalentă și se leagă slab paralel cu plasarea bilelor de grafit între ele. Chiar al patrulea electron al carbonului înseamnă căldura și conductivitatea electrică a grafitului - această legătură mai lungă și mai mică formează o compactitate mai mică a grafitului, care se reflectă în duritatea inferioară a suprafeței sale.Diamant (duritatea grafitului 2,26 g/cm3, diamant - 3,51 g/cm3). Din același motiv, grafitul este lipicios pe punct și întărește ușor bucățile de rășină care sunt folosite pentru a face creioane cu unt și măsline. Strălucirea plumbului se explică prin prezența grafitului. Fibrele de carbon sunt de mare valoare și pot fi răsucite pentru a produce cusături pe piese sau alte fire cu conținut ridicat de carbon. La temperaturi ridicate și în prezența unui catalizator, de exemplu, grafitul se poate transforma în diamant. Acesta este procesul de implementare pentru achiziția comercială a bucăților de diamante. Pe suprafața catalizatorului au început să crească cristale de diamant. Diamantele de grafit brut se formează la 15.000 atm și 300 K sau la 4.000 atm și 1.500 K. Diamantele bucăți pot fi extrase din carbohidrați. La formele amorfe de carbon, care nu formează cristale, acestea sunt aduse în satul cărbunelui, căruia îi rezistă încălzirea lemnului fără acces la vânt, lampă și funingine de gaz, care este creată prin sterilizarea la temperatură scăzută a carbohidraților în absență. de aer și se condensează pe o suprafață rece, vugilla periată - casă la fosfat de calciu în procesele textile, și producția de vugill de piatră (râu natural cu case) și de cocs, surplus uscat, obținut la arderea cocsării prin distilarea uscată a vugill de piatră și nafta. reziduuri (vugill bituminos), apoi bto. încălzire fără acces la aer. Cocsul este stagnat pentru topirea chavunului, în metalurgia feroasă și colorată. În timpul cocsării se creează și produse asemănătoare gazelor - gaz de cocs (H2, CH4, CO etc.) și produse chimice precum orfanele pentru îndepărtarea benzinei, produse farmaceutice, aditivi, produse farmaceutice, materiale plastice etc. Diagrama principalului aparat de producere a cocsului - cuptorul de cocs - este prezentată în Fig. 3. Diverse tipuri de cărbune și funingine sunt dezintegrate la suprafață și, prin urmare, sunt utilizate ca adsorbanți pentru purificarea gazelor, precum și catalizatori. Pentru a produce diferite forme de carbon, se folosesc metode speciale de tehnologie chimică. Grafitul bucată este extras din antracitul prăjit sau cocs nafta între electrozi de carbon la 2260° C (procesul Acheson) și vicorizat în producerea de uleiuri și electrozi, o cremă pentru îndepărtarea electrolitică a metalelor.
Budova atom vugletsiu. Nucleul NUBILSH ISOTOPu Vugveley Masoyu 12 (cusut 98,9%) 6 mai Protoniv і 6 neutroni (12 nuclloniv), troma roshtashovani pe sferturi, Kozhzhen 2 proton I doi neutroni analog gel nuclear. Celălalt izotop stabil al carbonului este 13C (aproximativ 1,1%), iar în urme izotopul instabil 14C se găsește în natură cu o perioadă de declin rapid de 5730 de ani, ceea ce poate duce la o proeminență b. În ciclul normal al carbonului al materiei vii, toți cei trei izotopi sub formă de CO2 iau parte. După moartea unui organism viu, carbonul este absorbit și este posibil să datați obiectele C pentru a înlocui nivelul de moarte al radioactivității 14C. Scăderea promovării b a 14CO2 este proporțională cu ora după moarte. În 1960, W. Libby a primit Premiul Nobel pentru cercetările sale asupra carbonului radioactiv.
DATAT DE RADIOACTIVITATE. Practic, 6 electroni în carbon creează o configurație electronică de 1s22s22px12py12pz0. Mai mulți electroni de alt nivel sunt valență, ceea ce indică poziția carbonului în grupa IVA a tabelului periodic (diviziunea. SISTEMUL PERIODIC DE ELEMENTE). Fragmentele pentru îndepărtarea unui electron dintr-un atom în fază gazoasă necesită energie mare (aproximativ 1070 kJ/mol), carbonul nu creează legături ionice cu alte elemente, deci în ce scop este necesară energizarea? electron cu crearea unui ion pozitiv. Deși electronegativitatea este mai mare de 2,5, carbonul nu prezintă o afinitate puternică pentru electroni, aparent nefiind un acceptor de electroni activ. Prin urmare, nu este suficient ca piesa cu sarcină negativă să fie rezolvată. Datorită naturii parțial ionice a liantului, semicarbonul se găsește, de exemplu, carburi. În semi-carbonii, carbonul prezintă stadiul de oxidare 4. Pentru ca mai mulți electroni să poată participa la formarea legăturilor, este necesar să se decupleze electronii 2s și să sară unul dintre acești electroni la orbital 2pz; În acest caz, se creează 4 legături tetraedrice cu 109° între ele. În jumătate, electronii de valență ai carbonului sunt extrași mai rar, astfel încât carbonul creează legături covalente intime între atomii vecini de tip 3-3 cu ajutorul unei perechi de electroni carbon. Energia de rupere a unei astfel de legături este încă de 335 kJ/mol, în timp ce pentru legătura Si-Si este de doar 210 kJ/mol, deci lancetele lungi de Si-Si sunt instabile. Natura covalentă a legăturii este păstrată în combinația de halogeni foarte reactivi cu carbon, CF4 și CCl4. Atomii de carbon creează mai mult de un electron al atomului de carbon din piele pentru a forma legătura; Așa se stabilește legătura dintre C=S și triplul SєS. Alte elemente creează, de asemenea, legături între atomii lor și doar același carbon formează lănci lungi. Prin urmare, pentru carbon există mii de compuși, numiți carbohidrați, în care carbonul este legat de apă și alți atomi de carbon, creând lance lungi sau structuri inelare.
CHIMIA ESTE ORGANICA. În acești compuși, este posibilă înlocuirea apei cu alți atomi, cel mai adesea aciditate, azot și halogeni în absența compușilor organici. Mai importanți dintre aceștia sunt carbohidrații fluorurati - în carbohidrați, în care apa este înlocuită cu fluor. Astfel de produse sunt în esență inerte și sunt folosite ca materiale plastice și uleioase (fluorocarburi sau carbohidrați, în care toți atomii de apă sunt înlocuiți cu atomi de fluor) și ca agenți frigorifici la temperatură joasă (agenți frigorifici, sau reoni, - carbohidrați fluoroclorurati). În anii 1980, fizicienii americani au descoperit chiar și carbonul de jumătate de mărime, în care atomii de carbon sunt uniți în 5 sau 6 nuclee care creează molecula C60 sub forma unei pungi goale, care are o structură complet simetrică. Fragmente ale acestui design stau la baza „domului geodezic”, descoperit de arhitectul și inginerul american Buckminster Fuller, o nouă clasă de cupole numite „buckminsterfullerenes” sau „fulerene” (și, de asemenea, pe scurt, „phaseballs” sau „ buckyballs””). Fulerenele - a treia modificare a carbonului pur (pe lângă diamant și grafit), care constă din 60 sau 70 (sau mai mulți) atomi - a fost supusă procesării laser în particule fracționate de carbon. Fulerenele de formă pliabilă sunt compuse din sute de atomi de carbon. Diametrul moleculei C60 CARBON este de 1 nm. În centrul unei astfel de molecule există suficient spațiu pentru a găzdui un atom mare de uraniu.
de asemenea FULERENI.
Masa atomică standard.În 1961, Consiliul Internațional de Chimie Teoretică și Aplicată (IUPAC) și Fizică a adoptat masa izotopului de carbon 12C ca unitate de masă atomică, care era legată de scara acrișă a maselor atomice care existase înainte. Masa atomică a carbonului în acest sistem este mai mare de 12.011, deoarece este medie pentru cei trei izotopi naturali ai carbonului în funcție de abundența lor în natură.
MASĂ ATOMICĂ. Puterea chimică a cărbunelui și deyakih yogo spoluk. Toate puterile fizice și chimice ale carbonului sunt induse de statisticile ELEMENTELOR CHIMICE. Reacția carbonului depinde de modificarea, temperatura și dispersia acestuia. La temperaturi scăzute, toate formele de carbon devin inerte, dar atunci când sunt încălzite, sunt oxidate de acidul acid, întărind oxizii:

Carbonul fin dispersat care este prea acru se va umfla atunci când este încălzit sau aprins. Crema de oxidare directă dezvăluie metode moderne de menținere a oxizilor. Suboxidul de carbon C3O2 se formează prin deshidratarea acidului malonic peste P4O10:
C3O2 are un miros neplăcut, dar este ușor de hidrolizat, redizolvând acidul malonic.
Monoxidul de carbon(II) CO este creat în timpul oxidării oricărei modificări a carbonului în drenarea acidității. Reacția este exotermă, citind 111,6 kJ/mol. Cocsul la temperatura de căldură albă reacționează cu apa: C + H2O = CO + H2; Amestecul de gaz care se dizolvă se numește „gaz de apă” și este un foc asemănător gazului. CO se dezvoltă și atunci când produsele nafta nu sunt complet aprinse, în cantități marcate, în evacuarea mașinilor și iese în timpul disocierii termice a acidului formic:
Etapa de oxidare a carbonului în CO este +2 și, deoarece fragmentele de carbon sunt mai stabile până la etapa de oxidare +4, CO este ușor oxidat de către acid la CO2: CO + O2 (r) CO2, această reacție este extrem de exotermă (283). kJ/mol). CO stagnează în industrie, conținând H2 și alte gaze inflamabile, cum ar fi substanțe de ardere sau asemănătoare gazelor. Când este încălzit la 500 ° C, CO din aceeași lume dizolvă CO2, dar la 1000 ° C se stabilește în mod egal la concentrații scăzute de CO2. CO reacționează cu clorul, calmante fosgen - COCl2, reacțiile se desfășoară în mod similar cu alți halogeni, reacția produce rapid sulfură de carbonil COS, cu metale (M) CO reacționează cu carbonili de diferite tipuri M(CO)x, care є concepte complexe. Carbonilul salivei este creat prin interacțiunea hemoglobinei din sânge cu CO, reacția hemoglobinei cu acidul, motiv pentru care carbonilul salivei este un produs rezidual. Ca urmare, funcția hemoglobinei ca purtător de acid către celule este blocată, ceea ce le face să moară (și în primul rând sunt afectate celulele creierului). (Există un alt nume pentru CO – „gaz dulce”). Deja 1% (vol.) În lume, este nesigur pentru persoanele care nu pot rămâne într-o astfel de atmosferă mai mult de 10 minute. Actele de putere fizică sunt indicate în tabel. Dioxidul de carbon sau dioxidul de carbon (IV) CO2 este creat atunci când carbonul elementar este ars până la aciditate în exces cu căldură (395 kJ/mol). CO2 (numele trivial este „dioxid de carbon”) este, de asemenea, creat de CO foarte oxidat, nafta, benzină, uleiuri și alți compuși organici. Când carbonații se descompun în apă ca urmare a hidrolizei, se observă și CO2:
Această reacție este adesea folosită în practica de laborator pentru absorbția CO2. Acest gaz poate fi extras la prăjirea bicarbonaților de metale:
În timpul interacțiunii fază gazoasă a aburului supraîncălzit cu CO:
Când sterilizați carbohidrați și substanțe fără acizi, de exemplu:

Într-un mod similar, produsele grub sunt oxidate într-un organism viu datorită eliberării de energie termică și a altor tipuri de energie. În acest caz, oxidarea are loc în pulpă prin etape intermediare, iar produsele finale sunt aceleași - CO2 și H2O, ca, de exemplu, sub ora de răspândire a cojilor sub acțiunea enzimelor, condensate în timpul fermentației glucozei:
Producția de tonaj mare de dioxid de carbon și oxizi metalici are loc în descompunerea termică a carbonaților în industrie:

CaO este utilizat în cantități mari în tehnologia de producție a cimentului. Stabilitatea termică a carbonaților și pierderea de căldură în aranjarea lor crește în consecință în seria CaCO3 (de asemenea, PREVENȚIE PUTERNICĂ ȘI PROTECȚIE ANTI INCENDIU). Budova electronice oxizi de carbon. Structura electronică a oricărui oxid de carbon poate fi descrisă prin trei circuite egale cu aranjamente diferite de perechi de electroni - trei forme rezonante:

Toți oxizii și carbonul spală budova liniare.
Acidul carugic. Când C2 reacţionează cu apa, se formează acid carbonic H2CO3. În CO2 saturat (0,034 mol/l), mai puțin de o fracțiune din molecule sunt dizolvate de H2CO3, iar cea mai mare parte a CO2 este prezentă în stare hidratată de CO2*H2O.
Carbonati. Carbonații sunt creați prin interacțiunea oxizilor metalici cu CO2, de exemplu, Na2O + CO2 -> NaHCO3, care, atunci când sunt încălziți, se descompun sub formă de CO2: 2NaHCO3 -> Na2CO3 + H2O + CO2 Carbonatul de sodiu, sau soda, vibrează din sodă Industria sa în cantități mari este importantă folosind metoda Solvay:

O altă metodă este eliminarea sifonului din CO2 și NaOH

Ionul carbonat CO32 are o suprafață plană cu o tăietură O-C-O egală cu 120° și o legătură lungă de CO de 1,31
(Div. de asemenea LUZHIV VIROBNITSTVO).
Halogenuri de carbon. Cărbunele reacționează ușor cu halogenii atunci când este încălzit, întărind tetrahalogenuri, dar fluiditatea reacției și randamentul produsului sunt mici. Prin urmare, halogenurile de carbon pot fi îndepărtate prin alte metode, de exemplu, CCl4 poate fi îndepărtat din disulfura de carbon clorurat: CS2 + 2Cl2 -> CCl4 + 2S Tetraclorura CCl4 este un reactiv neinflamabil, utilizat ca agent în procesele de curățare uscată, dar nu este recomandat pentru Stosovuvvat yogo ca pe jumătate măsurat, astfel încât temperatura este de așteptat. Eliberarea de fosgen (un lichid asemănător gazului). CCl4 în sine este, de asemenea, toxic și, dacă este inhalat în cantități mici, poate provoca insuficiență hepatică. СCl4 este creat prin reacția fotochimică dintre metanul СH4 și Сl2; în acest ritm, se dizolvă produsele metanului neclorurat - CHCl3, CH2Cl2 și CH3Cl. Reacțiile cu alți halogeni decurg în mod similar.
Reacția la grafit. Grafitul, ca modificare a carbonului, care crește în spații mari între bilele inelelor hexagonale, intră în reacții neașteptate, de exemplu, metalele de staniu, halogenii și zeci de săruri (FeCl3) pătrund în mine cu bile, creând semi-lukies. de tip KC8, KC16 (numit semi-lukami pentru propagare, incluziune sau cla. Agenții puternic oxidanți precum KClO3 într-o soluție acidă (sodiu sau acid azotic) dizolvă compușii cu un volum mare de compuși cristalini (până la 6 bile), care se explică prin fermentarea atomilor acizi și formarea de compuși la suprafață și care, în urma oxidării, se formează grupări carboxil (-COOH) - semitip de acid grafit oxidat sau melitic (benzen hexacarboxilic) C6 ( COOH) 6. În aceste condiţii, raportul W:O poate varia de la 6:1 la 6:2,5.
Carburi. Cărbunele se combină cu metale, bor și siliciu și cu diverși compuși numiți carburi. Cele mai active metale (subgrupa IA-IIIA) reacţionează cu carburi asemănătoare sărurilor, de exemplu, Na2C2, CaC2, Mg4C3, Al4C3. În industrie, carbura de calciu este îndepărtată din cocs și urmând următoarele reacții:

Carburele sunt neelectroconductoare, posibil fără bare, hidrolizate cu soluții de carbohidrați, de exemplu CaC2 + 2H2O = C2H2 + Ca(OH)2 Acetilena C2H2, care este creată prin reacție, servește ca produs de ieșire pentru instalația de fermentație a vorbirilor organice. . Acest proces, la urma urmei, reprezintă o tranziție de la substanțele anorganice la sinteza compușilor organici. Carburele care reacţionează cu hidroliza acetilenei se numesc acetilenide. Siliciul și carburile de bor (SiC și B4C) au legături covalente între atomi. Metalele de tranziție (elementele subgrupului B), atunci când sunt încălzite cu carbon, formează și carburi în fisurile suprafeței metalice; Legătura lor este apropiată de cea a metalului. Carburele de acest tip, cum ar fi WC, W2C, TiC și SiC, au duritate și refractaritate ridicate și au o conductivitate electrică bună. De exemplu, NbC, TaC și HfC sunt cele mai mari materiale refractare (mp = 4000-4200 ° C), carbura de diniobiu Nb2C este un supraconductor la 9,18 K, TiC și W2C au o duritate apropiată de diamant, iar duritatea B4C (structurală). taxa de diamant ) stabilită la 9,5 pe scara Mohs (div. Fig. 2). Carburele inerte sunt create în funcție de raza metalului de tranziție Carbon otrăvitor cu azot. Acest grup conține substanța NH2CONH2 – o substanță fără azot care va stagna și va arăta putred. Pleava este extrasă din NH3 și CO2 atunci când este încălzită sub presiune:
Ditsianul (CN)2 este adesea numit pseudohalogen pentru proprietățile sale bogate similare cu halogenii. Dicianul este supus oxidării ușoare a ionului de cianură de către acid, peroxid de apă sau ion Cu2+: 2CN- -> (CN)2 + 2e. Ionul de cianură, fiind un donor de electroni, creează cu ușurință compuși complecși cu ioni de metale de tranziție. Similar cu CO, ionul de cianură este o substanță excretoare, de o importanță vitală, care pătrunde într-un organism viu. Ionii complexi de cianuri au următoarea formulă []-0,5x, unde x este numărul de coordonare al metalului (agent de complexare), care este legat din punct de vedere empiric de a doua valoare a etapei de oxidare a ionului metalic. Exemple de astfel de ioni complecși (ionii activi efectivi sunt indicați mai jos) sunt ionul tetracianonichelat(II)-[]2-, hexacianoferrat(III) []3-, dicianoargentatul []-:

Carbonili. Monoxidul de carbon reacționează direct cu o varietate de metale sau ioni de metal, calmant compuși complecși numiți carbonili, de exemplu Ni(CO)4, Fe(CO)5, Fe2(CO)9, []3, Mo(CO)6, [ ] 2. Legătura în aceste semicomplexe este similară cu legătura din descrierile cianocomplexului. Ni(CO)4 este o substanță volatilă care este vicorizată pentru a întări nichelul din alte metale. Deteriorarea structurii chavunului și a oțelului în structuri este adesea asociată cu adăugarea de carbonili. Apa poate intra în depozitul de carbonili, care calmează hidrurile de carbonil, cum ar fi H2Fe(CO)4 și HCo(CO)4, care prezintă proprietăți acide și reacționează cu următoarele: H2Fe(CO)4 + NaOH -> NaHFe(CO) 4 + H2O Există și halogenuri de carbonil, de exemplu Fe(CO)X2, Fe(CO)2X2, Co(CO)I2, Pt(CO)Cl2 și X - orice halogen
(div. de asemenea SPLUKS METAL ORGANICI).
În carbohidrați. Vidomo impersonal semilună cu apă
(div. CHIMIE ORGANICA).
LITERATURĂ
Syunyaev Z.I. Naftovy vuglets. M., 1980 Chimia carbonului hipercoordonat. M., 1990
Enciclopedia lui Collier. - Deschide căsătoria. 2000 .
Sinonime:Mă întreb ce este „CARBON” în alte dicționare:
Tabelul nuclizilor Zagalnye Vidomosti Nume, simbol Vuglets 14, 14C Denumiri alternative radiocarbon, radiocarbon Neutroni 8 Protoni 6 Puterile nuclidului Masa atomica ... Wikipedia
Tabelul nuclizilor Zagalnye Vidomosti Nume, simbol Vuglets 12, 12C Neutroni 6 Protoni 6 Puterile nuclidului Masa atomica 12.0000000(0) ... Wikipedia
Carbonul este, probabil, principalul și cel mai important element chimic de pe Pământ, iar în spatele lui se formează un număr colosal de compuși diferiți, atât anorganici, cât și organici. Cărbunele este baza tuturor esențelor vii, putem spune că cărbunele, alături de apă și aciditate, este baza vieții pe planeta noastră! Vuglets are o varietate de forme care nu sunt similare în proprietățile lor fizice și chimice, nu în aspect. Totul este bine!
Istoria descoperirii cărbunelui
Vuglets este cunoscut oamenilor din cele mai vechi timpuri. Grafitul și vugilla au fost extrase de grecii antici, iar diamantele au fost găsite în India. Adevărat, piese asemănătoare au fost adesea confundate cu grafit. Prote, grafit mav zastosuvannya largă de mult timp în urmă, frunze de zokrema. Numele său este probabil similar cu cuvântul grecesc „grapho” - „scriu”. Grafitul este imediat vicorizat în măsline. Diamantele au început să fie comercializate în Brazilia în prima jumătate a secolului al XVIII-lea, moment din care nu au existat origini, iar în anii 1970 a fost dezvoltată tehnologia de extragere a diamantelor folosind fragmente. Astfel de bucăți de diamante sunt folosite în industrie, naturale, în felul lor, în bijuterii.
Vuglets în natură
Cea mai mare cantitate de carbon este colectată în atmosferă și hidrosferă sub formă de dioxid de carbon. În atmosferă, carbonul conține aproximativ 0,046% și chiar mai mult în aspectul perturbat al Oceanului de Lumină.
În plus, după cum știm, cărbunele este baza organismelor vii. De exemplu, o persoană care cântărește 70 kg are aproximativ 13 kg de cărbune! Există mult mai multe într-o singură persoană! Și cărbunele se găsește și în toate plantele și creaturile. Axis și noroc...
Circulația carbonului în natură
Modificări alotropice ale carbonului
Lemnul de cărbune este un element chimic unic care este creat prin așa-numitele modificări alotropice sau, mai simplu, prin diferite forme. Aceste modificări sunt împărțite în cristaline, amorfe și de tip cluster.
Modificările cristaline produc bavurile cristaline corecte. Acest grup include: diamant, fullerit, grafit, lonsdaleit, fibre și tuburi de carbon. Ceea ce este important este numărul mare de modificări cristaline ale carbonului care se află pe primul loc în clasamentul „Cele mai dure materiale din lume”.
 Forme alotropice ale carbonului: a) lonsdaleitul; b) diamant;
Forme alotropice ale carbonului: a) lonsdaleitul; b) diamant; c) grafit; d) carbon amorf; e) C60 (fuleren); e) grafen;
g) nanotub cu o singură bilă
Formele amorfe sunt create de carbonul din casele mici ale altor elemente chimice. Principalii reprezentanți ai acestui grup: vugilla (Kamyan, sat, activ), funingine, antracit.
Cele mai complexe și de înaltă tehnologie au un aspect semicarbonic al clusterelor. Clusterele sunt o structură specială atunci când atomii de carbon sunt aranjați în așa fel încât creează o formă goală umplută în mijloc cu atomi ai altor elemente, de exemplu, apă. Acest grup nu are atât de mulți reprezentanți; include nanoconuri de carbon, astrale și carbon.
 Grafitul - „partea întunecată” a diamantului
Grafitul - „partea întunecată” a diamantului Zastosuvannya vugletsiu
Vuglets și gândurile sale sunt de mare importanță în viața oamenilor. Cu carbon, sunt create principalele tipuri de combustibil de pe Pământ - gazul natural și nafta. Cărbunele este utilizat pe scară largă în industria chimică și metalurgică, viața de zi cu zi, inginerie mecanică și medicină. Modificările alotropice în aspectul diamantelor sunt vicoristice în bijuterii, fullerita și lonsdaleitul în producția de rachete. Acest semi-cărbune este folosit pentru prepararea diferitelor uleiuri pentru mecanisme, echipamente tehnice și multe altele. Industria acum nu se poate lipsi de cărbune, este vikorist prin!
Instituția de învățământ municipală „Școala secundară Nikiforivka nr. 1”
Vuglets și principalele sale semiconducte anorganice
Eseu
Vikonav: studiu clasa 9B
Sidorov Oleksandr
Cititor: Sakharova L.M.
Dmitrivka 2009
introduce
Capitolul I. Totul despre Vuglets
1.1. Vuglets în natură
1.2. Modificări alotropice ale carbonului
1.3. Puterea chimică a cărbunelui
1.4. Zastosuvannya vugletsiu
Secțiunea II. Semicarbune anorganic
Visnovok
Literatură
introduce
Vuglets (lat. Carboneum) C este un element chimic din grupa IV a tabelului periodic Mendelev: număr atomic 6, greutate atomică 12,011 (1). Să aruncăm o privire la atomul de carbon. La nivelul energetic extern al atomului de carbon există mai mulți electroni. Imaginabil grafic:
Cărbunele a fost recuperat de mult timp în urmă, iar prezența acestui element este necunoscută.
De exemplu, secolul al XVII-lea. Secolele florentine ale lui Averani și Targione au încercat să topească o grămadă de diamante diferite într-unul mare și să le încălzească într-o cameră de foc. Diamantele au dispărut, arzând în vânt. În 1772 r. Chimistul francez A. Lavoisier a arătat că atunci când un diamant este ars, se creează CO2. Lishe în 1797 r. Opinia engleză a lui S. Tennant a susținut că natura este identică cu grafitul și cu vugilla. După ardere, părțile brute de dioxid de carbon și diamant legate de oxid de carbon (IV) s-au dovedit a fi noi.
Diversitatea carbonului, care se explică prin faptul că atomii săi se combină între ei și atomii altor elemente în moduri diferite, se explică prin poziția particulară a carbonului între alte elemente.
Capitoleu. Totul despre vugletsyu
1.1. Vuglets în natură
Vuglets se găsește în natură atât în sălbăticie, cât și în aparență.
Cărbunele bogat are aspectul de diamant, grafit și carabină.
Diamantele sunt și mai rare. Cel mai mare diamant cunoscut este „Cullinan”, care a fost descoperit în 1905. din Pivdeniya Africa, cântărind 621,2 g și măsurând 10×6,5×5 cm. Fondul de diamante din Moscova păstrează unul dintre cele mai mari și mai frumoase diamante din lume - „Orlov” (37,92 g).
Îmi voi lua numele de la un diamant la o nucă. „Adamas” - de necassat, de necassat. Cele mai importante zăcăminte de diamante sunt situate în Noua Africa, Brazilia și Yakutia.
Depozite mari de grafit sunt situate în FRN, Sri Lanka, Siberia și Altai.
Principalele minerale carbonice sunt: magnezitul MgCO 3, calcitul (flat spar, vapnyak, marmur, creida) CaCO 3, dolomita CaMg (CO 3) 2 etc.
Toate minele combustibile - nafta, gaz, turbă, foraje de pietre și cărbune, șist - sunt realizate pe bază de carbon. Aproape în spatele depozitului de cărbune deka vikopni vugill, care va elimina până la 99%.
Înainte de cărbune, 0,1% din scoarța terestră cade.
Oxidul de carbon (IV) 2 pare să intre în atmosferă. Hidrosfera conține o cantitate mare de CO2.
1.2. Modificări alotropice ale carbonului
Carbonul elementar suferă trei modificări alotropice: diamant, grafit, carabină.
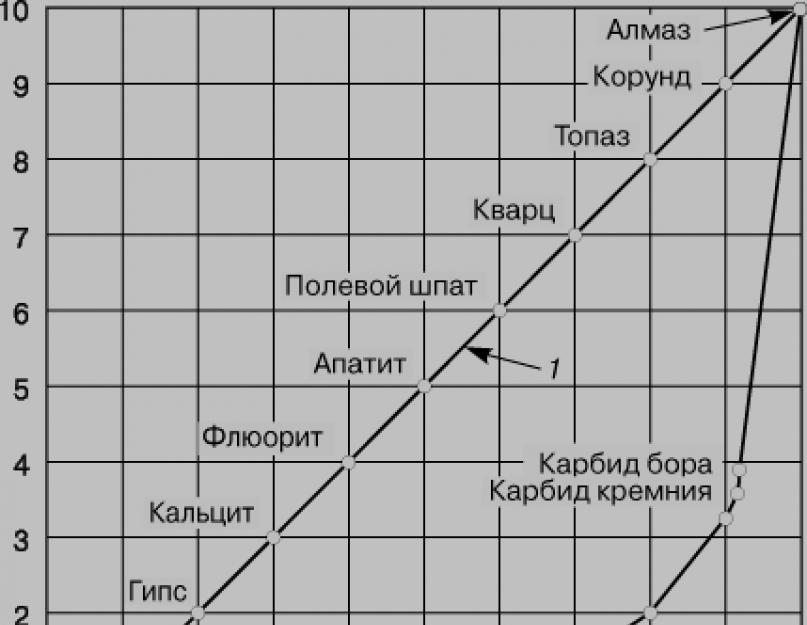
1. Diamantul este un flux cristalin transparent, fără bare, care curbează foarte puternic trecerea luminii. Atomii de carbon din diamante apar în stadiul de hibridizare sp 3. În acest caz, electronii de valență din atomii de carbon sunt dizolvați și sunt creați patru electroni nepereche. Când se creează legăturile chimice, particulele electronice se umflă în noi forme contorsionate și se extind în spațiu, astfel încât axele lor apar îndreptate spre vârfurile tetraedrului. Când vârfurile acestor diamante se suprapun cu cele ale altor atomi de carbon, se formează legături covalente sub tăietura de 109°28" și se creează o rețea cristalină atomică, caracteristică diamantului.
Atomul de carbon este jupuit în diamantul edemelor, care sunt similare cu altele, crescute de la centrul tetraedrelor până la vârfuri. Distanța dintre atomi din tetraedre este de până la 0,154 nm. Valoarea tuturor conexiunilor este aceeași. În acest fel, atomii din diamant sunt „împachetati” foarte strâns. La 20°W, duritatea diamantului devine 3,515 g/cm3. Aceasta explică duritatea lui Vinyatkov. Diamant este rău pentru efectuarea unui flux electric.
Născut în 1961 Uniunea Radyansky a lansat producția industrială de diamante sintetice din grafit.
În timpul sintezei industriale a diamantelor se aplică presiuni de mii de MPa și temperaturi cuprinse între 1500 și 3000°C. Procesul se realizează în prezența catalizatorilor, care pot fi metale, de exemplu Ni. Masa principală de diamante care sunt create sunt cristale mici și ferăstrău cu diamante.
Diamantul, când este încălzit fără expunere la mai mult de 1000°C, se transformă în grafit. La 1750 ° C, transformarea diamantului în grafit este rapidă.
Structura de diamant
2. Grafitul este o rășină cristalină gri-negru, cu sclipici metalic, grasă la suprafață și este asemănătoare ca duritate cu cea a hârtiei.
Atomii de carbon din cristalele de grafit suferă o hibridizare sp 2: în ei se formează trei legături covalente cu atomi legați. Distanța dintre liniile drepte ale conexiunilor este de 120°. Ca rezultat, este creată o plasă care constă din șase piese obișnuite. Distanța dintre nucleele atomice și centrul bilei devine 0,142 nm. Al patrulea electron al sferei exterioare a atomului de carbon din piele din grafit ocupă un orbital p, deci nu ia parte la hibridizare.
Particulele de electroni nehibrizi ale atomilor de carbon sunt orientate perpendicular pe suprafața bilei și suprapunându-se una după alta, formează legături σ pe partea dreaptă. Sferele sferice din grafit cristal sunt situate una câte una la o distanță de 0,335 nm și sunt slab conectate între ele, cel mai important de către forțele van der Waals. Prin urmare, grafitul are o rezistență mecanică scăzută și se desparte ușor în bucăți, care pot fi chiar zdrobite de forțele de umiditate. Legăturile dintre bilele atomilor de carbon din grafit au adesea un caracter metalic. Acest lucru se explică prin faptul că grafitul conduce mai bine curentul electric, dar nu este la fel de bun ca metalul.
Structura grafitului
Forța fizică a grafitului variază foarte mult de-a lungul liniilor drepte - perpendiculare și paralele cu bilele atomilor de carbon.
Când este încălzit fără acces la aer, grafitul nu recunoaște schimbările zilnice de până la 3700°C. La temperatura specificată, vinul fierbe fără să se topească.
Bucățile de grafit sunt păstrate din cele mai bune calități de cărbune de rocă la 3000°C în cuptoare electrice fără acces la aer.
Grafitul este stabil termodinamic pe o gamă largă de temperaturi și presiuni, deci este acceptat ca oțel carbon standard. Duritatea grafitului devine 2265 g/cm 3 .
3. Carabină - pulbere cristalină friabilă de culoare neagră. În structura sa cristalină, atomii de carbon sunt legați prin legături simple și triple, care alternează în benzi liniare.
−С≡С−С≡С−С≡С−
Discursul lui Qiu a fost preluat de V.V. Korshak, A.M. Sladkovim, V.I. Kasatochkinim, Yu.P. Kudryavtsev pe cob din anii 60 ai secolului XX.
S-a demonstrat ulterior că carbina poate fi prezentă în diferite forme și poate fi combinată cu lănci de poliacetilenă și policumulen, în care atomii de carbon sunt legați prin sublegături:
C=C=C=C=C=C=
Cele mai recente carabine au fost găsite în natură – în râurile de meteoriți.
Carabina are putere conductor, sub influența luminii conductivitatea sa crește foarte mult. Datorită utilizării diferitelor tipuri de legare și a diferitelor metode de așezare a lăncilor cu atomi de carbon la rețeaua cristalină, puterea fizică a carabinei poate varia într-o gamă largă. Când este încălzit fără acces peste 2000 C, carbonul este stabil; la temperaturi de aproximativ 2300 C, trecerea lui la grafit este evitată.
Cărbunele natural este compus din doi izotopi
(98,892%) și (1,108%). În plus, în atmosferă au fost detectate cantități mici de izotopi radioactivi, care sunt conținute în cantități mici.Anterior, se respecta că în satul vugilla, funinginea și cocsul sunt aproape de depozitul de cărbune pur și împărtășesc puterea diamantului și a grafitului, reprezentând o modificare alotropică independentă a carbonului („carbon amorf”). Cu toate acestea, s-a stabilit că aceste cuvinte sunt compuse din cele mai comune particule cristaline, în care atomii de carbon sunt legați în același mod ca în grafit.
4. Vugilla – grafit fin detaliat. Se întărește prin desfășurarea termică a rafurilor pe bază de carbon, fără expunere la vânt. Vugilla este dornică să lupte pentru autorități, datorită discursului, care este duhoarea înlăturării metodei de îndepărtare. Se vor răzbuna din nou pe casele care cad sub puterea lor. Cele mai importante soiuri de vugill sunt coca, satul vugill, funingine.
Cocsul iese atunci când cărbunele de rocă este încălzit fără acces la vânt.
Satul vugilla este creat prin încălzirea lemnului fără acces la vânt.
Funinginea este o pulbere cristalină fină de grafit. Se dizolvă prin vărsare în carbohidrați (gaz natural, acetilenă, terebentină etc.) cu acces limitat la aer.
Cărbunele mai activ este adsorbanții industriali poroși, care se formează în special cu cărbunele. Adsorbția este denumirea dată îndepărtării argilei de pe suprafața fluxurilor solide de gaze și a fluxurilor sparte. Vugille este extras mai activ din lemn masiv (turbă, maro și piatră vugill, antracit), lemn și produse din prelucrarea acestuia (vugill lemn, tirsiu, producții de morărit hârtie), producții din industria pielăriei, materiale etc. alimente fierte, pt. exemplu de pensule. Vugilla, care are o mare valoare mecanică, este extrasă din cojile de nucă de cocos și alte mazăre, din coji de fructe. Structura vugille este reprezentată de pori de toate dimensiunile, capacitatea de adsorbție și fluiditatea de adsorbție sunt determinate în loc de micropori pe masă sau volum de granule. Când se formează o vugila activă în mugure, materialul de ieșire este supus unei prelucrări termice fără acces la vânt, în urma căreia vugila și unele rășini sunt îndepărtate. Acest lucru creează o structură vugille mare poroasă. Pentru a îndepărta structura microporoasă, activarea trebuie oprită fie prin oxidare cu gaz sau abur, fie prin tratare cu reactivi chimici.
VIZNACHENNYA
Vuglets- Al șaselea element al tabelului periodic. Desemnat – Din latinescul „carboneum”. Rotații în altă perioadă, grupa IVA. Aplicați pe nemetale. Încărcarea de bază este de până la 6.
Vuglets se găsește în natură atât în sălbăticie, cât și în apariția numerelor. Cărbunele bogat are un aspect de diamant și grafit. Cremă de vikopnogo vugill, în adâncurile Pământului există mari achiziții de naftă. În scoarța terestră există concentrații mari de săruri ale acidului carbonic, în special carbonat de calciu. Vântul conține întotdeauna dioxid de carbon. Ei spun că organismele în creștere și create sunt formate din râuri, în lumina cărora cărbunele își ia soarta. Astfel, acest element este unul dintre cele mai abundente de pe Pământ, deși conținutul său în scoarța terestră este mai mic de 0,1% (greutate).
Masa atomică și moleculară a cărbunelui
Greutatea moleculară apoasă a unei hidrocarburi (Mr) este un număr care arată de câte ori masa unei molecule date este mai mare decât 1/12 greutatea unui atom de carbon, iar greutatea atomică apoasă a unui element (A r) este de câte ori greutatea medie a atomilor unui element chimic este mai mare pentru 1/12 masa unui atom de carbon
Fragmentele de cărbune apar sub formă de molecule monoatomice, ale căror valori sunt egale cu masa atomică și moleculară. Duhoarea este din ce în ce mai bună 12.0064.
Alotropia și modificarea alotropică a carbonului
În general, cărbunele arată ca un diamant care cristalizează într-un sistem cubic și hexagonal (Lonsdaleit) și grafitul care se află înaintea sistemului hexagonal (Fig. 1). Asemenea forme de cărbune, cum ar fi satul cărbunelui, cocsului și funinginei creează o structură dezordonată. Există, de asemenea, modificări alotropice, pe bază de carbon sintetic - carbon și policumulen - soiuri de carbon produse din polimeri lancet liniari de tip -C=C sau C=C=.
Mic 1. Modificări alotropice ale carbonului.
Există și modificări alotropice ale carbonului, care poartă următoarele denumiri: grafen, fuleren, nanotuburi, nanofibre, astralenă, carbon scuamos, nanotuburi colosale; carbon amorf, nanomuguri de carbon și nanospumă de carbon.
Izotopi ai carbonului
În natură, cărbunele este format din doi izotopi stabili: 12 C (98,98%) și 13 C (1,07%). Numerele lor de masă vor ajunge constant la 12 și 13. Nucleul unui atom la izotopul de carbon 12 C are șase protoni și șase neutroni, iar izotopul 13 C are același număr de protoni și cinci neutroni.
Există o singură bucată (radioactiv) izotop de carbon 14 C cu o perioadă de descompunere de aproximativ 5730 de ani.
Ioni vugletsiu
Pe nivelul actual de energie al unui atom de carbon, există mai mulți electroni care sunt de valență:
1s 2 2s 2 2p 2 .
Prin intermediul unui război de interacțiuni chimice, carbonul își poate pierde electronii de valență. fi donatorul lor și se transformă într-un ion încărcat pozitiv și acceptă atunci electroni de la alt atom. fi acceptorul lor și se transformă într-un ion încărcat negativ:
0 -2e → 2+ ;
0 -4e → 4+ ;
0 +4e → 4- .
Moleculă și atom de carbon
În general, carbonul se bazează pe aspectul moleculelor monoatomice C. Să arătăm autoritățile care caracterizează atomul și molecula de carbon:
Plutește cărbunele
Cele mai comune aliaje de carbon din întreaga lume sunt oțelul și chavun. Oțelul este un metal care conține carbon, care conține mai mult de 2% carbon. În chavun (de asemenea, un aliaj de gheață cu carbon), în loc de carbon, există mai mult - de la 2 la 4%.
Aplicați la rezolvarea problemelor
CAPUL 1
| Zavdannya | Ce este necesar pentru ca dioxidul de carbon (IV) să fie văzut (n.s.) atunci când se fierb 500 g de dioxid de carbon, care conține 0,1 parte de masă din casă. |
| Decizie | Să notăm reacția geloasă: CaCO3 = CaO + CO2-. Știm o mulțime de vapnyaku pur. Pentru al căror început este important să aibă o mare parte fără case: w limpede (CaCO3) = 1 - w impuritate = 1 - 0,1 = 0,9. m limpede (CaC03) = m (CaC03) xw limpede (CaCO3); m limpede (CaCO3) = 500×0,9 = 450 g. Apreciem numărul de cuvinte rostite de vapnyaku: n(CaC03) = m limpede (CaC03) / M(CaC03); n(CaC03) = 450/100 = 4,5 mol. Este în concordanță cu reacția egală cu n(CaCO3): n(CO2) = 1:1, atunci n(CaC03) = n(C02) = 4,5 mol. Apoi, înmuiat în oxid de carbon (IV), care a fost văzut a fi antic: V(CO2) = n(CO2) × Vm; V(CO 2 ) = 4,5 × 22,4 = 100,8 l. |
| Vіdpovid | 100,8 l |
CAPUL 2
| Zavdannya | Câtă soluție este necesară pentru a amesteca 0,05 părți în greutate sau 5% clor pentru a neutraliza 11,2 g de carbonat de calciu? |
| Decizie | Să notăm reacția de neutralizare a carbonatului de calciu cu acid clorhidric: CaC03 + 2HCI = CaCI2 + H20 + CO2-. Cunoaștem puterea carbonatului de calciu: M(CaC03) = Ar (Ca) + Ar (C) + 3×Ar (O); M(CaCO3) = 40 + 12 + 3×16 = 52 + 48 = 100 g/mol. n(CaC03) = m (CaC03) / M(CaC03); n(CaC03) = 11,2/100 = 0,112 mol. Este în concordanță cu reacția egală cu n(CaCO3) :n(HCl) = 1:2, apoi n(HCI) = 2×n(CaCO3) = 2×0,224 mol. Este important să spunem că apa cu clor este folosită în distrugere: M(HCI) = Ar (H) + Ar (CI) = 1 + 35,5 = 36,5 g/mol. m(HCl) = n(HCl) ×M(HCl) = 0,224 × 36,5 = 8,176 rub. Dizolvăm amestecul de apă cu clor: m soluție (HCI) = m(HCI)× 100/w(HCI); m soluție (HCl) = 8,176 × 100/5 = 163,52 rub. |
| Vіdpovid | 163,52 g |