(Birinchi elektron)
(Pauling orqasida)
| I | 53 |
| 126,90447 | |
| 5s 2 5p 5 | |
| Yod | |
Yod, yod(yunon tilidan, iodes - "binafsha") - ushbu guruhning bosh kichik guruhining elementi, kimyoviy elementlarning davriy jadvalining beshinchi davri D. I. Mendelev, atom raqami 53. I belgisi bilan ko'rsatilgan (lat. Iodum). Kimyoviy faol bo'lmagan metall galogenlar guruhiga kiradi. Oddiy onglar uchun oddiy suyuq yod (CAS raqami: 7553-56-2) - binafsha rangli metall yaltiroq qora-kulrang rangli kristallar, o'tkir hidni chiqaradigan binafsha bug'larini osongina yo'q qiladi. Rechvini molekulasi ikki atomli (formula I2).
Tibbiyot va biologiyada bu nutq deyiladi yod(masalan, "yodning bo'linishi"), davriy jadval va kimyoviy adabiyotlarning nomlari ishlatiladi yod.
Tarix
Yod 1811 yilda ochilgan. Kurtua dengiz yosunlarining kulida, 1815 yildan r. Gey-Lyusak uni kimyoviy element sifatida ko'rib chiqa boshladi.
Element belgisi J bv bilan almashtiriladi I Ko'rinishidan, yaqinda, XX asrning 50-yillarida.
Tabiatdan ma'lum
Dengiz suvida ko'p miqdorda yodidlar mavjud. Tabiatda mineral kabi erkin shaklda ham uchraydi va bunday topilmalar yakka o'zi - Vezuviyning termal buloqlarida va orolda topilgan. Vulkan (Italiya). Tabiiy yodidlar zahiralari 15 million tonnaga baholanadi, zahiralarning 99 foizi Chili va Yaponiyada joylashgan. Hozirda bu mamlakatlarda yod intensiv ishlab chiqarilmoqda, masalan, Chilidagi Atakama minerallari daryoga 720 tonnadan ortiq yod quyadi.
Rossiyada yodni sanoat ishlab chiqarish manbai xorijdagi kabi naftali burg'ulash suvlari bo'lib, ular tarkibida nafta, vikor suv o'tlari, shuningdek, Chilining ona jinslari (natriy) selitrasi mavjud bo'lib, bunday tuzdan yod ishlab chiqarishni sezilarli darajada oshiradi. .
Jismoniy kuch
Bug ', xuddi qutbsiz organik birikmalarda, masalan, benzolda bo'lgani kabi, xarakterli binafsha rangni namoyon qiladi, lekin qutbli spirtda jigarrang rang bilan almashtiriladi. Xona haroratida yod zaif porlashi bilan to'q binafsha rangli kristallarni hosil qiladi. Atmosfera bosimi ostida qizdirilganda, sharob sublimatsiyalanadi (vibratsiyalanadi), binafsha rangli bug'ga aylanadi; sovutilganda, yod kristallanadi va noyob holatni qoldiradi. Ushbu qobiq uchuvchan bo'lmagan uy xo'jaliklaridan yodni tozalash uchun ishlatiladi.
Kimyoviy quvvat
Kimyoviy jihatdan, hatto kamroq xlor va brom bo'lsa ham, faol yod qo'shing.
- Engil energiya bilan qizdirilganda, yod metallar bilan reaksiyaga kirishib, yodidlarni hosil qiladi:
- Yod faqat qizdirilganda suv bilan reaksiyaga kirishadi va yodli suv bilan reaksiyaga kirishmaydi:
- Elementar yod - oksidlovchi, mensch kuchli, past xlor va brom. Vodorod H 2 S, Na 2 S 2 O 3 va boshqa qo'shimchalar uni I ioniga yangilaydi -:
- Suv buzilganda, yod ko'pincha u bilan reaksiyaga kirishadi:
Zastosuvannya
Dori
Muqobil (norasmiy) tibbiyotda keng targ'ib qilingan bu da'vo shifokor sifatida tan olinmagan holda kam qo'llab-quvvatlanadi va ko'pincha turli reklama da'volari bilan birga keladi.
Div. shuningdek
Batareya ishlab chiqarish
Yod elektr transport vositalari uchun litiy-yodli akkumulyatorlarda musbat elektrod (oksidlovchi) sifatida ishlatiladi.
Lazer sintezi
Ushbu organik yod birikmalari uyg'ongan yod atomlarida yuqori energiyali gaz lazerlarini ishlab chiqarish uchun ishlatiladi (lazer termoyadroviy sintezi va sanoatida tadqiqotlar).
Radioelektron sanoat
Qolgan toshlarda keskin harakatlanuvchi suv nodir kristall displey generatorlari tomonidan yod ustiga quyiladi.
Yod ishlab chiqarish dinamikasi
Toksiklik
Yod zaharli moddadir. O'limga olib keladigan dozasi 2-3 g.Azot kislotasi darajasini va yurak-qon tomir tizimini buzadi. Yod bug'larini nafas olayotganda, bosh og'rig'i, yo'tal, diareya va ehtimol shishgan oyoq paydo bo'ladi. Agar u ko'zning shilliq qavati bilan aloqa qilsa, lakrimatsiya, ko'zlardagi oqlik va qizarish paydo bo'ladi. Agar u o'rtada bo'lsa, u kuchli zaiflik, bosh og'rig'i, qusish, diareya, tilda jigarrang qoplama, yurakdagi og'riq va yurak urish tezligini oshiradi. Bir kun o'tgach, olovlar yonib, jang maydonida qon paydo bo'ladi. Agar 2-3 kundan keyin davolanmasangiz, bu asoratlarni keltirib chiqarishi va miyokarditning boshlanishiga olib kelishi mumkin. Xursand bo'lmasdan, halokatli oxiri keladi.
Yod (I 2 ) davriy sistemaning 7-guruhida joylashgan D.I. Mendelev galogenlar kichik guruhida. Boshqa tomondan, yod atomida 1 juft bo'lmagan elektron mavjud; inert gaz qobig'i tugagunga qadar bitta elektron yo'qolmaydi. Atomning katta radiusi natijasida yod halogen kichik guruhida bo'lishidan qat'i nazar, o'ziga xos kuchga ega. Tashqi elektron yadrodan uzoqda joylashgan, shuning uchun yod uchun uni qo'shish osonroq, lekin uning o'ziga kirishi osonroq. Shuning uchun yod o'rinbosar sifatida ishlaydi.
Yodning jismoniy kuchi.
Yod yorqin kulrang-qora rangdagi kristallar bilan.
Yodning kimyoviy kuchi.
Yod ko'pchilik nometalllar bilan reaksiyaga kirishmaydi, faqat qizdirilganda va undan ham ko'proq metallar bilan reaksiyaga kirishadi. Masalan, boshqa barcha galogenlar tupurik bilan reaksiyaga kirishib, uch valentli tuz hosil qiladi. FeHal 3 , Yod esa atigi 2x valentlikka ega:
Fe + I 2 = FeI 2,
Suv bilan reaksiya quyidagicha davom etadi:
H 2 + I 2 = 2 Salom,
Reaksiya teskari va endotermikdir.
Yoda bilan obsessiya.
Reaksiya uchun yod laboratoriyadan chiqariladi:
MnO 2 + 4HI = MnI 2 + I 2 + 2H 2 O.
Yod keng tarqalgan kimyoviy elementdir. Ammo ko'pchilik spirtli ichimliklarni iste'mol qilishni yaxshi bilishmaydi, bu tibbiyot uchun muammodir. Biz ko'pincha qalqonsimon bez kasal bo'lganida tanadagi muammolar haqida gapiramiz. Yodning fizik va kimyoviy xossalarini kam odam biladi. Va bu tabiatda keng tarqalgan va inson hayoti uchun muhim bo'lgan noyob elementni qo'shishdir.
Yodning kimyoviy ta'siridan qochish mumkin, masalan, mahsulotlarda kraxmal borligi. Bundan tashqari, ko'plab odamlarni davolash uchun mikroelementlarni olishning ko'plab xalq usullari reklama qilinadi. Har bir inson qanday kuch borligini bilishi kerak.
Yodning Zagalniy xarakteristikasi
Metall bo'lmaganlarga etib boradigan faol mikroelementni qo'shish kerak. Davriy jadvalda galogenlar guruhi xlor, brom va ftordan iborat. Yod I belgisi bilan ko'rsatilgan va 53 seriya raqamiga ega. Ushbu mikroelementning nomi 19-asrdan boshlab juftning binafsha rangi orqali olingan. Hatto yong'oq yodi ham "binafsha, binafsha" deb talqin qilinadi.
Shunday qilib yod aniqlandi. Zavodda selitra ishlab chiqarishda ishlaydigan kimyogar Bernard Kurtua bu moddani juda tez kashf etdi. Kit sulfat kislota solingan probirkani ag‘darib, uni suv o‘tlari solingan bir qultumga botirdi, shundan so‘ng selitrani olish uchun foydalanildi. Bu holda binafsha rangga ega bo'lgan gaz ko'rindi. Bu Bernard Kurtuaga zarba berdi va u yangi elementni yasashni boshladi. Shunday qilib, 19-asrning boshlarida yod haqida ma'lum bo'ldi. 20-asrning o'rtalarida kimyogarlar bu elementni "yod" deb atay boshladilar, garchi u kengroq ma'noga ega edi.
Yodning kimyoviy kuchi
Rostini aytsam, ushbu elementning kimyoviy reaktsiyalarining faolligi haqida guvohlik berish uchun oddiy odamga hech narsa demang. Faqat kimyoni tushunadiganlar o'zlarining kimyoviy vakolatlarini tasvirlashda yordam berishlarini tushunadilar. Bu barcha metall bo'lmaganlarning eng faol elementidir. Yod boshqa moddalar, eruvchan kislotalar va noyob va o'ldiradigan birikmalar bilan reaksiyaga kirishishi mumkin. Men eng faol halogenlarni xohlayman.
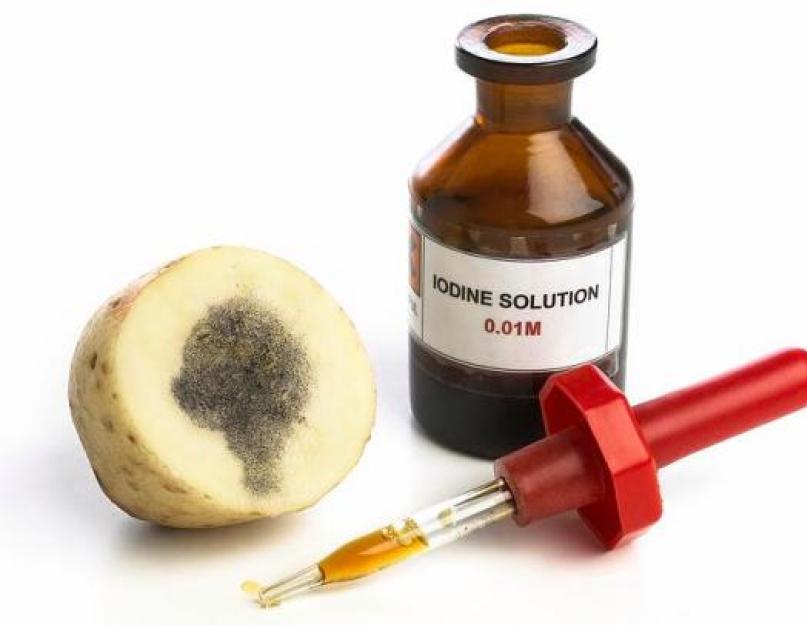
Qisqacha aytganda, yodning kimyoviy kuchini uning reaktsiyasidan ko'rish mumkin. Turli metallar bilan yod engil qizdirilganda reaksiyaga kirishadi, bunda yodidlar hosil bo'ladi. Ko'pincha yodid, kaliy va natriy. U suv bilan kamroq reaksiyaga kirishadi va boshqa elementlar bilan birlashadi. Sharob tarkibida azot, kislotalilik, ammiak va efir moylari mavjud. Biroq, yodning kimyoviy kuchi uning kraxmal bilan reaksiyasida eng katta. Kraxmalni olib tashlash uchun aralashmaga qo'shilsa, hid ko'k rangga aylanadi.

Jismoniy kuch
Barcha mikroelementlar orasida yod juda sezgir odamlar uchun muhimdir. Ko'pchilik uning o'ziga xos xususiyatlari haqida bilishmaydi. Yodning fizik va kimyoviy ta'siri maktabda qisqacha o'rganiladi. Asosan, bu element massasi 127 bo'lgan izotop bo'lib ko'rinadi. U barcha galogenlarning eng muhimi hisoblanadi. Shuningdek, uranning parchalanishi paytida chiqadigan radioaktiv yod 125. Tibbiyotda ushbu elementning massasi 131 va 133 bo'lgan individual izotoplari ko'proq uchraydi.
Barcha galogenlar faqat tabiiy ravishda qattiq bo'lgan yodni o'z ichiga oladi. Bundan tashqari, quyuq binafsha yoki qora kristallar yoki metall yaltiroq plitalarni ko'rishingiz mumkin. Hidi zaif xarakterli hidga ega, elektr toki urishi va grafitga o'xshash zarralar uchun yaxshi. Bunday tizimda bu mikroelement suvda yomon parchalanadi va keyin osongina gazga o'xshash holatga aylanadi. Sharob hatto xona haroratida ham binafsha rangli bug'ga aylanishi mumkin. Yodning bu fizik va kimyoviy xossalari ularni olib tashlash uchun ishlatiladi. Mikroelementni bosim ostida isitish va keyin uni sovutish uni uydan tozalaydi. Yod spirt, glitserin, benzol, xloroform yoki sulfat uglerod, spirtli kislota yoki binafsha turpda eritiladi.

Jerela Yoda
Ushbu mikroelementning organizmlarning ko'plab hayotiy funktsiyalari uchun ahamiyatidan qat'i nazar, yodni aniqlash qiyin. Yer qobig'ida kamroq, kamroq noyob elementlar mavjud. Ammo shuni ta'kidlash kerakki, yod tabiatda keng tarqalgan, uning parchalari hozirgi dunyoda oz miqdorda topilgan. Sharoblarning kontsentratsiyasi asosan dengiz suvida, suv o'tlarida, tuproqda va boshqa o'simliklar va mavjudotlarda bo'ladi.
Yodning kimyoviy kuchi uning shakli u yoqda tursin, tashqi ko'rinishida ham farq qilmasligi bilan izohlanadi. Ko'pincha u dengiz o'tlari eritmasidan va natriy nitrat ishlab chiqarishdan olinadi. Shunday qilib, yod Chili va Yaponiyada mavjud bo'lib, bu turdagi elementlarda etakchi hisoblanadi. Bundan tashqari, uni ko'plab sho'r ko'llar yoki nafta suvlari suvlaridan olish mumkin.
Yod inson tanasiga oziq-ovqat bilan kiradi. U tuproqlarda va o'rmonlarda mavjud. Viloyatimizda ale yodga boy tuproqlar keng tarqalgan. Shuning uchun yod ko'pincha foydalidir. Yod etishmasligidan kelib chiqadigan kasallikning oldini olish uchun element turli xil oziq-ovqat mahsulotlaridan qo'shiladi.

Uning organizmning hayotiyligidagi roli
Ko'pgina biologik jarayonlarda ishtirok etadigan bu mikroelementlarga yod qo'shiladi. Kichik miqdorda boylarda sharob bor. Ammo tirik organizmlar bundan ham muhimroqdir. Yod qalqonsimon bezda qalqonsimon gormonlar ishlab chiqarish jarayonida so'riladi. Hidlar organizmning hayotiy jarayonlarini tartibga soladi. Odamda yod yetishmasa, qalqonsimon bez kattalashib, turli patologiyalar paydo bo‘ladi. Noxush hid hosildorlikning pasayishi, zaiflik, bosh og'rig'i, xotira va kayfiyatning pasayishi bilan tavsiflanadi.
Tibbiyotda zastosuvannya
Eng katta qo'shimcha yodning 5% spirtli suyultirilishidir. Quloq atrofidagi terini dezinfeksiya qilish uchun foydalaning. Agar siz agressiv antiseptikni qabul qilmasangiz, pulpani yod va kraxmal bilan aralashtirishingiz kerak bo'ladi, masalan, Betadin, Yox yoki Yodinol. Mushaklardagi og'riqni yoki bo'g'imlarning patologiyasini yo'qotish uchun ko'pincha yodning steril kuchidan foydalaning, in'ektsiyadan keyin yod tarmog'ini olib tashlang.

Sanoatda zastosuvannya
Bu mikroelement sanoatda ham katta ahamiyatga ega. Maxsus kimyoviy sharoitlar tufayli yod turli o'simliklardan olinishi mumkin. Masalan, kriminologlar qog'oz yuzalarida barmoq izlarini aniqlash uchun foydalanadilar. Engil halogen lampalardan yodni keng ajratib oling. U fotografiya, kino sanoati va metallarni qayta ishlashda qo'llaniladi. Va shu bilan birga, bu mikroelement noyob kristall displeylarda, rangli oynalarni yaratishda, shuningdek, lazer termoyadroviy sintezi sohasida qo'llanila boshlandi.

Odamlar uchun muammo
Yodning hayotiy jarayonlardagi ahamiyatidan qat'i nazar, ko'p hollarda u odamlar uchun zaharli hisoblanadi. Ushbu aralashmaning 3 g dozasi yurak-qon tomir tizimining jiddiy buzilishiga olib keladi. Avvaliga odam o'zini zaif his qiladi, bosh og'rig'i, bosh aylanishi, yurak urishi tezlashadi. Agar siz yod bug'ini nafas olsangiz, u shilliq qavatning shishishi, ko'zning shilliq qavati va oyoqning shishishiga olib keladi. Yod bilan davolanmasa, o'limga olib keladi.
Yod (arzimas nomi - yod; qadimgi yunoncha ἰώdyķs - "binafsha (binafsha)") - kimyoviy elementlarning davriy jadvalining 17-guruh elementi (eski tasnifdan keyin - VII guruhning bosh kichik guruhining zo'rg'a mentli), beshinchi. davri, atom raqami 53. I belgisi bilan ko'rsatilgan (lat. Iodum). Kimyoviy faol bo'lmagan metall galogenlar guruhiga kiradi.
Oddiy onglar uchun oddiy suyuq yod (CAS raqami: 7553-56-2) - binafsha rangli metall yaltiroq qora-kulrang rangli kristallar, o'tkir hidni chiqaradigan binafsha bug'larini osongina yo'q qiladi. Rechvini molekulasi ikki atomli (formula I2).
Tarix
yod 1811 yilda ochilgan. Kurtua dengiz yosunlarining kulida, 1815 yildan r. Gey-Lyusak uni kimyoviy element sifatida ko'rib chiqa boshladi.
Ism va belgi
Elementning nomi Gey-Lyusak tomonidan taklif qilingan va yunonchaga o'xshaydi. ἰώdēs, itio-eēēs (lit. "binafsha o'xshash"), qaysi tikish rangi bilan bog'liq, deb frantsuz kimyogari Bernard Kurtua bashorat, dengiz o'tlari kul ona atirgul isitish sulfat kislota bilan konsentrlangan. Tibbiyot va biologiyada bu element va oddiy modda ko'pincha yod deb ataladi, masalan, XX asrning o'rtalariga qadar kimyoviy nomenklaturada ishlatilgan ismning eski versiyasiga o'xshash "distillangan yod".
Hozirgi kimyoviy nomenklaturada vikorist yod deb ataladi. Xuddi shu tushuncha boshqa ko'plab tillarda, masalan, nemis tilida uchraydi: umumiy til - Jod va terminologik jihatdan to'g'ri Iod. Shu bilan birga, 1950-yillarda element nomini o'zgartirib, Xalqaro global va amaliy kimyo ittifoqi J elementining belgisini I bilan almashtirdi.
Jismoniy kuch
Eng ilg'or aqllar uchun yod - bu metall porlashi va o'ziga xos hidli qattiq qora oltingugurtli suyuqlik. Bug ', xuddi qutbsiz organik birikmalarda, masalan, benzolda bo'lgani kabi, xarakterli binafsha rangni namoyon qiladi, lekin qutbli spirtda jigarrang rang bilan almashtiriladi. Xona haroratida yod zaif porlashi bilan to'q binafsha rangli kristallarni hosil qiladi. Atmosfera bosimi ostida qizdirilganda, sharob sublimatsiyalanadi (vibratsiyalanadi), binafsha rangli bug'ga aylanadi; sovutilganda, yod kristallanadi va noyob holatni qoldiradi. Ushbu qobiq uchuvchan bo'lmagan uy xo'jaliklaridan yodni tozalash uchun ishlatiladi.
Kimyoviy quvvat
Yod galogenlar guruhiga qo'shiladi.
Men bir qator kislotalarni eritaman: gidroiyodik (HI), yod (HIO), yod (HIO 2), yod (HIO 3), yod (HIO 4).
Kimyoviy jihatdan, hatto kamroq xlor va brom bo'lsa ham, faol yod qo'shing.
1. Metallar bilan yod, engil qizdirilganda, energetik reaksiyaga kirishib, yodidlar hosil qiladi:
Hg + I 2 = HgI 2
2. Yod faqat qizdirilganda suv bilan reaksiyaga kirishadi, yodid vodorod bilan reaksiyaga kirishmaydi:
I 2 + H 2 = 2HI
3. Atom yod - oksidlovchi, kamroq kuchli, past xlor va brom. Vodorod H 2 S, Na 2 S 2 O 3 va boshqa qo'shimchalar uni I ioniga yangilaydi -:
I 2 + H 2 S = S + 2HI
4. Suv buzilganda ko'pincha yod u bilan reaksiyaga kirishadi:
I 2 + H 2 O ↔ HI + HIO, pK =15,99
Mushuk qaltirab dumini silkitdi. Bu tovuq Ryaba haqidagi ertak emas, balki Yodning kashf etilishi tarixi. U natriy nitratni kaliy nitratiga aylantiruvchi Parij zavodida topilgan. Birinchisi to'liq ta'minlangan, ikkinchisi esa kam edi.
Qayta qurish suv o'tlarining tupurishi tufayli yo'qolgan qo'shimcha kul yordamida amalga oshirildi. 1808 toshning Vinayshli usuli, lekin ular sirni bilishmas edi. Men ichak nimaligini bilmasdim, robotlar uning orqasidan quvishdi. ikkita idishni o'tkazdi - sulfat kislotadan va fermentatsiyaning ortiqcha tuzlaridan.
Shamolda binafsha bug'lari uchib ketdi. Tsebachiv vlasnik zavodi Bernard Kurt. O'zim bir nechta testlarni o'tkazganimdan so'ng, keyin ma'lumotlarni boshqalarga uzataman. Pouch - 1814 yilda dunyo yangi elementning asos solinganligi haqida bilib oldi. Nim bo'lyapti yod.
Yodning kimyoviy va fizik xossalari
Kuchli Yoda obumovlení yogo roztashuvannyam u. 7-guruhgacha bo'lgan sug'urta elementi. U halogenlarni o'z ichiga oladi - eng faol metall bo'lmaganlar. Masalan, yodda elektron qobiq osongina qutblanadi.
Uning kosmosda ajralib turishi muhim emas. Bu boshqa elementlarning kationlarini metall bo'lmagan atomga 127 tagacha kirib borishiga imkon beradi. Elektron qobiqdagi "mehmonlar" ularni o'zgartirib, yodni barcha halogenlarning eng kovalentiga aylantiradi.
Oddiy qilib aytganda, element boshqa atomlar bilan ko'proq turli xil aloqalar hosil qilishi mumkin. Yod ko'pincha ijobiy polarizatsiyalanadi. Bu atom eng faol hisoblanadi. Siz uning rangini, o'sha binafsha rangni ko'rishingiz mumkin.
Atomdan yodga davriy jadvaldagi yozuvlar - tabiiy namuna. Bu atom massasi 127 bo'lgan barqaror izotop. 125, 129, 131 raqamlari bo'lgan boshqa atomlar alohida ajratilgan.

Ulardan Kozhen - radioaktiv yod. Izotoplar beta- va gamma-transferlarni hosil qiladi va tibbiyotda qo'llaniladi. Uran mahsulotlaridan radioaktiv yodni olib tashlang. Shunday qilib, yadro reaktorlari laboratoriya vazifasini bajaradi.
Standart yod mumkin ko'pchilik nometalllarni va taxminan 40% metallarni iste'mol qiladi. Olijanoblar, nafaqat boshqalar, 53-elementga munosabat bildirmaydilar. O'zaro ta'sir qilish mumkin emas, xuddi uglerod, kislotalilik va barcha inert gazlar kabi.
chi yod Bilasizmi, ulanish paytida siz yordamga qo'ng'iroq qilishingiz mumkin. Sof element parchalanishi mumkin. Jodite, demak, o'tloq va o'tloq-yer atomlari, rozchinni bilan yarim ko'ngildan gapiring. Ko'rinib turibdiki, 53-element suvda juda qizdirilganda paydo bo'ladi.
Rozchin yod organik moddalardan foydalansangiz, olib tashlash oson. Glitserin, sulfat uglerod yoki xlorli ugleroddan foydalaning. U nordonsiz chakana sotuvchi bo'lgani uchun, u binafsha rang bilan boyib ketishi mumkin. Radini nordon atomlarini o'z ichiga olganligi sababli, yod ekstrakti.
Sof shaklda, xona haroratida yod binafsha-qora rangga ega. Blisk rechovini metalleviy, yig'ish tegirmoni -. Hidi kuchli - kub santimetr uchun 5 g gacha.

Kristallar har biri 2 atomdan iborat molekulalardan iborat. Gazga o'xshash zavodda harorat 183 darajadan oshadi. Yodadan xalos bo'ling Kamdan-kam hollarda, hatto Selsiy shkalasi bo'yicha 114 dan yuqori bo'lishi mumkin.
Zastosuvannya yod
Yodga tuzlar qasam ichish sanoatida vikorist. Mova avtomobil faralari va maxsus effektli lampalar haqida. Asosiy ta'sir yorug'lik o'zgarishiga yo'l qo'ymaslik uchun filtrlardan foydalanishdir. Suvlar ularni vaqti-vaqti bilan zararsizlantirish qanchalik muhimligini biladi.
Polaroidni nomlash jarayoni, birinchi navbatda, fotografik mistikaning foydasiga aylandi. Jumboq muallifi ingliz Uilyam Talbot. U 19-asrning taniqli kimyogari va fizigi edi.
21-asr raqamli texnologiyalar tomonidan boshqariladi. Tim yod navini olish uchun dozaning salbiy fotosuratini olib tashlashga hojat yo'q. Jelatin bilan birlashganda, u astar qoplamasini qoplash uchun ishlatilishi mumkin bo'lgan emulsiya beradi. Yorug'lik sirtdan o'chadi va ko'rish boshlanadi. Ko'proq yorug'lik - ko'proq metall. Rasm shu tarzda paydo bo'ladi.
Yodning turg'unligi metallurgiyadan bilim. Birlashtirilgan elementlar yuqori tozalikdagi metallarni saqlashga yordam beradi. Issiqlik yo'lini yotqizishda sanoatchilar, masalan, vanadiy va tsirkonyumni ajratib olishadi. Ushbu refrakter elementlar raketa qotishmalari va yadroviy reaktor materiallari uchun zarurdir.
Avtomobil podshipniklarida ham topishingiz mumkin yod. Yakiy his qilyapsanmi? Element moyga qo'shiladi. Titan va zanglamaydigan po'lat uchun tavsiya etiladi. Qayta ishlash qismlarga standartdan 50 barobar jozibali ko'rinishga imkon beradi. Bu mastilda tarkibida 1-2% dan kam yod borligiga qaramasdan.

53-elementsiz tibbiyotni tasavvur qilib bo'lmaydi. Tanadagi yod qalqonsimon bezning ishlashini, TSH, T3 va T4 gormonlarini ishlab chiqarishni nazorat qiladi. Agar element etishmayotgan bo'lsa, bo'qoq rivojlanadi, bu saratonga olib kelishi mumkin.
Bunday holda, tananing o'zi nutq ishlab chiqara olmaydi. Yodni teridan, oziq-ovqat qo'shimchalaridan va dori-darmonlardan olish kerak. Qolganlarini taxmin qilish oson" Yodomarin».
Ular, ayniqsa, dengizdan uzoqda bo'lgan joylarda, tug'ilmaganlarga aytishlari kerak. Bunday hududlarda, qoida tariqasida, asosan okeanlar va ularning suvlari yaqinida joylashgan 53 elementning etishmasligi mavjud.
Dori vositalarining qolgan ishlanmalaridan biri ko'k yod. Kraxmalni qo'shishdan oldin, qo'shimcha quritish uchun kraxmal rangini o'zgartiradi. Kraxmal, shunday qilib, alkogol va boshqa keraksiz "qo'shimchalar" ta'sirini zararsizlantiradi. Shifokorlar hatto bu eliksirga ichki siqilish uchun ruxsat berishadi. yod bilan yuvish. Men qotib qolmoqchiman va aqldan ozishni xohlayman tuz, soda, yod.
Yod vannasi ham barqaror, ham radioaktiv shakllarda ruxsat etiladi. Shunday qilib, 131 izotopi qalqonsimon bezning faoliyatini yangilash uchun ishlatiladi. Jarayonlar qat'iy standartlashtirilgan; ortiqcha radioaktiv yod parchalari saratonga olib kelishi mumkin.
Vidobutok yod
Qancha yod daryoda poyabzalni ko'ryapsizmi? 30 ming tonnaga yaqin. Elementning jahon zaxiralari taxminan 15 000 000 tonnani tashkil qiladi. Ularning aksariyati ishga qabul qilinadi spolukah yoda. Toza ko'rinishdagi odamda tomirlar kamdan-kam hollarda so'nadi.
Tabiiy to'planishlardan - suv o'tlaridan oqimlarni ko'rish usuli hali ham dolzarbdir. Bir tonna quritilgan kelp 5 kilogrammni tashkil qiladi yod.