11 მენეჯერი აგრძელებს ქიმიური ძალების თემას, რაც კიდევ ერთხელ არის მჟავები და ფუძეები.
თეორია დღემდე No11 ODE ქიმიაში
მჟავები
Იცი რა მჟავები - ცე ქიმიური სპოლუკები, რომლებიც დისოცირდებიან პროტონებზე (H+). გამოიყენეთ უმარტივესი მჟავები - მარილმჟავა (HCl), გოგირდმჟავა (H2SO4), აზოტის მჟავა (HNO3).
ფონდები
ფონდები g - მეტყველება, რომელიც იშლება იონის ჰიდროქსიდში (OH-).
უმარტივესი კონდახებია წყალგაუმტარი კალიუმი და ნატრიუმი (KOH და NaOH). მათ უწოდებენ "დიკიმს", სიტყვის თვალსაზრისით, არა უსაფუძვლოდ. სუნი გამომწვევად მატულობს და ტყდება კანზე მოხვედრისას. ამასთან, არ არის უსაფრთხო ვარტოს გაუფასურება.
შემდეგ, მოდით გადავიდეთ ამ კლასების ქიმიური ძალების განხილვაზე.
მჟავების ქიმიური ძალა
ჩვენ გადავხედეთ მჟავების კლასიფიკაციას. მე გირჩევთ, რომ ქიმიური ხელისუფლების შემდგომი გამოკვლევების დაწყებამდე უნდა გამოიცნოთ გლობალური გონების მჟავების კლასიფიკაცია.
შემდეგ, მოდით გადავიდეთ მჟავების დომინირებაზე:
- რეაქცია ძირითად ოქსიდებთან: როგორც კონდახი, რეაქცია იყო გამოწვეული კალციუმის ოქსიდზე მარილმჟავასთან. პროდუქტებთან ამ რეაქციაში, є sil არის კალციუმის ქლორიდი, რომელიც სვამს გზებს ტყეში და წყალი, იაკუ მი პ'ემო დღე.
- რეაქცია ამფოტერულ ოქსიდებთანმაგალითად, თუთიის ოქსიდი:
- მჟავების რეაქცია მდელოებიდანატარებს ნეიტრალიზაციის სახელს. კონდახის მსგავსად, ნატრიუმის ჰიდროქსიდის რეაქცია მარილმჟავასთან იყო გამოწვეული, პროდუქტები - სიმტკიცე (ამ კონდახის სამზარეულოსთვის) და წყალი.
- მარილებით გაცვლითი რეაქციები, რეაქციის შედეგად მეტყველებისა და გაზის გამიჯვნა შეუძლებელია. როგორც კონდახი, რეაქცია გამოიწვია ბარიუმის ქლორიდზე გოგირდმჟავასთან, რის შედეგადაც იქმნება ბარიუმის სულფატის ნალექი და მფრინავი ქლორიდი წყალი.
- რეაქცია გაურკვეველი საფუძვლებითმაგალითად, მიდი ჰიდროქსიდი გოგირდის მჟავისგან:
- სუსტი მჟავების მოპოვება სხვადასხვა მარილებიდანმაგალითად, ფოსფორის და მარილმჟავას მარილები:
- რეაქცია ლითონებთანრა უნდა დავდგეთ წნევის გვერდით, სანამ წყალი - კონდახი - მაგნიუმის რეაქცია მარილმჟავასთან:
ქიმიური ენერგიის ბაზები
საფუძვლების ქიმიური ძალების აღლუმის წინ, უმჯობესია გამოიცნოთ საფუძვლების კლასიფიკაცია.
შემდეგ გადავიდეთ საძირკვლების ქიმიური ძალების ანალიზზე:
- მჟავებთან რეაქცია გამოწვეულია - ნეიტრალიზაციის რეაქცია
- რეაქცია ამფოტერული ბაზებითმაგალითად, თუთიის ჰიდროქსიდი და ალუმინი:
- რეაქცია მჟავა ოქსიდებთანმარილით და წყლით. მარაგი - ნატრიუმის ჰიდროქსიდის რეაქცია სილიციუმის ოქსიდთან (დამუშავებული ფოლადი):
- მარილებით გაცვლითი რეაქციები yakscho utvoryuєtsya ალყა ან გაზი (amіak). კონდახი - ბარიუმის ჰიდროქსიდის რეაქცია ნატრიუმის სულფატთან:
ODE-ს ხელმძღვანელის ტიპიური ვარიანტების ანალიზი ქიმიაში
დავალების პირველი ვარიანტი
მარილმჟავასთან რეაქცია შედის:
- სრიბლა ნიტრატი
- ბარიუმის ნიტრატი
- სრიბლო
- სილიციუმის ოქსიდი
მოდით შევხედოთ კანის ვაპადოკს:
- მარილმჟავა და ნიტრატი srіbla. Oskilki ნიტრატი sribla - ძლიერი, გაცვლითი რეაქცია შესაძლებელია, როგორც რეაქცია წამლის ნალექის გაზი. როგორც პროდუქტი, აზოტის მჟავა (როზჩინა) შეიძლება დაიშალა და ქლორიდის შრიბლოა (გაურკვეველი - თეთრი სირიის ალყა ). ეს ნიშნავს, რომ რეაქცია შესაძლებელია და ჩვენ უნდა წავიდეთ.
- ბარიუმის ნიტრატი და მარილმჟავა. რეაქციის პროდუქტების გაცვლა საცალო (აზოტის მჟავა და ბარიუმის ქლორიდი), რეაქციამ არ იმუშავა .
- სრიბლო დგანან ძაბვების რიგში წყლის შემდეგ, მდე არ რეაგირებს არაჟანგვის მჟავებთან ვ.
- სილიციუმის ოქსიდი - მჟავა ოქსიდი і არ რეაგირებს მჟავებთან .
მჟავე გემოვნება, კარგი მაჩვენებლები, ელექტრული გამტარობა, ურთიერთქმედება ლითონებთან, ძირითად და ამფოტერულ ოქსიდებთან, ფუძეებთან და მარილებთან, დასაკეცი ეთერების შეერთება სპირტებთან - არაორგანული და ორგანული მჟავების სიმძლავრისა და დამწვრობის ძალა.
1. წყალში მჟავა იშლება კატიონებად, წყალად და მჟავე ჭარბი ანიონებად, მაგალითად:
მჟავებში განსხვავებები ცვლის მაჩვენებლების ფერს: ლაკმუსი - ჩერვონიაში, მეთილის ფორთოხალი - ერიზიპელაში, ფენოლფთალეინის ფერი არ იცვლება.
2. რაზჩინის მჟავები რეაქციაში შედის ლითონებთან, რომლებიც ელექტროქიმიურ სერიაში დგანან დღეზე მეტი ხნის განმავლობაში, მთელი რიგი გონების ხანგრძლივობით, რომელთაგან ყველაზე მნიშვნელოვანია ვარდისფერი მარილის რეაქციის შედეგად მიღებული ხსნარი. არაორგანული და ორგანული მჟავების სიმძლავრის შემხედვარე შეგვიძლია ვთქვათ, რომ HNO 3 და H 2 SO 4 (კონს.) ლითონებთან (ცხრილი 19) ურთიერთქმედება მოგვიანებით მიმდინარეობს, მაგრამ მჟავების მნიშვნელობის სპეციფიკა მოგვიანებით იქნება ახსნილი.
ცხრილი 19
ორმხრივი პროდუქტები
მარტივი გამოსვლები აზოტის და გოგირდის მჟავებით

3. არაორგანული და ორგანული მჟავები ურთიერთქმედებენ გონებისთვის ძირითად და ამფოტერულ ოქსიდებთან, რაც აყალიბებს განსხვავებულ ძალას:

4. მე და სხვა მჟავები რეაგირებენ ფუძეებთან. მდიდარ ძირითად მჟავებს შეუძლიათ ანეიტრალონ როგორც საშუალო, ასევე მჟავე მარილები (ნეიტრალიზაციის რეაქციები):

5. რეაქცია მჟავებსა და მარილებს შორის მით უფრო იმ შემთხვევაში ხდება, რადგან იქმნება აირი ან ნალექი:

ფოსფორის მჟავას H 2 PO 4 ურთიერთქმედება ორთქლთან გამოიყენება დარჩენილი არაშეღებილი ნალექის დასახლებული ზედაპირის მეშვეობით კალციუმის ფოსფატ Ca 3 (PO 4) 2-მდე.
6. დასაკეცი ეთერები არა მხოლოდ ხსნიან ორგანულ მჟავებს, არამედ თანდათანობით ღრმა დონემდე:

ალი და არაორგანული მჟავები, მაგალითად აზოტის და გოგირდის:
მსგავსი რეაქცია ცელულოზის ორი და სამი ჰიდროქსოჯგუფის მონაწილეობით її nitruvannі იწვევს დასაკეცი ეთერების აღმოფხვრას: di-і ტრინიტროცელულოზა - აუცილებელი გამოსვლები უკვამლო დენთის წარმოებისთვის.
ერთ დროს, მინერალური და ორგანული მჟავების წარმომადგენლები შეიძლება იყოს განსაკუთრებით ძლიერი.
აზოტის აზოტის ინდივიდები HNO 3 I არის SIRCHA 4 (კონს.) მჟავების კონცენტრაცია omnimovy Tim, იგივე ორმხრივი რეზერვუარებით (ლითონები არალითონებით) Oxyluvachi Vistupatim არა Kationi N+, არამედ NITRAT-I SULFAT. -იონი. ლოგიკურია აღინიშნოს, რომ ასეთი რეაქციების შედეგად არ იხსნება H 2 წყალი, არამედ ჩნდება სხვა გამოსვლები: ზოგადი სიძლიერე და წყალი, ისევე როგორც ნიტრატის ან სულფატის იონების შეყვანის ერთ-ერთი პროდუქტი ნიტრატში ან სულფატში. მჟავების კონცენტრაციის დაქვეითება, ლითონის პოზიცია სერიულ დაძაბულობაში და გონების რეაქციები (ტემპერატურა, ლითონის დეტალების ხარისხი).
უნდა აღინიშნოს, რომ მეტალების რეაქციის მესამე პროდუქტი ციმურ მჟავებთან ხშირად გვხვდება "ბუკეტში" - შეურიეთ სხვა პროდუქტებს, მაგრამ მე-19 ცხრილში მითითებული იყო ყველაზე მნიშვნელოვანი პროდუქტები.
HNO 3 და H 2 SO 4 (კონც.) ქიმიური ქცევის თავისებურებები ნათლად ასახავს ქიმიური სიცოცხლის თეორიის თეზისს მეტყველების მოლეკულებში ატომების ურთიერთშეფრქვევის შესახებ. Yogo შეიძლება stitched და კონდახით ძალა ორგანული მჟავების, მაგალითად otstovoy და murashinoy.
ოპტიკური მჟავა CH 3 COOH, ისევე როგორც სხვა კარბოქსილის მჟავები, შურს იძიებენ ნახშირწყლების რადიკალების მოლეკულაზე. შესაძლებელია ახალი რეაქციები წყალში ატომების ჰალოგენის ატომებით ჩანაცვლებისთვის:
მჟავის მოლეკულაში ჰალოგენის ატომების შემოდინების ქვეშ, დისოციაციის საფეხურები ძლიერად მოძრაობს. მაგალითად, ქლოროძმარმჟავა შეიძლება იყოს 100-ჯერ უფრო ძლიერი ვიდრე ოქტომა (რატომ?).
მურაშის მჟავა HCOOH, თავის მხრივ, არ არის ნახშირწყლების რადიკალის მოლეკულაში. ახლის ჩანაცვლება წყლის ატომზე შურისძიების მიზნით, და ამაზე - მეტყველება ორმაგი ფუნქციით - ალდეჰიდის მჟავა და სხვა კარბოქსილის მჟავების მხარეს, იძლევა "ციმბირის სარკის" რეაქციას:

ნახშირბადის მჟავა, რომელიც იხსნება, H 2 CO 3 იშლება წყალში და ნახშირორჟანგად, რომელიც გადაიქცევა ამონიუმის ბიკარბონატად ჭარბი ამიაკით.
მჟავებიმეტყველების ნაკეცებს უწოდებენ, რომლებშიც მოლეკულების საწყობში არის ატომები და წყალი, ზდატნ_ზამ_შჩაცია ან ცვლის ლითონის ატომებს და მჟავას ჭარბს.
მჟავის მოლეკულებში მჟავიანობის არსებობის ან არარსებობის გამო, ისინი იყოფა მჟავეებად(H 2 SO 4 გოგირდმჟავა, H 2 SO 3 გოგირდმჟავა, HNO 3 აზოტის მჟავა, H 3 PO 4 ფოსფორის მჟავა, H 2 CO 3 ნახშირმჟავა, H 2 SiO 3 სილიციუმის მჟავა) და მაწონის გარეშე(HF ჰიდროქლორინის მჟავა, HCl მარილმჟავა, HBr ბრომის მარილმჟავა, HI იოდის მჟავა, H 2 S სულფონის მჟავა).
მჟავის მოლეკულაში წყლის ატომების რაოდენობის მიხედვით, მჟავები არის ერთბაზისური (1 H ატომით), ორფუძიანი (2 H ატომით) და სამფუძიანი (3 H ატომით). მაგალითად, აზოტის მჟავა HNO 3 არის ერთბაზისური, ნამსხვრევები მოლეკულაში არის ერთი ატომი წყალი, გოგირდის მჟავა H 2 SO 4 – ორმაგი დაფუძნებული და ა.შ.
არსებობს რამდენიმე არაორგანული ველი წყლის ატომებზე შურისძიების მიზნით, შენობები, რომლებიც უნდა შეიცვალოს მეტალმა.
მჟავის მოლეკულის ნაწილს წყლის გარეშე ეწოდება მჟავას ჭარბი.
მჟავას ჭარბიშეიძლება წარმოიქმნას ერთი ატომისგან (-Cl, -Br, -I) - უბრალოდ მჟავე ექსცესები, და შეიძლება - ატომების ჯგუფიდან (-SO 3, -PO 4, -SiO 3) - ყველა დასაკეცი ექსცესი.
წყალხსნარებში, მჟავის გაცვლისა და ჩანაცვლების რეაქციების დროს, ჭარბი არ იშლება:
H 2 SO 4 + CuCl 2 → CuSO 4 + 2 HCl
სიტყვა უწყლონიშნავს უწყლო, რაც ნიშნავს მჟავას წყლის გარეშე. Მაგალითად,
H 2 SO 4 - H 2 O → SO 3. მჟავე მჟავები და ანჰიდრიდები არ ირეცხება.
დაეუფლეთ მჟავას სახელწოდებას ელემენტის მჟავას სახელის სახით (მჟავა წარმომქმნელი აგენტი) დაბოლოებით „ნაია“ და უფრო მეტად „ვა“-ს დამატებით: H 2 SO 4 - სირჩანი; H 2 SO 3 - ქვანახშირი; H 2 SiO 3 - სილიციუმი და ა.შ.
ელემენტს შეუძლია დააკმაყოფილოს მჟავე მჟავების გაჟონვა. სხვადასხვა ადგილას, მჟავების სახელებს ექნებათ იგივე დაბოლოებები, თუ ელემენტი აჩვენებს მაღალ ვალენტობას (მჟავას მოლეკულას აქვს ატომების დიდი რაოდენობა მჟავაში). ეს ელემენტი აჩვენებს უფრო დაბალ ვალენტობას, მჟავას სახელით დამთავრებული იქნება „ზავოი“: HNO 3 - აზოტის, HNO 2 - აზოტის.
მჟავების კონტროლი შესაძლებელია წყალში ანჰიდრიდების ცვალებადობით.ზოგჯერ, ვინაიდან ანჰიდრიდები არ განსხვავდებიან წყალში, მჟავა შეიძლება გამოკლდეს სხვა ძლიერ მჟავას საჭირო მჟავას სიძლიერემდე. ეს მეთოდი დამახასიათებელია როგორც მჟავე, ასევე არამჟავე მჟავებისთვის. უმჟავო მჟავები ამოღებულია წყლისა და არალითონისგან ყველაზე პირდაპირი სინთეზით, წყლიდან წყლის მოცილების შემდგომი განსხვავებებით:
H 2 + Cl 2 → 2 HCl;
H2+S → H2S.
გაზის მსგავსი მდინარეების მოცილება HCl і H 2 S є მჟავებით.
უდიდესი გონებისთვის მჟავები იშვიათია და მძიმე.
მჟავების ქიმიური ძალა
მჟავების ტესტის განსაზღვრა ინდიკატორებზე. მდოგვის მჟავები (სილიციუმის მჟავა) კარგად არის განაწილებული წყალში. სპეციალური გამოსვლები - ინდიკატორები საშუალებას გაძლევთ განასხვავოთ მჟავას არსებობა.
ინდიკატორები - დასაკეცი ეკლესიები. stinks ცვლის zabarvlennya fallow in vіd vzaєmodії z სხვადასხვა ქიმიური გამოსვლები. ნეიტრალურ ჯიშებში - სუნი შეიძლება იყოს ერთი, საფუძვლების შემთხვევაში - სხვაგვარად. მჟავასთან ურთიერთობისას სუნი ცვლის თავის დაბინძურებას: მეთილის ნარინჯისფერი ინდიკატორი წითლდება, ლაკმუსის მაჩვენებელიც წითელია.
ურთიერთქმედება საფუძვლებთან წყლისა და მარილის ხსნარებით, რომელშიც არის მჟავის შემდგომი ჭარბი (ნეიტრალიზაციის რეაქცია):
H 2 SO 4 + Ca (OH) 2 → CaSO 4 + 2 H 2 O.
ურთიერთქმედება ბაზის ოქსიდებთან წყლისა და მარილის ხსნარებით (ნეიტრალიზაციის რეაქცია). სიძლიერე შურისძიების მიზნით მჟავას ჭარბი რაოდენობით, რადგან მან გაიმარჯვა ნეიტრალიზაციის რეაქციაში:
H 3 PO 4 + Fe 2 O 3 → 2 FePO 4 + 3 H 2 O.
 ურთიერთქმედება ლითონებთან.
მჟავებისა და ლითონების დანაშაულთან ურთიერთქმედებისთვის, თქვენ უნდა დაიბანოთ გონება:
ურთიერთქმედება ლითონებთან.
მჟავებისა და ლითონების დანაშაულთან ურთიერთქმედებისთვის, თქვენ უნდა დაიბანოთ გონება:
1. ლითონი შეიძლება გახდეს აქტიური მჟავიანობის თვალსაზრისით (რიგ აქტივობებში ლითონები არიან დამნაშავე წყალში ამოსვლაში). რატომ არის მეტალი უფრო მნიშვნელოვანი რიგ აქტივობებში, ის უფრო ინტენსიურია მჟავებთან ურთიერთქმედებისას;
2. მჟავა შეიძლება იყოს ძლიერი (წყლის მისაცემად H+).
მჟავას ლითონებთან ქიმიური რეაქციების დროს ძალა იხსნება და ჩანს წყალი (არსებობს ლითონების კომბინაცია აზოტთან და კონცენტრირებულ გოგირდმჟავებთან):
Zn + 2HCl → ZnCl 2 + H 2;
Cu + 4HNO 3 → CuNO 3 + 2 NO 2 + 2 H 2 O.
ამოიწურა საკვები? გსურთ გაიგოთ მეტი მჟავების შესახებ?
დამრიგებლის დახმარების მისაღებად - დარეგისტრირდით.
პირველი გაკვეთილი უფასოა!
საიტი, სრული ან პირადი ასლი მასალის ორიგინალზე გაგზავნილი obov'yazkove.
პრეზენტაციის წინასწარ დასაჩქარებლად, შექმენით თქვენი საკუთარი Google Post და იხილეთ აქამდე: https://accounts.google.com
წარწერები სლაიდამდე:
Vikladach: Brisket Tetyana Viktorivna გაკვეთილის თემა: მჟავები
Cіlі Уроку: Узагальнити та Закріпити знання за класификацію, номенклатуру, властивості органічних та неорганічних кислот nnya reaccій u moleculyarnomu და ionnomu viglyadі
მჟავების მნიშვნელობა მჟავები ბუნებაში მჟავების კლასიფიკაცია
ელექტროლიტებს მჟავებს უწოდებენ, ასეთი კათიონების დისოციაციის დროს იხსნება მხოლოდ ჰიდრატირებული წყლის იონები (H 3 O +). 1. მჟავების დანიშვნა
1923 წელს. პროტოლითური თეორია გაავრცელა ბერნსტედ-ლორიმ. მჟავები არის მოლეკულები, რომლებიც არის chi და ion, და რომლებიც არიან კათიონების დონორები წყლის H +-ისთვის. H+ კატიონს პროტონი ეწოდება, ამიტომ თეორიას პროტოლითური ეწოდება. მჟავების ელექტრონული თეორიისა და ამერიკელი ქიმიკოსის საფუძვლების შესაბამისი გ.მ. ლუისის მჟავები რეაგენტებია და ისინი ელექტრონების მიმღები არიან.
2. მჟავები ბუნებაში მურახა პირში კბენისას, ჭიანჭველას შურისძიების მიზნით. Її vikoristovuє და ჭინჭრის.
ობობა პედიპალპიდა თავის კარიბჭეს ისვრის ყვავილით, რომელიც წარმოიქმნება ოკტური მჟავისგან. ვიკორისტის ბრტყელი ათასწლეული საშინლად საშინელია - ჰიდროციანმჟავას ფსონი. Fly agaric vikoristovuyut іbotenovou მჟავა და її დაკეცილი იატაკიდან - მუსიმოლი. Ruinuvannya gіrskih porіd რომ utvorennya ґruntu. ლიქენები ხედავენ მჟავას, გარდაქმნიან გრანიტს ნანგრევებად.
ვიტამინები: ასკორბინის, ფოლიუმის, ოროტოვის, პანგამოვის, ნიკოტინის და სხვა. ჰიალურონის მჟავა კარამელის ზეთის მთავარი კომპონენტია. ამინომჟავები ქმნიან ცილებს. მილში მარილმჟავა ააქტიურებს ფერმენტ პეპსინოგენს, რომელიც ანადგურებს ცილებს და ასევე ანადგურებს დამპალ მიკროფლორას. მჟავები ადამიანებში.
საწყობის უკან: Kisen m_styat: H NO 3 , H 2 SO 3 ; მჟავის გარეშე: HCl, H2S. საფუძვლიანობისთვის: (მჟავას ფუძეულობა განისაზღვრება იმ კათიონების რაოდენობით, რომლებიც იქმნება დისოციაციის დროს). მონობაზური: HBr, HNO 2; Bibasic: H 2 S , H 2 SO 4; მდიდარი ბაზა: H 3 PO 4. მენეჯერი. დაასახელეთ მჟავები და მიეცით კლასიფიკაცია: HClO3, H2S, H3PO4, HBr. 3. მჟავების კლასიფიკაცია:
ურთიერთქმედება ლითონებთან, roztasovannymi ელექტროქიმიურ სერიაში, ლითონების ძაბვა წყალამდე. 4. მჟავების ქიმიური დომინირება: ოქსიდიზატორი, ჟანგვის აგენტი, მაგნიუმის აცეტატის დაჟანგვა
ურთიერთქმედება ძირითად და ამფოტერულ ოქსიდებთან. დამოუკიდებლად:
ურთიერთქმედება განსხვავებულ და არაგანსხვავებულ ფონდებთან. მათ შეუძლიათ გამოიყენონ საშუალო და მჟავე მარილები. ნეიტრალიზაციის ცე რეაქციები. თვითდაჭერა: 1 მოლი (ძალიან ბევრი) 1 მოლი ნატრიუმის ჰიდროსულფატი (მჟავე სიძლიერე) 1 მოლი 2 მოლი ნატრიუმის სულფატი (საშუალო სიძლიერის)
ძლიერი მჟავა კარგია სუსტი მჟავის მოსაპოვებლად არაკოროზიული მარილისგან. დამოუკიდებლად:
მარილმჟავა ფოლადი და chavunnyh virobіv იყიდება znyatya მასშტაბი ორთქლის ქვაბებში ფტორმჟავა HF. გაჟონეთ ხე ტერმიტების და სხვა კომის მოსაკლავად. მჟავების სტაზირება
გოგირდის მჟავა ფოსფორისა და აზოტის დანამატების წარმოებისთვის
აზოტის მჟავა
დავალება 1. დაწერეთ ფორმულა და დაახასიათეთ მჟავები მათი კლასიფიკაციის მიხედვით: სილიციუმის მჟავა, ჰიდროფთორმჟავა. ამოცანა 2. ფოსფორის მჟავა ყველაზე რეაქტიული რეაქტივია: K, SO 2, Na 2 SO 4, Na 2 CO 3, MgO, Ag, Ba (OH) 2. დაფიქსირდა
დავალება 1. H 2 SiO 3 - კისნევმისნა, ორფუძიანი, ურღვევი, სუსტი HF - მჟავე, მონობაზური, როზჩინნა, სუსტი.
Dyakuyu გაკვეთილისთვის!!!
მოლეკულური სიცოცხლის ცერემონია. მჟავის მოლეკულებში ატომები შეკრულია კოვალენტური პოლარული ბმებით. რაც უფრო მეტია კავშირების პოლარიზაცია წყლის ატომს შორის, ძველს, ელექტროუარყოფით ატომს (მაწონი, ცისფერი ან ჰალოგენის ატომი), მით მეტია კავშირები, მით უფრო გლუვი დისოციაცია და ჰეტეროლიზური გზა. და ეს ნიშნავს, რომ წყალში მეტი კათიონი იქნება და შუაში მეტი მჟავე იქნება. დიდი მნიშვნელობა აქვს არა მხოლოდ პოლარობას, არამედ კავშირის პოლარიზაციას. პოლარიზაცია - კავშირის დანიშნულებაა პოლარიზაცია სინგ რეაგენტების გავლენის ქვეშ. მაგალითად, წყლის მოლეკულები.
მჟავების კლასიფიკაცია
მჟავების კლასიფიკაცია მჟავაში ატომების ნაცვლად, ატომების რაოდენობა წყალში, განსხვავება და სხვა ნიშნები. Div Tab. 1.
|
კლასიფიკაციის ნიშნები |
მჟავა ჯგუფები |
კონდახი |
|
მაწონი ვარ |
||
|
ბეზკისნევი |
||
|
საბაზისო (ატომების რაოდენობა წყალში, შენობების შემცვლელები ლითონისთვის) |
მონობაზური |
|
|
ორმაგი ძირითადი |
||
|
ტრიბაზინი |
||
|
როზჩინისტი |
Საცალო |
|
|
გაურკვეველი |
||
|
ლეტკისტი |
||
|
ნელეთკი |
||
|
ელექტრული დისოციაციის ეტაპები |
H2SO4, HNO3, HCl |
|
|
სტაბილურობა |
სტაბილური |
H3PO4, H2SO4, HCl |
|
არასტაბილური |
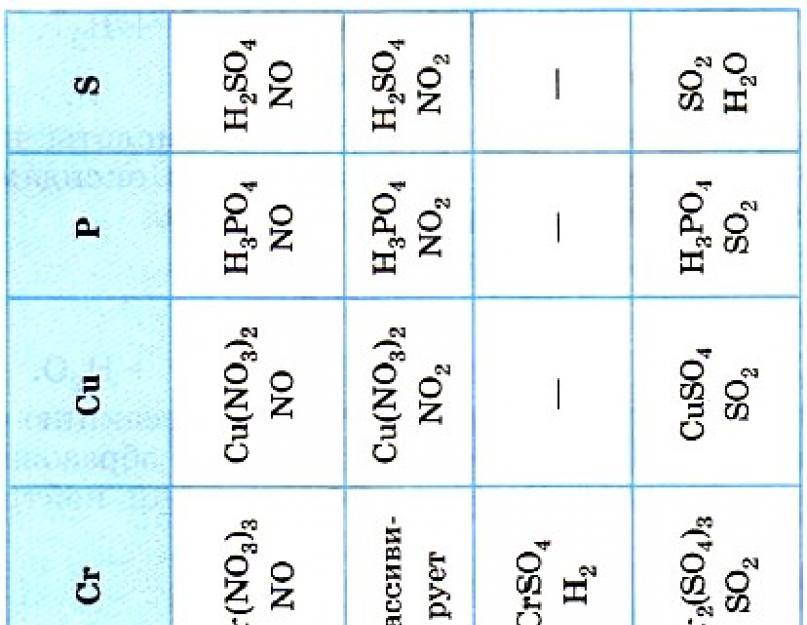
1. რეაქცია ლითონებთან.
ლითონები, ლპება რიგი ლითონის სტრესების დროს (ნახ. 1.) წყალამდე, აშორებს წყალს მჟავებიდან.
Mg + 2HCl = MgCl2 + H2
W კონცენტრირებულია აზოტიі სირქანიმჟავა რეაქციები სცილდება ანიონის სიჭარბეს. წყალი არ ჩანს. მალ. 2.
Cu + 4HNO3(კინეტები) = Cu (NO3)2 + 2NO2 + H2O
Cu + 2H2SO4(კინეტები) = Cu SO4 + SO2 + H2O
2. რეაქცია ძირითად და ამფოტერულ ოქსიდებთანმარილით და წყლით.
K2O + HNO3 = KNO3 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
3. რეაქცია მარილებთან.მჟავები რეაგირებენ სხვადასხვა მარილებთან, რეაქციის შედეგად ერთ-ერთი პროდუქტი ალყაში ხვდება, გაურკვეველი ნახევარგამოყოფის დასახლების ნატეხები მარჯვნივ გადაინაცვლებს და პრაქტიკულად შეუქცევად ძარცვავს.
H2SO4 + BaCl2 = BaSO4↓ +2 HCl
H2CO3 + BaCl2 = BaCO3↓ +2 HCl
4. რეაგირება ფუძეებთან და ამფოტერულ ჰიდროქსიდებთან.
KOH + HNO3 = KNO3 + H2O
Al(ON)3 + 3HCl = AlCl3 + 3H2O
NaOH + HNO3 = NaNO3 + H2O
5. მჟავების გამოვლენა დამატებითი მჟავა-ტუტოვანი მაჩვენებლებით.
მჟავე გარემოში ლაკმუსი ივსება წითელი დამაბინძურებლებით. მეთილის ფორთოხალი წითელია, ფენოლფთალეინი კი უფერო.
მჟავას შეკავების ძირითადი მეთოდები
1. უმჟავო მჟავების მიღება შესაძლებელია მარტივი გამოსვლებიდან.
2. კისენის მჟავა შეიძლება მოიხსნას მჟავა ოქსიდების დატენიანებით.
N2O5 + H2O → 2HNO3
SO3 + H2O → H2SO4
3. მჟავების გაყვანა სუსტი მჟავებიდან ძლიერში, აქროლადი მჟავების არააროლად მჟავებამდე და საცალო ვაჭრობის მჟავები არაასტაბილურ მჟავებამდე. მაგალითად, მარილმჟავა ძლიერი და სუსტია ottsova rozchinіv їх მარილებში.
CH3COONa + HCl = CH3COOH + NaCl
NaCl (მყარი) + H2SO4 = NaHSO4 + HCl
4. მჟავები შეიძლება მოიხსნას დეიაკის მარილების ან ჰალოიდების ჰიდროლიზის დროს.
Al2 S3 +6 H2O → 2Al(OH)3↓+ 3H2S
PCl5 + H2O → H3PO4 + 5HCl
სვანტე არენიუსის მჟავებისა და ფუძეების თეორია. ვონი ეფუძნება ელექტრული დისოციაციის თეორიას. Vidpovidno მას, მჟავა - cerehovina, scho utvoryuyut წყლის დატენიანება და ანიონმჟავა ჭარბი წყალში. და როგორც ჩანს, ფუძეები არის სიტყვები, რომლებიც წყლის დისოციაციისას იშლება ლითონის კატიონებად და ჰიდროქსო ჯგუფის ანიონებად.
ბრონსტედისა და ლოურის თეორია. თეორიის თანახმად, მჟავის მოლეკულები არის chi ioni, yakі ciy რეაქციებში არის პროტონის დონორი, ხოლო შემცვლელი მოლეკულები არის chi ioni, იაკ მიმღები პროტონები, ანუ მიმღებები.
ორგანულ ქიმიაში გამოიყენება ლუისის თეორია. მჟავა არ არის მოლეკულა, არამედ იონი, რომელსაც შეიძლება ჰქონდეს ვაკანტური ვალენტური ორბიტალები, რის შემდეგაც შენობის სუნი იღებს ელექტრონულ ფსონებს, მაგალითად, წყლის იონებს, ლითონის იონებს, დიაკონებს, ოქსიდებს და ასევე უამრავ მარილს. ლუისის მჟავებს, რომლებიც წყალში იონების შურისძიებას არ იღებენ, აპროტიკს უწოდებენ. პროტონის შემცველი მჟავები განიხილება, როგორც ოკრემიუმი მჟავების კლასში.
ლუისის თეორიის საფუძველია მთელი მოლეკულა ან იონი, რომელიც შეიძლება იყოს ელექტრონული წყვილის დონორი: ყველა ანიონი, ამიაკი, ამინები, წყალი, სპირტები, ჰალოგენები.
ლუისის მჟავებსა და ფუძეებს შორის რეაქციის მაგალითი.
AlCl3+ Cl- → Cl4-
Tsya vzaєmodіya є არომატული სპოლუკის ჰალოგენაციის საფუძველი.
უსანოვიჩის თეორია. ამ თეორიაში მჟავა არის ნაწილი, რადგან შესაძლებელია კათიონების დამატება ან ანიონების დამატება. Vіdpovіdno, pіdstava navpaki. ეს თეორია იშვიათად ირკვევა, რადგან ცილისწამებას ჰგავდა. Vіdpovіdno მას, იქნება ეს vzaєmodії იონების მონაწილეობისთვის შეიძლება გამოიწვიოს მჟავა-ტუტოვანი. მაგრამ ეს არც ისე ადვილია.
ილუსტრაციული დახასიათებისთვის, თუ როგორ იშლება მჟავა იონებად, კრემს ესმის ვიკორისტის ელექტრული დისოციაციის ხარისხი დისოციაციის მუდმივი. დისოციაციის მუდმივი არის იგივე მუდმივი rіvnovagi, რომელიც გვიჩვენებს, რომ shillnіst ზოგიერთი დიდი ობიექტის (მჟავები, მარილები რთული მცენარის) საპირისპიროდ dissociated საწყისი შევსების მეტი პატარა ობიექტები. დისოციაციის მუდმივი განისაზღვრება, როგორც იონების კონცენტრაციის ზრდა სტექიომეტრული კოეფიციენტების დონეზე, ქვედანაყოფები არადისოცირებული ფორმისთვის.
მდიდარი ვალენტური იონებით მეტყველების დისოციაციის დროს დისოციაცია უფრო ხშირად ხდება. კანის სტადიისთვის, არსებობს დისოციაციის მუდმივის მკაფიო მნიშვნელობა.
ტრიბაზური ბორის მჟავის დისოციაციის კონდახიჰ3 BO3 .
ეტაპი I: H3BO3 ↔ H+ + H2BO3-
ეტაპი I: H2BO3- ↔ H+ + HBO32-
ეტაპი I: HBO32- ↔ H+ + BO33-
ვირაზის დისოციაციის მუდმივები კანის ციხის საფეხურებისთვის ასე გამოიყურება:
![]()
![]()
![]()
დისოციაციის მუდმივების სამი მნიშვნელობა არის რობიმო ულვაში, რომლებიც მდიდარია ძირითადი მეტყველებით პირველ საფეხურზე მთავარ დისოციაციაში.
სამი არაორგანული მჟავა მნიშვნელოვან როლს ასრულებს ადამიანის ორგანიზმში. Ce - ფოსფორის მჟავა, ნახშირბადის და მარილმჟავა. Ფოსფორმჟავასისხლის ბუფერული სისტემების საცავში შესასვლელად. ბუფერს უწოდებენ ისეთ განსხვავებას, თუ მცირე რაოდენობით მჟავებს ან ფუძეებს უმატებენ, ისინი ცვლიან წყლის pH მაჩვენებელს. Qi სისტემები საჭიროა იმავე ადამიანში სისხლის მჟავიანობის გასაუმჯობესებლად და ვიწრო ინტერვალის მისაღწევად. ფოსფორის მჟავის ჭარბი რაოდენობა შედის მდიდარ ბიოლოგიურად აქტიურ გამოსვლებში, მაგალითად, ნუკლეინის მჟავებში და მდიდარ ფერმენტებში. ჩვენი ჯაგრისები შედგება კალციუმის ჰიდროქსიდის ფოსფატის Ca10(PO4)6(OH)2 ან კალციუმის ჰიდროქსიდის აპატიტისგან და კბილები შეიცავს კალციუმის ფტოროპატიტს Ca10(PO4)6F2. მალ. 8.


ვუგილნამჟავა ასევე დევს სისხლის ბუფერული სისტემების შესანახად. rahunok di ї legeni-სთვის ასეთი სისტემები შეიძლება სწრაფად და მარტივად დარეგულირდეს და შესაძლებელია სისხლში ნახშირორჟანგის ოდენობის ცვალებადობა.
სოლიანამჟავა არის შურისძიების მიერ shlunkovomu წვენი. ვონი აფრქვევს ცილების დენატურაციას და შეშუპებას, რაც აადვილებს მათ დაშლას ფერმენტებით. ის ქმნის მჟავე შუას, მას სჭირდება გარკვეული ფერმენტები. Vaughn vіdpovіdalna ანტიბაქტერიული შუა შlunkovogo წვენი.
ჯერელა
ძერელო ვიდეო - https://www.youtube.com/watch?v=KqOwvPrN8W4
dzherelo პრეზენტაცია - http://ppt4web.ru/khimija/kisloty5.html