Як ви вже знаєте, загальним способом отримання карбонових кислот може бути окислення відповідного альдегіду відповідно до рівняння
У промисловості цей процес проводять за допомогою кисню повітря у присутності каталізаторів.
Аналізуючи загальну формулу карбонових кислот, можна помітити, що до її молекули входять дві частини - вуглеводневий радикал (алкіл) і функціональна група
яку називають карбоксильною. Назва функціональної групи походить від назв утворюють її карбонілу >С=0 і гідроксилу -ОН.
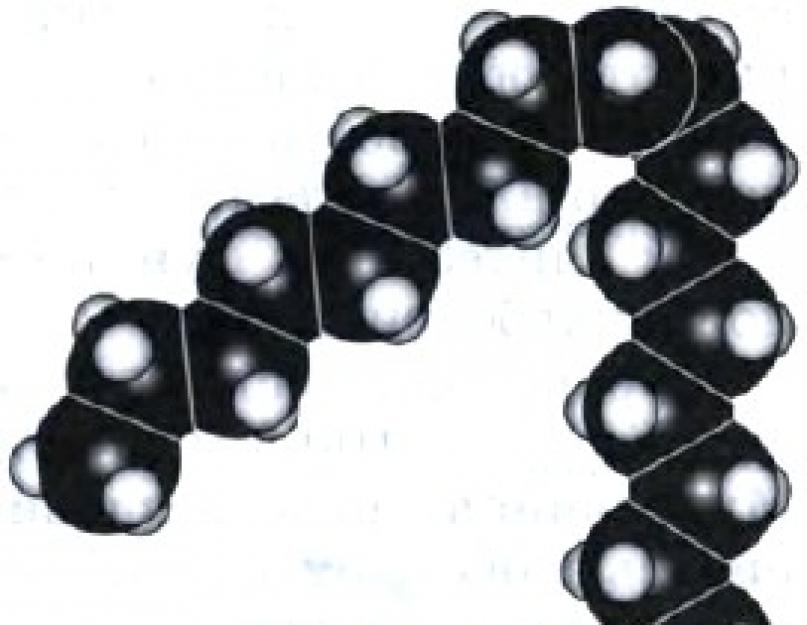
Клас карбонових кислот надзвичайно різноманітний. До нього входять одно-, дво- та багатоосновні кислоти, ненасичені та ароматичні. Але ці підкласи карбонових кислот є предметом вивчення в школах і класах природничо профілю. Ми лише згадаємо про дві ненасичені кислоти: З 17 Н 33 СООН - олеїнової кислоти (містить в молекулі один подвійний зв'язок) (рис. 50) і З 17 Н 31 СООН - лінолевої кислоти (містить в молекулі два подвійні зв'язки). Ці кислоти називають жирними, і тепер, очевидно, вам стало зрозуміло, чому ми звертаємо увагу на ці кислоти - вони входять до складу рідких жирів.

Мал. 50.
Масштабна модель молекули олеїнової кислоти
Однак повернемося до граничних одноосновних карбонових кислот. Починає гомологічний ряд цих кислот сполука, яка не повністю відповідає наведеному вище визначенню, - мурашина, або метанова кислота
Як видно, карбоксил у її молекулі пов'язаний не з вуглеводневим радикалом, а з атомом водню, як і карбоніл у мурашиному альдегіді (рис. 51).

Мал. 51.
Модель молекули мурашиної (метанової) кислоти:
Очевидно, що назви кислот та відповідних їм альдегідів ідентичні.
Те, що будова мурашиної кислоти відрізняється від будови молекул інших одноосновних карбонових кислот, зумовлює й особливості її хімічних властивостей. Вона вступає в реакцію «срібного дзеркала» подібно до альдегідів, оскільки її молекула є синтезом двох функціональних груп: карбонільної та карбоксильної.
Мурашина кислота - це рідина з різким запахом (t кип = 100,8 ° С), добре розчинна у воді. Мурашина кислота отруйна! При попаданні на шкіру вона спричиняє опіки. Жалюча рідина, що виділяється мурахами, кропивою, деякими видами медуз, містить цю кислоту (рис. 52).

Мал. 52.
Мурашину кислоту містить рідина, що шкодить:
1 – медуз; 2 – кропиви; 3 - мурах
Мурашина кислота має дезінфікуючу дію і тому знаходить застосування у харчовій, шкіряній та фармацевтичній промисловості, а також у медицині. Крім цього, її використовують при фарбуванні тканин та паперу (рис. 53).

Мал. 53.
Застосування мурашиної кислоти:
1 – шкіряна промисловість; 2 - фарбування тканин; 3 - медицина
Оцтова, або етанова, кислота

(Мал. 54) - це безбарвна рідина з характерним різким запахом, змішується з водою в будь-яких відносинах. Водні розчини оцтової кислоти надходять у продаж під назвою «столовий оцет» (3-5% розчин), «оцтова есенція» (70-80% розчин) і широко використовуються в харчовій промисловості.

Мал. 54.
Модель молекули оцтової (етанової) кислоти:
1 - кулястрижнева; 2 - масштабна
Оцтова кислота - хороший розчинник багатьох органічних сполук, що застосовується при фарбуванні, у шкіряному виробництві, лакофарбової промисловості (рис. 55). Крім цього, оцтова кислота є вихідною сировиною для виробництва багатьох важливих в технічному відношенні органічних сполук: штучних волокон, отрутохімікатів, кіно- і фотоплівок і т.д. есенцією.

Мал. 55.
Застосування оцтової кислоти:
1 – консервування; 2 – виробництво штучних волокон, тканин; 3 – приправа до їжі; 4-8 - виробництво органічних сполук (пестицидів 4, лаків 5, фарб 6, фотоплівки 7, клею 8)
Зі збільшенням відносної молекулярної маси в гомологічному ряду граничних одноосновних карбонових кислот збільшуються їх густина, температури кипіння та плавлення, зменшується розчинність у воді.
Вищі карбонові кислоти, також називають жирними (здогадалися чому), є твердими речовинами. Це, наприклад, пальмітинова 15 Н 31 СООН (рис. 56, 1) і стеаринова С 17 Н 35 СООН кислоти (рис. 56, 2).

Мал. 56.
Масштабні моделі молекул:
1 – пальмітинової кислоти; 2 - стеаринової кислоти
Хімічні властивості карбонових кислот визначаються насамперед їх приналежністю до типу кислот взагалі. Подібно до неорганічних кислот, карбонові кислоти є електролітами, правда дуже слабкими, а тому дисоціюють оборотно:
Водні розчини карбонових кислот змінюють фарбування індикаторів.
Зі збільшенням вуглеводневого радикалу відбувається зменшення ступеня електролітичної дисоціації.
Як і неорганічні кислоти, карбонові взаємодіють з металами, основними та амфотерними оксидами, основами, амфотерними гідроксидами та солями.
Так, мурашина та оцтова кислоти взаємодіють з металами, що стоять в електрохімічному ряду напруги до водню:

Ці кислоти реагують з основними та амфотерними оксидами з утворенням солей - форміатів та ацетатів:
Аналогічно мурашина та оцтова кислоти взаємодіють з основами та амфотерними гідроксидами:
Взаємодіють ці кислоти із солями слабших кислот. Реакції йдуть до кінця, якщо утворюється осад або газ:
Органічні кислоти, як ви вже знаєте, вступають у реакцію етерифікації зі спиртами, утворюючи складні ефіри, відповідно до рівняння

Нові слова та поняття
- Карбоксільна група.
- Карбонові кислоти. Граничні одноосновні карбонові кислоти.
- Ненасичені карбонові кислоти: олеїнова та лінолева.
- Мурашина та оцтова кислоти.
- Властивості карбонових кислот: взаємодія з металами, основними та амфотерними оксидами, основами, амфотерними гідроксидами та солями.
- Форміати та ацетати.
- Реакція етерифікації. Складні ефіри
- Застосування карбонових кислот.
Запитання та завдання
1. Які речовини називають граничними одноосновними карбоновими кислотами?
Граничні одноосновні карбонові кислоти – це органічні сполуки, молекули яких містять одну карбоксильну групу та насичений вуглеводневий радикал.
2. Розгляньте перехід кількісних змін у якісні на прикладі зміни фізичних властивостей карбонових кислот у гомологічному ряду.
Зі зростанням молярної маси збільшується температура плавлення та кипіння, зростає щільність речовини. Перші дев'ять представників гомологічного ряду – рідини, з десятого та вище – тверді речовини.
3. Які властивості є загальними для неорганічних та карбонових кислот? Підтвердьте відповідь рівняннями реакцій.
4. У які реакції можуть вступати олеїнові та лінолеві кислоти як ненасичені органічні сполуки? Як називають ці реакції? Запишіть їхнє рівняння. 
5. Структурну формулу мурашиної кислоти можна записати і таким чином. Отже, ця кислота буде речовиною з двоїстою функцією. Як можна її назвати? Яку реакцію, характерну для інших кислот, дасть мурашина кислота?
6. Запишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення: 
7. Яка речовина викликає жалющую дію кропиви та кліток медуз? Як зняти біль від опіків, спричинених виділеннями цих організмів?
Жаліюча дія викликана мурашиною кислотою. Для зменшення больових відчуттів місце ураження необхідно обробити розчином соди для нейтралізації кислоти.
8. В оцтовій кислоті розчинили 250 г вапняку, що містить 20% домішок, та отримали при цьому 33,6 л (н.у.) вуглекислого газу. Яку об'ємну частку становить вихід вуглекислого газу теоретично можливого? 
9. Цариця Клеопатра за порадою придворного медика розчинила в оцті найбільшу з відомих ювелірам перлину, а потім приймала отриманий розчин протягом деякого часу. Яку реакцію здійснила Клеопатра? Яке з'єднання вона приймала?
Клеопатра здійснила реакцію взаємодії оцтової кислоти та карбонату кальцію. Саме з нього складаються перлини. В результаті вийшла суміш із вуглекислого газу, ацетату кальцію та води. Пила вона саме ацетат кальцію.
10. На нейтралізацію 10,6 г суміші розчинів мурашиної та оцтової кислот витратили 200 г 4%-ного розчину гідроксиду натрію. Розрахуйте масові частки кислот у вихідній суміші. 
КАРБОНОВІ КИСЛОТИ
Карбоновими кислотами називають похідні вуглеводнів, що містять одну або декілька карбоксильних груп.
Число карбоксильних груп характеризує основність кислоти.
Залежно від кількості карбоксильних груп карбонові кислоти поділяються на одноосновні карбонові кислоти (містять одну карбоксильну групу), двоосновні (містять дві карбоксильні групи) та багатоосновні кислоти.
Залежно від виду радикала, пов'язаного з карбоксильною групою, карбонові кислоти поділяються на граничні, ненасичені та ароматичні. Граничні та ненасичені кислоти об'єднують під загальною назвою кислоти аліфатичного або жирного ряду.
Одноосновні карбонові кислоти
1.1 Гомологічний ряд та номенклатура
Гомологічний ряд одноосновних граничних карбонових кислот (іноді їх називають жирними кислотами) починається з мурашиної кислоти

Формула гомологічного ряду
Номенклатура ІЮПАК дозволяє зберігати для багатьох кислот їх тривіальні назви, які зазвичай вказують на природне джерело, з якого було виділено ту чи іншу кислоту, наприклад, мурашину, оцтову, масляну, валеріанову тощо.
Для складніших випадків назви кислот виробляють від назви вуглеводнів з тим самим числом атомів вуглецю, що у молекулі кислоти, з додаванням закінчення -овата слова кислота.Мурашина кислота Н-СООН називається метановою кислотою, оцтова кислота СН 3 -СООН - етановою кислотою і т.д.
Таким чином, кислоти розглядаються як похідні вуглеводнів, одна ланка яких перетворена на карбоксил:

При складанні назв кислот з розгалуженим ланцюгом за раціональною номенклатурою їх розглядають як похідні оцтової кислоти, в молекулі якої атоми водню заміщені радикалами, наприклад триметилоцтова кислота (СН 3) 3 С - СООН.
1.2 Фізичні властивості карбонових кислот
Тільки з чисто формальних позицій можна розглядати карбоксильну групу як комбінацію карбонільної та гідроксильної функцій. Фактично їх взаємний вплив один на одного такий, що повністю змінює їх властивості.
Звичайна для карбонілу поляризація подвійного зв'язку С=0 сильно зростає за рахунок додаткового стягування вільної електронної пари з сусіднього атома кисню гідроксильної групи:

Наслідком є значне ослаблення зв'язку О-Н в гідроксилі і легкість відщеплення атома водню від нього у вигляді протона (Н +). Поява зниженої електронної щільності (δ+) на центральному вуглецевому атомі карбоксилу призводить також до стягування σ-електронів сусіднього зв'язку С-С до карбоксильної групи та появи (як у альдегідів та кетонів) зниженої електронної щільності (δ+) на α-вуглецевому атомі кислоти .
Всі карбонові кислоти мають кислу реакцію (виявляється індикаторами) і утворюють солі з гідроксидами, оксидами і карбонатами металів і з активними металами:
Карбонові кислоти в більшості випадків у водному розчині дисоційовані лише малою мірою і є слабкими кислотами, значно поступаючись таким кислотам, як соляна, азотна та сірчана. Так, при розчиненні одного моля в 16 л води ступінь дисоціації мурашиної кислоти дорівнює 0,06, оцтової кислоти - 0,0167, тоді як соляна кислота при такому розведенні дисоційована майже повністю.
Для більшості одноосновних карбонових кислот рК а = 4,8, лише мурашина кислота має меншу величину рК а (близько 3,7), що пояснюється відсутністю електронодонорного ефекту алкільних груп.
У безводних мінеральних кислотах карбонові кислоти протонуються по кисню з утворенням карбкатіонів:

Зсув електронної густини в молекулі недисоційованої карбонової кислоти, про який говорилося вище, знижує електронну густину на гідроксильному атомі кисню і підвищує її на карбонільному. Це зрушення ще більше збільшується в аніоні кислоти:

Результатом зсуву є повне вирівнювання зарядів в аніоні, який фактично існує у формі А – резонанс карбоксилат-аніону.
Перші чотири представники ряду карбонових кислот - рухомі рідини, що змішуються з водою в усіх відношеннях. Кислоти, в молекулі яких міститься від п'яти до дев'яти атомів вуглецю (а також ізомасляна кислота) - маслянисті рідини, розчинність їх у воді невелика.
Вищі кислоти (від 10) - тверді тіла, практично нерозчинні у воді, при перегонці у звичайних умовах вони розкладаються.
Мурашина, оцтова та пропіонова кислоти мають гострий запах; середні члени ряду мають неприємний запах, вищі кислоти запаху не мають.

На фізичних властивостях карбонових кислот позначається значний ступінь асоціації внаслідок утворення водневих зв'язків. Кислоти утворюють міцні водневі зв'язки, оскільки зв'язку О-Н у них сильно поляризовані. Крім того, карбонові кислоти здатні утворювати водневі зв'язки за участю атома кисню карбонільного диполя, що має значну електронегативність. Дійсно, у твердому та рідкому стані карбонові кислоти існують в основному у вигляді циклічних димерів: 
Такі димерні структури зберігаються певною мірою навіть у газоподібному стані та у розведених розчинах у неполярних розчинниках.
Хімічні властивості
Для кислот характерні три типи реакцій: заміщення іона водню карбоксильної групи (утворення солей); за участю гідроксильної групи (освіта складних ефірів, галогенангідридів, ангідридів кислот); заміщення водню у радикалі.
Утворення солей. Карбонові кислоти легко утворюють солі при взаємодії із взаємодією з металами, їх оксидами, з лугами або основами, при дії аміаку або амінів:
Солі карбонових кислот знаходять широке застосування у народному господарстві. Вони використовуються як каталізатори, стабілізатори полімерних матеріалів, при виготовленні фарб і т.д.
Утворення складних ефірів. Зі спиртами кислоти дають складні ефіри:

Утворення галогенангідридів. При дії на кислоти галогенідів фосфору або SОС1 2 виходять галогенангідриди кислот:

Галогенангідриди – дуже реакційні речовини, які застосовуються для різноманітних синтезів.
Утворення ангідридів кислот. Якщо від двох молекул карбонових кислот відібрати одну молекулу води (у присутності водовіднімних речовин Р 2 Про 5 та ін), утворюється ангідрид карбонової кислоти:

Ангідриди кислот, подібно галогенангідридів, дуже реакційно-носнособні; вони розкладаються різними сполуками з активним воднем, утворюючи похідні кислоти та вільну кислоту:

Галогенування карбонових кислот. Водневі атоми вуглеводневих радикалів у кислотах за реакційною здатністю подібні до атомів водню в алканах. Виняток становлять атоми водню, розташовані у -вуглецевого атома (безпосередньо пов'язаного з карбоксилом). Так, при дії хлору та брому в присутності переносників галогенів (РС1 3 , 1 2 та ін) на карбонові кислоти або на їх хлорангідриди відбувається заміщення саме α-водневих атомів:

Дія окислювачів. Одноосновні карбонові кислоти, зазвичай, стійкі до дії окислювачів. Легко окислюються лише мурашина кислота (до 2 і Н 2 Про) і кислоти з третинним атомом вуглецю в α-положенні. При окисленні останніх виходять -оксикислоти:

У тварин організмах одноосновні карбонові кислоти також здатні окислюватися, причому атом кисню завжди прямує в β-положення. Так, наприклад, в організмі хворих на діабет масляна кислота переходить в β-оксимасляну кислоту:
Утворення кетонів Суха перегонка кальцієвих та барієвих солей карбонових кислот (крім мурашиної кислоти) призводить до утворення кетонів. Так, при перегонці ацетату кальцію, отриманого з СаСО 3 і СН 3 СООН, утворюється диметилкетон, при перегонці пропіоновокислого кальцію - діетилкетон:

Утворення амідів. При нагріванні солей амонієвих кислот виходять аміди:
Утворення вуглеводнів. При сплавленні солей лужних металів карбонових кислот з лугами (піроліз) відбувається розщеплення вуглецевого ланцюга та декарбоксилювання, в результаті чого з вуглеводневого радикалу кислоти утворюється відповідний вуглеводень, наприклад:
Найважливіші представники
Мурашина кислота - безбарвна рідина із різким запахом. Є сильним відновником та окислюється до вугільної кислоти. У природі вільна мурашина кислота зустрічається у виділеннях мурах, у соку кропиви, у поті тварин. Застосовують мурашину кислоту при фарбуванні тканин як відновник, при дубленні шкір, в медицині, в різних органічних синтезах.
Оцтова кислота - безбарвна рідина із різким запахом. Водний розчин (70 - 80 %) оцтової кислоти називається оцтовою есенцією, а 3 -5%-ний водний розчин - столовим оцтом.
Оцтова кислота широко трапляється у природі. Вона міститься в сечі, поті, жовчі та шкірі тварин, рослинах. Утворюється при оцтовокислому бродінні рідин, що містять спирт (вино, пиво та ін.).
Широко використовується у хімічній промисловості для виробництва ацетатного шовку, барвників, складних ефірів, ацетону, оцтового ангідриду, солей тощо. У харчовій промисловості оцтова кислота використовується для консервування продуктів, деякі складні ефіри оцтової кислоти застосовують у кондитерському виробництві.
Олійна кислота є рідиною з неприємним запахом. Міститься у вигляді складного ефіру в коров'ячому маслі. У вільному стані знаходиться в гіркій олії.
2. Двоосновні карбонові кислоти
Загальна формула гомологічного ряду граничних двоосновних кислот ![]()
Прикладами можуть бути:

Граничні двоосновні кислоти – тверді кристалічні речовини. Подібно до того, як це зазначалося для одноосновних кислот, граничні двоосновні кислоти з парним числом атомів вуглецю плавляться при вищій температурі, ніж сусідні гомологи з непарним числом атомів вуглецю. Розчинність у воді кислот з непарним числом атомів вуглецю значно вища за розчинність кислот з парним числом атомів вуглецю, причому зі зростанням довжини ланцюга розчинність кислот у воді зменшується.
Двоосновні кислоти дисоціюють послідовно:
Вони сильніші за відповідні одноосновні кислоти. Ступінь дисоціації двоосновних кислот знижується зі збільшенням їхньої молекулярної маси.
У молекулі двоосновних кислот містяться дві карбоксильні групи, тому вони дають два ряди похідних, наприклад середні та кислі солі, середні та кислі складні ефіри:

При нагріванні щавлевої та малонової кислот легко відщеплюється СО 2:
Двоосновні кислоти з чотирма та п'ятьма атомами вуглецю в молекулі, тобто янтарна та глутарова кислоти, при нагріванні відщеплюють елементи води і дають внутрішні циклічні ангідриди:

3. Ненасичені карбонові кислоти
Склад ненасичених одноосновних кислот з одним подвійним зв'язком можна виразити загальною формулою С n Н 2 n -1 СООН. Як і будь-яких біфункціональних сполук, їм характерні реакції як кислот, і олефинов. α.β-Ненасичені кислоти дещо перевершують по силі відповідні жирні кислоти, оскільки подвійний зв'язок, що знаходиться поряд з карбоксильною групою, посилює її кислотні властивості.
Акрилова кислота Найпростіша ненасичена одноосновна кислота
Олеїнова, лінолева та ліноленова кислоти.
Олеїнова кислота З 17 Н 33 СООН у вигляді гліцеринового ефіру надзвичайно поширена у природі. Її будова виражається формулою
Олеїнова кислота - безбарвна масляниста рідина, легша за воду, на холоді твердне в голчасті кристали, що плавляться при 14 °С. На повітрі вона швидко окислюється та жовтіє.
Молекула олеїнової кислоти здатна приєднувати два атоми галогену: 
У присутності каталізаторів, наприклад, Ni, олеїнова кислота приєднує два атоми водню, переходячи в стеаринову кислоту.
Олеїнова кислота являє собою цис-ізомер (усі природні ненасичені високомолекулярні кислоти, як правило, відносяться до цис-ряду).
Лінолева З 17 Н 31 СООН і ліноленова З 17 Н 29 СООН кислоти ще більш ненасичені, ніж олеїнова кислота. У вигляді складних ефірів з гліцерином гліцеридів- вони є головною складовою лляної та конопляної олій:

У молекулі лінолевої кислоти два подвійні зв'язки. Вона може приєднувати чотири атоми водню чи галогену. У молекулі лінолевої кислоти три подвійні зв'язки, тому вона приєднує шість атомів водню чи галогену. Обидві кислоти, приєднуючи водень, переходять у стеаринову кислоту.
Сорбінова кислота
Вона має дві сполучені один з одним і з карбоксильною групою подвійні зв'язки, що мають транс-конфігурацію; є чудовим консервантом для багатьох харчових продуктів: овочевих консервів, сиру, маргарину, фруктів, рибних та м'ясних продуктів.
Малеїнова та фумарова кислоти. Найпростішими з двоосновних кислот, що містять етиленовий зв'язок, є два структурні ізомери:

Крім того, для другої з цих кислот можливі дві просторові конфігурації:

Фумарова кислота міститься у багатьох рослинах: особливо часто вона зустрічається у грибах. Малеїнова кислота в природі не знайдено.
Обидві кислоти зазвичай отримують при нагріванні яблучної (оксіянтарної) кислоти:
При повільному обережному нагріванні виходить головним чином фумарова кислота; при більш сильному нагріванні та при перегонці яблучної кислоти виходить малеїнова кислота.
Як фумарова, так і малеїнова кислота при відновленні дають ту саму бурштинову кислоту.
Карбоновими кислотаминазивають сполуки, в яких міститься карбоксильна група:
Карбонові кислоти розрізняють:
- одноосновні карбонові кислоти;
- двоосновні (дикарбонові) кислоти (2 групи СООН).
Залежно від будови карбонові кислоти розрізняють:
- аліфатичні;
- аліциклічні;
- ароматичні.
Приклади карбонових кислот.


Одержання карбонових кислот.
1. Окислення первинних спиртів перманганатом калію та дихроматом калію:

2. Гіброліз галогензаміщених вуглеводнів, що містять 3 атоми галогену в одного атома вуглецю:
3. Одержання карбонових кислот із ціанідів:
При нагріванні нітрил гідролізується з утворенням ацетату амонію:
При підкисленні якого випадає кислота:
4. Використання реактивів Гриньяра:
5. Гідроліз складних ефірів:
6. Гідроліз ангідридів кислот:
7. Специфічні способи одержання карбонових кислот:
Мурашина кислота виходить при нагріванні оксиду вуглецю (II) з порошкоподібним гідроксидом натрію під тиском:
Оцтову кислоту одержують каталітичним окисленням бутану киснем повітря:
Бензойну кислоту отримують окисленням монозаміщених гомологів розчином перманганату калію:
Реакція Канніціаро. Бензальдегід обробляють 40-60% розчином гідроксиду натрію за кімнатної температури.

Хімічні властивості карбонових кислот.
У водному розчині карбонові кислоти дисоціюють:

Рівнавага зрушено сильно вліво, т.к. карбонові кислоти є слабкими.
Заступники впливають кислотність внаслідок індуктивного ефекту. Такі заступники відтягують електронну щільність він і них виникає негативний індуктивний ефект (-I). Відтягування електронної густини призводить до підвищення кислотності кислоти. Електронодонорні замісники створюють позитивний індуктивний заряд.

1. Утворення солей. Реагування з основними оксидами, солями слабких кислот та активними металами:

Карбонові кислоти – слабкі, т.к. мінеральні кислоти витісняють їх із відповідних солей:
2. Утворення функціональних похідних карбонових кислот:
3. Складні ефіри при нагріванні кислоти зі спиртом у присутності сірчаної кислоти – реакція етерифікації:
4. Утворення амідів, нітрилів:
3. Властивості кислот зумовлюються наявністю вуглеводневого радикалу. Якщо протікає реакція у присутність червоного фосфору, утворює наступний продукт:
4. Реакція приєднання.

8. Декарбоксилювання. Реакцію проводять сплавленням лугу із сіллю лужного металу карбонової кислоти:
9. Двоосновна кислота легко відщеплює СО 2при нагріванні:
Додаткові матеріали на тему: Карбонові кислоти.
Калькулятори з хімії |
|
| Хімія онлайн на нашому сайті для вирішення завдань та рівнянь. | |
Майже у всіх будинку є оцет. І більшість людей знають, що його основу складає. Але що вона є з хімічної точки зору? Які ще цього ряду існують та які їх характеристики? Спробуємо розібратися у цьому питанні та вивчити граничні одноосновні карбонові кислоти. Тим більше що в побуті застосовується не тільки оцтова, а й деякі інші, а похідні цих кислот взагалі часті гості в кожному будинку.
Клас карбонових кислот: загальна характеристика
З точки зору науки хімії, до цього класу сполук відносять кисневмісні молекули, які мають особливе угруповання атомів - карбоксильну функціональну групу. Вона має вигляд СООН. Таким чином, загальна формула, яку мають усі граничні одноосновні карбонові кислоти, виглядає так: R-COOH, де R - це частка радикал, яка може включати будь-яку кількість атомів вуглецю.
Відповідно до цього, визначення даного класу сполук можна дати таке. Карбонові кислоти - це органічні кисневмісні молекули, до складу яких входить одне або кілька функціональних угруповань -СООН - карбоксильні групи.
Те, що ці речовини ставляться саме до кислот, пояснюється рухливістю атома водню в карбоксилі. Електронна щільність розподіляється нерівномірно, тому що кисень - найбільш електронегативний у групі. Від цього зв'язок О-Н сильно поляризується, і атом водню стає дуже вразливим. Він легко відщеплюється, вступаючи у хімічні взаємодії. Тому кислоти у відповідних індикаторах дають таку реакцію:

Завдяки атому водню, карбонові кислоти виявляють окисні властивості. Однак наявність інших атомів дозволяє їм відновлюватись, брати участь у багатьох інших взаємодіях.
Класифікація
Можна виділити кілька основних ознак, якими ділять на групи карбонові кислоти. Перший - це природа радикала. За цим фактором виділяють:
- Аліциклічні кислоти.Приклад: хінна.
- Ароматичні.приклад: бензойна.
- Аліфатичні.Приклад: оцтова, акрилова, щавлева та інші.
- Гетероциклічні.Приклад: нікотинова.
Якщо говорити про зв'язки в молекулі, то також можна виділити дві групи кислот:

Також ознакою класифікації може бути кількість функціональних груп. Так, виділяють такі категорії.
- Одноосновні -лише одна-СООН-група. Приклад: мурашина, стеаринова, бутанова, валеріанова та інші.
- Двоосновні- відповідно, дві групи -СООН. Приклад: щавлева, малонова та інші.
- Багатоосновні- лимонна, молочна та інші.
Історія відкриття
Виноробство процвітало з давніх-давен. А, як відомо, один із його продуктів - оцтова кислота. Тому історія популярності даного класу з'єднань бере своє коріння ще з часів Роберта Бойля та Йоганна Глаубера. Однак при цьому хімічну природу цих молекул з'ясувати тривалий час не вдавалося.
Адже довгий час панували погляди віталістів, котрі заперечували можливість утворення органіки без живих істот. Але вже в 1670 році Д. Рей зумів отримати найпершого представника - метанову або мурашину кислоту. Зробив він це, нагріваючи у колбі живих мурах.
Пізніше роботи вчених Берцеліуса та Кольбе показали можливість синтезу цих сполук із неорганічних речовин (перегонкою деревного вугілля). В результаті була отримана оцтова. Таким чином були вивчені карбонові кислоти (фізичні властивості, будова) і започатковано для відкриття всіх інших представників низки аліфатичних сполук.
Фізичні властивості
Сьогодні докладно вивчені всі їхні представники. Для кожного з них можна знайти характеристику за всіма параметрами, включаючи застосування в промисловості та перебування в природі. Ми розглянемо, що являють собою карбонові кислоти, їх та інші параметри.
Отже, можна назвати кілька основних характерних параметрів.
- Якщо кількість атомів вуглецю в ланцюзі вбирається у п'яти, це різко пахнуть, рухливі і леткі рідини. Вище п'яти – важкі маслянисті речовини, ще більше – тверді, парафіноподібні.
- Щільність у перших двох представників перевищує одиницю. Решта легша за воду.
- Температура кипіння: що більше ланцюг, то вище показник. Чим розгалуженіша структура, тим нижче.
- Температура плавлення: залежить від парності кількості атомів вуглецю в ланцюзі. У парних вона вища, у непарних нижча.
- У воді розчиняються дуже добре.
- Здатні утворювати міцні водневі зв'язки.

Такі особливості пояснюються симетрією будови, а отже, і будовою кристалічних ґрат, її міцністю. Чим простіші і структуровані молекули, тим вищі показники, які дають карбонові кислоти. Фізичні властивості даних сполук дозволяють визначати галузі та способи використання їх у промисловості.
Хімічні властивості
Як ми позначали вище, дані кислоти можуть виявляти властивості різні. Реакції з участю важливі для промислового синтезу багатьох сполук. Визначимо найголовніші хімічні властивості, які може виявляти одноосновна карбонова кислота.
- Дисоціація: R-COOH = RCOO - + H +.
- Виявляє тобто взаємодіє з основними оксидами, а також їх гідроксидами. З простими металами взаємодіє за стандартною схемою (тобто лише з тими, що стоять до водню у ряді напруг).
- З сильнішими кислотами (неорганічні) поводиться як основа.
- Здатна відновлюватись до первинного спирту.
- Особлива реакція – етерифікація. Це взаємодія зі спиртами з утворенням складного продукту – ефіру.
- Реакція декарбоксилювання, тобто відщеплення від сполуки молекули вуглекислого газу.
- Здатна взаємодіяти з галогенідами таких елементів, як фосфор та сірка.

Очевидно, наскільки багатогранними є карбонові кислоти. Фізичні властивості, як і хімічні, досить різноманітні. З іншого боку, слід зазначити, що загалом за силою як кислоти всі органічні молекули досить слабкі проти своїми неорганічними колегами. Їхні константи дисоціації не перевищують показника 4,8.
Способи отримання
Існує кілька основних способів, якими можна отримувати граничні карбонові кислоти.
1. У лабораторії це роблять окисленням:
- спиртів;
- альдегідів;
- алкінів;
- алкілбензолів;
- деструкцією алкенів.
2. Гідроліз:
- складних ефірів;
- нітрилів;
- амідів;
- тригалогеналканів.
4. У промисловості синтез здійснюють окисленням вуглеводнів з великою кількістю атомів вуглецю в ланцюзі. Процес здійснюється у кілька стадій із виходом безлічі побічних продуктів.
5. Деякі окремі кислоти (мурашина, оцтова, масляна, валеріанова та інші) одержують специфічними способами, використовуючи природні інгредієнти.
Основні сполуки граничних карбонових кислот: солі
Солі карбонових кислот - важливі сполуки, які у промисловості. Вони виходять в результаті взаємодії останніх з:
- металами;
- основними оксидами;
- лугами;
- амфотерними гідроксидами.

Особливо важливе значення серед них мають ті, що утворюються між лужними металами натрієм та калієм та вищими граничними кислотами – пальмітиновою, стеариновою. Адже продукти подібної взаємодії – мила, рідкі та тверді.
Мила
Так, якщо йдеться про подібну реакцію: 2C 17 H 35 -COOH + 2Na = 2C 17 H 35 COONa + H 2 ,
то продукт, що утворюється - стеарат натрію - це є за своєю природою звичайне господарське мило, що використовується для прання білизни.
Якщо замінити кислоту на пальмітинову, а метал на калій, то вийде пальмітат калію – рідке мило для миття рук. Тому можна з упевненістю заявляти, що солі карбонових кислот – це насправді важливі сполуки органічної природи. Їхнє промислове виробництво та використання просто колосальне у своїх масштабах. Якщо уявити, скільки мила витрачає кожна людина на Землі, то нескладно уявити й ці масштаби.
Ефіри карбонових кислот
Особлива група сполук, що має місце у класифікації органічних речовин. Це клас утворюються вони при реакції карбонових кислот зі спиртами. Назва таких взаємодій – реакції етерифікації. Загальний вигляд можна уявити рівнянням:
R, -COOH + R"-OH = R, -COOR" + H 2 O.
Продукт із двома радикалами і є складний ефір. Очевидно, що в результаті реакції карбонова кислота, спирт, складний ефір і вода зазнали значних змін. Так, водень від молекули кислоти йде у вигляді катіону і зустрічається з гідроксо-групою, що відщепився від спирту. Через війну формується молекула води. Угруповання, що залишилося від кислоти, приєднує себе радикал від спирту, утворюючи молекулу складного ефіру.

Чим же такі важливі ці реакції і в чому промислове значення їх продуктів? Вся справа в тому, що складні ефіри використовуються як:
- харчові добавки;
- ароматичні добавки;
- складовий компонент парфуму;
- розчинники;
- компоненти лаків, фарб, пластмас;
- медикаментів та інше.
Зрозуміло, що їх використання досить широкі, щоб виправдати обсяги виробництва, у промисловості.
Етанова кислота (оцтова)
Це гранична одноосновна карбонова кислота аліфатичного ряду, яка є однією з найпоширеніших за обсягами виробництва у всьому світі. Формула її – СН 3 СООН. Такої поширеності вона завдячує своїм властивостям. Адже сфери її використання вкрай широкі.
- Вона є харчовою добавкою під кодом Е-260.
- Використовується у харчовій промисловості для консервації.
- Застосовується у медицині для синтезу лікарських засобів.
- Компонент при отриманні запашних сполук.
- Розчинник.
- Учасник процесу друкарства, фарбування тканин.
- Необхідний компонент у реакціях хімічних синтезів безлічі речовин.
У побуті її 80% розчин прийнято називати оцтовою есенцією, а якщо розбавити його до 15%, то вийде просто оцет. Чиста 100% кислота називається крижаною оцтовою.
Мурашина кислота
Найперший і найпростіший представник даного класу. Формула – НСООН. Також є харчовою добавкою під кодом Е-236. Її природні джерела:
- мурахи та бджоли;
- кропива;
- хвоя;
- фруктів.
Основні галузі використання:
Також у хірургії розчини цієї кислоти використовують як антисептичні засоби.