Al 11-lea capitol continuă tema puterilor chimice, inclusiv acizii și bazele.
Teoria înainte de sarcina nr. 11 ODE cu chimie
Acizi
Voi ghici ce acid - sunt compuși chimici care se disociază pe protoni (H+). Se folosesc cei mai simpli acizi - acid clorhidric (HCl), acid (H2SO4), acid azotic (HNO3).
Bazele
Bazele g - compuși care se disociază în ioni de hidroxid (OH-).
Cele mai simple soluții sunt hidroxidul de potasiu și sodiu (KOH și NaOH). Nu fără motiv sunt numite caustice. Duhoarea este puternică și ustură când lovește pielea. De aceea nu este sigur să le subestimați.
Ei bine, haideți să ne uităm la autoritățile chimice ale acestor clase.
Puterea chimică a acizilor
Ne-am uitat la clasificarea acizilor în. Recomand ca înainte de examinarea ulterioară a autorităților chimice, acestea să descopere clasificarea acizilor gazelor naturale.
Acum, să trecem la puterea acizilor:
- reacție cu oxizi bazici: de regulă, se induce o reacție între oxidul de calciu și acidul clorhidric. Produsele acestei reacții sunt sarea - clorura de calciu, care este ceea ce acoperă drumurile înghețate, și apa, pe care o bem în fiecare zi.
- reacție cu oxizi amfoteri de exemplu, oxid de zinc:
- reacția acizilor din pajiști fi numit neutralizare. De exemplu, se induce reacția hidroxidului de sodiu cu acidul clorhidric, produsele sunt sare (în acest caz este de bucătărie) și apă.
- reacții de schimb cu sărurile, dacă rezultatul reacției este crearea unei substanțe sau a unui gaz nealcoolic. De regulă, este indusă reacția clorurii de bariu cu acidul sulfuric, în urma căreia se creează un precipitat de sulfat de bariu și clor volatil.
- reacție cu fundamente neîntrerupte, de exemplu, hidroxid de cupru din acid sulfuric:
- concentrația acizilor slabi din sărurile lor, de exemplu, săruri ale acidului fosforic cu acid clorhidric:
- reacție cu metalele, ce să stea lângă tensiunea la reacția apă - cap la cap a magneziului cu acid clorhidric:
Puterea chimică a fundamentelor
Înainte de a studia principiile chimice ale principiilor, este important să înțelegem clasificarea principiilor.
Acum, să trecem la analiza principiilor chimice ale puterii:
- a fost efectuată o reacție cu acizi - reacție de neutralizare
- reacție cu baze amfotere, de exemplu, zinc și hidroxid de aluminiu:
- reacție cu oxizi acizi cu sare si apa. Cap la cap - reacția hidroxidului de sodiu cu oxidul de siliciu (gravarea sticlei):
- reacții de schimb cu sărurile Cum se creează un asediu sau gaz (amonia). Exemplu - reacția hidroxidului de bariu cu sulfatul de sodiu:
Selectarea opțiunilor tipice pentru specificarea ODE cu chimie
Prima versiune a plantei
Reacția cu acidul clorhidric implică:
- nitrat sribla
- nitrat de bariu
- sriblo
- oxid de siliciu
Să aruncăm o privire asupra afecțiunilor pielii:
- Acidul clorhidric și nitratul sunt tăiate. Fragmentele de nitrat de șliver sunt sare, reacția de schimb este posibilă, ca o preparare a reacției de precipitare și gaz. Cum poate fi dizolvat produsul de acid azotic (redus) și clorura de sribloA (nu facut - asediu alb sirny ). Aceasta înseamnă că o reacție este posibilă, iar acesta este răspunsul pentru noi.
- Azotat de bariu și acid clorhidric. Produse ale acestei reacții de schimb razchinnі (acid azotic și clorură de bariu), prin urmare nicio reactie .
- Sriblo stai la rand dupa apa, deci nu reactioneaza cu acizii neoxidanti V.
- oxid de siliciu - oxid acid і nu reactioneaza cu acizii .
Kisli Smak, di on the izndidikatori, eektric este pro -vidniy, principalul cu oxizi amfoteri, bazele solurilor, tocitul depozitelor de alcooli efirv - puterea de putere a acizilor organici.
1. În apă, acizii se disociază în cationi de apă și anioni de exces acid, de exemplu:
Culoarea acizilor schimbă culoarea indicatorilor: turnesol - pentru vinuri roșii, metil portocaliu - pentru erizipel, culoarea fenolftaleinei nu se schimbă.
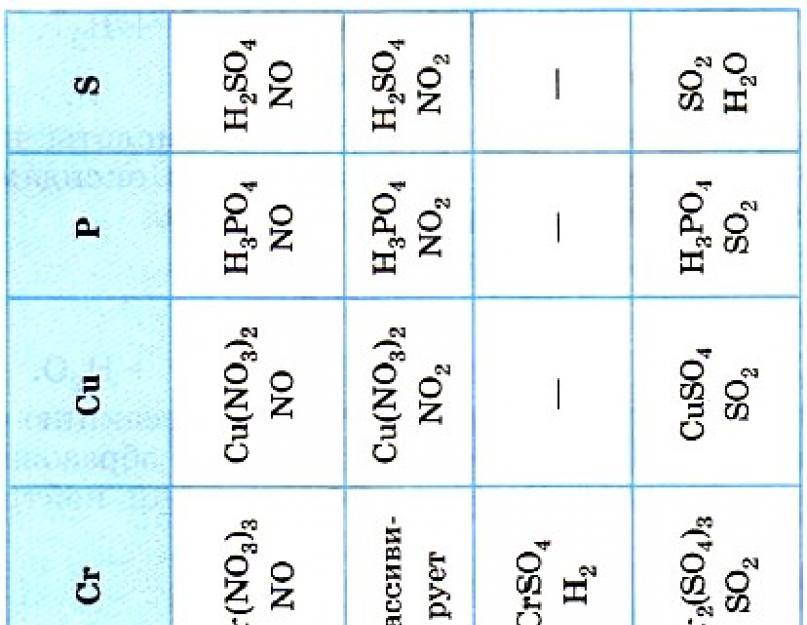
2. Acizii distructivi reacționează cu metalele, care stau în seria electrochimică direct deasupra apei, pentru adăugarea unui număr de minți, dintre care cele mai importante sunt create ca urmare a reacției sării dizolvate. Având în vedere puterea acizilor anorganici și organici, este clar că interacțiunea HNO 3 și H 2 SO 4 (conc.) cu metalele (Tabelul 19) decurge diferit, dar particularitățile acizilor desemnați vor fi explicate mai târziu.
Tabelul 19
Produse de interacțiune
compuși simpli cu acizi azotic și sulfuric

3. Acizii anorganici și organici interacționează cu oxizii bazici și amfoteri pentru a forma săruri dăunătoare:

4. Atât acizii, cât și alți acizi reacţionează cu bazele. Acizii bogati bazici pot neutraliza atât sărurile neutre, cât și sărurile acide (printr-o reacție de neutralizare):

5. Reacția dintre acizi și săruri are loc numai atunci când se creează un gaz sau un precipitat:

Interacțiunea acidului fosforic H 2 PO 4 cu fosfatul de calciu Ca 3 (PO 4) 2 se aplică prin formarea precipitatului neîntrerupt rămas la suprafață.
6. Eteri de pliere sunt vindecați nu numai de acizi organici, ci și de acizi:

Toți acizii anorganici, cum ar fi acidul azotic și sulful:
O reacție similară care implică două sau trei grupări hidroxil ale celulozei la nitrare duce la îndepărtarea eterilor de pliere: di-trinitroceluloză - substanțe necesare pentru producerea prafului de pușcă fără fum.
În zilele noastre, reprezentanții acizilor minerali și organici capătă o putere deosebită.
Particularitatea puterii azotului HNO 3 și a acizilor concentrați de sulf H 2 SO 4 (conc.) se formează prin aceea că, atunci când interacționează cu substanțe simple (metale și nemetale), agenții oxidanți reacţionează nu cu cationii H+, ci cu nitrații și ioni de sulfat. Este logic să ne dăm seama că în urma unor astfel de reacții nu se creează apa H 2, ci se eliberează alte substanțe: sare de legare și apă, precum și unul dintre produsele ionilor reînnoiți de nitrat sau sulfat, în funcție de concentrația ії acizi, poziția metalului într-un număr de reacții de tensiuni și drenuri (temperaturi, nivelul de detaliere a metalului etc.).
Trebuie remarcat faptul că cel de-al treilea produs al reacției metalelor cu acești acizi este adesea creat în „buchet” - care este combinat cu alte produse, iar în Tabelul 19 sunt indicate cele mai importante produse.
Aceste caracteristici ale comportamentului chimic al HNO 3 și H 2 SO 4 (conc.) ilustrează clar teoria reacției chimice despre influxul reciproc al atomilor în moleculele substanțelor. De asemenea, poate fi tratată folosind puterea acizilor organici, cum ar fi edemul și furnicile.
Acidul otic CH 3 COOH, ca și alți acizi carboxilici, conține un radical carbohidrat în moleculă. Unele posibile reacții implică înlocuirea atomilor de apă cu atomi de halogen:
Când atomii de halogen sunt infuzați în molecula de acid, stadiul de disociere a acesteia este foarte avansat. De exemplu, acidul cloroctic este de 100 de ori mai puternic la sută (de ce?).
Acidul Murashic HCOOH, pe de altă parte, este absent din molecula de radicali carbohidrați. În loc să înlocuiți atomul cu apă și, de asemenea, cu o funcție dublă - un acid aldehidic și, atunci când este înlocuit cu alți acizi carboxilici, dă reacția unei „oglinzi în oglindă”:

Acidul cargolic, care este dizolvat, H 2 CO 3 se descompune în apă și dioxid de carbon, care în exces de amoniac este transformat în hidrocarbonat de amoniu.
Acizi sunt numite vorbire pliabilă, care conține molecule care includ atomi și apă, care sunt înlocuite sau schimbate cu atomi de metal și exces de acid.
Datorită prezenței sau absenței acidității în molecula de acid, acestea sunt împărțite în aciditate(H 2 SO 4 acid sulfuric, H 2 SO 3 acid sulfuric, HNO 3 acid azotic, H 3 PO 4 acid fosforic, H 2 CO 3 acid carbonic, H 2 SiO 3 acid silicic) și fără acru(acid fluorhidric HF, acid clorhidric HCl (acid clorhidric), acid bromhidric HBr, acid iodhidric HI, acid iodhidric H2S).
În funcție de numărul de atomi de apă dintr-o moleculă de acid, acizii pot fi monobazici (cu 1 atom de H), dibazici (cu 2 atomi de H) și tribazici (cu 3 atomi de H). De exemplu, acidul azotic HNO 3 este monobazic, fragmentele din moleculă conțin un atom de apă, acid sulfuric H 2 SO 4 – dibazic etc.
Există foarte puțini compuși anorganici care pot înlocui atomii și apa și sunt înlocuiți cu metal.
Porțiunea unei molecule de acid fără apă se numește reziduu acid.
Exces de acid poate fi pliat dintr-un atom (-Cl, -Br, -I) - din excese acide simple, sau dintr-un grup de atomi (-SO 3, -PO 4, -SiO 3) - din excese pliate.
În soluții apoase, reacțiile de schimb și înlocuirea excesului de acid nu duc la distrugere:
H2SO4 + CuCl2 → CuSO4 + 2 HCl
Cuvântul anhidridăînseamnă anhidru, care este un acid fără apă. De exemplu,
H 2 SO 4 – H 2 O → SO 3. Acizii fără acizi nu distrug anhidridele.
Denumirea acidului este derivată din denumirea elementului de dizolvare a acidului (agent de formare a acidului) cu adăugarea terminației „naya” și uneori „va”: H 2 SO 4 – sirchana; H 2 SO 3 – vugilna; H 2 SiO 3 - siliciu etc.
Elementul poate dizolva o mulțime de acizi acri. Odată indicat, numele acidului va fi complet dacă elementul prezintă o valență mare (molecula de acid are în schimb un număr mare de atomi de acid). Deoarece elementul prezintă o valență mai mică, capătul acidului va fi „conținând”: HNO3 – azot, HNO2 – azot.
Acizii pot distruge anhidridele din apă.În cazurile în care anhidridele nu se dizolvă în apă, acidul poate fi înlocuit prin adăugarea unui alt acid puternic. Această metodă este caracteristică atât acizilor acri, cât și acizilor neacizi. Acizii fără acizi pot fi îndepărtați prin sinteză directă din acizi apos și nemetalici cu descompunerea ulterioară a extrasului din apă:
H2 + CI2 → 2 HCI;
H2+S → H2S.
Îndepărtarea substanțelor asemănătoare gazelor cu HCl și H 2 S și acizi.
Pentru cele mai extraordinare minți, acizii apar atât în cele rare, cât și în cele dure.
Puterea chimică a acizilor
Dizolvați acizii pe indicatori. Toți acizii (cu excepția siliciului) se dizolvă bine în apă. Indicatorii speciali de vorbire vă permit să determinați prezența acidului.
Indicatoarele sunt o serie de unități pliabile. Este necesar să se schimbe infuzia prin interacțiunea cu diverse substanțe chimice. În zonele neutre, duhoarea este de un fel, dar în zonele fundamentale, este diferită. Când interacționează cu acidul, duhoarea își schimbă barbaria: indicatorul de metil portocaliu devine roșu, iar indicatorul de turnesol devine roșu.
Interacționează cu elementele de bază cu apă diluată și sare, care conține un exces acid stabil (reacție de neutralizare):
H2SO4 + Ca(OH)2 → CaS04 + 2H2O.
Interacționează cu oxizii de bază cu adaos de apă și sare (reacție de neutralizare). Pentru a elimina excesul de acid din același acid care a fost recuperat din reacția de neutralizare:
H3PO4 + Fe2O3 → 2 FeP04 + 3H2O.
 Interacționează cu metalele.
Pentru interacțiunea acizilor cu metalele, trebuie luate următorii pași:
Interacționează cu metalele.
Pentru interacțiunea acizilor cu metalele, trebuie luate următorii pași:
1. metalul poate deveni activ în raport cu acizii (în unele cazuri, activitatea metalelor se datorează reacției lor la apă). Cu cât metalul este mai activ, cu atât interacțiunea cu acizii este mai intensă;
2. Acidul poate fi menținut puternic (pentru a adăuga corect apă H+).
Când apar reacții chimice ale acidului și metalelor, sarea este dizolvată și apare apă (pe lângă reacția metalelor cu acizii azotic și sulfuric concentrat):
Zn + 2HCI → ZnCI2 + H2;
Cu + 4HNO 3 → CuNO 3 + 2 NO 2 + 2 H 2 O.
Rămâneți fără mâncare? Vrei să afli mai multe despre acizi?
Pentru a obține ajutor de la un tutor, înregistrați-vă.
Prima lecție - fără rău!
site-ul, cu copierea integrală sau parțială a materialului trimis către Pershodzherelo ob'yazkov.
Pentru a vedea rapid prezentarea în avans, creați-vă propriul cont Google și accesați: https://accounts.google.com
Subtitrări înainte de diapozitive:
Vykladach: Grudinina Tetyana Viktorivna Tema lecției: Acizi
Obiectivele lecției: Înțelegerea și consolidarea cunoștințelor despre clasificarea, nomenclatura, puterea acizilor organici și anorganici Învață să explici puterea puterilor chimice ale acizilor anorganici și organici Învață să formuleze corect reacțiile și aspectul molecular și ionic
Valorile acizilor Acizii în natură Clasificarea acizilor Puterea chimică a acizilor Îndepărtarea acizilor Stagnarea acizilor Plan de lecție:
Electroliții se numesc acizi; la disociarea acestor cationi, în apă se formează doar ionii hidratați (H 3 O +). 1. Valoarea acizilor
În 1923 a fost fondată pe teoria proto-litică de către Bernstead-Lauri. Acizii sunt molecule și ioni care sunt donatori de cationi H+. Cationul H+ se numește proton, deci teoria este numită protolitică. Similar cu teoria electronilor a acizilor și fundamentale a chimistului american G.M. Acizii Lewis sunt reactivi care acționează ca acceptori de electroni.
2. Acizi în natură Placă acidă (acizi azotic, sulfuric) Acizi la arici (malic, măcriș, citric, lactic, oleic, cava și altele) „Alte chimice” de animale și legume. Când este mușcat, murakha este decojită pentru a îndepărta acidul murakha. Vikorista și kropiva.
Păianjenul pedipalpid împușcă o floare către inamicii săi, care este compusă din acid otic. Milpiedele plate emană cel mai teribil lucru - vaporii de acid cianhidric. Agaric musca contine acid ibotenic si muscimol. Distrugerea stâncilor muntoase și crearea solului. Lichenii pot vedea acizi care transformă granitul în gunoi.
Vitamine: acid ascorbic, acid folic, orotova, pangamova, nicotină și altele. Acidul hialuronic este componenta principală a mastilului suglob. Aminoacizii digeră proteinele. Acidul clorhidric din coajă activează enzima pepsinogen, care descompune proteinele aricilor și, de asemenea, reduce microflora putrefactivă. Acizi la oameni.
În spatele depozitului: Kisen răzbunare: H NO 3, H 2 SO 3; Fără acid: HCI, H2S. Pe baza bazicității: (bazicitatea unui acid este determinată de numărul de cationi care sunt creați în timpul disocierii). Monobazic: HBr, HNO2; Dibazic: H2S, H2S04; Bogat de bază: H 3 PO 4 . Zavdannya. Denumiți acizii și datați clasificarea lor: HClO3, H2S, H3PO4, HBr. 3. Clasificarea acizilor:
Interacțiuni cu metalele dizolvate în domeniul electrochimic al metalelor în apă. 4. Puterea chimică a acizilor: oxidant, oxidant, oxidarea acetatului de magneziu
Interacțiuni cu oxizii bazici și amfoteri. Independent:
Interacțiunea cu fundații separate și neseparate. Sărurile medii și acide pot fi ajustate. Această reacție este neutralizarea. Independent: 1 mol (exces) 1 mol sulfat acid de sodiu (sare acidă) 1 mol 2 mol sulfat de sodiu (sare mijlocie)
Un acid puternic poate fi combinat cu un acid slab dintr-o sare neîntreruptă. Independent:
Acid clorhidric Pentru descompunerea calcarului și coroziunii în nichelate, cromate, galvanizate etc. extracte de oțel și chavun Pentru detartrarea cazanelor cu abur Acid fluor HF. Infiltrați lemnul pentru a preveni termitele și alți țânțari. Stagnarea acidului
Acid sircanic Pentru extragerea substanțelor fosfor și azotate În extracția rășinilor vibuhovye Fibre bucăți Barvniki Materiale plastice Umplerea bateriilor
Acid azotic Producție vibrantă de acizi azotici Vibuhov Rechovin Likarski Rechovin Barvniki Materiale plastice
Sarcina 1. Scrieți formule și caracterizați acizii pe baza clasificării lor: acid silicic, acid fluorhidric. Zavdannya 2. Următorii reactivi reacţionează cu acidul fosforic: K, SO2, Na2SO4, Na2CO3, MgO, Ag, Ba (OH)2. Securizat
Comanda 1. H 2 SiO 3 – acid, dibazic, non-razchinnaya, slab HF – neacid, monobazic, liber, slab Comanda 2. Tipuri
Multumesc pentru lectie!!!
Cerechoviny molecular budova. Atomii moleculelor de acid sunt legați prin legături polare covalente. Cu cât polarizarea legăturilor dintre atomul de apă, care se formează prin scuipat, este mai mare și atomul electronegativ (acid, acid sau atom de halogen), cu atât mai mult aceste legături se vor disocia într-un mod heterolitic. Aceasta înseamnă că conținutul de cationi din apă va fi mai mare, iar mijlocul va fi mai acid. Ceea ce este de mare importanță nu este doar polaritatea, ci și polarizarea legăturii. Polarizare - aceasta este capacitatea unei legături de a fi polarizată sub influența reactivilor activi. De exemplu, moleculele de apă.
Clasificarea acizilor
Clasificarea acizilor in locul atomilor de acizi, dupa atomi de apa, dupa gravitate si dupa alte semne. Tabel Div 1.
|
Semnele de clasificare |
Grupa de acizi |
fundul |
|
Apariția acrișiunii |
||
|
Bezkisnevi |
||
|
Basicitatea (numărul de atomi de apă care pot fi înlocuiți cu metal) |
Monobază |
|
|
Binar |
||
|
Tribazic |
||
|
Rozchinist |
Rozchinni |
|
|
Nerozchinnі |
||
|
Capacitatea de zbor |
||
|
Puiilor |
||
|
Stadiul disocierii electrolitice |
Н2SO4, HNO3, HCI |
|
|
Stabilitate |
Grajd |
H3PO4, N2SO4, HCI |
|
Instabil |
1. Reacția cu metalele.
Metalele, amestecate cu un număr de metale (Fig. 1.) în apă, îndepărtează apa din acizi.
Mg + 2HCI = MgCI2 + H2
Cu concentrat azotі sirchaniy reacția acidă decurge din excesul anionic. Apa nu se vede. Mic 2.
Cu + 4HNO3(capăt) = Cu (NO3)2 + 2NO2 + H2O
Cu + 2H2SO4(capăt) = Cu SO4 + SO2 + H2O
2. Reacția cu oxizi bazici și amfoteri cu sare si apa.
K2O+ HNO3 = KNO3 + H2O
Al2O3 + 6HCI = 2AlCI3 + 3H2O
3. Reacția cu sărurile. Acizii reacționează cu diferite săruri, ca urmare a reacției unul dintre produse cade sub asediu, lăsând soluția de reacții neînsemnate deplasând echilibrul la dreapta și făcând-o practic ireversibilă.
Н2SO4 + BaCl2 = BaSO4↓ +2 HCl
H2CO3 + BaCl2 = BaCO3↓ +2 HCl
4. Reacționează cu baze și hidroxizi amfoteri.
KOH + HNO3 = KNO3 + H2O
Al(ON)3 + 3HCI = AlCI3 + 3H2O
NaOH + HNO3 = NaNO3 + H2O
5. Identificarea acizilor cu ajutorul indicatorilor acido-bazici.
Într-un mediu acru, turnesolul se umflă cu fermentație roșie. Portocaliul de metil este roșu, iar fenolftalena este liberă.
Metode de bază de retenție a acidului
1. Acizii neacizi pot fi izolați din soluții simple.
2. Aciditatea acidului poate fi îndepărtată prin hidratarea oxizilor acizi.
N2O5 + H2O → 2HNO3
SO3 + H2O → H2SO4
3. Îndepărtarea acizilor de la acizii slabi de la acizii tari, de la cei volatili la cei nevolatili, de la cei volatili la cei nevolatili. De exemplu, acidul clorhidric puternic distruge proprietățile mai slabe ale sărurilor lor.
СH3COONa + HCl = CH3COOH + NaCl
NaСl (solid) + H2SO4 = NaНSO4 + HCl
4. Acizii pot fi îndepărtați prin hidroliza anumitor săruri sau halogenuri.
Al2S3 +6 H2O → 2Al(OH)3↓+ 3H2S
PCl5 + H2O → H3PO4 + 5HCl
Teoria acizilor și bazelor de Svante Arrhenius. Vaughn se bazează pe teoria disocierii electrolitice. Similar cu acesta, acizii sunt substanțe care dizolvă ionii hidratați și anionii de exces acid în apă. Și aparent, bazele sunt un număr de compuși care se disociază în apă în cationi metalici și anioni grup hidroxil.
Teoria Bronsted și Lowry. În concordanță cu această teorie, acizii sunt molecule și ioni, care în această reacție sunt donatori de protoni, iar substituenții sunt molecule și ioni, care acceptă protoni, adică acceptori.
În chimia organică, teoria Lewis este la bază. Un acid este o moleculă sau un ion care conține orbitali de valență liberi, ca urmare a cărora aceștia pot accepta vapori de electroni, de exemplu, ioni de apă, ioni de metal, oxizi și o serie de săruri. Acizii Lewis, care nu înlocuiesc apa ionică, se numesc aprotici. Acizii care conțin protoni sunt considerați o clasă diferită de acizi.
Baza teoriei lui Lewis este o moleculă sau un ion care este un donator de perechi de electroni: toți anionii, amoniacul, aminele, apa, alcoolii, halogenii.
Exemplu de reacție între acizi și baze Lewis.
AlCl3+ Cl- → Cl4-
Această interacțiune stă la baza halogenării compușilor aromatici.
teoria lui Usanovici. În această teorie, un acid este o parte care este capabilă să separe cationii sau să adauge anioni. Evident, este o configurație dus-întors. Această teorie este rar exploatată pentru că a devenit atât de obscură. Aparent, înainte de aceasta, orice interacțiune care implică ioni poate fi redusă la acido-bază. Dar nu este foarte ușor.
Pentru a caracteriza în mod clar modul în care un acid se disociază în ioni, pe lângă înțelegerea stadiului disocierii electrolitice, utilizați următoarele concepte: constanta de disociere. Constanta de disociere este un tip de constantă, care arată capacitatea unui obiect mare (acid, sare sau complex) de a se disocia invers de a adormi în obiecte mai mici. Constanta de disociere este calculată ca adaos de concentrații de ioni în stadiul coeficienților lor stoichiometrici, împărțite în forma nedisociată.
În cazul disocierii vorbirii cu ioni de valență bogati, disocierea are loc într-un ritm similar. Pentru stadiul de piele, valoarea constantei de disociere este mai mare.
Aplicarea disocierii acidului boric tribazicH3 B.O.3 .
Etapa I: H3BO3 ↔ H+ + H2BO3-
Etapa I: H2BO3- ↔ H+ + HBO32-
Etapa I: НВО32- ↔ Н+ + КО33-
Defalcarea constantelor de disociere pentru piele în aceste etape arată astfel:
![]()
![]()
![]()
Aceste valori ale constantelor de disociere se bazează pe faptul că multe discursuri de bază se disociază în principal în funcție de prima etapă.
Trei acizi anorganici joacă un rol important în corpul uman. Tse este acid fosforic, acid clorhidric. Acid fosforic intră în depozitul de sisteme tampon de sânge. Tampoanele sunt acele lucruri care, atunci când adaugă cantități mici de acizi sau baze, își modifică valoarea zilnică a pH-ului. Aceste sisteme sunt necesare pentru a menține aciditatea sângelui la pacient și pentru a menține intervale înguste. Excesul de acid fosforic intră înaintea excesului de multe substanțe biologic active, cum ar fi acizii nucleici și multe enzime. Periile noastre sunt compuse din hidroxid de calciu, fosfat, Ca10(PO4)6(OH)2 sau hidroxiapatită de calciu, iar dinții noștri conțin fluorapatit de calciu, Ca10(PO4)6F2. Mic 8.


Vugilna Acidul este, de asemenea, stocat în sistemele tampon de sânge. În practică, astfel de sisteme pot fi ajustate rapid și ușor, iar nivelul de dioxid de carbon din sânge poate fi variat.
Solyana acidul este prezent în sucul shlank. Previne denaturarea și umflarea proteinelor, ceea ce le face mai ușor de descompus de către enzime. Creează o substanță acidă care necesită enzime. Vaughn este responsabil pentru conținutul antibacterian al sucului de coajă.
JERELA
video dzherelo - https://www.youtube.com/watch?v=KqOwvPrN8W4
Prezentare Dzherelo - http://ppt4web.ru/khimija/kisloty5.html