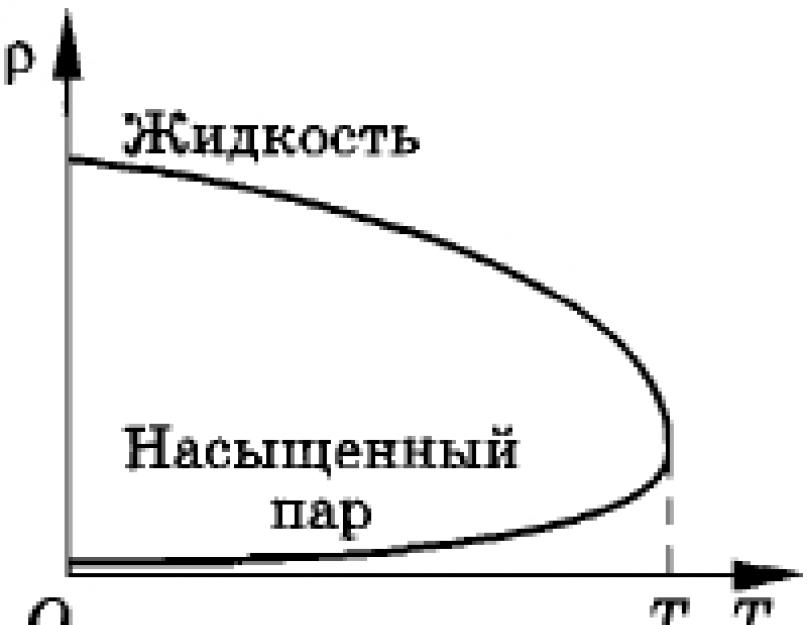
La temperaturi ridicate, izoterma orizontală a unui gaz real (div. Fig. 6.4) devine foarte scurtă și, la temperaturi scăzute, se transformă într-un punct (în Fig. 6.4 - punctul K). Temperatura Qiu este numită critică.
Temperatura este numită critică atunci când există un sentiment de dominație în autoritățile fizice între un cuplu care se află într-o relație dinamică cu ea. Temperatura pielii este critică. De exemplu, temperatura critică pentru acidul carbonic C2 este t K = 31 °C, iar pentru apă - t K = 374 °C.
Tabăra critică
Punctul care corespunde punctului K, la care secțiunea izotermă orizontală începe să se rotească la o temperatură T = Tk, se numește punct critic (punct critic). Presiunea și obligația se numesc critice. Presiunea critică pentru dioxid de carbon este 7,4 10 6 Pa (73 atm), iar pentru apă 2,2 10 7 Pa (218 atm). Într-un stadiu critic, radia are volumul maxim, iar aburul este saturat - presiunea maximă.
Puterea materiei prime și aburului infuzat la o temperatură critică
Am observat deja că la temperaturi mai ridicate, puterea aburului infuzat crește (div. § 6.3). Cu toate acestea, grosimea boabelor, care este egală cu vaporii acestuia, se modifică ca urmare a expansiunii sale atunci când este încălzită.
Tabelul 2 arată puterea apei și a aburului saturat pentru diferite temperaturi.
masa 2
Dacă un copil este plasat pe un strat curbat de grosime în mijloc și infuzat cu abur cu temperatură, atunci mijlocul curbei coboară și aburul urcă (Fig. 6.6). La o temperatură critică, curbele ofensatoare devin furioase, astfel încât puterea mijlocului devine egală cu puterea aburului. Există o diferență între familie și cuplu.

Mic 6.6
Gaz și abur
Am experimentat cuvintele „gaz” și „abur” de multe ori. Acești termeni s-au pierdut în acele ore când se credea că aburul poate fi transferat la sursă, dar gazul nu era disponibil. Deoarece toate gazele au fost condensate (Div. § 6.7), nu a existat un substitut pentru o astfel de terminologie dublă. Aburul și gazul sunt la fel, nu există nicio diferență fundamentală între ele. Dacă vorbim despre câteva feluri, atunci cereți respect că temperatura lor este mai puțin decât critică și sub presiune pot fi transformate într-o casă. Vorbim din nou și din nou despre vapori de apă, și nu despre apă gazoasă, despre abur saturat și nu despre gaz saturat etc.
Investigarea experimentală a etapei critice
Experimente în dezvoltarea unui lagăr critic în 1863. Învățături rusești M. P. Avenarius. Dispozitivul, care poate fi folosit pentru prevenirea unei stări critice (dispozitivul lui Avenarius), constă dintr-o baie de vânt (Fig. 6.7) și un tub de sticlă etanș (fiole), situat în mijlocul băii, cu eter rar. Volumul fiolei (capacitatea acesteia) este egal cu volumul critic de ulei esențial turnat în tub. Spațiul de deasupra eterului din fiolă este umplut cu vapori de eter infuzați.

Mic 6.7
Cu ajutorul unui aragaz sau a unui alt încălzitor, cada cu hidromasaj este încălzită. În afara taberei, Eterul este păzit prin sticlă și în cele din urmă la ușă.
La temperatura camerei, puteți distinge clar între aceeași pereche (Fig. 6.8 a). Pe măsură ce lumea se apropie de temperatura critică, volumul eterului rar crește, iar între miez și vapori acesta devine slab exprimat și instabil (Fig. 6.8, b).

Mic 6.8
Când se apropie de punctul critic dintre ele, totul este cunoscut (Fig. 6.8, c).
Când se răcește, apare o ceață care umple întregul tub (Fig. 6.8, d). Petele de lumină dispar. Apoi mirosurile se înfurie imediat și din nou sunetul izbucnește între aceeași pereche (Fig. 6.8, e).
Pentru a asigura transmiterea undelor de aer se mentine o presiune critica scazuta (aproximativ 36 atm). Temperatura critică este, de asemenea, scăzută: 194 °C.
Dacă comprimați gazul, ridicându-i temperatura la un nivel mai critic (div. Fig. 6.4, izoterma T 3), și, de îndată ce porniți de la obligații foarte mari, atunci modificarea obligației va duce la creșterea presiunii. și va deveni inevitabil gaz ideal egal. Cu toate acestea, dacă la o temperatură sub critică, condensarea aburului a avut loc sub presiune, atunci acum nu va mai fi lichid în vas. La temperaturi peste critice, gazul nu poate fi eliberat sub presiune.
Iată sensul de bază al conceptului de temperatură critică.
Diagrama celor mai importante benzinării și benzinării
Să ne întoarcem din nou la micul 6.4, care arată izoterma unui gaz real. Conectăm toate capetele din stânga ale parcelelor izoterme orizontale, acestea sunt punctele care indică condensarea completă a aburului saturat și începutul comprimării miezului. Veți vedea o curbă lină care se va termina în punctul critic K. Pentru cel mic 6.9 există o curbă ART. În stânga curbei AC, între aceasta și izoterma critică (secțiunea izotermă SC), există o zonă umbrită care indică o stare de vorbire rară (în Fig. 6.9 această zonă este văzută ca hașura orizontală). Punctul de piele al acestei zone este caracterizat de parametrii p, V și T, care caracterizează starea de echilibru termic.

Mic 6.9
Acum putem vedea printr-o curbă netedă toate capetele din dreapta ale graficelor izoterme orizontale. Această curbă a bebelușului 6.9 se va termina și în punctul K. Două linii AK și BK delimitează zona, al cărei punct de piele reprezintă nivelul dintre mijloc și perechea infuzată (în Fig. 6.9 această zonă este vizibilă hașura verticală). În contrast, regiunea este rară și regiunea este egală cu gazul, întreaga cealaltă regiune corespunde stării de vorbire asemănătoare gazului. Pe bebelușul 6.9 câștigat există hașura oblică.
Ca urmare, a fost realizată o diagramă a celor mai importante site-uri de producție de gaze și gaze. Punctul de piele de pe această diagramă reprezintă starea curentă a sistemului: gaz, gaz sau echilibrul dintre gaz și gaz.
La o temperatură critică, puterea țării și cuplurile infestate devin inexorabile. Peste temperatura critică, casa nu poate dormi.
Strict aparent, ne vom uita pe scurt la acest material puterea chimică și fizică a apei în cazuri rare, iar puterea puterii puterii este așa.
Pentru un raport despre puterea apei în stare solidă, puteți citi articolul - PUTEREA APEI ÎN STAND SOLID (citiți →).
Apa este o resursă vitală pentru planeta noastră. Fără el, viața pe Pământ este imposibilă; fără ea, procesul geologic natural nu poate avea loc. Marele gânditor și gânditor Volodymyr Ivanovich Vernadsky a scris în lucrările sale că nu există o astfel de componentă, a cărei valoare ar putea „echivala cu ea pentru afluxul în timpul principalelor și mai periculoase procese geologice”. Apa este prezentă nu numai în corpul tuturor viețuitoarelor de pe planeta noastră, ci și în toate râurile de pe Pământ - în minerale, în roci muntoase... Studiul puterilor unice ale apei ne dezvăluie în mod constant noi și noi secrete, se întreabă. ne face noi ghicitori și ne dă noi chemări.
Putere anormală a apei
Bagato puterile fizice și chimice ale apei să fii surprinzător și să ieși din reguli și tipare ascunse și din cele anormale, de exemplu:
- Pe baza legilor stabilite în spatele principiului similarității, în cadrul unor științe precum chimia și fizica, am putea realiza că:
- Fierbem apa la minus 70°C, si o congelam la minus 90°C;
- apa nu picură din vârful robinetului, ci curge într-un șuvoi subțire;
- gheața se scufundă și nu plutește la suprafață;
- Sticla cu apă nu ar fi rămas fără mai mult de câteva boabe de tsukru.
- Suprafața apei are un potențial electric negativ;
- Când este încălzită de la 0 la 4°C (mai precis 3,98°C), apa se micșorează;
- Este declanșată capacitatea mare de căldură a apei rare;
După cum sa spus deja, în acest material vom acoperi puterile fizice și chimice de bază ale apei și vom discuta unele dintre ele cu scurte comentarii.
Puterea fizică a apei
PUTEREA FIZICĂ – puterea care se manifestă prin reacții chimice.
Puritatea apei
Puritatea apei se datorează prezenței bacteriilor, sărurilor unor metale importante în ea..., pentru a afla despre interpretarea termenului APĂ PURĂ pe versiunea site-ului nostru, trebuie să citiți articolul APĂ PURĂ (citește → ).
Culoarea apei
Culoarea apei este stocată în depozite chimice și case mecanice.
De exemplu, să ne uităm la „Culorile mării”, date de „Great Radian Encyclopedia”.
Culoarea mării. Culoarea care este percepută de ochi, dacă cineva este atent să se minuneze de suprafața mării, Culoarea mării se află cu culoarea apei mării, culoarea cerului, cantitatea și caracterul întunericului, înălțimea Soarelui deasupra orizontului și așa mai departe.
Conceptul de culoare a mării este subdivizat în conceptul de culoare a apei mării. Sub culoarea apei de mare puteți înțelege culoarea care este percepută de ochi atunci când priviți direct apa de mare peste un corp alb. De la suprafața mării, o parte nesemnificativă a schimburilor de lumină în cădere este ruptă, iar unele dintre ele pătrund în adâncuri, unde sunt îngropate și disipate de molecule de apă, particule de lichide în suspensie și bulbi fracționați de gaze. Moleculele de apă se risipesc în cele mai puternice culori albastru și verde. Părțile importante pot fi, totuși, diferite. Prin urmare, apa de mare cu o cantitate mică de suspensie apare albastru-verde (culoarea părților deschise ale oceanelor), iar cu o cantitate semnificativă de suspensie - verde gălbui (de exemplu, Marea Baltică). Latura teoretică a teoriei despre C. m. a fost extinsă de V. V. Shuleikin și C. V. Raman.
Marea Enciclopedie Radyanska. - M: Enciclopedia Radyansk. 1969-1978
Mirosul apei
Mirosul de apă - apa curată, de regulă, nu are miros.
Seninătatea apei
Seninătatea apei constă în descompunerea apelor sale minerale și în loc de case mecanice, ape organice și colonii:
CLARAȚIA APEI - capacitatea apei de a permite trecerea luminii. Sună ca un disc Secchi. Constă în principal în concentrația de substanțe organice și anorganice importante din apă. Poate exista o scădere bruscă ca urmare a poluării antropice și a eutrofizării cu apă.
Dicționar enciclopedic ecologic. – Chișinău I.I. A făcut Yu. 1989
CLARAȚIA APEI - capacitatea apei de a trece prin pasaje luminoase. A se întinde într-un vas cu apă, a trece prin schimburi, apariția unor case importante în el, dizolvarea discursurilor etc. În apă, cele roșii și galbene se estompează mai puternic, iar cele violete pătrund mai adânc. În ordinea clarității, în ordinea schimbării, apele sunt împărțite:
- prozori;
- ușor opalescent;
- opalescent;
- ușor kalamutni;
- Kalamutni;
- foarte kalamutni.
Glosar de hidrogeologie și geologie inginerească. - M: Gostoptehizdat. 1961
Gustă apa
Gustul apei este să zacă în depozitul discursurilor ei.
Glosar de hidrogeologie și geologie inginerească
Gustul apei este puterea apei care se află în spatele descompunerii sărurilor și gazelor sale. Tabelul arată concentrația de săruri prezente în apa de băut (în mg/l), de exemplu, tabelul (conform Personalului).
Temperatura apei
Temperatura de topire a apei:
TEMPERATURA DE TOPIRE - temperatura la care un lichid trece de la o stare solidă la o stare rară. Punctul de topire al solidelor este același cu punctul de îngheț al gheții, de exemplu punctul de topire al gheții, aproximativ °C, sau punctul de îngheț al apei.
Temperatura apei de fierbere : 99,974°C
Dicționar enciclopedic științific și tehnic
TEMPERATURA DE FIIERE, temperatura la care se poate trece de la o treapta (faza) la alta, fie de la lichid la abur sau gaz. Punctul de fierbere crește odată cu creșterea presiunii externe și scade odată cu astfel de modificări. Setați-le să oscileze la o presiune standard de 1 atmosferă (760 mmHg) Setați temperatura apei de fierbere la o presiune standard la 100 °C.
Dicționar enciclopedic științific și tehnic
Punct de apă triplu
Punct triplu al apei: 0,01 ° C, 611,73 Pa;
Dicționar enciclopedic științific și tehnic
PUNCT TRIPLU, temperatură și presiune, la care toate cele trei etape ale vorbirii (solide, rare, asemănătoare gazelor) pot fi îndepărtate în același timp. Pentru apă, punctul triplu este la o temperatură de 273,16 K și 610 Pa.
Dicționar enciclopedic științific și tehnic
Tensiunea superficială a apei
Tensiunea superficială a apei înseamnă forța de agregare a moleculelor de apă una câte una, de exemplu, care parametru determină modul în care aceeași apă este absorbită de corpul uman.
Duritatea apei
Dicţionar marin
Rigiditatea apei - puterea apei care este drenată în loc să-și descompună sărurile metalelor din luncă-pământ, obiectiv. arr. calciu și magneziu (sub formă de săruri bicarbonate - bicarbonați), și săruri ale acizilor minerali tari - acid și clorhidric. J. St apare în unități speciale, așa numite. grade de duritate. Gradul de duritate se numește oxid de calciu (CaO), care este egal cu 0,01 g la 1 litru de apă. Apa dură nu este potrivită pentru durata de viață a cazanelor; fragmentele provoacă o acumulare puternică de calcar pe pereții acestora, ceea ce poate cauza prăbușirea tuburilor cazanului. Cazanele de presiune mare și mai ales de înaltă presiune sunt necesare pentru a consuma apă absolut purificată (condens de la motoarele cu abur și turbine, purificat prin filtre suplimentare din casa de ulei, precum și distilat, care se prepară în evaporatoare speciale).
Samoilov K. I. Dicţionar marin. - M.-L.: Statul Viyskovo-Morske Vidavnitstvo al NKVMF la Uniunea Republicii Socialiste Ruse, 1941
Dicționar enciclopedic științific și tehnic
Duritatea apei, lipsa de calitate a apei, creează un efect pozitiv prin dizolvarea sării în ea, în principal calciu și magneziu.
Calcarul din cazane și țevi este creat prin prezența carbonatului de calciu dizolvat în apă, care se dizolvă în apă la contactul cu calcarul. Când este fierbinte sau stropit, carbonatul de calciu începe să precipite, apărând ca depuneri dure, spumoase, pe suprafețele din mijlocul cazanelor. Carbonatul de calciu previne, de asemenea, spumarea laptelui. Recipient schimbător de ioni (3), umplut cu granule acoperite cu materiale de sodiu. cu care intra in contact apa. Ionii de sodiu, fiind activi, inlocuiesc ionii de calciu Resturile de sare de sodiu sunt indepartate din efectele nocive ale apei la fierbere, iar depunerile nu dispar.
Dicționar enciclopedic științific și tehnic
Structura apei
Mineralizarea apei
Mineralizarea apei :
Dicționar enciclopedic ecologic
MINERALIZAREA APEI - saturarea apei anorganice. (minerale) substanțe care sunt prezente în aspectul ei de ioni și coloizi; Cantitatea totală de săruri anorganice care sunt importante să se găsească în apa dulce, stadiul de mineralizare poate fi exprimată în mg/l sau g/l (una în g/kg).
Dicționar enciclopedic ecologic. – Chișinău: Sediul central al Enciclopediei Radian din Moldova. I.I. A făcut Yu. 1989
Vâscozitatea apei
Vâscozitatea apei caracterizează suportul intern al particulelor din mijloc:
Dicționar geologic
Vâscozitatea apei (rіdini) este puterea rіdini, care se formează în Rusia prin forța vicioasă a frecării. Iar factorul implicat este transferul rotorului de la bilele de apă, care se deplasează cu mare fluiditate, la bilele cu mai puțină fluiditate. Art. Art. se află sub diferențe de temperatură și concentrație. Din punct de vedere fizic, se evaluează coeficientul. vâscozitatea, care este inclusă într-o serie de formule pentru curgerea apei.
Dicţionar geologic: 2 volume. - M: Nadra. Editat de K. N. Paffengolts și în. 1978
Există două tipuri de vâscozitate a apei:
- Vâscozitatea dinamică a apei - 0,00101 Pas (la 20 ° C).
- Vâscozitatea cinematică a apei este de 0,01012 cm 2 /s (la 20 ° C).
Punct critic de apă
Punctul critic al apei se numește starea sa la presiune și temperatură constantă, atunci când este într-o stare asemănătoare gazului și rară (faza asemănătoare gazului și rară).
Punct critic de apă: 374 ° C, 22,064 MPa.
Pătrunderea dielectrică a apei
Pătrunderea dielectrică este un coeficient care arată cât de mult este mai mare forța de interacțiune între două sarcini în vid decât cea într-un mediu lichid.
Acest afișaj este extrem de ridicat, iar în câmpurile electrice statice este de până la 81.
Capacitatea termică a apei
Capacitatea termică a apei - apa are o capacitate termică foarte mare:
Dicționar ecologic
Capacitatea termică este puterea râurilor de a absorbi căldura. Se exprimă în cantitatea de căldură care se topește în lichid atunci când este încălzită cu 1°C. Capacitatea termică a apei este de aproximativ 1 cal/g sau 4,2 J/g. Capacitatea termică a solului (la 14,5-15,5°C) variază (de la solurile tratate cu turbă) de la 0,5 la 0,6 cal (sau 2,1-2,5 J) pe unitate de volum 0,2 până la 0,5 cal (sau 0,8-2,1 J) pe unitate masa (g).
Dicționar ecologic. - Alma-Ata: „Știință”. B.A. Bikiv. 1983
Dicționar enciclopedic științific și tehnic
Apoi capacitatea termică (marcată cu), căldura necesară pentru a crește temperatura a 1 kg de lichid cu 1K. Vizibil în J/K.kg (de J-JOLE). Fluidele cu o masă termică mare, cum ar fi apa, necesită mai multă energie pentru a crește temperatura, în timp ce fluidele cu o capacitate termică scăzută nu.
Dicționar enciclopedic științific și tehnic
Conductibilitatea termică a apei
Conductivitatea termică a materialului depinde de capacitatea acestuia de a conduce căldura din părțile sale fierbinți către cele reci.
Transferul de căldură din apă are loc fie la nivel molecular, care este transferat de moleculele de apă, fie prin mișcarea/mișcarea oricărei sau a tuturor apelor - conductivitate termică turbulentă.
Conductivitatea termică a apei depinde de temperatură și presiune.
Lungimea apei
Sub planeitatea vorbirii, se înțelege capacitatea acesteia de a-și schimba forma sub infuzia de tensiune constantă sau presiune constantă.
Planeitatea boabelor este indicată de slăbirea părților lor, care pot absorbi cu ușurință stresul suplimentar.
Inductanța apei
Inductanța înseamnă puterea magnetică a circuitelor închise ale fluxului electric. Apa, din cauza anumitor supratensiuni, conduce electricitatea și, prin urmare, devine inductivă.
Puterea apei
Grosimea apei se determină prin aducerea amestecului la volum la temperatura dorită. Citiți mai multe în materialul nostru CARE ESTE ALCHINITATEA APEI?(citește →).
Etanșeitatea apei
Consistența apei este nesemnificativă și depinde de salinitatea apei și de presiune. De exemplu, apa distilată are o valoare de 0,0000490.
Conductibilitatea electrică a apei
Conductivitatea electrică a apei conține o mulțime de săruri datorită numărului de săruri dizolvate în ele.
Radioactivitatea apei
Radioactivitatea apei se datorează emisiilor de radon și radiu.
Puterea fizico-chimică a apei
Glosar de hidrogeologie și geologie inginerească
PUTEREA FIZICO-CHIMICĂ A APEI - parametri care indică proprietățile fizico-chimice ale apelor naturale. Acestea prezintă indicatori ai concentrației ionilor de apă (pH) și potențialul de oxid (Eh).
Glosar de hidrogeologie și geologie inginerească. - M: Gostoptehizdat. Editor: A. A. Makkaveev, editor O. K. Lange. 1961
Apă încărcată cu acid
Potențialul de oxid al apei
Potențialul de oxid al apei (ORP) - capacitatea apei de a intra în reacții biochimice.
Puterea chimică a apei
PUTEREA CHIMICA A DIBUZOARELOR – aceasta este puterea care apare ca rezultat al reactiilor chimice.
Mai jos este puterea chimică a apei din spatele manualului „Fundamentals of Chemistry. Ghid de internet” de A. V. Manuilova, V. I. Rodionova.
Interacțiunile apei cu metalele
Când apa reacționează cu majoritatea metalelor, are loc o reacție din apa văzută:
- 2Na + 2H2O = H2 + 2NaOH (ruginit);
- 2K + 2H2O = H2 + 2KOH (rapid);
- 3Fe + 4H2O = 4H2 + Fe3O4 (doar după încălzire timp de o oră).
Nu toate, dar doar câteva metale active pot lua parte la reacțiile de oxid de acest tip. Cele mai ușor de reacționat sunt metalele de luncă și luncă-pământ din grupele I și II.
Interacțiunile apei cu nemetale
Nemetalele reacţionează cu apa, de exemplu, carbonul şi apa (metanul). Aceste cuvinte sunt mult mai puțin active, mai puțin metalice, dar totuși reacționează cu apa la temperaturi ridicate:
- C + H2O = H2 + CO (cu încălzire puternică);
- CH4 + 2H2O = 4H2 + CO2 (cu încălzire mare).
Interacțiunea apei cu curentul electric
Când funcționează cu jet electric, apa este împărțită în apă și jeleu. Aceasta este, de asemenea, o reacție oxidativă, în care apa este atât un agent de oxidare, cât și un agent de precipitare.
Interacțiunile apei cu oxizii nemetalici
Apa reacționează cu mulți oxizi nemetalici și unii oxizi metalici. Acestea nu sunt reacții oxidative, ci reacții seminale:
SO2 + H2O = H2SO3 (acid sulfuric)
SO3 + H2O = H2SO4 (acid sulfuric)
CO2 + H2O = H2CO3 (acid carbonic)
Interacțiunile apei cu oxizii metalici
Unii oxizi de metal pot reacționa cu apa. Am auzit deja exemple de astfel de reacții:
CaO + H2O = Ca(OH)2 (hidroxid de calciu (hidroxid))
Nu toți oxizii metalici reacţionează cu apa. Piesa este practic incompatibilă cu apa și, prin urmare, nu reacționează cu apa. De exemplu: ZnO, TiO2, Cr2O3, de exemplu, rezistent la apă. De asemenea, oxizii de saliva nu se dizolvă în apă și nu reacționează cu aceasta.
Hidratarea și hidratarea cristalelor
Apa dizolvă solidele, hidrații și hidrații cristalini, în care este reținută molecula de apă.
De exemplu:
- CuS04 + 5H2O = CuS04,5H2O;
- CuSO4 – rășină de culoare albă (sulfat de cupru anhidru);
- CuSO4.5H2O - hidrat de cristal (sulfat de cupru), cristale albastre.
Alte aplicații pentru prepararea hidraților:
- H2SO4 + H2O = H2SO4.H2O (hidrat de acid sulfuric);
- NaOH + H2O = NaOH.H2O (hidroxid de sodiu).
O conexiune care leagă apa în hidrați și hidrați de cristal, vikorist ca uscător. Cu acest ajutor, de exemplu, vaporii de apă pot fi văzuți din aerul umed atmosferic.
Bio-sinteză
Apa ia parte la biosinteză, ca urmare a căreia se creează aciditatea:
6n CO 2 + 5n H 2 O = (C 6 H 10 O 5) n + 6n O 2 (la lumină slabă)
 Credem că puterea apelor este diversă și consumă aproape toate aspectele vieții de pe Pământ. După cum am formulat una dintre cele de mai sus... este necesar să tratam apa într-o manieră cuprinzătoare, și nu în contextul altor manifestări.
Credem că puterea apelor este diversă și consumă aproape toate aspectele vieții de pe Pământ. După cum am formulat una dintre cele de mai sus... este necesar să tratam apa într-o manieră cuprinzătoare, și nu în contextul altor manifestări.
În timpul pregătirii materialului, s-au extras informații din cărțile - Yu. P. Rassadkin „Apă de urgență și non-urgență”, Yu. Ya. Fialkov „Puterea independentă a roșinilor de urgență”, Pidruchnik „Fundamentals of Chemistry”. Ghid de internet” de A. V. Manuilova, V. I. Rodionova și în.
Cum se transferă gaz în țară? Diagrama punctului de fierbere este în concordanță cu dieta dumneavoastră. Puteți transforma gazul la mediu fie prin modificarea temperaturii, fie prin creșterea presiunii.
În secolul al XIX-lea, mișcarea în menghină părea mai ușoară lucrătorilor, scăzând temperatura. La începutul acestui secol, marele fizician englez Michael Farady a reușit să comprima gazele la presiunea vaporilor și să transforme în acest fel o mulțime de gaze (clor, dioxid de carbon etc.).
Cu toate acestea, mai multe gaze - apă, azot, kisen - nu au cedat hidrogenării. Oricât de mult a crescut presiunea, duhoarea nu a revenit în patrie. S-ar putea crede că acidul și alte gaze nu pot fi rare. Au fost asigurate până la gaze proaspete sau constante.
De fapt, eșecurile s-au datorat circumstanțelor nerezonabile ale unei situații importante.
Să aruncăm o privire la perechea care se află în aer și să ne gândim la ce se întâmplă cu ele la un punct de fierbere crescut și, evident, o creștere similară a presiunii. În caz contrar, este evident că punctul de pe graficul de fierbere se prăbușește în sus. Este clar că pe măsură ce temperatura crește, mediul se extinde și grosimea acestuia scade. Cum rămâne cu pariul, apoi crește temperatura de fierbere? Evident, se extinde, dar, așa cum am spus deja, presiunea aburului infuzat crește semnificativ mai rapid, iar temperatura de fierbere mai scăzută. Prin urmare, grosimea aburului nu scade, ci, dimpotrivă, grosimea crește din cauza creșterii temperaturii de fierbere.
Pe măsură ce grosimea miezului scade, iar grosimea vaporilor crește, atunci, prăbușindu-se „în sus” de-a lungul curbei de fierbere, vom ajunge inevitabil la un punct în care grosimea miezului și a vaporilor devin egale (Fig. 4 .3). ).
În acest punct miraculos, care se numește critic, curba de fierbere se termină. Fragmentele tuturor diferențelor dintre gaz și gaz sunt legate de diferența de putere, apoi la un punct critic autoritățile țării și gazele devin aceleași. Pielea are propria sa temperatură critică și propria sa presiune critică. Deci, pentru apă, punctul critic este o temperatură de 374° și 218,5 atm.
De îndată ce comprimați un gaz a cărui temperatură este sub critică, procesul de comprimare va fi reprezentat de o săgeată care traversează curba punctului de fierbere (Fig. 4.4). Aceasta înseamnă că în momentul atingerii presiunii, când presiunea aburului este mai mare (punctul în care săgeata traversează curba punctului de fierbere), gazul începe să se condenseze în mijloc. Dacă vasul nostru ar fi fost iluminat, atunci în acel moment am fi turnat stiulețul creației în sfera libertății în zilele vasului. Cu o presiune constantă, mingea va crește până când tot gazul este transferat la mijloc. O compresie suplimentară va necesita o menghină mai mare.

Este complet diferit în dreapta când gazul este comprimat, temperatura oricărei substanțe este critică. Procesul de comprimare poate fi descris din nou uitându-se la săgețile care merg de jos în sus. Dar acum această săgeată nu traversează curba de fierbere. Aceasta înseamnă că atunci când aburul este stors, nu se condensează, ci mai degrabă se condensează în mod constant.
La temperatura criticului este un lucru greșit, rodi rodi, pierce-ul Rozdil: cu waskanni, pentru a fi pistonul pistonului, un singur râu este un singur râu, spun important, dacă se numește denumiri de gaz și dacă a fost numit cu un gaz.
Prezența unui punct critic arată că între o stare rară și cea asemănătoare gazului nu există o semnificație fundamentală. La prima vedere, s-ar putea crede că nu există o astfel de importanță fundamentală doar în cazul temperaturilor care sunt mai critice. Tse, prote, negarazd. Existența unui punct critic indică posibilitatea reconstituirii lichidului pur, care poate fi turnat într-un balon - într-un cazan de tip gaz fără fierbere asemănătoare apei.
O astfel de cale de transformare este prezentată în Fig. 4.4. Crucea indică o patrie clară. De îndată ce reduceți puțin presiunea (săgeata în jos), aduceți-o la fierbere, aduceți-o la fierbere și apoi creșteți puțin temperatura (săgeata dreapta). Ale mi lucrurile stau cu totul altfel, Strângem și mai tare patria, până la o presiune mai critică. O pată care reprezintă peisajul rural, stând vertical în sus. Apoi continuăm să jucăm linia - acest proces va fi reprezentat de o linie orizontală. Acum, din moment ce am fost acuzați de temperatura critică, vom reduce presiunea până în weekend. Dacă schimbați acum temperatura, puteți elimina aceeași pereche care ar fi putut fi îndepărtată la o lungime mult mai simplă și mai scurtă.
În acest fel, este acum posibilă, prin modificarea presiunii și temperaturii în jurul punctului critic, să se elimine perechea prin intermediul unei tranziții neîntrerupte de la unul la altul sau de la celălalt. O astfel de tranziție continuă nu va necesita fierbere sau condensare.
Testele timpurii ale rarefării unor gaze precum gazul acru, azotul, apa nu erau departe, deoarece era clar că se dezvolta o temperatură critică. Aceste gaze au temperaturi critice foarte scăzute: azot -147°C, acid -119°C, apă -240°C sau 33 K. Deținătorul recordului este heliul, a cărui temperatură critică este mai mare de 4,3 K. Se amestecă aceste gaze cu Acest este posibil într-un singur mod - cerința este să le reducă temperatura sub valoarea specificată.
Dacă puneți o mulțime de ridichi într-un recipient închis, atunci o parte din ridiche se va evapora și se va infuza aburi peste ridiche. Presiunea, însă, și puterea aburului depind de temperatură. Puterea aburului este semnificativ mai mică decât puterea aburului la aceeași temperatură. Dacă creșteți temperatura, grosimea miezului se va modifica (§ 198), presiunea și puterea aburului saturat vor crește. In masa 22 arată puterea apei și a vaporilor de apă infuzați pentru diferite temperaturi (și, de asemenea, pentru vicii similare). În fig. 497 Aceste date sunt afișate în vizualizarea grafică. Partea superioară a graficului arată modificarea grosimii lichidului în funcție de temperatură. Când temperatura crește, grosimea mijlocului se schimbă. Partea inferioară a graficului arată puterea aburului infuzat în funcție de temperatură. Puterea aburului crește. La o temperatură care indică punctul, se evită puterea sursei și aburul saturat.

Mic 497. Depunere de densitate a apei si abur saturat in functie de temperatura
Tabelul 22. Puterea apei și a aburului saturat la diferite temperaturi
|
Temperatura, |
Presiunea unui pariu forțat, |
Puterea apei, |
Puterea aburului infuzat, |
Căldura Pitah de creare a aburului, |
Tabelul arată că cu cât temperatura este mai mare, cu atât diferența dintre grosimea sursei și grosimea aburului saturat este mai mică. La orice temperatură (în apă la ) grosimea este redusă. Temperatura la care se atinge grosimea miezului și aburului saturat se numește temperatura critică a substanței date. În fig. 497 Acest lucru este indicat de punct. Un menghin care arata puncte se numeste menghin critic. Temperaturile critice ale diferitelor substanțe variază foarte mult între ele. Acțiunile lor sunt indicate în tabel. 23.
Tabelul 23. Temperatura critică și presiunea critică a fluidelor active
|
Rechovina |
Temperatura este critică |
Presiune critică, atm |
Rechovina |
Temperatura este critică |
Presiune critică, atm |
|
Vuglets gaz |
|||||
|
Kisen |
|||||
|
Alcool etilic |
|||||
Ce indică apariția unei temperaturi critice? Ce se va întâmpla cu temperaturi și mai ridicate?
Dovezile arată că la temperaturi care sunt mai mult decât critice, lichidul poate exista doar într-o stare asemănătoare gazului. Dacă schimbăm sarcinile ocupate de un cuplu, la o temperatură mai critică, atunci presiunea aburului crește, dar nu devine intens și continuă să fie lipsit de același lucru: deși este o presiune mare, nu suntem. vizibile în două zone, separate printr-un cordon ascuțit. Oh, cum ar trebui să fii mereu atent când la temperaturi scăzute din cauza condensului de abur. Cu toate acestea, deoarece temperatura oricărui discurs este mai critică, atunci consistența discursului în aspectul sursei și aburul care se acumulează în spatele ei este imposibilă sub orice presiune.
Poziția critică a vorbirii poate fi observată cu ajutorul unui dispozitiv suplimentar, prezentat în Fig. 498. Vinul este alcătuit dintr-o cutie de lichid cu flacon, care poate fi folosită la încălzirea lichidului („lazne inflamate”), și o fiolă de sticlă cu eter, care se află în mijlocul laznei. Când laserul este încălzit, meniscul din fiolă se ridică, devine mai plat și se știe că indică faptul că a trecut prin punctul critic. Când fiola este răcită, fiola de raptian kalamut este lăsată netulburată de prezența altor picături de eter, după care eterul este colectat în partea inferioară a fiolei.

Mic 498. Aplicând precauție stării critice a ephira
Iac este evident de la masă. 22, în apropierea punctului critic al gropii, căldura generată de abur devine mai mică. Aceasta înseamnă că, odată cu creșterea temperaturii, se modifică intensitatea energiilor interne ale vorbirii în stări rare și asemănătoare aburului. Adevărat, forțele de agregare ale moleculelor se află în spațiile dintre molecule. Deoarece puterile și vaporii variază puțin, diferențele medii dintre molecule variază, de asemenea, puțin. Ei bine, în acest caz, valorile energiei potențiale de interacțiune între molecule sunt puțin crescute. O altă creștere a căldurii de creare a aburului - care lucrează împotriva presiunii externe - se schimbă, de asemenea, pe măsură ce lumea se apropie de o temperatură critică. Ts vibiva, chim Mensha vidminist la cățelul Paris і Rydini, Tim Menzhe Rosshirennya, viparovanni, eu, robotul Ozhe, Tim Mensh, sănătatea sănătății și viparovanni.
Pe baza temperaturii critice, a fost indicată pentru prima dată în 1860. Dmitro Ivanovici Mendelev (1834-1907), chimist rus, care a descoperit legea fundamentală a chimiei de zi cu zi - legea periodică a elementelor chimice. Chimistul englez Thomas Andrews are mari realizări la această temperatură critică, raportând despre comportamentul acidului carbonic în timpul unei schimbări izoterme a muncii pe care o ocupă. Andrews a arătat că la temperaturi mai scăzute într-un vas închis, este posibil să se combine acidul carbonic într-o stare rară și asemănătoare gazului; La temperaturi mai mari decât aceasta, este imposibil să faci față și întregul vas este umplut doar cu gaz, pentru a nu schimba lichidul.
După ce a fost atinsă temperatura critică, a devenit clar că nu a fost posibil de mult timp să se transforme în casă gaze precum acidul și apa. Temperatura critică este și mai mică (Tabelul 23). Pentru a transforma aceste gaze în lichide, ele trebuie să fie răcite sub temperatura critică. Fără cine, toate încercările la această educație sunt sortite eșecului.
Izoterme experimentale și teoretice
În primul rând, izotermele experimentale pentru gaze reale (dioxid de carbon) au fost studiate de Andrews și au fost determinate de presiunea izotermă ridicată a vaporilor nesaturați prezenți în cilindrul de sub piston (izoterma prezentată în Fig. 2.19 a).
După cum este evident din izotermele prezentate în Fig. 2.19, a, puneți toate ingredientele într-o parcelă orizontală, pe măsură ce temperatura se schimbă odată cu temperatura și când ajunge temperatura critica() știe complet. Temperatura critică este indicată de izoterma critică 4; în punctul critic există un punct de inflexiune.
Dacă trasați o linie izotermă prin punctele extreme ale diagramelor orizontale (va fi ca un inel), atunci întreaga zonă cu diagrame în coordonate (,) va fi împărțită în trei zone (Fig. 2.19, b) - regiunea a stațiilor rare, regiunea stațiilor de tip benzină și regiunea stațiilor bifazate ів (în Se dezvăluie imediat o stare de vorbire asemănătoare gazului și rară). Este semnificativ faptul că în fig. 2.19 cadrul dur al discursului nu a fost descris.
Zona de condiții asemănătoare gazului, care este deasupra izotermei critice, se numește gaz. Izoterma acestui gaz este prezisă de izoterma unui gaz ideal (Fig. 2.19a, izoterma 5). În acest galus de temperaturi, râul este într-o stare asemănătoare gazului sub orice presiune sau presiune, atunci. Aplicând o compresie izotermă gazului, este imposibil să se transforme la temperaturi normale la astfel de temperaturi. Acest lucru se explică prin faptul că heliul și apa nu au putut fi convertite într-o stare rară prin procesul suplimentar de compresie izotermă (pentru heliu și apă, temperaturile critice au devenit similare). Dacă luați un gaz care se află sub izoterma critică, atunci cu compresie izotermă poate fi convertit la starea inițială. Pe baza acestui fapt, acest gaz se numește un cuplu nesaturat.

Să aruncăm o privire la izoterma numărul 2 din Fig. 2.19, a. Poate fi împărțit în trei parcele.
Dilyanka -. Când stoarceți aburul nesaturat, mergeți până la punctul în care este apăsată presiunea.
Dilyanka -. Condensarea aburului saturat are loc la o presiune constantă, care este egală cu presiunea aburului saturat la o anumită temperatură. În această galusa, două faze ale vorbirii - rare și asemănătoare vaporilor - apar în rivnovasi. Când este atins punctul, întreaga pereche se transformă într-una singură.
Dilyanka -. Aici te ferești de tabăra rară a vorbirii. Modificarea volumului datorată presiunii crescute va fi nesemnificativă. Prin urmare, izotermele acestui galus sunt practic verticale.
Să aruncăm o privire la raportul de la care se primește punct critic(Parametrii care sunt legați de aceștia sunt desemnați ca , і ).
U punct critic ai grijă tabără critică a discursului Pentru toată lumea, el știe diferența dintre o familie și un cuplu de reproducere. Acest lucru se manifestă prin faptul că, atunci când sunt încălzite într-un vas închis, unele substanțe, când se atinge o temperatură critică, apar între sol și abur - ele creează o singură substanță omogenă (tăria aburului și a aburului). în jur, sau tensiunea superficială dispare, căldura de creare a aburului ajunge la zero).
3. Verificarea izotermelor teoretice și experimentale. Să aruncăm o privire la tipul de izoterme care pot fi obținute din ecuația (2.86). În acest scop vom rescrie ceremonia în felul următor:
![]() . (2.88)
. (2.88)
Se pare că o astfel de rimă cubică conține fie una, fie trei rădăcini de vorbire. În fig. 2.19, este trasat un grafic al uneia dintre izotermele diversificate - pentru aceasta în zona viciului () nivelul soluției (2.88) dă trei rădăcini de vorbire (linia orizontală trage izoterma în trei puncte, adică. Unele sensuri sunt obligatorii, i). Acest lucru duce la un comportament în zig-zag (ca bici) al izotermelor în zona de încălzire de o oră a aburului saturat și a razei.

Acest comportament al izotermei în acest galus nu este în concordanță cu experimentul. În alte domenii, în care doar individul sau doar un cuplu sunt conștienți, se are grijă să nu se lase suficient timp între experiment și teorie.
Este semnificativ faptul că parcelele de viță de vie ale izotermelor rosrahunkiene sunt adesea confirmate prin experiment. Dacă creați un rezervor în care gazul va avea centre zilnice de condensare (de exemplu, pulberi sau ioni), atunci o presiune izotermă mai mare (tranziția 1-2-3) poate primi următoarele titluri cuplu încrucișat Acest lucru este confirmat de izoterma cadrului, plasată între punctele 2 și 3 (Fig. 2.20, a). Presiunea aburului intersectat depășește presiunea aburului infuzat la o anumită temperatură. Aceste stații vor fi metastabile (mici) - la traversarea centrelor de condensare, aburul se transformă rapid în mijloc (tranziția 3-4), se ajunge la echilibrul dintre cuplul saturat și mijloc.
Stadiile metastabile pot fi îndepărtate într-un mod similar ridiche supraîncălzită. Pentru a face acest lucru, este necesar să îndepărtați din centrul și pereții vasului unde există centre de creare a aburului (de exemplu, pulberi, bulbi de gaze produse în centru). Temperaturile supraîncălzite sunt indicate de plantele care sunt încălzite la o izotermă între punctele 6 și 7 (Fig. 2.20, a), iar temperatura va fi mai mare decât punctul de fierbere. De îndată ce centrii de creare a aburului încep să fiarbă, mănușa începe să fiarbă (tranziția 7-8).
Condițiile care corespund izotermelor dintre punctele 3 și 7 (marcate printr-o linie punctată) sunt absolut instabile (Fig. 2.20, a) și nu pot fi implementate în practică.
De exemplu, în Fig. 2.20 b grafice ale izotermelor varicoase la diferite temperaturi. Dacă da, este necesar să se asigure că figurile plate sunt aceleași (Fig. 2.20, c), ceea ce este rezultatul unui alt element de termodinamică.
4. Parametri critici de vorbire. Să ne uităm la modul în care, prin măsurarea experimentală a parametrilor critici ai vorbirii (), care indică punctul critic, putem estima poziția care este inclusă în ecuația Van der Waals.
Punctul critic de pe izoterma critică este indicat printr-un punct de inflexiune, iar acest punct, care este similar cu graficul, va fi orizontal. Aceasta înseamnă că în acest moment presiunea asupra gazului este egală cu zero. Să știm ce se întâmplă. În acest scop vom rescrie ecuația (12.99) în felul următor:
![]()
![]() ,
, ![]() .
.