ВУГЛЕРОД, С (а. carbon; н. Kohlenstoff; ф. carbone; і. carbono), - хімічний елемент IV групи періодичної системи Менделєєва, атомний номер 6, атомна маса 12,041. Природний вуглець складається із суміші 2 стабільних ізотопів: 12 С (98,892%) та 13 С (1,108%). Відомо також 6 радіоактивних ізотопів вуглецю, з яких найбільш важливим є ізотоп 14 З періодом напіврозпаду 5,73.10 3 років (цей ізотоп у невеликих кількостях постійно утворюється у верхніх шарах атмосфери в результаті опромінення ядер 14 N нейтронами космічного випромінювання).
Вуглець відомий з глибокої давнини. Дерев'яний використовувався для відновлення металів із руд, а алмаз - як. Визнання вуглецю як хімічний елемент пов'язане з ім'ям французького хіміка А. Лавуазьє (1789).
Модифікації та властивості вуглецю
Відомі 4 кристалічні модифікації вуглецю: графіт, алмаз, карбін і лонсдейліт, що сильно відрізняються за своїми властивостями. Карбін - штучно отриманий різновид вуглецю, що є дрібнокристалічний порошок чорного кольору, кристалічна структура якого характеризується наявністю довгих ланцюжків атомів вуглецю, розташованих паралельно один одному. Щільність 3230-3300 кг/м 3 теплоємність 11,52 Дж/моль.К. Лонсдейліт виявлений у метеоритах та отриманий штучно; його структура та фізичні властивості остаточно не встановлені. Для вуглецю характерний також стан із невпорядкованою структурою — т.зв. аморфний вуглець (сажа, кокс, деревне вугілля). Фізичні властивості "аморфного" вуглецю сильно залежить від дисперсності частинок і від наявності домішок.
Хімічні властивості вуглецю
У сполуках вуглець має ступеня окиснення +4 (найпоширеніша), +2 і +3. За звичайних умов вуглець хімічно інертний, за високих температур сполучається з багатьма елементами, виявляючи сильні відновлювальні властивості. Хімічна активність вуглецю зменшується у ряду "аморфний" вуглець, графіт, алмаз; взаємодія з киснем повітря у цих різновидів вуглецю відбувається відповідно при температурах 300-500°С, 600-700°З 850-1000°З утворенням діоксиду (CO 2) і монооксиду (CO) вуглецю. Діоксид розчиняється у воді з утворенням вугільної кислоти. Всі форми вуглецю стійкі до лугів і кислот. З галогенами вуглець практично не взаємодіє (крім графіту, який F 2 вище 900°С реагує), тому його галогеніди отримують непрямим шляхом. Серед азотовмісних сполук важливе практичне значення мають ціаністий водень HCN (синільна кислота) та його численні похідні. При температурах вище 1000 ° С вуглець взаємодіє з багатьма металами, утворюючи карбіди. Усі форми вуглецю нерозчинні у звичайних неорганічних та органічних розчинниках.
Найважливіша властивість вуглецю - здатність його атомів утворювати міцні хімічні зв'язки між собою, а також між собою та іншими елементами. Здатність вуглецю утворювати 4 рівнозначні валентні зв'язки з іншими атомами вуглецю дозволяє будувати вуглецеві скелети різних типів (лінійні, розгалужені, циклічні); саме цими властивостями пояснюється виняткова роль вуглецю в будові всіх органічних сполук і, зокрема, всіх живих організмів.
Вуглець у природі
Середній вміст вуглецю у земній корі 2,3.10 % (за масою); при цьому основна маса вуглецю концентрується в осадових гірських породах (1%), тоді як в інших гірських породах істотно нижчі і приблизно однакові (1-3.10%) концентрації цього елемента. Вуглець накопичується у верхній частині, де його присутність пов'язана в основному з живою речовиною (18%), деревиною (50%), кам'яним вугіллям (80%), нафтою (85%), антрацитом (96%), а також з доломітами та вапняками. Відомо понад 100 мінералів вуглецю, з яких найбільш поширені карбонати кальцію, магнію та заліза (кальцит CaCO 3 , доломіт (Ca, Mg)CO 3 і сидерит FeCO 3). З накопиченням вуглецю в земній корі часто пов'язане і накопичення інших елементів, що сорбуються органічною речовиною і водойм, що осаджуються після його поховання на дні, у вигляді нерозчинних сполук. Великі кількості діоксиду CO 2 виділяються в атмосферу із Землі при вулканічній діяльності та при спалюванні органічних палив. З атмосфери CO 2 засвоюється рослинами в процесі фотосинтезу і розчиняється в морській воді, складаючи цим найважливіші ланки загального кругообігу вуглецю Землі. Важливу роль відіграє вуглець у космосі; на Сонці вуглець займає 4-е місце за поширеністю після водню, гелію та кисню, беручи участь у ядерних процесах.
Застосування та використання
Найважливіше народно-господарське значення вуглецю залежить від того, що близько 90% всіх первинних джерел енергії, споживаної людиною, посідає органічне паливо. Спостерігається тенденція використовувати нафту і як паливо, бо як сировину для різноманітних хімічних виробництв. Найменшу, але дуже істотну роль народному господарстві грає вуглець, видобутий як карбонатів (металургія, будівництво, хімічні виробництва), алмазів (ювелірні прикраси, техніка) і графіту (ядерна техніка, жароміцні тигли, олівці, деякі види мастил і і т.д.). За питомою активністю ізотопу 14 С у залишках біогенного походження визначають їх вік (радіовуглецевий метод датування). 14 С широко використовується як радіоактивний індикатор. Важливе значення має найпоширеніший ізотоп 12 С - одна дванадцята частина маси атома цього ізотопу прийнята за одиницю атомної маси хімічних елементів.
Вугілля
З (Carboneum), Неметалічний хімічний елемент IVA підгрупи (C, Si, Ge, Sn, Pb) періодичної системи елементів. Зустрічається в природі у вигляді кристалів алмазу (рис. 1), графіту або фулерену та інших форм і входить до складу органічних (вугілля, нафта, організми тварин і рослин та ін.) та неорганічних речовин (вапняк, харчова сода та ін.). Вуглець широко поширений, але вміст його в земній корі всього 0,19% (див. також АЛМАЗ; ФУЛЕРЕНИ).
Вуглець широко використовується у вигляді простих речовин. Окрім дорогоцінних алмазів, що є предметом ювелірних прикрас, велике значення мають промислові алмази – для виготовлення шліфувального та ріжучого інструменту. Деревне вугілля та інші аморфні форми вуглецю застосовуються для знебарвлення, очищення, адсорбції газів в областях техніки, де потрібні адсорбенти з розвиненою поверхнею. Карбіди, сполуки вуглецю з металами, а також з бором та кремнієм (наприклад, Al4C3, SiC, B4C) відрізняються високою твердістю та використовуються для виготовлення абразивного та ріжучого інструменту. Вуглець входить до складу сталей та сплавів в елементному стані та у вигляді карбідів. Насичення поверхні сталевих виливків вуглецем за високої температури (цементація) значно збільшує поверхневу твердість і зносостійкість.
також СПЛАВИ. У природі є безліч різних форм графіту; деякі отримані штучно; є аморфні форми (наприклад, кокс та деревне вугілля). Сажа, кістяне вугілля, лампова сажа, ацетиленова сажа утворюються при спалюванні вуглеводнів при нестачі кисню. Так званий білий вуглець виходить сублімацією піролітичного графіту при зниженому тиску - це дрібні прозорі кристали графітових листочків із загостреними кромками.
Історична довідка.Графіт, алмаз і аморфний вуглець відомі з давніх-давен. Здавна відомо, що графітом можна маркувати інший матеріал, і сама назва "графіт", що походить від грецького слова, що означає "писати", запропоновано А.Вернером у 1789 році. Проте історія графіту заплутана, часто за нього приймали речовини, що володіють подібними зовнішніми фізичними властивостями , наприклад молібденіт (сульфід молібдену), який один час вважався графітом. Серед інших назв графіту відомі "чорний свинець", "карбідне залізо", "сріблястий свинець". У 1779 К.Шееле встановив, що графіт можна окислити повітрям із заснуванням вуглекислого газу. Вперше алмази знайшли застосування в Індії, а в Бразилії дорогоцінні камені набули комерційного значення в 1725; родовища у Південній Африці було відкрито 1867. У 20 в. Основними виробниками алмазів є ПАР, Заїр, Ботсвана, Намібія, Ангола, Сьєрра-Леоне, Танзанія та Росія. Штучні алмази, технологія яких була створена в 1970 році, виробляються для промислових цілей.
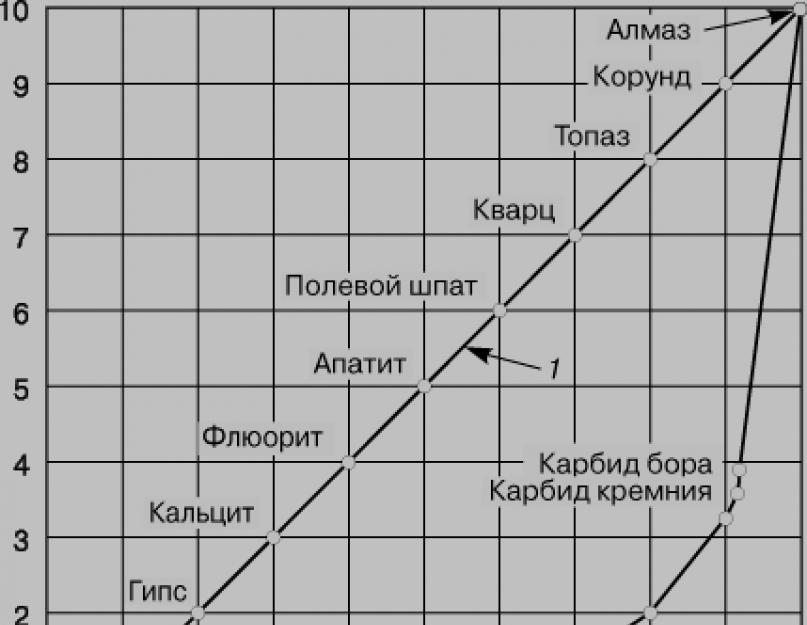
Алотропія.Якщо структурні одиниці речовини (атоми для одноатомних елементів або молекули для поліатомних елементів та сполук) здатні з'єднуватися один з одним у більш ніж одній кристалічній формі, це явище називається алотропією. У вуглецю три алотропічні модифікації - алмаз, графіт та фулерен. В алмазі кожен атом вуглецю має 4 тетраедрично розташовані сусіди, утворюючи кубічну структуру (рис. 1,а). Така структура відповідає максимальній ковалентності зв'язку, і всі 4 електрони кожного атома вуглецю утворюють високоміцні зв'язки С-С, тобто. у структурі відсутні електрони провідності. Тому алмаз відрізняється відсутністю провідності, низькою теплопровідністю, високою твердістю; він найтвердіший із відомих речовин (рис. 2). На розрив зв'язку С-С (довжина зв'язку 1,54, звідси ковалентний радіус 1,54/2 = 0,77) в тетраедричній структурі потрібні великі витрати енергії, тому алмаз, поряд з винятковою твердістю, характеризується високою температурою плавлення (3550 ° C ).

Іншою аллотропічною формою вуглецю є графіт, що сильно відрізняється від алмазу за властивостями. Графіт - м'яка чорна речовина з кристалів, що легко шаруються, відрізняється гарною електропровідністю (електричний опір 0,0014 Ом*см). Тому графіт застосовується у дугових лампах та печах (рис. 3), у яких необхідно створювати високі температури. Графіт високої чистоти застосовують у ядерних реакторах як сповільнювач нейтронів. Температура його плавлення при підвищеному тиску дорівнює 3527° C. При звичайному тиску графіт сублімується (переходить з твердого стану в газ) при 3780° C.

Структура графіту (рис. 1,б) є системою конденсованих гексагональних кілець з довжиною зв'язку 1,42 (значно коротше, ніж в алмазі), але при цьому кожен атом вуглецю має три (а не чотири, як в алмазі) ковалентні зв'язки трьома сусідами, а четвертий зв'язок (3,4) занадто довгий для ковалентного зв'язку і слабко пов'язує паралельно покладені шари графіту між собою. Саме четвертий електрон вуглецю визначає тепло- та електропровідність графіту - цей більш довгий і менш міцний зв'язок формує меншу компактність графіту, що відображається в меншій твердості його в порівнянні з алмазом (щільність графіту 2,26 г/см3, алмазу - 3,51 г/ см3). З тієї ж причини графіт слизький на дотик і легко відокремлює лусочки речовини, що використовується для виготовлення мастила та олівців грифелів. Свинцевий блиск грифеля пояснюється переважно наявністю графіту. Волокна вуглецю мають високу міцність і можуть використовуватись для виготовлення штучного шовку або іншої пряжі з високим вмістом вуглецю. При високих тиску та температурі в присутності каталізатора, наприклад, заліза, графіт може перетворюватися на алмаз. Цей процес реалізований для промислового одержання штучних алмазів. Кристали алмазу ростуть на поверхні каталізатора. Рівнавага графіт алмаз існує при 15 000 атм і 300 K або за 4000 атм і 1500 K. Штучні алмази можна отримувати і з вуглеводнів. До аморфних форм вуглецю, що не утворюють кристалів, відносять деревне вугілля, що отримується нагріванням дерева без доступу повітря, лампову і газову сажу, що утворюється при низькотемпературному спалюванні вуглеводнів при нестачі повітря і конденсується на холодній поверхні, кісткове вугілля - домішка до фосфату кальцію в процесі тканини, і навіть кам'яне вугілля (природна речовина з домішками) і кокс, сухий залишок, одержуваний при коксуванні палив методом сухої перегонки кам'яного вугілля чи нафтових залишків (бітумінозного вугілля), тобто. нагрівання без доступу повітря. Кокс застосовується для виплавки чавуну, в чорній та кольоровій металургії. При коксуванні утворюються також газоподібні продукти - коксовий газ (H2, CH4, CO та ін.) та хімічні продукти, які є сировиною для отримання бензину, фарб, добрив, лікарських препаратів, пластмас і т.д. Схема основного апарату виробництва коксу - коксової печі - наведено на рис. 3. Різні види вугілля та сажі відрізняються розвиненою поверхнею і тому використовуються як адсорбенти для очищення газу, рідин, а також як каталізатори. Для здобуття різних форм вуглецю застосовують спеціальні методи хімічної технології. Штучний графіт отримують прожарюванням антрациту або нафтового коксу між вуглецевими електродами при 2260° С (процес Ачесона) і використовують у виробництві мастил і електродів, зокрема для електролітичного отримання металів.
Будова атома вуглецю.Ядро найбільш стабільного ізотопу вуглецю масою 12 (поширеність 98,9%) має 6 протонів і 6 нейтронів (12 нуклонів), розташованих трьома квартетами, кожен містить 2 протона і два нейтрони аналогічно ядру гелію. Інший стабільний ізотоп вуглецю - 13C (бл. 1,1%), а в слідових кількостях існує в природі нестабільний ізотоп 14C з періодом напіврозпаду 5730 років, що має b-випромінювання. У нормальному вуглецевому циклі живої матерії беруть участь усі три ізотопи у вигляді СО2. Після смерті живого організму витрата вуглецю припиняється і можна датувати С-об'єкти, що містять, вимірюючи рівень радіоактивності 14С. Зниження b-випромінювання 14CO2 пропорційно часу, що минув з смерті. У 1960 У.Ліббі за дослідження з радіоактивним вуглецем був удостоєний Нобелівської премії.
також ДАТУВАННЯ ЗА РАДІОАКТИВНОСТІ. В основному стані 6 електронів вуглецю утворюють електронну конфігурацію 1s22s22px12py12pz0. Чотири електрони другого рівня є валентними, що відповідає положенню вуглецю в IVA групі періодичної системи (див. ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ). Оскільки для відриву електрона від атома в газовій фазі потрібна велика енергія (близько 1070 кДж/моль), вуглець не утворює іонні зв'язки з іншими елементами, так як для цього був би необхідний відрив електрона з утворенням позитивного іона. Маючи електронегативність, що дорівнює 2,5, вуглець не виявляє і сильної спорідненості до електрона, відповідно не будучи активним акцептором електронів. Тому не схильний до утворення частки з негативним зарядом. Але з частково іонним характером зв'язку деякі сполуки вуглецю існують, наприклад, карбіди. У сполуках вуглець виявляє ступінь окислення 4. Щоб чотири електрони змогли брати участь у освіті зв'язків, необхідно розпарювання 2s-електронів та перескок одного з цих електронів на 2pz-орбіталь; при цьому утворюються 4 тетраедричні зв'язки з кутом між ними 109°. У сполуках валентні електрони вуглецю лише частково відтягнуті від цього, тому вуглець утворює міцні ковалентні зв'язки між сусідніми атомами типу З-З допомогою загальної електронної пари. Енергія розриву такого зв'язку дорівнює 335 кДж/моль, тоді як для зв'язку Si-Si вона становить всього 210 кДж/моль, тому довгі ланцюжки Si-Si-нестійкі. Ковалентний характер зв'язку зберігається навіть у з'єднаннях високореакційних галогенів з вуглецем, CF4 і CCl4. Вуглецеві атоми здатні надавати на утворення зв'язку більше одного електрона кожного атома вуглецю; так утворюються подвійна С=С та потрійна СєС зв'язку. Інші елементи також утворюють зв'язок між своїми атомами, але тільки вуглець здатний утворювати довгі ланцюги. Тому для вуглецю відомі тисячі сполук, званих вуглеводнями, в яких вуглець пов'язаний з воднем та іншими атомами вуглецю, утворюючи довгі ланцюги або кільцеві структури.
ХІМІЯ ОРГАНІЧНА. У цих сполуках можливе заміщення водню на інші атоми, найчастіше на кисень, азот та галогени з утворенням безлічі органічних сполук. Важливе значення серед них займають фторвуглеводні – вуглеводні, у яких водень заміщений на фтор. Такі сполуки надзвичайно інертні, і їх використовують як пластичні та мастильні матеріали (фторвуглеці, тобто вуглеводні, в яких всі атоми водню заміщені на атоми фтору) і як низькотемпературні холодоагенти (хладони, або фреони, - фторхлорвуглеводні). У 1980-х роках фізиками США було виявлено дуже цікаві сполуки вуглецю, в яких атоми вуглецю з'єднані в 5- або 6-кутники, що утворюють молекулу С60 формою порожньої кулі, що має досконалу симетрію футбольного м'яча. Оскільки така конструкція лежить в основі "геодезичного купола", винайденого американським архітектором та інженером Бакмінстером Фуллером, новий клас сполук був названий "бакмінстерфулеренами" або "фулеренами" (а також коротше - "фазиболами" або "бакіболами"). Фулерени - третя модифікація чистого вуглецю (крім алмазу та графіту), що складається з 60 або 70 (і навіть більше) атомів, - була отримана дією лазерного випромінювання на дрібні частинки вуглецю. Фулерени складнішої форми складаються з кількох сотень атомів вуглецю. Діаметр молекули С60 ВУГЛЕРОД 1нм. У центрі такої молекули достатньо простору приміщення великого атома урану.
також ФУЛЕРЕНИ.
Стандартна атомна маса.У 1961 Міжнародні спілки теоретичної і прикладної хімії (ІЮПАК) і з фізики прийняли за одиницю атомної маси масу ізотопу вуглецю 12C, скасувавши кисневу шкалу атомних мас, що існувала до того. Атомна маса вуглецю в цій системі дорівнює 12,011, так як вона є середньою для трьох природних ізотопів вуглецю з урахуванням їхньої поширеності в природі.
АТОМНА МАСА . Хімічні властивості вуглецю та деяких його сполук. Деякі фізичні та хімічні властивості вуглецю наведені у статті ХІМІЧНІ ЕЛЕМЕНТИ. Реакційна здатність вуглецю залежить від його модифікації, температури та дисперсності. При низьких температурах всі форми вуглецю досить інертні, але при нагріванні окислюються киснем повітря, утворюючи оксиди:

Дрібнодисперсний вуглець у надлишку кисню здатний вибухати при нагріванні або від іскри. Крім прямого окислення існують сучасніші методи одержання оксидів. Субоксид вуглецю C3O2 утворюється при дегідратації малонової кислоти над P4O10:
C3O2 має неприємний запах, що легко гідролізується, знову утворюючи малонову кислоту.
Монооксид вуглецю(II) СО утворюється при окисленні будь-якої модифікації вуглецю в умовах нестачі кисню. Реакція екзотермічна, виділяється 111,6 кДж/моль. Кокс при температурі білого жару реагує з водою: C + H2O = CO + H2; газова суміш, що утворюється, називається "водяний газ" і є газоподібним паливом. СO утворюється також при неповному згорянні нафтопродуктів, у помітних кількостях міститься в автомобільних вихлопах, виходить при термічній дисоціації мурашиної кислоти:
Ступінь окислення вуглецю в СО дорівнює +2, а оскільки вуглець більш стійкий до ступеня окислення +4, то СО легко окислюється киснем до CO2: CO + O2 (r) CO2, ця реакція сильно екзотермічна (283 кДж/моль). СО застосовують у промисловості суміші з H2 та іншими горючими газами як паливо або газоподібного відновника. При нагріванні до 500° C CO у помітній мірі утворює і CO2, але при 1000° C рівновагу встановлюється при малих концентраціях СO2. CO реагує з хлором, утворюючи фосген - COCl2, аналогічно протікають реакції з іншими галогенами, реакції з сіркою виходить сульфід карбонілу COS, з металами (M) СO утворює карбоніли різного складу M(CO)x, що є комплексними сполуками. Карбоніл заліза утворюється при взаємодії гемоглобіну крові з CO, перешкоджаючи реакції гемоглобіну з киснем, тому що карбоніл заліза - міцніша сполука. Внаслідок цього блокується функція гемоглобіну як переносника кисню до клітин, які при цьому гинуть (і в першу чергу уражаються клітини мозку). (Звідси ще одна назва СО – "чадний газ"). Вже 1% (об.) З у повітрі небезпечний для людини, якщо він знаходиться в такій атмосфері більше 10 хв. Деякі фізичні властивості СО наведені у таблиці. Діоксид вуглецю, або оксид вуглецю(IV) CO2 утворюється при згорянні елементного вуглецю надлишку кисню з виділенням тепла (395 кДж/моль). CO2 (тривіальна назва - "вуглекислий газ") утворюється також при повному окисненні СО, нафтопродуктів, бензину, олій та ін органічних сполук. При розчиненні карбонатів у воді в результаті гідролізу також виділяється СО2:
Таку реакцію часто використовують у лабораторній практиці для одержання CO2. Цей газ можна отримати і при прожарюванні бікарбонатів металів:
При газофазній взаємодії перегрітої пари з СО:
При спалюванні вуглеводнів та їх кисневиробних, наприклад:

Аналогічно окислюються харчові продукти у живому організмі з виділенням теплової та інших видів енергії. При цьому окислення протікає в м'яких умовах через проміжні стадії, але кінцеві продукти ті ж - СO2 і H2O, як, наприклад, під час розкладання цукрів під дією ферментів, зокрема при ферментації глюкози:
Багатотоннажне виробництво вуглекислого газу та оксидів металів здійснюється в промисловості термічним розкладанням карбонатів:

CaO у великих кількостях використовується у технології виробництва цементу. Термічна стабільність карбонатів та витрати теплоти на їх розкладання за цією схемою зростають у ряді CaCO3 (див. також ПОЖЕЖНА ПРОФІЛАКТИКА І ПРОТИПОЖЕЖНИЙ ЗАХИСТ). Електронна будова оксидів вуглецю. Електронну будову будь-якого оксиду вуглецю можна описати трьома рівноймовірними схемами з різним розташуванням електронних пар - трьома резонансними формами:

Усі оксиди вуглецю мають лінійну будову.
Вугільна кислота.При взаємодії С2 з водою утворюється вугільна кислота H2CO3. У насиченому розчині CO2 (0,034 моль/л) лише частина молекул утворює H2CO3, а більшість CO2 перебуває у гідратованому стані CO2*H2O.
Карбонати.Карбонати утворюються при взаємодії оксидів металів з CO2, наприклад, Na2O + CO2 -> NaHCO3 які при нагріванні розкладаються з виділенням СО2: 2NaHCO3 -> Na2CO3 + H2O + CO2 Карбонат натрію, або соду, виробляють у содовій промисловості у великих кількостях переважно методом Сольве:

Іншим методом соду отримують з CO2 та NaOH

Карбонат-іон CO32 має плоску будову з кутом O-C-O, рівним 120°, і довжиною СО-зв'язку 1,31
(Див. також ЛУЖІВ ВИРОБНИЦТВО).
Галогеніди вуглецю.Вуглець безпосередньо реагує з галогенами при нагріванні, утворюючи тетрагалогеніди, але швидкість реакції та вихід продукту невеликі. Тому галогеніди вуглецю отримують іншими методами, наприклад, хлоруванням дисульфіду вуглецю отримують CCl4: CS2 + 2Cl2 -> CCl4 + 2S Тетрахлорид CCl4 - негорюча речовина, використовується як розчинник у процесах сухого чищення, але не рекомендується застосовувати його як полум'ягасник, так як температурі відбувається утворення отруйного фосгену (газоподібна отруйна речовина). Сам ССl4 також отруйний і при вдиханні у помітних кількостях може спричинити отруєння печінки. СCl4 утворюється і фотохімічної реакції між метаном СH4 і Сl2; при цьому можливе утворення продуктів неповного хлорування метану - CHCl3, CH2Cl2 та CH3Cl. Аналогічно протікають реакції з іншими галогенами.
Реакція графіту.Графіт як модифікація вуглецю, що відрізняється великими відстанями між шарами гексагональних кілець, вступає в незвичайні реакції, наприклад, лужні метали, галогени та деякі солі (FeCl3) проникають між шарами, утворюючи сполуки типу KC8, KC16 (звані сполуками впровадження, включення або кла. Сильні окислювачі типу KClO3 в кислому середовищі (сірчаної або азотної кислоти) утворюють речовини з великим об'ємом кристалічних ґрат (до 6 між шарами), що пояснюється впровадженням кисневих атомів та утворенням сполук, на поверхні яких в результаті окислення утворюються карбоксильні групи (-СООН) - сполуки типу оксидованого графіту або мелітової (бензолгексакарбонової) кислоти С6(COOH)6. У цих сполуках відношення З:O може змінюватися від 6:1 до 6:2,5.
Карбіди.Вуглець утворює з металами, бором і кремнієм різноманітні сполуки, які називаються карбідами. Найбільш активні метали (IA-IIIA підгруп) утворюють солеподібні карбіди, наприклад, Na2C2, CaC2, Mg4C3, Al4C3. У промисловості карбід кальцію отримують з коксу та вапняку за наступними реакціями:

Карбіди неелектропровідні, майже безбарвні, гідролізуються з утворенням вуглеводнів, наприклад CaC2 + 2H2O = C2H2 + Ca(OH)2 Ацетилен C2H2, що утворюється по реакції, служить вихідною сировиною у виробництві багатьох органічних речовин. Цей процес цікавий, оскільки представляє перехід від сировини неорганічної природи до синтезу органічних сполук. Карбіди, що утворюють при гідроліз ацетилен, називаються ацетиленідами. У карбідах кремнію та бору (SiC та B4C) зв'язок між атомами ковалентний. Перехідні метали (елементи B-підгруп) при нагріванні з вуглецем теж утворюють карбіди змінного складу в тріщинах поверхні металу; зв'язок у них близький до металевої. Деякі карбіди такого типу, наприклад WC, W2C, TiC і SiC, відрізняються високою твердістю і тугоплавкістю, мають хорошу електропровідність. Наприклад, NbC, TaC і HfC - найбільш тугоплавкі речовини (т.пл. = 4000-4200 ° С), карбід дініобію Nb2C - надпровідник при 9,18 К, TiC і W2C за твердістю близькі алмазу, а твердість B4C (структурного аналога алмазу ) становить 9,5 за шкалою Моосу (див. рис. 2). Інертні карбіди утворюються, якщо радіус перехідного металу Азотпохідні вуглецю.До цієї групи відноситься сечовина NH2CONH2 – азотне добриво, що застосовується у вигляді розчину. Сечовину отримують з NH3 та CO2 при нагріванні під тиском:
Диціан (CN)2 за багатьма властивостями подібний до галогенів і його часто називають псевдогалоген. Диціан одержують м'яким окисленням ціанід-іону киснем, пероксидом водню або іоном Cu2+: 2CN- -> (CN)2 + 2e. Ціанід-іон, будучи донором електронів, легко утворює комплексні з'єднання з іонами перехідних металів. Подібно до СО, ціанід-іон є отрутою, пов'язуючи життєво важливі сполуки заліза в живому організмі. Ціанідні комплексні іони мають загальну формулу []-0,5x, де х - координаційне число металу (комплексоутворювача), що емпірично дорівнює подвоєному значенню ступеня окислення іона металу. Прикладами таких комплексних іонів є (будова деяких іонів наведено нижче) тетраціанонікелат(II)-іон []2-, гексаціаноферрат(III) []3-, диціаноаргентат []-:

Карбоніли.Монооксид вуглецю здатний безпосередньо реагувати з багатьма металами або іонами металів, утворюючи комплексні сполуки, які називаються карбонілами, наприклад Ni(CO)4, Fe(CO)5, Fe2(CO)9, []3, Mo(CO)6, [] 2. Зв'язок у цих сполуках аналогічний зв'язку в описаних вище ціанокомплекс. Ni(CO)4 - летюча речовина, що використовується для відокремлення нікелю від інших металів. Погіршення структури чавуну та сталі в конструкціях часто пов'язане з утворенням карбонілів. Водень може входити до складу карбонілів, утворюючи карбонілгідриди, такі, як H2Fe(CO)4 і HCo(CO)4, що виявляють кислотні властивості та реагують з лугом: H2Fe(CO)4 + NaOH -> NaHFe(CO)4 + H2O Відомі також карбонілгалогеніди, наприклад Fe(CO)X2, Fe(CO)2X2, Co(CO)I2, Pt(CO)Cl2, де Х - будь-який галоген
(див. також МЕТАЛООРГАНІЧНІ СПОЛУКИ).
Вуглеводні.Відомо безліч сполук вуглецю з воднем
(див. ХІМІЯ ОРГАНІЧНА).
ЛІТЕРАТУРА
Сюняєв З.І. Нафтовий вуглець. М., 1980 Хімія гіперкоординованого вуглецю. М., 1990
Енциклопедія Кольєра. - Відкрите суспільство. 2000 .
Синоніми:Дивитися що таке "ВУГЛЕРОД" в інших словниках:
Таблиця нуклідів Загальні відомості Назва, символ Вуглець 14, 14C Альтернативні назви радіовуглець, радіокарбон Нейтронів 8 Протонів 6 Властивості нукліду Атомна маса … Вікіпедія
Таблиця нуклідів Загальні відомості Назва, символ Вуглець 12, 12C Нейтронів 6 Протонів 6 Властивості нукліду Атомна маса 12,0000000(0) … Вікіпедія
Вуглець - це, мабуть, основний і найдивовижніший хімічний елемент на Землі, адже за його допомогою формується колосальна кількість різноманітних сполук, як неорганічних, так і органічних. Вуглець є основою всіх живих істот, можна сказати, що вуглець, нарівні з водою та киснем, є основою життя на нашій планеті! Вуглець має різноманітність форм, які не схожі ні за своїми фізико-хімічними властивостями, ні на вигляд. Але все це вуглець!
Історія відкриття вуглецю
Вуглець був відомий людству ще з давніх-давен. Графіт та вугілля використовувалися ще давніми греками, а алмази знайшли застосування в Індії. Щоправда, за графіт часто приймали схожі на вигляд сполуки. Проте, графіт мав широке застосування у давнину, зокрема листи. Навіть його назва походить від грецького слова "графо" - "пишу". Графіт зараз використовується у олівцях. Діамантами почали вперше торгувати в Бразилії в першій половині 18 століття, з цього часу відкрито безліч родовищ, а в 1970 році була розроблена технологія отримання алмазів штучним шляхом. Такі штучні алмази застосовують у промисловості, натуральні ж, своєю чергою, в ювелірному справі.
Вуглець у природі
Найбільш значну кількість вуглецю зібрано в атмосфері та гідросфері у вигляді вуглекислого газу. В атмосфері вуглецю міститься близько 0,046%, а ще більше – у розчиненому вигляді у Світовому Океані.
Крім того, як ми бачили вище, вуглець є основою живих організмів. Наприклад, у тілі людини масою 70 кг міститься близько 13 кг вуглецю! Це лише в одній людині! А вуглець міститься також у всіх рослинах та тваринах. Ось і рахуйте…
Кругообіг вуглецю в природі
Алотропні модифікації вуглецю
Вуглець - унікальний хімічний елемент, який утворює так звані алотропні модифікації, або, простіше кажучи, різні форми. Ці модифікації поділяються кристалічні, аморфні та у вигляді кластерів.
Кристалічні модифікації мають правильні кристалічні грати. До цієї групи належать: алмаз, фулерит, графіт, лонсдейліт, вуглецеві волокна та трубки. Переважна більшість кристалічних модифікацій вуглецю на перших місцях у рейтингу «Найтвердіші матеріали у світі».
 Алотропні форми вуглецю: a) лонсдейліт; б) діамант;
Алотропні форми вуглецю: a) лонсдейліт; б) діамант; в) графіт; г) аморфний вуглець; д) C60 (фулерен); е) графен;
ж) одношарова нанотрубка
Аморфні форми утворені вуглецем із невеликими домішками інших хімічних елементів. Основні представники цієї групи: вугілля (кам'яне, деревне, активоване), сажа, антрацит.
Найскладнішими та високотехнологічними є сполуки вуглецю у вигляді кластерів. Кластери — це особлива структура, коли атоми вуглецю розташовані в такий спосіб, що утворюють порожню форму, яка заповнена зсередини атомами інших елементів, наприклад, води. У цій групі не так вже й багато представників, до неї входять вуглецеві наноконуси, астралени та дівуглець.
 Графіт - "темна сторона" алмазу
Графіт - "темна сторона" алмазу Застосування вуглецю
Вуглець та його сполуки мають велике значення у життєдіяльності людини. З вуглецю утворені основні види палива на Землі - природний газ та нафта. З'єднання вуглецю широко застосовуються в хімічній та металургійній промисловості, у будівництві, у машинобудуванні та медицині. Алотропні модифікації у вигляді алмазів використовують у ювелірній справі, фулерит та лонсдейліт у ракетобудуванні. Зі сполук вуглецю виготовляються різні мастила для механізмів, технічне обладнання та багато іншого. Промисловість зараз не може обійтися без вуглецю, він використовується скрізь!
МОУ «Нікіфорівська середня загальноосвітня школа №1»
Вуглець та його основні неорганічні сполуки
Реферат
Виконав: учень 9В класу
Сидоров Олександр
Вчитель: Сахарова Л.М.
Дмитрівка 2009
Вступ
Глава I. Все про вуглець
1.1. Вуглець у природі
1.2. Алотропні модифікації вуглецю
1.3. Хімічні властивості вуглецю
1.4. Застосування вуглецю
Розділ II. Неорганічні сполуки вуглецю
Висновок
Література
Вступ
Вуглець (лат. Carboneum) С – хімічний елемент IV групи періодичної системи Менделєєва: атомний номер 6, атомна маса 12,011 (1). Розглянемо будову атома вуглецю. На зовнішньому енергетичному рівні атома вуглецю знаходяться чотири електрони. Зобразимо графічно:
Вуглець був відомий з давніх-давен, і ім'я першовідкривача цього елемента невідоме.
Наприкінці XVII ст. флорентійські вчені Аверані та Тарджоні намагалися сплавити кілька дрібних алмазів в один великий і нагріли їх за допомогою запалювального скла сонячним промінням. Алмази зникли, згорівши на повітрі. У 1772 р. французький хімік А. Лавуазьє показав, що при згорянні алмазу утворюється СО2. Лише у 1797 р. англійський вчений С. Теннант довів ідентичність природи графіту та вугілля. Після згоряння рівних кількостей вугілля та алмазу обсяги оксиду вуглецю (IV) виявилися однаковими.
Різноманітність сполук вуглецю, що пояснюється здатністю його атомів з'єднуватися один з одним і атомами інших елементів у різний спосіб, зумовлює особливе положення вуглецю серед інших елементів.
ГлаваI. Все про вуглецю
1.1. Вуглець у природі
Вуглець знаходиться в природі як у вільному стані, так і у вигляді сполук.
Вільний вуглець зустрічається у вигляді алмазу, графіту та карбину.
Алмази дуже рідкісні. Найбільший з відомих алмазів – «Куллінан» був знайдений у 1905 р. у Південній Африці, важив 621,2 г і мав розміри 10×6,5×5 см. В Алмазному фонді в Москві зберігається один із найбільших та найкрасивіших алмазів у світі - "Орлов" (37,92 г).
Свою назву алмаз отримав від грецьк. "Адамас" - непереможний, незламний. Найзначніші родовища алмазів перебувають у Південній Африці, Бразилії, Якутії.
Великі поклади графіту перебувають у ФРН, Шрі-Ланці, Сибіру, Алтаї.
Головними вуглецевими мінералами є: магнезит МgСО 3 , кальцит (вапняний шпат, вапняк, мармур, крейда) СаСО 3 , доломіт СаМg(СО 3) 2 та ін.
Усі горючі копалини – нафта, газ, торф, кам'яні та бурі вугілля, сланці – побудовані на вуглецевій основі. Близькі за складом до вуглецю деякі викопні вугілля, що містять до 99%.
Перед вуглецю припадає 0,1% земної кори.
У вигляді оксиду вуглецю (IV) 2 вуглець входить до складу атмосфери. У гідросфері розчинено велику кількість СО 2 .
1.2. Алотропні модифікації вуглецю
Елементарний вуглець утворює три алотропні модифікації: алмаз, графіт, карбін.
1. Алмаз – безбарвна, прозора кристалічна речовина, що надзвичайно сильно заломлює промені світла. Атоми вуглецю в алмазі перебувають у стані sр 3 -гібридизації. У збудженому стані відбувається розпарювання валентних електронів в атомах вуглецю та утворення чотирьох неспарених електронів. При утворенні хімічних зв'язків електронні хмари набувають однакової витягнутої форми і розташовуються в просторі так, що їх осі виявляються спрямованими до вершин тетраедра. При перекриванні вершин цих хмар з хмарами інших атомів вуглецю виникають ковалентні зв'язки під кутом 109°28", і утворюється атомна кристалічна решітка, характерна для алмазу.
Кожен атом вуглецю в алмазі оточений чотирма іншими, розташованими від нього у напрямках від центру тетраедрів до вершин. Відстань між атомами в тетраедрах дорівнює 0,154 нм. Міцність всіх зв'язків однакова. Таким чином, атоми в алмазі "упаковані" дуже щільно. При 20°З щільність алмазу становить 3,515 г/см 3 . Цим пояснюється його виняткова твердість. Діамант погано проводить електричний струм.
У 1961 р. у Радянському Союзі було розпочато промислове виробництво синтетичних алмазів із графіту.
При промисловому синтезі алмазів використовуються тиску тисячі МПа і температури від 1500 до 3000°С. Процес ведуть у присутності каталізаторів, якими можуть бути деякі метали, наприклад Ni. Основна маса алмазів, що утворюються, - невеликі кристали і алмазний пил.
Діамант при нагріванні без доступу повітря вище 1000°С перетворюється на графіт. При 1750 ° С перетворення алмазу на графіт відбувається швидко.
Структура алмазу
2. Графіт - сіро-чорна кристалічна речовина з металевим блиском, жирна на дотик, по твердості поступається навіть папері.
Атоми вуглецю в кристалах графіту перебувають у стані sр 2 -гібридизації: кожен з них утворює три ковалентні зв'язки з сусідніми атомами. Кути між напрямками зв'язків дорівнюють 120°. В результаті утворюється сітка, що складається з правильних шестикутників. Відстань між сусідніми ядрами атомів вуглецю усередині шару становить 0,142 нм. Четвертий електрон зовнішнього шару кожного атома вуглецю в графіті займає р-орбіталь, що не бере участь у гібридизації.
Негібридні електронні хмари атомів вуглецю орієнтовані перпендикулярно до площини шару, і перекриваючись один з одним, утворюють справакалізовані σ-зв'язки. Сусідні шари в кристалі графіту знаходяться один від одного на відстані 0,335 нм і слабко пов'язані між собою, переважно силами Ван-дер-Ваальса. Тому графіт має низьку механічну міцність і легко розщеплюється на лусочки, які власними силами дуже міцні. Зв'язок між шарами атомів вуглецю у графіті частково має металевий характер. Цим пояснюється той факт, що графіт добре проводить електричний струм, але все ж не так добре, як метали.
Структура графіту
Фізичні властивості у графіті сильно різняться за напрямками – перпендикулярним і паралельним шарам атомів вуглецю.
При нагріванні без доступу повітря графіт не зазнає жодних змін до 3700°С. За вказаної температури він виганяється, не плавлячись.
Штучний графіт одержують із кращих сортів кам'яного вугілля при 3000°С в електричних печах без доступу повітря.
Графіт термодинамічно стійкий у широкому інтервалі температур і тисків, тому він приймається як стандартний стан вуглецю. Щільність графіту становить 2265 г/см 3 .
3. Карбін - дрібнокристалічний порошок чорного кольору. У його кристалічній структурі атоми вуглецю з'єднані одинарними і потрійними зв'язками, що чергуються, в лінійні ланцюжки.
−С≡С−С≡С−С≡С−
Цю речовину вперше отримано В.В. Коршаком, А.М. Сладковим, В.І. Касаточкіним, Ю.П. Кудрявцевим на початку 60-х років XX ст.
Згодом було показано, що карбін може існувати в різних формах і містить поліацетиленові, так і полікумуленові ланцюжки, в яких вуглецеві атоми пов'язані подвійними зв'язками:
С=С=С=С=С=С=
Пізніше карбін був знайдений у природі – у метеоритній речовині.
Карбін має напівпровідникові властивості, під дією світла його провідність сильно збільшується. За рахунок існування різних типів зв'язку та різних способів укладання ланцюгів з вуглецевих атомів у кристалічній решітці фізичні властивості карбину можуть змінюватися в широких межах. При нагріванні без доступу повітря вище 2000 С карбін стійкий, при температурах близько 2300 С спостерігається його перехід в графіт.
Природний вуглець складається із двох ізотопів
(98,892%) та (1,108%). Крім того, в атмосфері виявлено незначні домішки радіоактивного ізотопу, який одержують штучним шляхом.Раніше вважали, що деревне вугілля, сажа і кокс близькі за складом чистого вуглецю і відрізняються за властивостями від алмазу і графіту, являють собою самостійну алотропну модифікацію вуглецю («аморфний вуглець»). Однак було встановлено, що ці речовини складаються з найдрібніших кристалічних частинок, в яких атоми вуглецю пов'язані так само, як у графіті.
4. Вугілля – тонко подрібнений графіт. Утворюється при термічному розкладанні вуглецевмісних сполук без доступу повітря. Вугілля істотно різняться за властивостями залежно від речовини, з якої вони отримані та способу отримання. Вони завжди містять домішки, що впливають на їх властивості. Найважливіші сорти вугілля – кокс, деревне вугілля, сажа.
Кокс виходить під час нагрівання кам'яного вугілля без доступу повітря.
Деревне вугілля утворюється при нагріванні дерева без доступу повітря.
Сажа дуже дрібний графітовий кристалічний порошок. Утворюється при спалюванні вуглеводнів (природного газу, ацетилену, скипидару та ін) при обмеженому доступі повітря.
Активне вугілля - пористі промислові адсорбенти, що складаються переважно з вуглецю. Адсорбцією називають поглинання поверхнею твердих речовин газів та розчинених речовин. Активне вугілля отримують з твердого палива (торфу, бурого та кам'яного вугілля, антрациту), дерева та продуктів його переробки (деревного вугілля, тирси, відходів паперового виробництва), відходів шкіряної промисловості, матеріалів тваринного походження, наприклад кісток. Вугілля, що відрізняється високою механічною міцністю, виробляють із шкаралупи кокосових та інших горіхів, із кісточок плодів. Структура вугілля представлена порами всіх розмірів, проте адсорбційна ємність та швидкість адсорбції визначаються вмістом мікропор в одиниці маси або об'єму гранул. При виробництві активного вугілля спочатку вихідний матеріал піддають термічної обробки без доступу повітря, в результаті якої з нього видаляється волога та частково смоли. При цьому утворюється крупнопориста структура вугілля. Для отримання мікропористої структури активацію роблять або окисленням газом або парою, або обробкою хімічними реагентами.
ВИЗНАЧЕННЯ
Вуглець- Шостий елемент Періодичної таблиці. Позначення – С від латинського «carboneum». Розташований у другому періоді, IVА групі. Належить до неметалів. Заряд ядра дорівнює 6.
Вуглець знаходиться у природі як у вільному стані, так і у вигляді численних сполук. Вільний вуглець зустрічається у вигляді алмазу та графіту. Крім викопного вугілля, у надрах Землі перебувають великі скупчення нафти. У земній корі зустрічаються у величезних кількостях солі вугільної кислоти, особливо карбонат кальцію. У повітрі завжди є діоксид вуглецю. Нарешті, рослинні та тваринні організми складаються з речовин, в освіті яких бере участь вуглець. Таким чином, цей елемент - один із поширених на Землі, хоча загальний його вміст у земній корі становить лише близько 0,1% (мас.).
Атомна та молекулярна маса вуглецю
Відносна молекулярна маса речовини (M r) - це число, що показує, у скільки разів маса даної молекули більша за 1/12 маси атома вуглецю, а відносна атомна маса елемента (A r) — у скільки разів середня маса атомів хімічного елемента більша за 1/12 маси атома вуглецю
Оскільки у вільному стані вуглець існує у вигляді одноатомних молекул, значення його атомної і молекулярної мас збігаються. Вони дорівнюють 12,0064.
Алотропія та алотропні модифікації вуглецю
У вільному стані вуглець існує у вигляді алмазу, що кристалізується в кубічній та гексагональній (лонсдейліт) системі, та графіту, що належить до гексагональної системи (рис. 1). Такі форми вуглецю, як деревне вугілля, кокс чи сажа мають невпорядковану структуру. Також є алотропні модифікації, отримані синтетичним шляхом - це карбін і полікумулен - різновиди вуглецю, побудовані з лінійних ланцюгових полімерів типу -C=C або C=C=.
Мал. 1. Алотропні модифікації вуглецю.
Відомі також алотропні модифікації вуглецю, що мають такі назви: графен, фулерен, нанотрубки, нановолокна, астрален, скловуглець, колосальні нанотрубки; аморфний вуглець, вуглецеві нанопочки та вуглецева нанопена.
Ізотопи вуглецю
У природі вуглець існує у вигляді двох стабільних ізотопів 12 С (98,98%) та 13 С (1,07%). Їхні масові числа дорівнюють 12 і 13 відповідно. Ядро атома ізотопу вуглецю 12 С містить шість протонів і шість нейтронів, а ізотопу 13 С - таку кількість протонів і п'ять нейтронів.
Існує один штучний (радіоактивний) ізотоп вуглецю 14 С з періодом напіврозпаду рівним 5730 років.
Іони вуглецю
На зовнішньому енергетичному рівні атома вуглецю є чотири електрони, які є валентними:
1s 2 2s 2 2p 2 .
Через війну хімічного взаємодії вуглець може втрачати свої валентні електрони, тобто. бути їх донором, і перетворюватися на позитивно заряджені іони чи приймати електрони іншого атома, тобто. бути їх акцептором, і перетворюватися на негативно заряджені іони:
0 -2e → 2+ ;
0 -4e → 4+ ;
0 +4e → 4- .
Молекула та атом вуглецю
У вільному стані вуглець існує у вигляді одноатомних молекул С. Наведемо деякі властивості, що характеризують атом і молекулу вуглецю:
Сплави вуглецю
Найбільш відомі сплави вуглецю у всьому світі - це сталь та чавун. Сталь - це метал заліза з вуглецем, вміст вуглецю у якому перевищує 2%. У чавуні (теж сплав заліза з вуглецем) вміст вуглецю вище - від 2-х до 4%.
Приклади розв'язання задач
ПРИКЛАД 1
| Завдання | Який обсяг оксиду вуглецю (IV) виділиться (н.у.) при випаленні 500 г вапняку, що містить 0,1 масову частку домішок. |
| Рішення | Запишемо рівняння реакції випалу вапняку: CaCO 3 = CaO + CO 2 -. Знайдемо масу чистого вапняку. Для цього спочатку визначимо його масову частку без домішок: w clear (CaCO 3) = 1 - w impurity = 1 - 0,1 = 0,9. m clear (CaCO 3) = m(CaCO 3) xw clear (CaCO 3); m clear (CaCO 3) = 500×0,9 = 450 г. Розрахуємо кількість речовини вапняку: n(CaCO 3) = m clear (CaCO 3) / M(CaCO 3); n(CaCO 3) = 450/100 = 4,5 моль. Відповідно до рівняння реакції n(CaCO 3) :n(CO 2) = 1:1, отже n(CaCO 3) = n(CO 2 ) = 4,5 моль. Тоді, обсяг оксиду вуглецю (IV), що виділився, буде дорівнює: V(CO 2) = n(CO 2) × V m; V(CO 2 ) = 4,5×22,4 = 100,8 л. |
| Відповідь | 100,8 л |
ПРИКЛАД 2
| Завдання | Скільки потрібно розчину, що містить 0,05 масових часток, або 5% хлороводню, для нейтралізації 11,2 г карбонату кальцію? |
| Рішення | Запишемо рівняння реакції нейтралізації карбонату кальцію хлороводнем: CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 -. Знайдемо кількість речовини карбонату кальцію: M(CaCO 3 ) = Ar (Ca) + Ar (C) + 3×A r (O); M(CaCO 3) = 40 + 12 + 3×16 = 52 + 48 = 100 г/моль. n(CaCO 3) = m (CaCO 3) / M(CaCO 3); n(CaCO 3) = 11,2/100 = 0,112 моль. Відповідно до рівняння реакції n(CaCO 3) :n(HCl) = 1:2, отже n(HCl) = 2×n(CaCO 3) = 2×0,224 моль. Визначимо масу речовини хлороводню, що міститься в розчині: M(HCl) = Ar (H) + Ar (Cl) = 1 + 35,5 = 36,5 г/моль. m(HCl) = n(HCl) ×M(HCl) = 0,224 × 36,5 = 8,176 р. Розрахуємо масу розчину хлороводню: m solution (HCl) = m(HCl)× 100 / w(HCl); m solution (HCl) = 8,176 × 100/5 = 163,52 р. |
| Відповідь | 163,52 г |