VUQLEROD, C (a. karbon; n. Kohlenstoff; f. karbon; i. karbon), - Mendeliev dövri sisteminin IV qrupunun kimyəvi elementi, atom nömrəsi 6, atom kütləsi 12.041. Təbii kömür 2 sabit izotopun cəmindən əmələ gəlir: 12 C (98,892%) və 13 C (1,108%). Karbonun 6 radioaktiv izotopu da var, bunlardan ən vacibi kosmik təkamülün 14 N neytronudur).
Vouglets v_domy z dərin antik. Taxta vikoristovuvsya filizlərdən metalların və almazın kəşfi üçün - yak. Kömürün kimyəvi element kimi tanınması fransız kimyaçısı A.Lavuazyenin (1789) adları ilə bağlıdır.
Kömürdə dəyişikliklər və güc
Kömürün 4 kristal modifikasiyası var: qrafit, almaz, karbin və lonsdaleit, onların üstünlüyü ilə güclü şəkildə etiraz edilir. Karabin, qara rəngli incə kristal toz olan kömür parçasıdır, kristal quruluşu bir-bir paralel olaraq çürüyən iki uzun kömür atomunun olması ilə xarakterizə olunur. Qalınlığı 3230-3300 kq / m 3 istilik tutumu 11.52 J / mol.K. Meteoritlərdə və otrimanii parçasında Lonsdalet təzahürləri; Onun strukturu və fiziki gücü kifayət qədər təfərrüatlı şəkildə qurulmamışdır. Kömür üçün xarakterik də nizamsız bir quruluşa malik bir düşərgədir - sözdə. amorf kömür (kök, koks, kənd vugіllya). "Amorf" kömürün fiziki gücü hissəciklərin dağılması və evlərin olması səbəbindən ağır şəkildə yatırılır.
Kömürlərdə kimyəvi güc
Kömürün dibində oksidləşmə dərəcəsi +4 (ən geniş), +2 və +3-dür. Ən böyük ağıllar üçün kömür kimyəvi cəhətdən təsirsizdir, yüksək temperaturda güclü ruhlandırıcı güc göstərən elementlərin zənginliyi ilə baş verir. Kömürün kimyəvi aktivliyi sıra "amorf" kömür, qrafit, almazda dəyişir; bu müxtəlif növ kömürlərdə turş hava ilə qarşılıqlı təsirlər 300-500°С, 600-700°С, 850-1000°С temperaturda kömürün karbon qazı (CO 2) və monooksid (CO) məhlullarına qədər müşahidə olunur. Dioksid həll edilmiş karbol turşusu ilə sudan fərqlənir. Kömür sapı bütün formaları lugіv і turşuları. Halojenlərlə karbon praktiki olaraq müdaxilə etmir (F 2-nin 900 ° C-dən yüksək reaksiya verdiyi crym qrafit), buna görə də halogenlər dolayı yolla çıxarılır. Azotlu çirkləndiricilərin ortasında sianist suyun HCN (hidrosiyan turşusu) və yoqo ədədi itkilərinin praktik əhəmiyyəti böyük praktik əhəmiyyət kəsb edir. 1000 ° C-dən yüksək temperaturda karbon, karbid təşkil edən zəngin metallarla qarşılıqlı təsir göstərir. Görkəmli qeyri-üzvi və üzvi yetişdiricilərdə kömür uyğunsuzluqları meydana gətirməlidir.
Kömürdəki ən əhəmiyyətli güc, atomlardan birinin öz aralarında, eləcə də öz aralarında və digər elementlər arasında mineral kimyəvi bağlar qurmaq üçün yaradılmasıdır. Karbonun digər karbon atomları ilə 4 bərabər valentlik bağı qurmaq qabiliyyəti müxtəlif növ (xətti, örtülmüş, siklik) karbon skeletlərinin əmələ gəlməsinə imkan verir; Güclərin özü kömürün bütün üzvi sahələrin, zokremanın və bütün canlı orqanizmlərin həyatındakı rolunu izah edir.
Təbiətə yaxın kömür
Yer qabığında kömürün orta miqdarı 2,3,10% (kütlə üçün); eyni zamanda, kömürün əsas kütləsi çöküntü dağ süxurlarında (1%) cəmləşmişdir, baxmayaraq ki, digər dağ süxurlarında bu elementin konsentrasiyası tamamilə aşağıdır və təxminən eyni (1-3,10%). Kömür yuxarı hissənin yaxınlığında toplanır və onun mövcudluğu əsasən canlı nitq (18%), ağac (50%), kam'yanim vugillya (80%), nafta (85%), antrasit (96%) ilə əlaqələndirilir. dolomitlər və vapnyaklarla. Kalsium, maqnezium və dəmirin ən geniş karbonatları (kalsit CaCO 3, dolomit (Ca, Mg) CO 3 və siderit FeCO 3) olan kömürdə 100 mineral ehtiva edir. Yerin qabığında yığılmış kömürlə tez-tez qeyri-müəyyən tarlaların gözü qarşısında gün dəfn edildikdən sonra yığılan üzvi nitq və su ilə udulan digər elementlərin yığılması olur. Vulkanik fəaliyyət zamanı və üzvi yanğınların yanması zamanı Yerdən atmosferdə böyük miqdarda CO 2 dioksid görünür. Atmosferdən CO 2 fotosintez prosesində roslinlər tərəfindən qəbul edilir və dəniz suyuna yayılaraq yerin karbon dairəsinin ən mühüm lankasını təşkil edir. Kosmosun kömürü mühüm rol oynayır; Günəşdə kömür nüvə proseslərində iştirak edərək su, helium və turşudan sonra eninə görə 4-cü yeri tutur.
Zastosuvannya və vikoristannya
Ən mühüm xalq-hökumət əhəmiyyəti, insanlar tərəfindən israf edilən bütün ilkin enerji mənbələrinin 90% -ə yaxınının üzvi şəkildə oturduğunu nəzərə alaraq kömür qoymaqdır. Müxtəlif kimyəvi virobnitlər üçün sirovinə bənzəyən nafta və turş kimi vikorasiya tendensiyası var. Kömürdə, vidobutiumda karbonatlar (metallurgiya, həyat, kimya istehsalı), almaz (zərgərlik zərgərliyi, texnologiya) və qrafitdə (nüvə texnologiyası, odlu tige, zeytun, deyaki vidi mastil və s.) xalq dövlətçiliyinin rolunu da adlandıracağam. . Biogen çıxış qalıqlarında 14 C izotopunun aktivliyi üçün їх əsr göstərilir (radiokarbonla tanışlıq üsulu). 14 C radioaktiv göstərici kimi geniş istifadə olunur. Əhəmiyyətli bir dəyər ən böyük izotop 12 C-dir - bu izotopun bir atomunun kütləsinin on ikidə biri kimyəvi elementlərin atom kütləsinin vahidi kimi qəbul edilir.
Vougillya
Z (Karbon), Elementlərin dövri sisteminin qeyri-metal kimyəvi elementi IVA altqrupu (C, Si, Ge, Sn, Pb). almaz kristalları (Şəkil. 1), qrafit və ya fulleren və digər formaları kimi görünüşlü təbiətdə Zustrichaetsya və üzvi (yun, nafta, canlılar və roslin və digər) və qeyri-üzvi çıxışlar (vapnyak, kharchova soda və digər) anbar daxil edin. Kömür geniş yayılmışdır və yer qabığında yoqo əvəzinə ale cəmi 0,19% təşkil edir (div. həmçinin ALMAZ; FULEREN).
Kömür zahirən sadə çıxışlarda geniş vikoristovuєtsya edir. Zərgərlik bəzəklərinin mövzusu olan bahalı brilyantlara nəzər salaq, almazları düzəltmək böyük əhəmiyyət kəsb edir - daşlama və kəsici alətlərin hazırlanması üçün. Vogillya kəndi və digər amorf kömür formaları texnologiya sahələrində qazların zərərsizləşdirilməsi, təmizlənməsi, adsorbsiya edilməsi, açıq səthdən depo adsorbent kimi istifadə olunur. Karbidi, metallarla yarı kömür, həmçinin bor və silisium ilə (məsələn, Al4C3, SiC, B4C) aşındırıcı alət hazırlamaq üçün yüksək sərtlik və vikorozla işlənir. Element polad və karbidlərin gözündə polad və ərintilərin anbarına daxil olmaq üçün kömür. Yüksək temperatur (sementləşdirmə) üçün kömür ilə polad döymələrin səthinin artması səthin sərtliyini və aşınma müqavimətini əhəmiyyətli dərəcədə artırır.
həmçinin ərintisi. Təbiətdə qrafitin şəxsiyyətsiz formaları var; deakі otrimani parçası; є amorf formalar (məsələn, vugіllya kəndindəki koks). Karbohidratları tüpürərkən, turş olmadıqda his, çalı, çıraq qara, asetilen hisi həll olunur. Beləliklə, ağ kömürün adları aşağı təzyiqlə pirolitik qrafiti sublimasiya edir - kəskin kənarlardan qrafit yarpaqlarının kristallarının kəskin boşluqları var.
Tarixi sübut. Qədim dövrlərdən qrafit, almaz və amorf kömür. Uzun müddətdir ki, başqa materialın qrafitlə işarələnə biləcəyi məlumdur və “yazmaq” mənasını verən yunan sözünə bənzəyən “qrafit” adının özü 1789-cu ildə A.Verner tərəfindən təklif edilmişdir. Prote іstorіya grafіtu dolaşıq, tez-tez yeni sözlər üçün qəbul, scho vodіyut zvnіshnіmi fiziki orqanları kimi, məsələn molibdenіt (molibden sulfid), bir saat vvazhavsya graphіt üçün. Qrafitin digər adları arasında "qara qurğuşun", "karbid tökmə", "parlaq qurğuşun" var. 1779-cu ildə K. Scheele müəyyən etdi ki, qrafit karbon qazının təsiri ilə oksidləşə bilər. Əvvəllər almazların Hindistanda tapıldığı bilinirdi və Braziliyada bahalı daşlar 1725-ci ildə kommersiya baxımından qiymətli oldu; Pvdenny Afritsy yaxınlığında cins 1867-ci ildə aşkar edilmişdir. 20-ci əsrdə. Əsas almaz istehsalçıları PAR, Zahir, Botsvana, Namibiya, Anqola, Sierra Leone, Tanzaniya və Rusiyadır. Texnologiyası 1970-ci ildə yaradılmış brilyant parçaları sənaye məqsədləri üçün əyirilir.
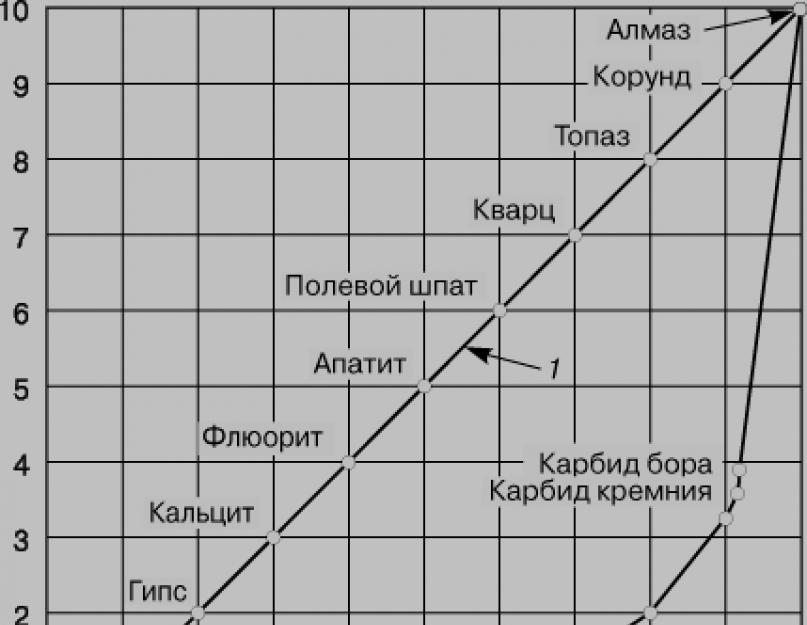
Alotropiya. Nitqin struktur vahidləri (monatomik elementlər üçün atomlar və ya çox atomlu elementlər üçün molekullar və spoluk) bir-bir daha böyük bir alt kristal şəklində qurulduğundan, bu fenomen alotropiya adlanır. Kömürün üç alotropik modifikasiyası var - almaz, qrafit və fulleren. Almaz qabığında karbon atomu kubik quruluş yaradaraq, tetraedral şəkildə suscid şəklində düzülə bilər (şəkil 1a). Belə bir quruluş bağın maksimum kovalentliyini verir və karbonun dəri atomunun bütün 4 elektronu yüksək icmalı C-C bağları qurur, tobto. struktur gündəlik elektron keçiriciliyə malikdir. Buna görə almaz keçiriciliyinə, aşağı istilik keçiriciliyinə, yüksək sərtliyinə görə nəfəs alır; Digər çıxışlardan ən çətini (şək. 2). Tetrahedral quruluşda CC bağının (bağ 1,54, kovalent radius 1,54/2 = 0,77) açılması üçün böyük miqdarda enerji tələb olunur, buna görə də almaz, bənövşəyi sərtliyə malik böyüklük sırası ilə xarakterizə olunur. yüksək ərimə nöqtəsi ilə (3550 ° C).

Karbonun başqa bir allotropik forması, üstünlük üçün almazla güclü mübahisə edən qrafitdir. Qrafit, asanlıqla yellənən və güclü elektrik keçiriciliyindən (elektrik opiri 0,0014 Ohm * sm) təsirlənən kristallardan hazırlanmış yumşaq qara nitqdir. Buna görə də, yüksək temperatur tələb edən qövs lampaları və sobalarda qrafit durğunlaşır (şəkil 3). Yüksək təmizlikli qrafit neytronlara əlavə olaraq nüvə reaktorlarında yığılır. Hərəkətli bir vitse ilə ərimə nöqtəsinin temperaturu 3527 ° C-dir. Güclü təzyiqlə qrafit 3780 ° C-də sublimasiya edir (bərk vəziyyətdən qaza keçir).

Qrafitin strukturu (şəkil 1,b) uzunmüddətli əlaqəsi 1.42 (əhəmiyyətli dərəcədə qısa, almazda daha aşağı) olan qatılaşdırılmış altıbucaqlı üzüklər sistemidir, lakin bu dəri ilə karbon atomu üç ola bilər (və chotiri deyil, almazdakı kimi) kovalent ulduzların dilləri asqılarla üçqat olur və dördüncü halqa (3,4) kovalent əlaqə üçün çox uzundur və aralarında qrafit toplarının yerləşdirilməsi ilə paralel olaraq zəif birləşir. Karbondakı ən dördüncü elektron qrafitin elektrik keçiriciliyinin istiliyini göstərir - daha uzunömürlülük və daha az maqnit bağı, almaz vəziyyətində qrafitin daha aşağı sərtliyində görünən qrafitin daha az kompaktlığını meydana gətirir. qrafitin qalınlığı 2, 26 q/sm3, almaz - 3,51 q/sm3). Z tієї yaxşı dotik üzərində selikli qrafit səbəb və asanlıqla neft və zeytun şifer hazırlanması üçün vicorated olan nitq parçaları yumşaltmaq. Stylusun aparıcı parıltısı qrafitin mövcudluğundan daha vacib izah olunur. Kömürün lifləri yüksək kömürlə toxuna bilər və bir parça tikişi və ya yüksək kömür ilə digər iplik hazırlamaq üçün bükülə bilər. Yüksək təzyiq və temperaturda katalizatorun, məsələn, duzun iştirakı ilə qrafit almaza çevrilə bilər. Parça almazların sənaye alınması üçün bütün reallaşdırma prosesi. Almaz kristalları katalizatorun səthində böyüyür. Rivnavaga qrafit almazı 15.000 atm və 300 K və ya 4000 atm və 1500 K üçün istifadə olunur. Parça almaz karbohidratlardan götürülə bilər. Amorf formalara kömürləşə bilərəm, kristalları çökməyən, təkrar giriş olmadan ağacın qızdırılması ilə qəbul edilən vugillya kəndini, durğun olmayan havalarda karbohidratlara duzlanaraq aşağı temperaturda çökən lampa və qaz hisini gətirə və kondensasiya edə bilərəm. soyuq səthdə, kistkove vugillya - toxuculuq proseslərində kalsium fosfat üçün ev və navit daş vugillya (evli təbii rexovina) və koks, quru artıqlıq, daş vugiliya və nafta yataqlarının (bitumlu vugillya) quru distillə üsulu ilə kokslanması. , tobto. təkrar giriş olmadan istilik. Koks qara və rəngli metallurgiyada çavunu əritmək üçün istifadə olunur. Kokslaşma zamanı qaza bənzər məhsullardan da istifadə olunur - koks qazı (H2, CH4, CO və s.) və kimyəvi məhsullar, məsələn, benzinin çıxarılması üçün kükürd, farb, dobriv, əczaçılıq preparatları, plastiklər və s. Koks istehsalı üçün əsas aparatın - koks sobasının sxemi Şəkildə göstərilmişdir. 3. Müxtəlif növ kömür və his, qazın təmizlənməsi üçün bir adsorbent, eləcə də katalizatorlar kimi boş bir səth və vicorous tərəfindən nüfuz edir. Kömürün müxtəlif formalarının istehsalı üçün kimyəvi texnologiyanın xüsusi üsullarına ehtiyac var. Piece qrafit 2260 ° C (Acheson prosesi) və neft və elektrodların istehsalında vikorist, metalların elektrolitik çıxarılması üçün krem, karbon elektrodları arasında antrasit və ya nafta koksu qovurmaq üçün istifadə olunur.
Budova atom vugletsyu. Kütləsi 12 (eni 98,9%) olan ən sabit karbon izotopunun nüvəsi 6 proton və 6 neytrondan (12 nuklon) ibarətdir, triomin ilə kvartetlərlə qarışdırılır, dəri helium nüvəsi kimi 2 proton və iki neytrondan ibarətdir. Karbonun ikinci stabil izotopu 13C (bl. 1,1%) və iz miqdarda qeyri-sabit izotop 14C təbiətdə 5730 il müddətinə rast gəlinir, b-dəyişdirilə bilər. Canlı maddənin normal karbon dövrəsində, CO2 şəklində üç izotopun taleyini götürün. Canlı bir orqanizmin ölümündən sonra vitrata karbona bağlanır və 14C radioaktivlik səviyyəsini pozaraq qisas alına bilən C-cisimləri təyin etmək mümkündür. 14CO2-nin b-modifikasiyasının azalması ölümdən sonrakı saata mütənasibdir. 1960-cı ildə U.Libbi radioaktiv karbonla işinə görə Nobel mükafatına layiq görülüb.
həmçinin RADİOAKTİVİYYƏ ÜÇÜN TARİX. Əsas stansiyada karbondakı 6 elektron 1s22s22px12py12pz0 elektron konfiqurasiyasını təşkil edir. Digər bərabər olan Chotiri elektronları dövri sistemin İVA qrupunda karbonun vəziyyətini əks etdirən valentlikdir (div. ELEMENTLƏRİN DÖVRİ SİSTEMİ). Qaz fazasında bir atom şəklində bir elektron sürmək üçün qəlpələr çox enerji tələb edir (təxminən 1070 kJ / mol), karbon digər elementlərlə ion bağlarını həll etmir, buna görə də elektronu bir elektronla sürmək lazımdır. müsbət qəbul o. 2,5 kimi yüksək olan elektronegativ olmasına baxmayaraq, karbon bir elektrona güclü sporidlik göstərmir, görünür, aktiv elektron qəbuledicisi deyil. Mənfi yüklü hissənin utvochennya üçün skhilny deyil. Ale s tez-tez ionny xarakter zv'yazku deyakі spoluky uglezyu іsnuyut, məsələn, karbidi. Künclərdə karbon 4-cü oksidləşmə mərhələsini göstərir. Elektronların bir hissəsi bağların işıqlandırılmasında iştirak edə bilməsi üçün 2s-elektronları depasasiya etmək və bu elektronlardan birini 2pz-orbitala tullanmaq lazımdır; aralarında 109 ° kəsik ilə 4 tetraedral əlaqə qurulur. Valentlik elektronlarının yan tərəflərində karbon daha az çəkilir, buna görə də karbon qlobal elektron bahisin köməyi ilə Z-Z tipli yer atomları arasında maqnit kovalent bağlar yaradır. Belə bir əlaqənin inkişafı üçün enerji 335 kJ / mol qədər yüksəkdir, Si-Si rabitəsi üçün isə yalnız 210 kJ / mol olur ki, bu da Si-Si qeyri-sabit bir əlaqədən çoxdur. Bağın kovalent təbiəti yüksək reaktiv halogenlərin karbon, CF4 və CCl4 ilə birləşməsində saxlanılır. Karbon atomu zdatnі qəbul edilmiş bağa dərinin karbon atomunun birdən çox elektronunu qoyur; belə utvoryuyuyutsya podvіyna C \u003d C və potrіyna CєS zv'yazku. Digər elementlər də öz atomları arasında bağ yaradır, lakin yalnız binanın kömürü iynəyarpaqlı nizələr yaradır. Buna görə də, kömür üçün, su və karbon digər atomları ilə bəzi kömür əlaqələri, dovgі lances və ya kiltsev strukturları təmin karbohidratlar adlı minlərlə spolks var.
KİMYA ÜZVİ. Bu sahələrdə suyu başqa atomlarla, çox vaxt kisen, azot və halogenlərlə və şəxsiyyətsiz üzvi sahələrin məhlulları ilə əvəz etmək mümkündür. Onların arasında əhəmiyyətli bir dəyər flüorokarbohidratlar tərəfindən işğal edilir - karbohidratlarda, sular flüorla əvəz olunur. Beləliklə, onlar plastik və yağlı materiallar (flüorkarbonlar, karbohidratlarda, flüor atomlarını əvəz edən bütün su atomlarında) və aşağı temperaturda soyuducu maddələr (soyuqlar və ya freonlar, - flüorxlorlu karbohidratlar) kimi dilüstü inert və vikorativdirlər. 1980-ci illərdə Amerika Birləşmiş Ştatlarının fizikləri karbon atomlarının 5 və ya 6 kəsiklərə birləşdirildiyi, C60 molekulunu boş kisə şəklinə salan, simmetriyanı tamamlaya bilən yarıdan çox kömür göstərdilər. futbol m'ya cha. Bu dizaynın qırıqları amerikalı memar və mühəndis Buckminster Fuller tərəfindən tapılan "geodeziya qübbəsinin" altında yatır, "buckminsterfulerenes" və ya "fulerenes" adlarından yeni adlar sinfi (həmçinin qısaca - "fasiballs" və ya "buckyballs") . Fulleren - 60 və ya 70 (və daha çox) atomdan ibarət olan saf karbonun üçüncü modifikasiyası (krimdən almaz və qrafit), - bula karbonun fraksiya hissəcikləri üzərində lazer modifikasiyası ilə çıxarıldı. Bükülən formada olan fullerenlər bir neçə yüz karbon atomundan əmələ gəlir. C60 CARBON molekulunun diametri 1 nm-dir. Belə bir molekulun mərkəzində böyük uran atomu üçün kifayət qədər yer var.
həmçinin FULLERENI.
Standart atom kütləsi. 1961-ci ildə Nəzəri və Tətbiqi Kimyanın Beynəlxalq Kompilyasiyası (IUPAC) və fizika əvvəllər istifadə edilən atom çəkilərinin turşu şkalasını genişləndirərək, atom çəkisinin vahidi kimi karbon 12C izotopunu qəbul etdi. Bu sistemdəki karbonun atom çəkisi 12.011-dir, buna görə də təbiətdəki enliklərinin yaxşılaşdırılması ilə karbonun üç təbii izotopunun orta göstəricisidir.
ATOM MASASI. Chemіchnі vlastivostі vugletsyu vugletsyu deyih yoqo spoluk. Statistikada karbonun induksiya edən fiziki-kimyəvi qüvvəsi KİMYİ Elementlər. Kömürün reaksiya binası yogo modifikasiyası, temperatur və dispersiya şəklində çökdürülür. Aşağı temperaturda kömürün bütün formaları təsirsizdir, lakin qızdırıldıqda turş oksidləşir, söndürən oksidlər:

İncə səpələnmiş karbon qızdırılanda və ya qığılcımlar əmələ gələndə həddindən artıq asidik bina vibesinə malikdir. Birbaşa oksidləşmə kremi oksidlərin saxlanması üçün müasir üsullara əsaslanır. Karbon suboksid C3O2 malon turşusunun P4O10 üzərində dehidratasiyası ilə həll olunur:
C3O2 qəbuledilməz bir qoxuya sahib ola bilər, asanlıqla hidrolizə olunur, malon turşusunu bərpa edir.
Karbonmonoksit (II) CO oksidləşmə zamanı həll olunur, istər turş olmayanların şüurunda karbonun modifikasiyası. Reaksiya ekzotermikdir, 111,6 kJ/mol görünür. Ağ istilikdə koks su ilə reaksiya verir: C + H2O = CO + H2; çökən qaz məbləği "su qazı" adlanır və qaza bənzər oddur. CO həmçinin naftoməhsulların qeyri-bərabər yanması zamanı həll olur, xatirə sümüklərində avtomobilin qazlarında tapıla bilər, qarışqa turşusunun termik dissosiasiyası zamanı çıxır:
CO-da karbonun oksidləşmə mərhələsi +2, karbonun qəlpələri isə +4 oksidləşmə mərhələsinə qədər daha sabitdir, sonra CO turşu ilə CO2-yə asanlıqla oksidləşir: CO + O2 (r) CO2 və reaksiya. güclü ekzotermikdir (283 kJ/mol). CO zastosovuyut sənaye summіshі z H2 və solğun və ya qaz kimi havalandırma kimi digər yanan qazlar. 500 ° C-yə qədər qızdırıldıqda, CO dünyada CO2-ni həll edir, lakin 1000 ° C-də CO2-nin aşağı konsentrasiyalarında bərabər olur. CO xlorla reaksiya verir, fosgenə çevrilir - COCl2, eyni şəkildə digər halogenlərlə reaksiyalar gedir, kükürdlə reaksiyalar karbonil sulfid COS-dan çıxır, metallarla (M) CO müxtəlif anbar M (CO) x-nin karbonillərini həll edir, kompleks yarımlardır. Karbonil tüpürcək qan hemoglobinin CO ilə qarşılıqlı təsirində həll olunur, hemoglobinin turş ilə reaksiyasını dəyişdirir, buna görə də karbonil tüpürcək bədxassəli bir xəstəlikdir. Bunun nəticəsində hemoglobinin klitinə, yaksa ölərsə (və ilk növbədə beyin hüceyrələri təsirlənir) turşuluq daşıyıcısı kimi funksiyası bloklanır. (CO-nun başqa bir adı var - "çadnı qazı"). Artıq 1% (cild) İnsanlar üçün təhlükəli görünür, belə bir atmosferdə 10 dəqiqədən çox olduğu bilinir. SO-nun fiziki gücünün aktları cədvəllərdə göstərilmişdir. Karbon qazı və ya karbon oksidi (IV) CO2 elementar karbon yandırıldıqda həll olunur, istiliklə çox turş olur (395 kJ / mol). CO2 (xırda adı - "karbon qazı") CO, neft məhsulları, benzin və digər üzvi birləşmələrin tam oksidləşməsi zamanı da həll olunur. Suda müxtəlif karbonatlarla hidroliz nəticəsində CO2 də görünür:
Belə bir reaksiya CO2-nin saxlanması üçün laboratoriya praktikasında tez-tez rast gəlinir. Bu qaz bikarbonat metalları qovurarkən çıxarıla bilər:
Həddindən artıq qızdırılan buxarın CO ilə qaz fazalı qarşılıqlı təsiri zamanı:
Karbohidratlarda spalyuvannі və їx kisnevirobnyh zaman, məsələn:

Eynilə, qida məhsulları canlı orqanizmdə istilik və digər enerji növləri ilə oksidləşir. Oksidləşmə yumşaq şüurlarda aralıq mərhələlərdən keçdikdə və sonra son məhsullar eyni olduqda - CO2 və H2O, məsələn, fermentlərin fermentasiyası altında dövrlərin çəkilməsi saatı, fermentasiya zamanı zokrema. qlükoza:
Karbon dioksid və metal oksidlərinin zəngin tonajı karbonatların sənaye istilik paylanmasında tapılır:

Böyük miqdarda CaO sement istehsalı texnologiyasında qalib gəlir. Karbonatların istilik dayanıqlığı və onların paylanması üzrə istilik itkisi sxeminə görə CaCO3 seriyasında artım (div. Elektron Budova Oksigen Karbon. İstənilən növ karbon oksidinin elektron ömrü elektron cütlərinin müxtəlif paylanması - üçlü rezonans formaları ilə üçlü rezonans sxemləri ilə təsvir edilə bilər:

Oksidləşmiş kömürün bığları xətti bir həyat biçir.
Vuqlik turşusu. C2 su ilə qarşılıqlı əlaqədə olduqda, karbon turşusu H2CO3 həll olunur. CO2-nin ən böyük çeşidində (0,034 mol/l) molekulların yalnız bir hissəsi H2CO3-ü həll edir və CO2-nin əksəriyyəti hidratlı CO2*H2O stansiyasında olur.
Karbonat. Karbonatlar metal oksidlərinin CO2 ilə qarşılıqlı təsirində həll olunur, məsələn, Na2O + CO2 -> NaHCO3 və qızdırıldıqda CO2 müşahidələri ilə parçalanırlar: 2NaHCO3 -> Na2CO3 + H2O + CO2 onların sayı Solvay metodundan daha vacibdir:

Başqa bir üsul, sodanın CO2 və NaOH-dən çıxarılmasıdır

Karbonat-ion CO32 düz ola bilər, kəsilmiş O-C-O, bərabər 120° və uzun CO-link 1.31
(Div. həmçinin LUZHIV VIROBNITSTVO).
Kömürdə halidlər. Kömür qızdırıldıqda halogenlərlə vasitəçi olmadan reaksiya verir, tetrahalidləri asanlaşdırır, aloe vera, reaksiya sürəti və məhsulun məhsuldarlığı kiçikdir. Buna görə də, karbon halogenidləri başqa üsullarla çıxarılır, məsələn, karbon xlor disulfidi CCl4 ilə çıxarılır: CS2 + 2Cl2 -> CCl4 + 2S yarım ay kimi yogo, belə ki, temperatur kimi partlayış fosgeninin məhlulu (qaz kimi partlayış). çıxış). CCl4 özü də virulentdir və parçalanmış sümüklərdə tənəffüs edilərsə, qaraciyərin zədələnməsinə səbəb ola bilər. СCl4 metan СH4 və Сl2 arasında fotokimyəvi reaksiyalarda həll olur; eyni zamanda metanın kəskin olmayan xlorlama məhsullarını - CHCl3, CH2Cl2 və CH3Cl-ni həll etmək mümkündür. Eynilə, reaksiyalar digər halogenlərlə davam edir.
Qrafitə reaksiya. Qrafit, altıbucaqlı halqaların topları arasında böyük boşluqlarla üfürülən karbonun bir modifikasiyası olaraq, qeyri-ibtidai reaksiyalara girir, məsələn, metal gölməçələri, halogenlər və duzun turşuları (FeCl3) toplar arasında nüfuz edərək K C8 tipini təmin edir. , KC16 Turş mühitdə (kükürdlü və ya nitrat turşusu) KClO3 növünün güclü oksidləşdirici maddələri nitqi böyük həcmdə kristal taxıllarla (toplar arasında 6-ya qədər) həll edir, bu da turşu atomlarının udulması və səthdə əmələ gəlməsi ilə izah olunur. onların səthi nəticəsində və oksidləşmə utvoryayutsya karboksil qrupları (-COOH ) - yarım növ oksidləşmiş qrafit və ya melit (benzenhexakarboksilik) turşusu C6(COOH)6.
Karbid. Kömür karbid adlanan müxtəlif materiallardan olan metallar, bor və silisiumdan hazırlanır. Ən aktiv metallar (IA-IIIA alt qrupu) duz kimi karbidləri həll edir, məsələn, Na2C2, CaC2, Mg4C3, Al4C3. Sənayedə, kalsium karbid təhqiredici reaksiyalar üçün koks və vapdan alınır:

Karbid qeyri-elektrik keçiricidir, barsız ola bilər, karbohidratlara hidrolizə olunur, məsələn CaC2 + 2H2O = C2H2 + Ca(OH)2 . Cycavia, qırıqların bütün prosesi qeyri-üzvi təbiət sirovinasından üzvi birləşmələrin sintezinə keçidi təmsil edir. Asetilenin hidrolizində istifadə olunan karbidlərə asetilidlər deyilir. Silisium karbidləri və bor (SiC və B4C) atomlar arasında kovalent bağlara malikdir. Keçid metalları (elementlər B-alt qrup) kömürlə qızdırıldıqda, onlar da metalın səthindəki çatlarda dəyişkən anbarın karbidini həll edirlər; onların zv'yazok metala yaxındır. Bu tip karbid agentləri, məsələn, WC, W2C, TiC və SiC, yüksək sərtlik və odadavamlı xüsusiyyətlərə malikdir və yaxşı elektrik keçiriciliyinə malikdir. Məsələn, NbC, TaC və HfC ən odadavamlı nitqdir (m.p. = 4000-4200 ° C), deniobium karbid Nb2C 9,18 K-da super keçiricidir, almaza yaxın sərtlik üçün TiC və W2C və B4C sərtliyi (almazın struktur analoqu) ) Mohs şkalasından 9,5 geriyə çevrilir (div. Şəkil 2). İnert karbid, keçid metalının radiusu kimi sabitdir Azot zəhərlənməsi. NH2CONH2 sechovin qrupun zirvəsinə gətirilir - azot dostu, bir baxışda durğunlaşır. Secovina, aşağı istilikdə qızdırıldıqda NH3 və CO2-dən alınır:
Dicyane (CN)2 tez-tez halogenlərə və yoqoya bənzər gücünə görə psevdohalogen adlanır. Dicyane sianid-ion turşusu, su peroksid və ya Cu2+ ionu ilə yumşaq oksidləşməyə malikdir: 2CN- -> (CN)2 + 2e. Sianid-ion elektron donoru olmaqla keçid metal ionları ilə asanlıqla mürəkkəb reaksiyalar aparır. CO kimi, sianid-ion canlı orqanizmdə koridorun otrutoyu, pov'yazuyuchi həyat əhəmiyyətli hissəsidir. Sianid kompleks ionları []-0,5x ümumi düsturuna malik ola bilər, burada x metalın (mürəkkəb əmələ gətirən agent) koordinasiya nömrəsidir, empirik olaraq metal ionunun oksidləşmə vəziyyətinin ikinci ikinci qiymətindən yüksəkdir. Belə kompleks ionların qruntları є (aşağıda induksiya edilmiş budov deyaky ionları) tetrasiyanikelat (II) -ion [] 2-, heksasiyanoferrat (III) [] 3-, disiyanoargentat [] -:

Karbonillər. Aralıqsız karbonmonoksit binası zəngin metallar və ya metal ionları ilə reaksiya verir, kompleks yarımları asanlaşdırır, çünki onlar karbonillər adlanır, məsələn, Ni (CO) 4, Fe (CO) 5, Fe2 (CO) 9, [] 3, Mo (CO) ) 6, [ ] 2. Bu hallarda keçid siyanokompleksin təsvirlərindəki keçidə bənzəyir. Ni (CO) 4 - nikel və digər metalların su ilə möhkəmləndirilməsi üçün hazırlanmış uçan nitq. Quruluşlarda çavun və poladın strukturunun pisləşməsi çox vaxt karbonil məhlulları ilə əlaqələndirilir. Su karbonil anbarına daxil ola bilər, H2Fe(CO)4 və HCo(CO)4 kimi karbonil hidridləri, məsələn, turşu güc göstərən və çəmənliklə reaksiya verir: H2Fe(CO)4 + NaOH -> NaHFe(CO)4 + H2O V_domi həmçinin karbonil halidləri, məsələn, Fe (CO) X2, Fe (CO) 2X2, Co (CO) I2, Pt (CO) Cl2, de X - halogen olsun
(bölmə həmçinin METAL-ÜZVİ LƏRƏKLƏR).
Karbohidratlarda. Suyun zülmətində Vіdomo bezlіch spoluk
(div. KİMYA ÜZVİ).
ƏDƏBİYYAT
Sunyayev Z.İ. Naftovy kömür. M., 1980 Hiperkoordinasiya edilmiş kömür kimyası. M., 1990
Collier ensiklopediyası. - Vіdkrite suspіlstvo. 2000 .
Sinonimlər:Görəsən, "VUGLEROD" başqa lüğətlərdə nədir:
Nuklidlər cədvəli Zagalnі vіdomostі Adı, simvol Vuglets 14, 14C
Nuklidlər cədvəli Zagalnі vіdomostі Adı, simvolu Vuglets 12, 12C Neutronіv 6 Protonіv 6 Nuklidin gücü Atom kütləsi 12.0000000(0) ... Wikipedia
Kömür - tse, bəlkə də, Yerdəki əsas və ən vacib kimyəvi element və hətta bunun üçün əlavə olaraq həm qeyri-üzvi, həm də üzvi çoxlu sayda müxtəlif sahələr əmələ gəlir. Kömür bütün canlıların əsasıdır, demək olar ki, su və turş kimi kömür də planetimizdəki həyatın əsasıdır! Vugletlər fiziki və kimyəvi güclərinə və görünüşünə görə oxşar olmadığı üçün formaları fərqli ola bilər. Ale bütün tse vuglets!
Tarix
Vouglets buv vіdomiy chelovedstve s davn_h çoxdan. Qrafit və vuqilla qədim yunanlar tərəfindən qalib gəldi və almazların Hindistanda tapıldığı bilinirdi. Düzdür, qrafit tez-tez oxşar görünüşlü mərtəbələr üçün səhv edilir. Prote, qrafit mav qədim zamanlarda geniş əkilir, zokrema yarpaqları. Navit yoqo adı yunanca "grafo" - "yazıram" sözünə bənzəyir. Qrafit zeytunlarda eyni zamanda yoluxucudur. Almazlar ilk dəfə 18-ci əsrin birinci yarısında Braziliyada alqı-satqısına başlanılmış, eyni zamanda anonim cinslər aşkarlanmış, 1970-ci ildə almazların parça-parça alınması texnologiyası genişləndirilmişdir. Belə parçalanmış brilyantlar sənətkarlıqda, təbii quyuda, öz qara rəngli, zərgərlikdə zastosovuyut.
Təbiətə yaxın kömür
Karbonun ən əhəmiyyətli miqdarı atmosferdə və hidrosferdə karbon qazı şəklində qəbul edilmişdir. Kömür atmosferində 0,046% -ə yaxın və daha çox - Müqəddəs Okeanın səpələnmiş görünüşündə var.
Bundan əlavə, biz daha çox içdikcə, kömür canlı orqanizmlərin əsasını təşkil edir. Məsələn, 70 kq kütləsi olan min adamda təxminən 13 kq kömür var! Bir adamda daha az! Və kömürlər bütün böyümələr və canlılarla eynidir. Ox və şadlanmaq ...
Krugoobіg vugleciu in prirodі
Kömürün alotropik modifikasiyası
Vouglets unikal kimyəvi elementdir, bu da onu allotropik modifikasiyalar və ya daha sadə şəkildə, fərqli formalar adlandırır. Bu modifikasiyalar kristal, amorf və çoxluqlara bənzəyir.
Kristal dəyişiklikləri düzgün kristal ola bilər. Tsієї qruplarına yalan deyirlər: almaz, fullerit, qrafit, lonsdaleit, karbon lifləri və borular. “Dünyada Nayverdiş materialları” reytinqinin ilk aylarında kömürün kristal modifikasiyaları daha mühümdür.
 Kömürün alotrop formaları: a) lonsdaleit; b) almaz;
Kömürün alotrop formaları: a) lonsdaleit; b) almaz; c) qrafit; d) amorf kömür; e) C60 (fuleren); f) qrafen;
g) tək top nanoboru
Digər kimyəvi elementlərin kiçik evlərindən kömürdən hazırlanmış amorf formalar. Bu qrupun əsas nümayəndələri bunlardır: vugillya (kamyan, kənd, aktiv), his, antrasit.
Ən mürəkkəb və yüksək texnologiyalı olanlar klasterlərin gözü qarşısında yarı sərindir. Karbonun atomları boş formanı təmin edəcək şəkildə öğütülürsə, ortada digər elementlərin atomları, məsələn, su ilə doldurulursa, çoxluqlar xüsusi bir quruluşdur. Bu qrupun o qədər çox nümayəndəsi yoxdur, ona karbon nanokonları, astral və bikarbonat daxildir.
 Qrafit - almazın "qaranlıq tərəfi"
Qrafit - almazın "qaranlıq tərəfi" Zastosuvannya vugletsyu
Həmin yoqa yarı ananın kömürləri insanın həyatında böyük əhəmiyyət kəsb edir. Kömürdən Yer kürəsində müəyyən edilmiş əsas yanğın növləri - təbii qaz və nafta. Kömür kimya və metallurgiya sənayesində, məişətdə, maşınqayırmada və tibbdə geniş istifadə olunur. Almazda alotropik modifikasiyalar zərgərlikdə vicarious görünüş, raket istehsalında fullerit və lonsdaleit. Gecənin yarısında mexanizmlər üçün texniki cəhətdən təchiz edilmiş və zəngin şəkildə fərqlənən müxtəlif yağlar hazırlanır. Promislovіst eyni zamanda kömür olmadan edə bilməz, vikoristovuєtsya skrіz!
Memorandum "Nikiforivska 1 saylı orta təhsil məktəbi"
Kömür və yogo əsas qeyri-üzvi plitələr
İnşa
Vikonav: 9B sinif şagirdi
Sidorov Oleksandr
Müəllim: Saxarova L.M.
Dmitrivka 2009
Giriş
I fəsil. Kömür haqqında hər şey
1.1. Təbiətə yaxın kömür
1.2. Kömürün alotropik modifikasiyası
1.3. Kömürlərdə kimyəvi güc
1.4. Zastosuvannya vugletsyu
Rozdil II. Qeyri-üzvi kömür yığınları
Vişnovok
Ədəbiyyat
Giriş
Vuqlets (lat. Carboneum) C Mendeliev dövri sisteminin IV qrupunun kimyəvi elementidir: atom nömrəsi 6, atom kütləsi 12.011 (1). Gəlin kömürlərdəki atomun həyatına baxaq. Karbon atomunun enerji səviyyəsində bəzi elektronlar var. Qrafik şəkildə təmsil olunur:
Vuglets buv v_domy z davnіh-çoxdan əvvəl və іm'ya pershov_dkrivach tsgogo element nevіdome.
Naprikintsi XVII əsr. Averan və Tarjoninin Florensiyalı keşişləri kiçik miqdarda kiçik brilyantları bir böyük almazda birləşdirməyə çalışdılar və onları astar anbarının köməyi üçün yuxulu mədənlərə qızdırdılar. Səthdə yanan brilyantlar peyda oldu. 1772-ci ildə səh. Fransız kimyaçısı A.Lavoisier göstərdi ki, almaz yandırıldıqda CO2 udulur. Lish, 1797 səh. İngilis rəyləri S. Tennant didov_v _qrafit və vugillyanın təbiətinin eyniliyi. Karbon oksidi (IV) ilə birləşən bərabər miqdarda kömür və almaz yandırıldıqdan sonra onların eyni olduğu ortaya çıxdı.
Kömürün müxtəlifliyi, digər elementlərin atomlarının atomlarından birinin müxtəlif yollarla qurulması, karbonun digər elementlərin ortasındakı mövqeyinə yaxınlaşması ilə izah olunur.
FəsilI. Kömür haqqında hər şey
1.1. Təbiətə yaxın kömür
Kömür təbiətdə sərbəst düşərgədə olduğu kimi, yerə baxanda da tanınır.
Vilnıy kömürü almaz, qrafit və karbinə baxanda itilənir.
Almazlar daha nadirdir. Ən böyük məlum almaz 1905-ci ildə tapılan "Cullinan"dır. Pvdenniy Afrikada, çəkisi 621,2 g və 10 × 6,5 × 5 sm.Moskvada Almaz Fondunda dünyanın ən böyük və ən gözəl almazlarından biri - "Orlov" (37,92 q) toplanır.
Adımı almaz deyəcəm, otrimav v_d qoz. "Adamas" - dayandırılmaz, qırılmaz. Almazların ən əhəmiyyətli cinsləri Pivdenny Afrika, Braziliya, Yakutiyada tapılır.
Böyük miqdarda qrafit FRN, Şri-Lanzi, Sibir, Altaydan alınır.
Baş karbonlu minerallar є: maqnezit МgСО 3 , kalsit (vapnispat, vapnyak, marmur, kreida) CaCO 3 , dolomit CaMg (СО 3) 2 və in.
Yanan kopalinin bığları - nafta, qaz, torf, daş və kömür fırtınaları, şist - kömür əsasında. Anbarın arxasında kömür deyakі vykopnі vugіllya, scho mіstjat 99% -ə qədər bağlayın.
Yer üzündə qızılca 0,1% kömür düşür əvvəl.
Karbon oksidi (IV) gördükdə 2 karbon atmosfer anbarına daxil olur. Hidrosferdə çoxlu miqdarda CO 2 var.
1.2. Kömürün alotropik modifikasiyası
Elementar karbon üç alotropik modifikasiya edir: almaz, qrafit, karbin.
1. Almaz, işığın dəyişməsini güclü şəkildə pozan lüləsiz, aydın kristal nitqdir. Almazdakı karbon atomları sp 3-hibridləşmə stansiyasında yenidən alınır. Oyanmış vəziyyətdə, karbon atomlarında valent elektronların zəifləməsi baş verməyə başlayır və qoşalaşmamış elektronların bir hissəsini qəbul edir. Kimyəvi bağlar qurulduqda, elektron qaranlıqlar eyni burulmuş formada şişir və kosmosda genişlənir ki, onların oxları düz tetraedrin zirvələrində görünür. Dairələrin təpələri karbonun kiçik atomları ilə kəsişdikdə, 109 ° 28 "kənarındakı kovalent bağlar qırışır və almaz üçün xarakterik olan atom kristal şəbəkəsi qurulur.
Karbon atomu tetraedrlərin mərkəzindəki zirvələrə qədər düz xətlərlə ortada fırlanan xotirma іnşimi kəsikləri ilə almazla dərilənmişdir. Tetrahedradakı atomlar arasında 0,154 nm-ə çatır. Bütün əlaqələrin əhəmiyyəti eynidir. Bu rütbədə almazdakı atomlar daha da güclü şəkildə “doldurulur”. 20°C temperaturda almazın qalınlığı 3,515 q/sm3 olur. Bu, yoga şərabının sərtliyi ilə izah olunur. Diamant elektrik cərəyanını aparmaq üçün pisdir.
1961-ci ildə Radyansk İttifaqına qrafitdən sintetik almaz istehsalı üçün əl işi verildi.
Almazların sənaye sintezi zamanı 1000 MPa təzyiqdə və 1500-dən 3000°C-ə qədər olan temperaturda vikoroz istehsal olunur. Proses katalizatorların iştirakı ilə həyata keçirilir, metal ola bilər, məsələn, Ni. Qurulmuş almazların əsas kütləsi kiçik kristallar və almaz mişarıdır.
Almaz, 1000 ° C-dən çox qızdırıldıqda, qrafitə çevrilir. 1750 ° C-də almazın qrafitə çevrilməsi sürətlidir.
Almaz quruluşu
2. Qrafit - boz-qara kristal nitq, metal parıltılı, nöqtə üzərində yağlı, sərtliyə görə kağızı bükmək mümkündür.
Qrafit kristallarındakı karbon atomları sp 2-hibridləşmə stansiyasında yenidən alınır: dəri onlardan susid atomları ilə üç kovalent bağ əmələ gətirir. 120 ° dovnyuyut zv'yazkіv düz xətləri ilə Kuti mizh. Nəticədə, düzgün altı hissədən yaranan bir şəbəkə qurulur. Vіdstan mіzh suіdnіmi nüvə atomіv vіdnії sredinі sferası 0,142 nm olur. Dəri atomunun xarici sferasının dördüncü elektronu hibridləşmədə iştirak etməyən qrafitdə p-orbitalını tutur.
Karbonda hibrid olmayan elektron atomları kürə müstəvisinə perpendikulyar olaraq oriyentasiya olunur və bir-bir kəsişərək sağ əlli σ bağları əmələ gətirirlər. Kristal qrafitdəki susidni kürələri 0,335 nm məsafədə bir və eyni şəkildə tapılır və bir-biri ilə zəif bağlıdır, ən əsası Van der Waals qüvvələri. Buna görə də, qrafit aşağı mexaniki gücə malikdir və güc qüvvələrinin gücü ilə asanlıqla zolaqlara bölünür. Qrafitdəki karbon atomlarının topları arasındakı halqa çox vaxt metal xarakter daşıyır. Bu, qrafitin elektrik cərəyanını aparmaq üçün yaxşı olduğunu izah edir, lakin hələ də atdıqları kimi o qədər də yaxşı deyil.
Qrafit quruluşu
Qrafitin fiziki gücü düz xətlər - karbon atomlarının perpendikulyar və paralel topları üçün kəskin şəkildə fərqlənir.
Təkrar giriş olmadan qızdırıldığında, qrafit 3700 ° C-ə qədər gündəlik dəyişiklikləri bilmir. Göstərilən temperatura görə şərablar dalğalanır, ərimir.
Parça qrafit, havaya çıxışı olmayan elektrik sobalarında 3000 ° C-də daş yununun ən qısa siniflərindən əldə edilir.
Qrafit geniş temperatur və təzyiq diapazonunda termodinamik cəhətdən sabitdir, buna görə də standart kömür dəyirmanı kimi qəbul edilir. Qrafitin qalınlığı 2265 q/sm3 təşkil edir.
3. Karbіn - qara rəngli kristal toz. Kristal quruluşunda karbon atomları xətti lanslarda çəkilmiş tək və üçlü bağlarla bağlanır.
−С≡С−С≡С−С≡С−
Qiunun çıxışı V.V. Korşak, A.M. Sladkovim, V.I. Kasatochkinim, Yu.P. Kudryavtsev XX əsrin 60-cı illərində.
İllərlə sübut edilmişdir ki, karbin müxtəlif formalarda istifadə oluna bilər və bəzi karbonlu atomlarda poliasetilen, eləcə də polikumulen lansetləri intiqam alır və asma halqalarla bağlanır:
C=C=C=C=C=C=
Təbiətdəki son bilik karbini meteorit ağzındadır.
Karabin güc keçiricisi kimi istifadə edilə bilər; Karbinin fiziki gücünün kristal məhlulunda müxtəlif növ birləşmələrdən və karbon atomları ilə lansların çəkilməsinin müxtəlif üsullarından istifadə edildiyinə görə, onlar geniş diapazonda dəyişə bilirlər. Giriş olmadan qızdırıldığında 2000 C-dən çox olur, karbin sabitdir, 2300 C-yə yaxın temperaturda qrafitə keçmək mümkündür.
Təbii kömür iki izotopdan ibarətdir
(98,892%) və (1,108%). Bundan əlavə, atmosferdə bir yol parçası olan radioaktiv izotopun əhəmiyyətsiz evləri aşkar edilmişdir.Əvvəllər onlar hörmət edirdilər ki, vugillya, his və koks kəndi təmiz kömür anbarına yaxındır və almaz və qrafitdə güc uğrunda mübarizə aparır, kömürün müstəqil alotropik modifikasiyasıdır (“amorf kömür”). Bununla belə, müəyyən edilmişdir ki, nitq ən kristal hissəciklərdən ibarətdir və karbon atomları qrafit kimi bağlanır.
4. Vugilla - incə detallı qrafit. giriş poіtrya olmadan term_chnomu rozladann_ vugletsev_snyh poluk at Utvoryuєєtsya. Vogillya otrimannya üsulunun otrimant qoxusuna görə köhnəlmiş şəkildə hakimiyyətə böhtan atılmalıdır. Davam edin və güclərinə vurduqları kiçik evlərdən qisas alın. Vugіllyanın ən vacib növləri kok, kənd vugіllya, hisdir.
Koks havaya çıxışı olmayan daş vugill qızdırılması hər saat çıxacaq.
Ağacın havaya çıxmadan qızdırılması zamanı vugillya kəndi məskunlaşır.
Soot incə qrafit kristal tozdur. Utvoryuetsya karbohidratlarda (təbii qaz, asetilen, skipidar və s.) Orta dərəcədə havaya çıxışı ilə yandıqda.
Daha aktiv kömür - məsaməli sənaye adsorbentləri, daha əhəmiyyətlisi kömürlə əmələ gəlir. Bərk qazların və nitqlərin səthində adsorbsiyaya gil deyilir. Sərt palitraları rədd etmək üçün aktiv Vugille (torf, Kam'yanny Vugille'nin qəhvəyi tonu, antrasit), yogo re-crosser məhsulunun ağacı (kənd vugille, Tirsi, kağız canlıların vidkhodyv), viddhodiw shkiyrya, material. məxluqun məxluqu və Fond fərziyyəsinə. Yüksək mexaniki güc yayan vougillya kokos və digər dağların qabıqlarından, meyvə qotazlarından titrəyir. Kömürün strukturu bütün genişlənmələrin məsamələri ilə təmsil olunur, tək kütlədə və ya həcmdə qranullarda mikroməsamələrin əvəzinə proteadsorbsiya qabiliyyəti və adsorbsiya konsistensiyası göstərilir. Aktiv karbon lifinin meydana gəlməsi ilə xarici material təkrar giriş olmadan istilik emalına məruz qalır, bunun nəticəsində su və tez-tez qatran görünür. Bu zaman vogillin iri məsaməli strukturu qurulur. Mikrogözenekli quruluşu aradan qaldırmaq üçün aktivləşdirmə ya oksidləşdirici qaz və ya buxarla, ya da kimyəvi reagentləri emal etməklə həyata keçirilə bilər.
Təyinat
Vuqletlər- Dövri Cədvəlin altıncı elementi. Təyinat - Latın dilindən "carboneum". Başqa bir dövrdə köklənmə, IVA qrupu. Qeyri-metallara uzanın. Nüvənin yükü 6-a qədərdir.
Kömür təbiətdə pulsuz düşərgədə olduğu kimi, rəqəmlərə baxanda da tapılır. Vilniy vuglets almaz və qrafit kimi görünən zaustrichaetsya. Vikopny vugillya cinayəti, Yerin zirvələrində böyük neft alışları var. Yer qabığında əzəmətli sümüklərdə karbon turşusu, xüsusilə kalsium karbonat duzları var. Zavodun yuxarı hissəsində karbon qazı var. Nareşti, böyüyən və canlı orqanizmlər nitqlərdən əmələ gəlir, onların işığında kömürlər öz taleyini alır. Beləliklə, bu element Yerdəki ən geniş elementlərdən biridir, baxmayaraq ki, yer qabığında ümumi işıq miqdarı yalnız təxminən 0,1% (ağırlıq) təşkil edir.
Karbonun atom və molekulyar kütləsi
Nitqin görünən molekulyar çəkisi (M r) müəyyən bir molekulun kütləsinin karbon atomunun kütləsinin 1/12-dən və elementin görünən atom kütləsindən (A r) neçə dəfə çox olduğunu göstərən rəqəmdir. ) kimyəvi element atomlarının orta kütləsinin bir karbon atomunun 1/12 kütləsindən bir neçə dəfə çox olmasıdır.
Sərbəst dəyirmandakı qırıqlar monoatomik molekulların görünüşündə kömürdür, atom və molekulyar çəkilərin dəyərləri dəyişir. Qoxusu 12.0064-ə qədərdir.
Karbonun alotropiyası və alotropik modifikasiyası
Sərbəst dəyirmanda kömür kub və altıbucaqlı (lonsdaleit) sistemlərdə kristallaşan almaz və altıbucaqlı sistemə qədər uzanan qrafit kimi görünür (şək. 1). Belə ki, bir vugіllya kəndi kimi bir kömür yaratmaq, koks və his bir nizamsız strukturu biçmək. Həmçinin, sintetik yolla aradan qaldırılan alotropik modifikasiyalar - ce karbin və polikumulen - C=C və ya C=C= tipli xətti nayza polimerlərindən ilhamlanan karbonda fərqlənir.
Mal. 1. Kömürün alotrop modifikasiyaları.
Kömürün alotropik modifikasiyaları da var ki, onları belə adlandırmaq olar: qrafen, fulleren, nanoborular, nanoliflər, astralin, kömür, nəhəng nanoborular; amorf kömür, kömür nanobudsları və kömür nanofoam.
Karbon izotopları
Təbiətdə karbon 12 C (98,98%) və 13 C (1,07%) iki sabit izotopda mövcuddur. Son kütləvi rəqəmlər cəmi 12 və 13-dür. Karbon 12 C izotopu üçün atomun nüvəsi altı proton və altı neytrona, 13 C izotopu üçün isə eyni sayda proton və beş neytrona bərabərdir.
Biz eyni parçalanma müddəti 5730 ilə bərabər olan bir parça (radioaktiv) karbon 14 C izotopundan istifadə edirik.
Kömürlərdə iony
Atomun eyni enerji səviyyəsində mən є chotiri elektronlarını karbonlaşdırıram, yakі є valent:
1s 2 2s 2 2p 2 .
Kimyəvi qarşılıqlı müharibə vasitəsilə kömür öz valent elektronlarını sərf edə bilər, tobto. donor olmaq və başqa bir atomdan elektron qəbul etmək üçün müsbət yüklü iona çevrilmək, tobto. qəbuledici olun və mənfi yüklü iona çevrilin:
0 -2e → 2+ ;
0 -4e → 4+ ;
0 +4e → 4- .
Molekul və atom
Sərbəst düşərgədə karbon monoatomik molekulların C gözündə mövcuddur. Gəlin karbonun atomunu və molekulunu xarakterizə edən əməllərin gücünü təqdim edək:
Kömür əridin
Bütün dünyada ən çox yayılmış kömür ərintisi polad və çavundur. Polad - ce kömür ilə metal tökmə, kömür əvəzinə, 2% -dən çoxdur. Chavunіdə (həmçinin kömür ilə şoran ərintisi) kömür əvəzinə daha çox - 2 ilə 4% arasında.
Tapşırıqların həllini tətbiq edin
KÖK 1
| menecer | Bu obsyag karbon oksidi (IV) evlərin 0,1 kütlə hissəsini əhatə edə bilən 500 q vapnyak qaynadılan zaman görünür (n.o.). |
| Həll | Vipal Vapnyakın bərabər reaksiyasını yazaq: CaCO 3 \u003d CaO + CO 2 -. Biz təmiz vapnyakın kütləsini bilirik. Birinci yarım üçün, evsiz kütlənin birinci yarısı üçün əhəmiyyətlidir: w aydın (CaCO 3) = 1 - w çirk = 1 - 0,1 = 0,9. m şəffaf(CaCO 3) = m(CaCO 3) xw şəffaf(CaCO 3); m şəffaf (CaCO 3) \u003d 500 × 0,9 \u003d 450 q. Razrahuyemo bir vapnyak üçün çox danışır: n (CaCO 3) \u003d m şəffaf (CaCO 3) / M (CaCO 3); n (CaCO 3) \u003d 450/100 \u003d 4,5 mol. Bərabər reaksiya n(CaCO 3) :n(CO 2) = 1:1, həmçinin n (CaCO 3) \u003d n (CO 2) \u003d 4,5 mol. Todi, gördüyünüz karbon oksidi (IV) daha baha olacaq: V(CO 2) \u003d n(CO 2) × V m; V (CO 2 ) \u003d 4,5 × 22,4 \u003d 100,8 litr. |
| Vidpovid | 100,8 l |
KÖK 2
| menecer | 11,2 q kalsium karbonatı neytrallaşdırmaq üçün nə qədər dəyişmək lazımdır, 0,05 kütlə şaxtası və ya 5% xlorlu su ilə nə etmək olar? |
| Həll | Kalsium karbonatın xlorlu su ilə neytrallaşdırılmasının bərabər reaksiyasını yazırıq: CaCO 3 + 2HCl \u003d CaCl 2 + H 2 O + CO 2 -. Kalsium karbonat üçün nitqin miqdarını bilirik: M(CaCO 3 ) = Ar (Ca) + Ar (C) + 3×A r (O); M(CaCO 3) \u003d 40 + 12 + 3 × 16 \u003d 52 + 48 \u003d 100 q / mol. n (CaCO 3) \u003d m (CaCO 3) / M (CaCO 3); n (CaCO 3) \u003d 11,2 / 100 \u003d 0,112 mol. n (CaCO 3) reaksiyasına bərabər etibarlıdır: n (HCl) = 1: 2, həmçinin n(HCl) \u003d 2 × n (CaCO 3) \u003d 2 × 0,224 mol. Əhəmiyyətli odur ki, nitq kütləsi rozchinidə intiqam alınmalı olan xlorlu sudur: M(HCl) \u003d Ar (H) + Ar (Cl) \u003d 1 + 35,5 \u003d 36,5 q / mol. m (HCl) \u003d n (HCl) × M (HCl) \u003d 0,224 × 36,5 \u003d 8,176 p. Rozrahuyemo masu rozchin xlorlu su: m həll (HCl) = m (HCl) × 100 / w (HCl); m həll (HCl) = 8.176 × 100/5 = 163.52 p. |
| Vidpovid | 163,52 q |