У 11 завданні продовжується тема хімічних властивостей, цього разу вже кислот та основ.
Теорія до завдання №11 ОДЕ з хімії
Кислоти
Нагадаю, що кислоти - це хімічні сполуки, що дисоціюють на протони (H+). Приклади найпростіших кислот – соляна (HCl), сірчана (H2SO4), азотна (HNO3).
Основи
Основи ж - речовини, що дисоціюють на гідроксид іони (OH-).
Найпростішими прикладами є їдкий калій та натрій (KOH та NaOH). Їдкими їх називають, до речі, недарма. Вони дійсно роз'їдають і щипають при попаданні на шкіру. Тому небезпека їх не варто недооцінювати.
Отже, перейдемо до розгляду хімічних властивостей цих класів.
Хімічні властивості кислот
Класифікацію кислот ми розглядали у . Я рекомендую перед подальшим вивченням хімічних властивостей згадати класифікацію кислот загального розуміння.
Отже, перейдемо до розгляду властивостей кислот:
- реакція з основними оксидами: як приклад наведена реакція оксиду кальцію з соляною кислотою. У цій реакції продуктами є сіль - хлорид кальцію, яким посипають дороги в ожеледицю, і вода, яку ми п'ємо щодня.
- реакція з амфотерними оксидаминаприклад, оксидом цинку:
- реакція кислот із лугаминосить назву нейтралізації. Як приклад, наведена реакція їдкого натру із соляною кислотою, продуктами є сіль (у даному прикладі кухонна) та вода.
- обмінні реакції із солями, якщо результаті реакції утворюється нерозчинне речовина чи газ. Як приклад наведена реакція хлориду барію з сірчаною кислотою, в результаті якої утворюється осад сульфату барію та летючий хлороводень.
- реакція з нерозчинними основами, наприклад гідроксиду міді із сірчаною кислотою:
- витіснення слабких кислот із розчинів їх солей, наприклад солей фосфорної кислоти хлороводневою кислотою:
- реакція з металами, що стоять у ряду напруги до водню - приклад - реакція магнію з соляною кислотою:
Хімічні властивості основ
Перед вивченням хімічних властивостей основ, корисно згадати класифікацію основ .
Отже, перейдемо до аналізу хімічних властивостей основ:
- вищенаведена реакція з кислотами - реакція нейтралізації
- реакція з амфотерними основами, наприклад, гідроксидом цинку та алюмінію:
- реакція з кислотними оксидамиз утворенням солі та води. Приклад - реакція їдкого натрію з оксидом кремнію (травлення скла):
- обмінні реакції із солямиякщо утворюється осад або газ (аміак). Приклад - реакція гідроксиду барію з сульфатом натрію:
Розбір типових варіантів завдань ОДЕ з хімії
Перший варіант завдання
У реакцію із соляною кислотою вступає:
- нітрат срібла
- нітрат барію
- срібло
- оксид кремнію
Розглянемо кожен випадок:
- Соляна кислота та нітрат срібла. Оскільки нітрат срібла - сіль, обмінна реакція можлива, якщо препарат реакції осад чи газ. Як продукт може утворитися азотна кислота (розчинна) і хлорид сріблоа (нерозчинний - білий сирний осад ). Значить, реакція можлива, і відповідь нам підходить.
- Нітрат барію та соляна кислота. Продукти цієї реакції обміну розчинні (азотна кислота та хлорид барію), тому реакція не йде .
- Срібло стоїть у ряді напруг після водню, тому не реагує з кислотами-неокислювачами в.
- Оксид кремнію - кислотний оксид і з кислотами не реагує .
Кислий смак, дія на індикатори, електрична провідність, взаємодія з металами, основними та амфотерними оксидами, основами та солями, утворення складних ефірів зі спиртами – ці властивості є загальними для неорганічних та органічних кислот.
1. У воді кислоти дисоціюють на катіони водню та аніони кислотних залишків, наприклад:
Розчини кислот змінюють колір індикаторів: лакмусу – у червоний, метилового помаранчевого – у рожевий, колір фенолфталеїну не змінюють.
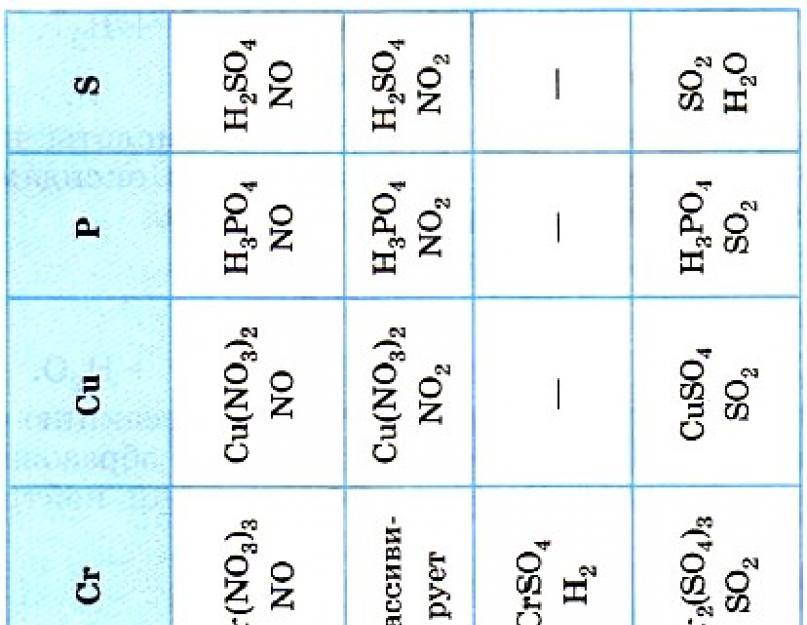
2. Розчини кислот реагують з металами, що стоять в електрохімічному ряду напруг лівіше водню, за дотримання ряду умов, найважливішим з яких є утворення в результаті реакції розчинної солі. Розглядаючи цю властивість неорганічних та органічних кислот, наголосимо, що взаємодія HNO 3 і Н 2 SO 4 (конц.) з металами (табл. 19) протікає інакше, але ці особливості зазначених кислот будуть пояснені дещо пізніше.
Таблиця 19
Продукти взаємодії
простих речовин з азотною та сірчаною кислотами

3. Неорганічні та органічні кислоти взаємодіють з основними та амфотерними оксидами за умови, що утворюється розчинна сіль:

4. І ті та інші кислоти вступають у реакцію з основами. Багатоосновні кислоти можуть утворити як середні, так і кислі солі (це реакції нейтралізації):

5. Реакція між кислотами та солями йде лише в тому випадку, якщо утворюється газ або осад:

Взаємодія фосфорної кислоти Н 2 РO 4 з вапняком припиниться через утворення поверхні останнього нерозчинного осаду фосфату кальцію Са 3 (РO 4) 2 .
6. Складні ефіри утворюють не тільки органічні кислоти відповідно до загального рівняння:

але й неорганічні кислоти, наприклад азотна та сірчана:
Аналогічна реакція за участю двох і трьох гідроксогруп целюлози при її нітруванні призводить до отримання складних ефірів: ді-і тринітроцелюлози - необхідних речовин для виробництва бездимного пороху.
Водночас окремі представники мінеральних та органічних кислот мають особливі властивості.
Особливості властивостей азотної HNO 3 і концентрованої сірчаної Н 2 SO 4 (конц.) кислот обумовлені тим, що при їх взаємодії з простими речовинами (металами та неметалами) окислювачами виступатимуть не катіони Н+, а нітрат-і сульфат-іони. Логічно очікувати, що в результаті таких реакцій утворюється не водень Н 2 , а виходять інші речовини: обов'язково сіль і вода, а також один із продуктів відновлення нітрат- або сульфат-іонів залежно від концентрації кислот, положення металу в ряді напруг та умов реакції (температури, ступеня подрібненості металу тощо).
Слід зазначити, що третій продукт реакції металів із цими кислотами часто утворюється у «букеті» - суміші коїться з іншими продуктами, але у таблиці 19 вказали переважаючі продукти.
Ці особливості хімічної поведінки HNO 3 та Н 2 SO 4 (конц.) наочно ілюструють тезу теорії хімічної будови про взаємний вплив атомів у молекулах речовин. Його можна простежити і на прикладі властивостей органічних кислот, наприклад оцтової та мурашиної.
Оцтова кислота СН 3 СООН, як і інші карбонові кислоти містить у молекулі вуглеводневий радикал. У ньому можливі реакції заміщення атомів водню атомами галогенів:
Під впливом атомів галогену у молекулі кислоти її ступінь дисоціації сильно підвищується. Наприклад, хлороцтова кислота майже в 100 разів сильніша за оцтову (чому?).
Мурашина кислота НСООН, на відміну оцтової, немає у молекулі вуглеводневого радикала. Замість нього вона містить атом водню, а тому є речовиною з двоїстою функцією – альдегідокислотою і, на відміну від інших карбонових кислот, дає реакцію «срібного дзеркала»:

Вугільна кислота, що утворюється, Н 2 СO 3 розпадається на воду і вуглекислий газ, який в надлишку аміаку перетворюється на гідрокарбонат амонію.
Кислотаминазиваються складні речовини, до складу молекул яких входять атоми водню, здатні заміщатися або обмінюватися на атоми металу та кислотний залишок.
За наявністю або відсутністю кисню в молекулі кислоти поділяються на кисневмісні(H 2 SO 4 сірчана кислота, H 2 SO 3 сірчиста кислота, HNO 3 азотна кислота, H 3 PO 4 фосфорна кислота, H 2 CO 3 вугільна кислота, H 2 SiO 3 кремнієва кислота) та безкисневі(HF фтороводородна кислота, HCl хлороводнева кислота (соляна кислота), HBr бромоводнева кислота, HI іодоводородна кислота, H 2 S сірководнева кислота).
Залежно від числа атомів водню в молекулі кислоти кислоти бувають одноосновні (з 1 атомом Н), двоосновні (з 2 атомами Н) та триосновні (з 3 атомами Н). Наприклад, азотна кислота HNO 3 одноосновна, оскільки в молекулі її один атом водню, сірчана кислота H 2 SO 4 – двоосновна і т.д.
Неорганічних сполук, що містять чотири атоми водню, здатні заміщатися на метал, дуже мало.
Частина молекули кислоти без водню називається кислотним залишком.
Кислотні залишкиможуть складатися з одного атома (-Cl, -Br, -I) - це прості кислотні залишки, а можуть - із групи атомів (-SO 3, -PO 4, -SiO 3) - це складні залишки.
У водних розчинах при реакціях обміну та заміщення кислотні залишки не руйнуються:
H 2 SO 4 + CuCl 2 → CuSO 4 + 2 HCl
Слово ангідридозначає безводний, тобто кислота без води. Наприклад,
H 2 SO 4 – H 2 O → SO 3 . Безкисневі кислоти ангідридів не мають.
Свою назву кислоти одержують від назви утворює кислоту елемента (кислотообразователя) з додаванням закінчень «ная» і рідше «ва»: H 2 SO 4 – сірчана; H 2 SO 3 – вугільна; H 2 SiO 3 - кремнієва і т.д.
Елемент може утворити кілька кисневих кислот. У разі зазначені закінчення у назві кислот будуть тоді, коли елемент виявляє високу валентність (у молекулі кислоти великий вміст атомів кисню). Якщо елемент виявляє нижчу валентність, закінчення в назві кислоти буде «зайвою»: HNO 3 – азотна, HNO 2 – азотиста.
Кислоти можна одержувати розчиненням ангідридів у воді.У разі, якщо ангідриди у воді не розчиняються, кислоту можна отримати дією іншої сильнішої кислоти на сіль необхідної кислоти. Цей спосіб характерний як для кисневих, так і безкисневих кислот. Безкисневі кислоти отримують так само прямим синтезом з водню і неметалу з подальшим розчиненням отриманої сполуки у воді:
H 2 + Cl 2 → 2 HCl;
H2+S → H2S.
Розчини отриманих газоподібних речовин HCl і H 2 S є кислотами.
За звичайних умов кислоти бувають як у рідкому, і у твердому стані.
Хімічні властивості кислот
Розчини кислот діють на індикатори. Усі кислоти (крім кремнієвої) добре розчиняються у воді. Спеціальні речовини – індикатори дозволяють визначити наявність кислоти.
Індикатори – це речовини складної будови. Вони змінюють своє забарвлення залежно від взаємодії з різними хімічними речовинами. У нейтральних розчинах - вони мають одне забарвлення, у розчинах основ – інше. При взаємодії з кислотою вони змінюють своє забарвлення: індикатор метиловий оранжевий забарвлюється червоний, індикатор лакмус – теж червоний.
Взаємодіють із основами з утворенням води та солі, в якій міститься постійний кислотний залишок (реакція нейтралізації):
H 2 SO 4 + Ca(OH) 2 → CaSO 4 + 2 H 2 O.
Взаємодіють із заснованими оксидами з утворенням води та солі (реакція нейтралізації). Сіль містить кислотний залишок тієї кислоти, яка використовувалась у реакції нейтралізації:
H 3 PO 4 + Fe 2 O 3 → 2 FePO 4 + 3 H 2 O.
 Взаємодіють із металами.
Для взаємодії кислот із металами повинні виконуватися деякі умови:
Взаємодіють із металами.
Для взаємодії кислот із металами повинні виконуватися деякі умови:
1. метал має бути досить активним по відношенню до кислот (у ряду активності металів він повинен розташовуватися до водню). Чим лівіше знаходиться метал у ряді активності, тим інтенсивніше він взаємодіє з кислотами;
2. кислота має бути досить сильною (тобто здатною віддавати іони водню H+).
При протіканні хімічних реакцій кислоти з металами утворюється сіль і виділяється водень (крім взаємодії металів з азотною та концентрованою сірчаною кислотами):
Zn + 2HCl → ZnCl 2 + H 2;
Cu + 4HNO 3 → CuNO 3 + 2 NO 2 + 2 H 2 O.
Залишились питання? Хочете знати більше про кислоти?
Щоб отримати допомогу репетитора – зареєструйтесь.
Перший урок – безкоштовно!
сайт, при повному або частковому копіюванні матеріалу посилання на першоджерело обов'язкове.
Щоб скористатися попереднім переглядом презентацій, створіть собі обліковий запис Google і увійдіть до нього: https://accounts.google.com
Підписи до слайдів:
Викладач: Грудініна Тетяна Вікторівна Тема уроку: Кислоти
Цілі уроку: Узагальнити та закріпити знання про класифікацію, номенклатуру, властивості органічних та неорганічних кислот Навчити пояснювати спільність хімічних властивостей неорганічних та органічних кислот Навчити правильно складати рівняння реакцій у молекулярному та іонному вигляді
Визначення кислот Кислоти у природі Класифікація кислот Хімічні властивості кислот Отримання кислот Застосування кислот План уроку:
Кислотами називаються електроліти, при дисоціації яких як катіони утворюються тільки гідратовані іони водню (H 3 O +). 1. Визначення кислот
У 1923р. було запропоновано протолітичну теорію Бернстедом-Лаурі. Кислоти – це молекули чи іони, які є донорами катіонів водню Н+. Катіон Н+ називається протоном, тому теорія називається протолітичною. Відповідно до електронної теорії кислот та основ американського хіміка Г.М. Льюїса кислоти – це реагенти, які є акцепторами електронів.
2. Кислоти в природі Кислотні дощі (азотна, сірчана кислоти) Кислоти в їжі (яблучна, щавлева, лимонна, молочна, олійна, кавова та інші) «Хімічна зброя» тварин і рослин. Мураха при укусі впорскує отруту, що містить мурашину кислоту. Її використовує і кропива.
Павук педипальпіда стріляє у своїх ворогів цівкою, що складається з оцтової кислоти. Плоскі тисячіножки використовують отруту страшнішу - пари синильної кислоти. Мухомори використовують іботенову кислоту та її складну сполуку – мусцимол. Руйнування гірських порід та утворення ґрунту. Лишайники можуть виділяти кислоти, здатні перетворювати граніт на потерть.
Вітаміни: аскорбінова, фолієва, оротова, пангамова, нікотинова та інші. Гіалуронова кислота – основний компонент мастила суглобів. Амінокислоти утворюють білки. Соляна кислота у шлунку активує фермент пепсиноген, що розкладає білки їжі, а також знищує гнильну мікрофлору. Кислоти в людини.
За складом: Кисень містять: Н NO 3 , H 2 SO 3 ; Безкисневі: HCl, H2S. За основністю: (основність кислоти визначається числом катіонів, що утворюються при дисоціації). Одноосновні: HBr, HNO 2; Двоосновні: H 2 S , H 2 SO 4; Багатоосновні: H 3 PO 4 . Завдання. Назвати кислоти і дати їм класифікацію: HClO3, H2S, H3PO4, HBr. 3. Класифікація кислот:
Взаємодія з металами, розташованими в електрохімічному ряді напруги металів до водню. 4. Хімічні властивості кислот: окислювач, відновлення відновник, окислення ацетат магнію
Взаємодія з основними та амфотерними оксидами. Самостійно:
Взаємодія з розчинними та нерозчинними основами. Можуть утворювати середні та кислі солі. Це реакції нейтралізації. Самостійно: 1 моль (надлишок) 1 моль гідросульфат натрію (кисла сіль) 1 моль 2моль сульфат натрію (середня сіль)
Сильна кислота здатна витіснити слабку кислоту навіть з нерозчинної солі. Самостійно:
Соляна кислота Для розчинення окалини та іржі при нікелюванні, хромуванні, цинкуванні тощо. сталевих та чавунних виробів Для зняття накипу в парових котлах Плавікова кислота HF. Просочують деревину для запобігання термітам та іншим комахам. Застосування кислот
Сірчана кислота Для виробництва фосфорних та азотних добрив У виробництві вибухових речовин Штучних волокон Барвників Пластмас Заливка акумуляторів
Азотна кислота Виробництво азотних добрив Вибухових речовин Лікарських речовин Барвники Пластмаси
Завдання 1. Напишіть формули та дайте характеристику кислотам на основі їхньої класифікації: кремнієва кислота, плавикова кислота. Завдання 2. З якими речовинами реагуватиме фосфорна кислота: К, SO 2 , Na 2 SO 4 , Na 2 CO 3 , MgO , Ag , Ba (OH) 2 . Закріплення
Завдання 1. H 2 SiO 3 – кисневмісна, двоосновна, нерозчинна, слабка HF – безкиснева, одноосновна, розчинна, слабка Завдання 2. Відповіді
Дякую за урок!!!
Це речовини молекулярної будови. Атоми у молекулах кислот пов'язані ковалентними полярними зв'язками. Чим більше поляризований зв'язок між атомом водню, здатним відщеплюватися, та електронегативним атомом (кисню, сірки або атомом галогену), тим більше цей зв'язок схильний дисоціювати гетеролітичним шляхом. А значить, тим більше в розчині буде катіонів водню і тим кисліше буде середовище. Велике значення має не тільки полярність, а й поляризованість зв'язку. Поляризованість - це здатність зв'язку поляризуватися під дією певних реагентів. Наприклад, молекули води.
Класифікація кислот
Класифікація кислот за вмістом атомів кисню, за кількістю атомів водню, за розчинністю та іншими ознаками. Див Табл. 1.
|
Ознаки класифікації |
Групи кислот |
приклад |
|
Наявність кисню |
||
|
Безкисневі |
||
|
Основність (кількість атомів водню, здатних заміщатися на метал) |
Одноосновні |
|
|
Двоосновні |
||
|
Триосновні |
||
|
Розчинність |
Розчинні |
|
|
Нерозчинні |
||
|
Леткість |
||
|
Нелеткі |
||
|
Ступінь електролітичної дисоціації |
Н2SO4, HNO3, HCl |
|
|
Стабільність |
Стабільні |
H3PO4, Н2SO4, HCl |
|
Нестабільні |
1. Реакція із металами.
Метали, розташовані у ряді напруг металів (Рис. 1.) до водню, витісняють водень із кислот.
Mg + 2HCl = MgCl2 + H2
З концентрованою азотноїі сірчанийкислотою реакції йдуть за рахунок аніонного залишку. Водень не виділяється. Мал. 2.
Cu + 4HNO3(кінець) = Cu (NO3)2 + 2NO2 + H2O
Cu + 2H2SO4(кінець) = Cu SO4 + SO2 + H2O
2. Реакція з основними та амфотерними оксидамиз утворенням солі та води.
K2O+ HNO3 = KNO3 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
3. Реакція із солями.Кислоти реагують з розчинами солей, якщо результаті реакції один із продуктів випадає в осад, оскільки утворення нерозчинних сполук зміщує рівновагу вправо і робить її практично незворотною.
Н2SO4 + BaCl2 = BaSO4↓ +2 HCl
H2CO3 + BaCl2 = BaCO3↓ +2 HCl
4. Реагують з основами та амфотерними гідроксидами.
КОН + HNO3 = KNO3 + H2O
Al(ON)3 + 3HCl = AlCl3 + 3H2O
NaOH + HNO3 = NaNO3 + H2O
5. Виявлення кислот з допомогою кислотно-основних індикаторів.
У кислому середовищі лакмус набуває червоного забарвлення. Метиловий помаранчевий – червоний, а фенолфталеїновий – безбарвний.
Основні способи одержання кислот
1. Безкисневі кислоти можна отримати із простих речовин.
2. Кисень містять кислоти можна отримати гідратацією відповідних кислотних оксидів.
N2O5 + H2O → 2HNO3
SO3 + H2O → H2SO4
3. Отримання кислот витісненням слабких кислот сильними, летких – нелетючими, розчинних – нерозчинними. Наприклад, сильна соляна кислота витісняє слабку оцтову розчинів їх солей.
СH3COONa + HCl = CH3COOH + NaCl
NaСl (тв.) + H2SO4 = NaНSO4 + HCl
4. Кислоти можна отримати при гідроліз деяких солей або галогенідів.
Al2 S3 +6 H2O → 2Al(OH)3↓+ 3H2S
PCl5 + H2O → H3PO4 + 5HCl
Теорія кислот та основ Сванте Арреніуса. Вона ґрунтується на теорії електролітичної дисоціації. Відповідно до неї, кислоти - це речовини, що утворюють у водному розчині гідратовані іони водню та аніони кислотного залишку. А відповідно, основи - це речовини, що дисоціюють у водному розчині на катіони металу та аніони гідроксогрупи.
Теорія Бренстеда та Лоурі. Відповідно до цієї теорії, кислоти - це молекули чи іони, які у цій реакції є донорами протонів, а підстави - це молекули чи іони, які приймають протони, т. е. акцептори.
В органічній хімії існує теорія Льюїса. Кислота - це молекула або іон, що має вакантні валентні орбіталі, внаслідок чого вони здатні приймати електронні пари, наприклад, водні іони, іони металів, деякі оксиди, а також ряд солей. Кислоти Льюїса, які не містять іонів водню, називаються апротонними. Протонсодержащие кислоти розглядаються, як окремий випадок класу кислот.
Основа з теорії Льюїса - це молекула або іон, здатні бути донорами електронних пар: всі аніони, аміак, аміни, вода, спирти, галогени.
Приклад реакції між кислотами та основами Льюїса.
AlCl3+ Cl- → Cl4-
Ця взаємодія є основою галогенування ароматичних сполук.
Теорія Усановича. У цій теорії кислота - це частка, яка здатна відщеплювати катіони або приєднувати аніони. Відповідно, підстава навпаки. Цією теорією користуються дуже рідко, тому що вона вийшла надто загальною. Відповідно до неї, будь-які взаємодії за участю іонів можна звести до кислотно-основних. А це не дуже зручно.
Для кількісної характеристики того, як кислота дисоціює на іони, крім поняття ступеня електролітичної дисоціації використовують поняття константа дисоціації. Константа дисоціації - це вид константи рівноваги, яка показує схильність деякого великого об'єкта (кислоти, солі чи комплексного з'єднання) оборотно дисоціювати із заснуванням більш маленьких об'єктів. Константа дисоціації визначається як добуток концентрацій іонів у ступені їх стехіометричних коефіцієнтів, поділений на недисоційовану форму.
У разі дисоціації речовини з багатовалентними іонами, дисоціація відбувається східчасто. Для кожного ступеня існує власне значення константи дисоціації.
Приклад дисоціації триосновної борної кислотиH3 BO3 .
I ступінь: Н3ВО3 ↔ Н+ + Н2ВО3-
I ступінь: Н2ВО3- ↔ Н+ + НВО32-
I ступінь: НВО32- ↔ Н+ + ВО33-
Вираз констант дисоціації по кожному з цих ступенів виглядатиме так:
![]()
![]()
![]()
Зі значення констант дисоціації робимо висновок, що багатоосновні речовини в основному дисоціюють по першому ступені.
В організмі людини велику роль відіграють три неорганічні кислоти. Це - фосфорна кислота, вугільна та соляна. Фосфорна кислотавходить до складу буферних систем крові. Буферними називають такі розчини, які при додаванні невеликих кількостей кислот або основ змінюють свій водневий показник рН. Ці системи потрібні для того, щоб підтримувати кислотність крові у певному та досить вузькому інтервалі. Залишки фосфорної кислоти входять до залишків багатьох біологічно активних речовин, наприклад нуклеїнових кислот та багатьох ферментів. Наші кістки складаються з гідроксиду фосфату кальцію Сa10(PO4)6(OH)2 або гідроксіапатиту кальцію, а зуби включають фторапатит кальцію Сa10(PO4)6F2. Мал. 8.


Вугільнакислота також належить до складу буферних систем крові. За рахунок дії легень такі системи можна швидко і легко регулювати, і можна варіювати кількість вуглекислого газу в крові.
Солянакислота міститься у шлунковому соку. Вона сприяє денатурації та набухання білків, що полегшує їх подальше розщеплення ферментами. Вона створює кисле середовище, необхідне дії ферментів. Вона відповідальна за антибактеріальне середовище шлункового соку.
ДЖЕРЕЛА
джерело відео - https://www.youtube.com/watch?v=KqOwvPrN8W4
джерело презентації - http://ppt4web.ru/khimija/kisloty5.html