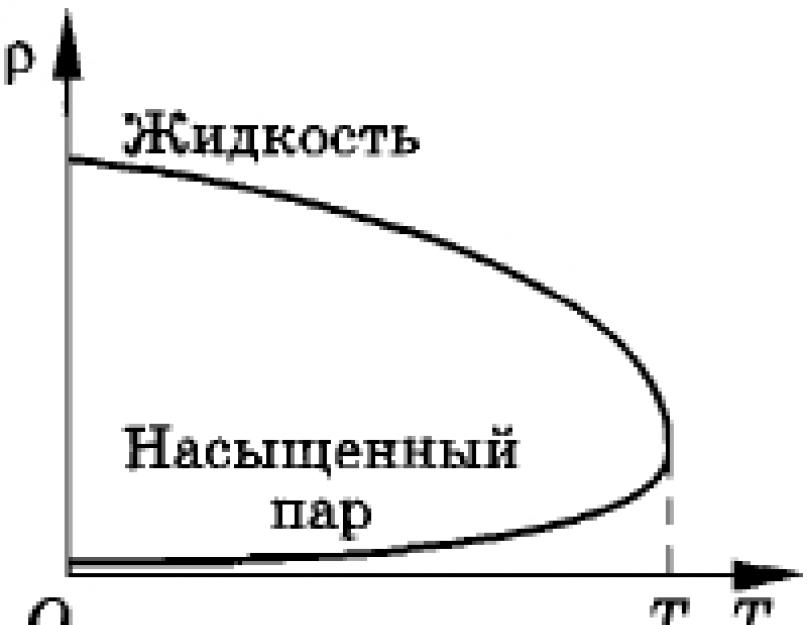
За досить високих температур горизонтальна ділянка ізотерми реального газу (див. рис. 6.4) стає зовсім короткою і при певній температурі звертається в точку (на рис. 6.4 - точка К). Цю температуру називають критичною.
Критичною називається температура, при якій зникають відмінності у фізичних властивостях між рідиною та парою, що перебувають з нею в динамічній рівновазі. Кожна речовина має критичну температуру. Наприклад, критична температура для вуглекислоти С2 дорівнює t K = 31 °С, а для води - t K = 374 °С.
Критичний стан
Стан, що відповідає точці К, до якої звертається горизонтальна ділянка ізотерми при температурі Т = Т к, називають критичним станом (критична точка). Тиск та обсяг у цьому стані називають критичними. Критичний тиск для вуглекислого газу дорівнює 7,4 10 6 Па (73 атм), а води 2,2 10 7 Па (218 атм). У критичному стані рідина має максимальний об'єм, а насичена пара – максимальний тиск.
Щільність рідини та її насиченої пари при критичній температурі
Ми вже зазначали, що при збільшенні температури зростає щільність насиченої пари (див. § 6.3). Щільність рідини, що знаходиться в рівновазі зі своєю парою, навпаки, зменшується внаслідок її розширення при нагріванні.
У таблиці 2 наведено значення щільності води та її насиченої пари для різних температур.
Таблиця 2
Якщо одному малюнку накреслити криві залежності щільності рідини та її насиченої пари від температури, то рідини крива піде вниз, а пари - вгору (рис. 6.6). При критичній температурі обидві криві зливаються, тобто щільність рідини стає рівною щільності пари. Відмінність між рідиною та парою зникає.

Мал. 6.6
Газ та пара
Ми багато разів вживали слова «газ» та «пар». Ці терміни виникли в ті часи, коли вважалося, що пара може бути перетворена на рідину, а газ немає. Після того, як усі гази були сконденсовані (див. § 6.7), для такої двоїстої термінології не залишилося підстав. Пара і газ - це те саме, з-поміж них принципової різниці немає. Коли говорять про пару якоїсь рідини, то зазвичай мають на увазі, що його температура менша за критичну і стисненням її можна перетворити на рідину. Тільки за звичкою ми говоримо про водяну пару, а не про водяний газ, про насичену пару, а не про насичений газ і т.д.
Експериментальне дослідження критичного стану
Експерименти з вивчення критичного стану виконав 1863 р. російський учений М. П. Авенаріус. Прилад, за допомогою якого можна спостерігати критичний стан (прилад Авенаріуса), складається з повітряної ванни (рис. 6.7) і запаяної скляної трубочки (ампули), що знаходиться всередині ванни, з рідким ефіром. Об'єм ампули (їй місткість) дорівнює критичному об'єму ефіру, налитого в трубочку. Простір над ефіром в ампулі заповнено насиченою парою ефіру.

Мал. 6.7
За допомогою газового пальника або іншого нагрівача повітряну ванну підігрівають. За станом ефіру спостерігають через скляне віконце у приладі.
При кімнатній температурі можна чітко бачити межу між рідиною та парою (рис. 6.8 а). У міру наближення до критичної температури об'єм рідкого ефіру збільшується, а межа розділу рідина – пара стає слабовираженою, нестійкою (рис. 6.8, б).

Мал. 6.8
При підході до критичного стану межа з-поміж них зникає зовсім (рис. 6.8, в).
При охолодженні з'являється туман, що заповнює всю трубочку (рис. 6.8, г). Це утворюються крапельки рідини. Далі вони зливаються разом, і знову виникає межа поділу між рідиною та парою (рис. 6.8, д).
Для досвіду обраний ефір, тому що він має порівняно низький критичний тиск (близько 36 атм). Критична температура його також невелика: 194 °С.
Якщо стискати газ, підтримуючи його температуру вище за критичну (див. рис. 6.4, ізотерма Т 3), причому, як і раніше, почати з дуже великих обсягів, то зменшення обсягу призведе до зростання тиску відповідно до рівняння стану ідеального газу. Однак якщо при температурі нижче критичної при певному тиску відбувалася конденсація пари, то тепер утворення рідини в посудині не буде. При температурі вище критичної газ не можна звернути в рідину за жодних тисків.
У цьому полягає основне значення поняття критичної температури.
Діаграма рівноважних станів газу та рідини
Ще раз повернемося до малюнку 6.4, на якому зображено ізотерми реального газу. З'єднаємо всі ліві кінці горизонтальних ділянок ізотерм, тобто ті точки, які відповідають закінченню конденсації насиченої пари та початку стиснення рідини. Вийде плавна крива, що закінчується в критичній точці К. На малюнку 6.9 це крива ART. Зліва від кривої АК, між нею та критичною ізотермою (ділянка ізотерми СК), розташована область, що відповідає рідкому стану речовини (на рис. 6.9 ця область виділена горизонтальною штрихуванням). Кожній точці цієї області відповідають параметри р, V і Т, що характеризують рідину стан теплової рівноваги.

Мал. 6.9
З'єднаємо тепер плавною кривою всі праві кінці горизонтальних ділянок ізотерм. Ця крива малюнку 6.9 теж закінчується у точці К. Дві лінії АК і ВК обмежують область, кожна точка якої відповідає стану рівноваги між рідиною і насиченою парою (на рис. 6.9 ця область виділена вертикальним штрихуванням). За винятком області рідкого стану та області рівноваги рідини з газом вся інша область відповідає газоподібному стану речовини. На малюнку 6.9 вона виділена косою штрихуванням.
В результаті вийшла діаграма рівноважних станів газу та рідини. Кожній точці на цій діаграмі відповідає певний стан системи: газ, рідина або рівновага між рідиною та газом.
При критичній температурі властивості рідини та насиченої пари стають невиразними. Вище критичної температури рідина не може існувати.
Строго кажучи, у цьому матеріалі ми коротко розглянемо не лише хімічні та фізичні властивості води в рідкому стані,а й властивості властиві їй загалом як такий.
Докладніше з властивостями води у твердому стані ви можете ознайомитись у статті — ВЛАСТИВОСТІ ВОДИ У ТВЕРДОМУ СТАНІ (читати →).
Вода - над-значуща речовина для нашої планети. Без неї на Землі життя неможливе, без нього не проходить жоден геологічний процес. Великий вчений і мислитель Володимир Іванович Вернадський у своїх роботах писав, що не існує такого компонента, значення якого могло б «порівнятися з нею за впливом на хід основних, найгрізніших геологічних процесів». Вода присутня не тільки в організмі всіх живих істот нашої планети, а й у всіх речовинах на Землі – у мінералах, у гірських породах… Вивчення унікальних властивостей води постійно відкриває нам нові й нові таємниці, задає нам нові загадки та кидає нові виклики.
Аномальні властивості води
Багато фізичні та хімічні властивості водидивують і випадають із загальних правил і закономірностей і є аномальними, наприклад:
- Відповідно до закономірностей, встановлених за принципом подібності, в рамках таких наук як хімія та фізика, ми могли б очікувати, що:
- вода закипатиме при мінус 70°С, а замерзатиме при мінус 90°С;
- вода не капатиме з кінчика крана, а литися тонким струмком;
- лід тонутиме, а не плаватиме на поверхні;
- у склянці води не розчинилося б більше кількох крупинок цукру.
- Поверхня води має негативний електричний потенціал;
- При нагріванні від 0 до 4°C (точніше 3,98°C) вода стискається;
- Викликає здивування висока теплоємність рідкої води;
Як уже зазначалося вище, в даному матеріалі ми перерахуємо основні фізичні та хімічні властивості води та зробимо до деяких із них короткі коментарі.
Фізичні властивості води
ФІЗИЧНІ ВЛАСТИВОСТІ – це властивості, які проявляються поза хімічними реакціями.
Чистота води
Чистота води – залежить від наявності в ній домішок, бактерій, солей важких металів … , для ознайомлення з інтерпретацією терміну ЧИСТА ВОДА за версією нашого сайту необхідно прочитати статтю ЧИСТА ВОДА (читати →).
Колір води
Колір води – залежить від хімічного складу та механічних домішок.
Наприклад наведемо визначення «Кольори моря», дане «Великою радянською енциклопедією».
Колір моря. Колір, що сприймається оком, коли спостерігач дивиться на поверхню моря, Колір моря залежить від кольору морської води, кольору неба, кількості та характеру хмар, висоти Сонця над горизонтом та ін.
Поняття Колір моря слід відрізняти від поняття колір морської води. Під кольором морської води розуміють колір, що сприймається оком при прямовисному огляді морської води над білим тлом. Від поверхні моря відбивається лише незначна частина падаючих неї світлових променів, решта їх частина проникає вглиб, де поглинається і розсіюється молекулами води, частинками завислих речовин і дрібними бульбашками газів. Відбиті і виходять з моря розсіяні промені і створюють Ц. м. Молекули води розсіюють найсильніше синій і зелені промені. Зважені частки майже однаково розсіюють усі промені. Тому морська вода з малою кількістю суспензій здається синьо-зеленою (колір відкритих частин океанів), а із значною кількістю суспензій - жовтувато-зеленою (наприклад, Балтійське море). Теоретична сторона вчення про Ц. м. розроблена В. В. Шулейкіним та Ч. В. Раманом.
Велика Радянська Енциклопедія. - М: Радянська енциклопедія. 1969-1978
Запах води
Запах води – чиста вода, як правило, не має запаху.
Прозорість води
Прозорість води - залежить від розчинених у ній мінеральних речовин та вмісту механічних домішок, органічних речовин та колоїдів:
ПРОЗОРНІСТЬ ВОДИ - здатність води пропускати світло. Зазвичай вимірюється диском Секкі. Залежить в основному від концентрації зважених та розчинених у воді органічних та неорганічних речовин. Може різко знижуватися внаслідок антропогенного забруднення та евтрофування водойм.
Екологічний енциклопедичний словник. – Кишинів І.І. Дід ю. 1989
ПРОЗОРНІСТЬ ВОДИ - здатність води пропускати світлові промені. Залежить від товщини шару води, що проходить променями, наявності в ній зважених домішок, розчинених речовин тощо. У воді сильніше поглинаються червоні та жовті промені, глибше проникають фіолетові. За рівнем прозорості, у порядку зменшення її, розрізняють води:
- прозорі;
- слабо опалесцентні;
- опалесцентні;
- злегка каламутні;
- каламутні;
- сильно каламутні.
Словник з гідрогеології та інженерної геології. - М: Гостоптехіздат. 1961
Смак води
Смак води – залежить від складу розчинених у ній речовин.
Словник з гідрогеології та інженерної геології
Смак води - властивість води, що залежить від розчинених у ній солей та газів. Є таблиці відчутної смак концентрації солей, розчинених у питній воді (в мг/л), наприклад наступна таблиця (по Штаффу).
Температура води
Температура плавлення води:
ТЕМПЕРАТУРА ПЛАВЛЕННЯ — температура, за якої речовина переходить із ТВЕРДОГО СТАНУ в рідке. Температура плавлення твердої речовини дорівнює температурі замерзання рідини, наприклад температура плавлення льоду, Про °С, дорівнює температурі замерзання води.
Температура кипіння води : 99,974°C
Науково-технічний енциклопедичний словник
ТЕМПЕРАТУРА КИПІННЯ, температура, за якої речовина переходить з одного стану (фази) в інший, тобто з рідини в пару або газ. Температура кипіння зростає зі збільшенням зовнішнього тиску і знижується за його зменшенні. Зазвичай її вимірюють при стандартному тиску 1 атмосферу (760 мм рт. ст.) Температура кипіння води при стандартному тиску становить 100 °С.
Науково-технічний енциклопедичний словник
Потрійна точка води
Потрійна точка води: 0,01 ° C, 611,73 Па;
Науково-технічний енциклопедичний словник
ТРІЙНА ТОЧКА, температура і тиск, при яких всі три стани речовини (твердий, рідкий, газоподібний) можуть існувати одночасно. Для води потрійна точка знаходиться при температурі 273,16 К та тиску 610 Ра.
Науково-технічний енциклопедичний словник
Поверхневий натяг води
Поверхневе натяг води – визначає силу зчеплення молекул води один з одним, наприклад, від цього параметра залежить те, як засвоюється та чи інша вода організмом людини.
Жорсткість води
Морський словник
Жорсткість води (Stiffness of Water) - властивість води, що знекровлюється вмістом розчинених у ній солей лужноземельних металів, гол. обр. кальцію та магнію (у вигляді двовуглекислих солей - бікарбонатів), і солей сильних мінеральних кислот - сірчаної та соляної. Ж. Ст вимірюється в особливих одиницях, так зв. градусах жорсткості. Градусом жорсткості називається ваговий вміст окису кальцію (СаО), що дорівнює 0,01 г на 1 л води. Жорстка вода непридатна для живлення котлів, оскільки сприяє сильному утворенню накипу на їх стінках, що може спричинити перепал трубок котла. Котли великих потужностей і особливо високих тисків повинні харчуватися абсолютно очищеною водою (конденсат від парових машин і турбін, очищений за допомогою фільтрів від домішки олії, а також дистилят, що готується в спеціальних випарниках).
Самойлов К. І. Морський словник. - М.-Л.: Державне Військово-морське Видавництво НКВМФ Союзу РСР, 1941
Науково-технічний енциклопедичний словник
Жорсткість води, нездатність води утворювати піну з милом через розчинені в ній солі, в основному кальцію і магнію.
Накип у казанах і трубах утворюється через присутність у воді розчиненого карбонату кальцію, що потрапляє у воду при контакті з вапняком. У гарячій або окропі карбонат кальцію переходить в осад у вигляді твердих вапняних відкладень на поверхнях всередині котлів. Карбонат кальцію також не дає милу пінитися. Іонообмінний контейнер(3), заповнений гранулами, покритими матеріалами натрію. з якими вода входить у контакт. Іони натрію як активніші, заміщають іони кальцію Оскільки солі натрію залишаються розчинними навіть за кип'ятінні, накип не утворюється.
Науково-технічний енциклопедичний словник
Структура води
Мінералізація води
Мінералізація води :
Екологічний енциклопедичний словник
МІНЕРАЛІЗАЦІЯ ВОДИ - насичення води неорганічні. (мінеральними) речовинами, що перебувають у ній у вигляді іонів та колоїдів; загальна сума неорганічних солей, що містяться переважно у прісній воді, ступінь мінералізації зазвичай виражають у мг/л або г/л (іноді в г/кг).
Екологічний енциклопедичний словник. – Кишинів: Головна редакція Молдавської радянської енциклопедії. І.І. Дід ю. 1989
В'язкість води
В'язкість води - характеризує внутрішній опір частинок рідини її руху:
Геологічний словник
В'язкість води (рідини) - властивість рідини, що обумовлює при русі виникнення сили тертя. Є фактором, що здійснює передачу руху від шарів води, що переміщуються з великою швидкістю, до шарів з меншою швидкістю. Ст ст. залежить від температури та концентрації розчину. Фізично вона оцінюється коеф. в'язкості, що входить до ряду формул руху води.
Геологічний словник: у 2-х томах. - М: Надра. За редакцією К. Н. Паффенгольця та ін. 1978
Розрізняють два види в'язкості води:
- Динамічна в'язкість води - 0,00101 Пас (при 20 ° C).
- Кінематична в'язкість води - 0,01012 см 2 /с (при 20 ° C).
Критична точка води
Критичною точкою води називається її стан при певному співвідношенні тиску і температури, коли її властивості однакові в газоподібному та рідкому стані (газоподібній та рідкій фазі).
Критична точка води: 374 ° C, 22,064 MПа.
Діелектрична проникність води
Діелектрична проникність, загалом, є коефіцієнтом, що показує, у скільки сила взаємодії між двома зарядами у вакуумі більше ніж у певному середовищі.
Що стосується водою цей показник надзвичайно високий й у статичних електричних полів дорівнює 81.
Теплоємність води
Теплоємність води — вода має напрочуд високу теплоємність:
Екологічний словник
Теплоємність – властивість речовин поглинати тепло. Виражається в кількості тепла, що поглинається речовиною при нагріванні на 1°С. Теплоємність води близько 1 кал/г, чи 4,2 Дж/г. Теплоємність ґрунту (при 14,5-15,5°С) коливається (від піщаних до торф'яних ґрунтів) від 0,5 до 0,6 кал (або 2,1-2,5 Дж) на одиницю об'єму та від 0,2 до 0,5 кал (або 0,8-2,1 Дж) на одиницю маси (г).
Екологічний словник. - Алма-Ата: "Наука". Б.А. Биків. 1983
Науково-технічний енциклопедичний словник
Питома теплоємність (позначення с), тепло, необхідне для того, щоб підняти температуру 1 кг речовини на 1К. Вимірюється у Дж/К.кг (де Дж-ДЖОУЛЬ). Речовини з високою питомою теплоємністю, такі як вода, вимагають більшої кількості енергії для підвищення температури, ніж речовини з низькою питомою теплоємністю.
Науково-технічний енциклопедичний словник
Теплопровідність води
Теплопровідність речовини має на увазі його здатність проводити тепло від своїх гарячіших частин до холодніших.
Передача тепла у воді відбувається або на молекулярному рівні, тобто передається молекулами води, або завдяки руху/переміщенню яких або обсягів вод - турбулентна теплопровідність.
Теплопровідність води залежить від температури та тиску.
Плинність води
Під плинністю речовин розуміють їхню здатність змінювати свою форму під впливом постійної напруги або постійного тиску.
Плинність рідин, як і визначається рухливістю їх частинок, які у стані спокою нездатні сприймати дотичні напруги.
Індуктивність води
Індуктивність визначає магнітні властивості замкнутих ланцюгів електричного струму. Вода, за винятком деяких випадків, електричний струм проводить, а отже і має певну індуктивність.
Щільність води
Щільність води визначається ставленням її маси до об'єму при певній температурі. Детальніше читайте у нашому матеріалі ЩО ТАКЕ ЩІЛЬНІСТЬ ВОДИ(читати →).
Стисність води
Стисливість води – незначна і залежить від солоності води та тиску. Наприклад, у дистильованої води вона дорівнює 0,0000490.
Електропровідність води
Електропровідність води - багато в чому залежить від кількості розчинених у них солей.
Радіоактивність води
Радіоактивність води залежить від вмісту в ній радону, еманації радію.
Фізико-хімічні властивості води
Словник з гідрогеології та інженерної геології
ФІЗИКО-ХІМІЧНІ ВЛАСТИВОСТІ ВОДИ - параметри, що визначають фізико-хімічні особливості природних вод. До них відносяться показники концентрації водневих іонів (рН) та окисно-відновний потенціал (Eh).
Словник з гідрогеології та інженерної геології. - М: Гостоптехіздат. Укладач: А. А. Маккавєєв, редактор О. К. Ланґе. 1961
Кислотно-лужна рівновага води
Окисно-відновний потенціал води
Окисно-відновний потенціал води (ОВП) - здатність води вступати в біохімічні реакції.
Хімічні властивості води
ХІМІЧНІ ВЛАСТИВОСТІ РЕЧОВИНИ – це властивості, що виявляються внаслідок хімічних реакцій.
Нижче наведено Хімічні властивості води за підручником «Основи хімії. Інтернет-підручник» авторів А. В. Мануйлова, В. І. Родіонова.
Взаємодія води з металами
При взаємодії води з більшістю металів відбувається реакція із виділенням водню:
- 2Na + 2H2O = H2 + 2NaOH (бурхливо);
- 2K + 2H2O = H2 + 2KOH (бурхливо);
- 3Fe + 4H2O = 4H2 + Fe3O4 (тільки під час нагрівання).
Не всі, а лише досить активні метали можуть брати участь в окисно-відновних реакціях цього типу. Найбільш легко реагують лужні та лужноземельні метали І та ІІ груп.
Взаємодія води з неметалами
З неметалів з водою реагують, наприклад, вуглець та його водневу сполуку (метан). Ці речовини набагато менш активні, ніж метали, але все ж таки здатні реагувати з водою при високій температурі:
- C + H2O = H2 + CO (при сильному нагріванні);
- CH4 + 2H2O = 4H2 + CO2 (при сильному нагріванні).
Взаємодія води з електричним струмом
При дії електричним струмом вода розкладається на водень та кисень. Це також окислювально-відновна реакція, де вода є одночасно і окислювачем, і відновником.
Взаємодія води з оксидами неметалів
Вода вступає у реакцію з багатьма оксидами неметалів та деякими оксидами металів. Це не окислювально-відновні реакції, а реакції сполуки:
SO2 + H2O = H2SO3 (сірчиста кислота)
SO3 + H2O = H2SO4 (сірчана кислота)
CO2 + H2O = H2CO3 (вугільна кислота)
Взаємодія води з оксидами металів
Деякі оксиди металів можуть вступати в реакції з'єднання з водою. Приклади таких реакцій ми вже зустрічали:
CaO + H2O = Ca(OH)2 (гідроксід кальцію (гашене вапно))
Не всі оксиди металів здатні реагувати із водою. Частина практично не розчинна у воді і тому з водою не реагує. Наприклад: ZnO, TiO2, Cr2O3, з яких готують, наприклад, стійкі до води фарби. Оксиди заліза також не розчиняються у воді і не реагують із нею.
Гідрати та кристалогідрати
Вода утворює сполуки, гідрати та кристалогідрати, в яких повністю зберігається молекула води.
Наприклад:
- CuSO4 + 5 H2O = CuSO4.5H2O;
- CuSO4 – речовина білого кольору (безводний сульфат міді);
- CuSO4.5H2O - кристалогідрат (мідний купорос), сині кристали.
Інші приклади утворення гідратів:
- H2SO4 + H2O = H2SO4.H2O (гідрат сірчаної кислоти);
- NaOH + H2O = NaOH.H2O (гідрат їдкого натру).
З'єднання, що зв'язують воду в гідрати і кристалогідрати, використовують як осушувачі. З їхньою допомогою, наприклад, видаляють водяні пари з вологого атмосферного повітря.
Біо-синтез
Вода бере участь у біо-синтезі в результаті якого утворюється кисень:
6n CO 2 + 5n H 2 O = (C 6 H 10 O 5) n + 6n O 2 (при дії світла)
 Ми бачимо, що властивості води різноманітні та охоплюють практично всі аспекти життя на Землі. Як сформулював один із вчених… вивчати воду необхідно комплексно, а не в контексті окремих її проявів.
Ми бачимо, що властивості води різноманітні та охоплюють практично всі аспекти життя на Землі. Як сформулював один із вчених… вивчати воду необхідно комплексно, а не в контексті окремих її проявів.
Під час підготовки матеріалу використовувалася інформація з книжок – Ю. П. Рассадкіна «Вода звичайна і незвичайна», Ю. Я. Фіалкова «Незвичайні властивості звичайних розчинів», Підручника «Основи хімії. Інтернет-підручник» авторів А. В. Мануйлова, В. І. Родіонова та ін.
Як перетворити газ на рідину? Графік кипіння відповідає це питання. Перетворити газ на рідину можна, або зменшуючи температуру, або збільшуючи тиск.
У ХІХ столітті підвищення тиску представлялося завданням легшою, ніж зниження температури. На початку цього століття великому англійському фізику Михайлу Фараді вдалося стиснути гази до значень пружності парів і в такий спосіб перетворити на рідину багато газів (хлор, вуглекислий газ та ін.).
Однак деякі гази - водень, азот, кисень - не піддавалися зрідженню. Скільки не збільшували тиск, вони не перетворювалися на рідину. Можна було подумати, що кисень та інші гази не можуть бути рідкими. Їх зарахували до справжніх, або постійних газів.
Насправді ж невдачі були викликані нерозумінням однієї важливої обставини.
Розглянемо рідину та пару, що перебувають у рівновазі, і подумаємо, що відбувається з ними при зростанні температури кипіння і, зрозуміло, відповідному зростанні тиску. Інакше кажучи, уявімо, що точка на графіці кипіння рухається вздовж кривої вгору. Зрозуміло, що рідина у разі підвищення температури розширюється і щільність її падає. Що ж до пари, то збільшення температури кипіння? Вочевидь, сприяє його розширенню, але, як ми вже казали, тиск насиченої пари зростає значно швидше, ніж температура кипіння. Тому густина пари не падає, а, навпаки, швидко зростає зі збільшенням температури кипіння.
Оскільки щільність рідини падає, а щільність пари зростає, то, рухаючись "вгору" по кривій кипіння, ми неминуче дістанемося до такої точки, в якій щільності рідини та пари зрівняються (рис. 4.3).
У цій чудовій точці, яка називається критичною, крива кипіння обривається. Оскільки всі відмінності між газом і рідиною пов'язані з різницею в щільності, то в критичній точці властивості рідини та газу стають однаковими. Для кожної речовини існує своя критична температура та свій критичний тиск. Так, для води критична точка відповідає температурі 374°З тиску 218,5 атм.
Якщо стискати газ, температура якого нижче критичної, процес його стиснення зобразиться стрілкою, що перетинає криву кипіння (рис. 4.4). Це означає, що в момент досягнення тиску, що дорівнює пружності пари (точка перетину стрілки з кривою кипіння), газ почне конденсуватися в рідину. Якби наша посудина була прозорою, то в цей момент ми побачили б початок утворення шару рідини на дні судини. При постійному тиску шар рідини зростатиме, поки, нарешті, весь газ не перетвориться на рідину. Подальше стиснення потребує збільшення тиску.

Зовсім інакша справа при стисканні газу, температура якого вища за критичну. Процес стиснення знову можна зобразити у вигляді стрілки, що йде знизу вгору. Але тепер ця стрілка не перетинає криву кипіння. Значить, при стисканні пар не конденсуватиметься, а лише безперервно ущільнюватиметься.
При температурі вище критичної неможливе існування рідини і газу, поділених межею розділу: При стисканні до будь-яких щільностей під поршнем буде знаходитися однорідна речовина, і важко сказати, коли її можна назвати газом, а коли рідиною.
Наявність критичної точки показує, що між рідким та газоподібним станом немає принципової відмінності. На перший погляд могло б здатися, що такої принципової відмінності немає тільки в тому випадку, коли йдеться про температури вище за критичну. Це, проте, негаразд. Існування- критичної точки вказує на можливість перетворення рідини - справжнісінької рідини, яку можна налити в склянку - в газоподібний стан без жодного подібності кипіння.
Такий шлях перетворення показано на рис. 4.4. Хрестиком відзначено явну рідину. Якщо трохи знизити тиск (стрілка вниз), вона закипить, закипить вона і в тому випадку, якщо трохи підвищити температуру (стрілка вправо). Але ми зробимо зовсім інакше, Стиснемо рідину дуже сильно, до тиску вище критичного. Крапка, що зображує стан рідини, піде вертикально вгору. Потім підігріємо рідину - цей процес зобразиться горизонтальною лінією. Тепер, після того як ми опинилися правіше за Критичну температуру, знизимо тиск до вихідного. Якщо тепер зменшити температуру, то можна отримати справжнісіньку пару, яка могла бути отримана з цієї рідини більш простим і коротким шляхом.
Таким чином, завжди можливо, змінюючи тиск і температуру в обхід критичної точки, отримати пару шляхом безперервного переходу його з рідини або рідина з пари. Такий безперервний перехід не потребує кипіння чи конденсації.
Ранні спроби зрідження таких газів, як кисень, азот, водень, тому були невдалими, що було відомо про існування критичної температури. У цих газів критичні температури дуже низькі: у азоту -147°С, у кисню -119°С, у водню -240°С, або 33 К. Рекордсменом є гелій, його критична температура дорівнює 4,3 К. Перетворити ці гази на рідина можна лише одним "способом - треба знизити їх температуру нижче зазначеної"
Якщо деяку кількість рідини помістити в закриту посудину, то частина рідини випарується і над рідиною буде насичена пара. Тиск, отже, і щільність цієї пари залежить від температури. Щільність пари зазвичай значно менша за щільність рідини при тій же температурі. Якщо підвищити температуру, то щільність рідини зменшиться (§ 198), тиск і щільність насиченої пари зростуть. У табл. 22 наведено значення щільності води та насиченої водяної пари для різних температур (а отже, і для відповідних тисків). На рис. 497 ці дані наведені у вигляді графіка. Верхня частина графіка показує зміну густини рідини залежно від її температури. При підвищенні температури густина рідини зменшується. Нижня частина графіка показує залежність щільності насиченої пари від температури. Щільність пари збільшується. При температурі, що відповідає точці , щільності рідини та насиченої пари збігаються.

Мал. 497. Залежність щільності води та її насиченої пари від температури
Таблиця 22. Властивості води та її насиченої пари при різних температурах
|
Температура, |
Тиск насиченої пари, |
Щільність води, |
Щільність насиченої пари, |
Питома теплота пароутворення, |
З таблиці видно, що чим вище температура, тим менша різниця між щільністю рідини та щільністю її насиченої пари. За деякої температури (у води при ) ці щільності збігаються. Температуру, при якій щільності рідини та її насиченої пари збігаються, називають критичною температурою даної речовини. На рис. 497 їй відповідає точка. Тиск, що відповідає точці, називають критичним тиском. Критичні температури різних речовин сильно різняться між собою. Деякі їх наведено у табл. 23.
Таблиця 23. Критична температура та критичний тиск деяких речовин
|
Речовина |
Критична температура, |
Критичний тиск, атм |
Речовина |
Критична температура, |
Критичний тиск, атм |
|
Вуглець газ |
|||||
|
Кисень |
|||||
|
Спирт етиловий |
|||||
На що вказує існування критичної температури? Що буде за ще більш високих температур?
Досвід показує, що при температурах, вищі за критичну, речовина може перебувати тільки в газоподібному стані. Якщо ми будемо зменшувати обсяг, зайнятий парою, при температурі вище критичної, то тиск пари зростає, але він не стає насиченим і продовжує залишатися однорідним: хоч би як великий тиск, ми не виявимо двох станів, розділених різким кордоном, як це завжди спостерігається при нижчих температурах внаслідок конденсації пари. Отже, якщо температура якої-небудь речовини вище критичної, то рівновага речовини у вигляді рідини і пари, що стикається з нею, неможливо ні при якому тиску.
Критичний стан речовини можна спостерігати за допомогою приладу, зображеного на рис. 498. Він складається із залізної коробки з вікнами, яку можна нагрівати вище («повітряна лазня»), і скляної ампули з ефіром, що знаходиться всередині лазні. При нагріванні лазні меніск в ампулі піднімається, стає більш плоским і зникає, що і свідчить про перехід через критичний стан. При охолодженні лазні ампула раптово каламутніє внаслідок утворення безлічі дрібних крапель ефіру, після чого ефір збирається в нижній частині ампули.

Мал. 498. Прилад спостереження критичного стану ефіру
Як очевидно з табл. 22, у міру наближення до критичної точки питома теплота пароутворення стає дедалі менше. Це тим, що з підвищенні температури зменшується відмінність внутрішніх енергій речовини у рідкому і пароподібному станах. Справді, сили зчеплення молекул залежить від відстаней між молекулами. Якщо щільності рідини та пари відрізняються мало, то мало відрізняються і середні відстані між молекулами. Отже, при цьому мало відрізнятимуться і значення потенційної енергії взаємодії молекул. Друге доданок теплоти пароутворення - робота проти зовнішнього тиску - теж зменшується в міру наближення до критичної температури. Це випливає з того, що чим менша відмінність у щільності пари і рідини, тим менше розширення, що відбувається при випаровуванні, і, отже, тим менша робота, що здійснюється при випаровуванні.
На існування критичної температури вперше вказав на 1860г. Дмитро Іванович Менделєєв (1834-1907), російський хімік, який відкрив основний закон сучасної хімії – періодичний закон хімічних елементів. Великі досягнення у вивченні критичної температури має англійський хімік Томас Ендрюс, який зробив докладне вивчення поведінки вуглекислоти при ізотермічній зміні займаного нею обсягу. Ендрюс показав, що при температурах нижче в замкнутій посудині можливе співіснування вуглекислоти в рідкому та газоподібному станах; при температурах вище таке співіснування неможливе і вся посудина наповнена тільки газом, як би не зменшувати його обсяг.
Після відкриття критичної температури стало зрозуміло, чому довго не вдавалося перетворити на рідину такі гази, як кисень чи водень. Їхня критична температура дуже низька (табл. 23). Щоб перетворити ці гази на рідину, їх потрібно охолодити нижче критичної температури. Без цього всі спроби їхнього зрідження приречені на невдачу.
Експериментальні та теоретичні ізотерми
Вперше експериментальні ізотерми для реальних газів (вуглекислий газ) були вивчені Ендрюсом, вони були отримані повільним ізотермічним стисненням ненасиченої пари, що знаходиться в циліндрі під поршнем (ізотерми наведені на рис. 2.19 а).
Як очевидно з ізотерм, наведених на рис. 2.19,а, всі вони містять горизонтальну ділянку, яка з підвищенням температури зменшується і при досягненні критичної температури() повністю зникає. Критичній температурі відповідає критична ізотерма 4 на ній в критичній точці є точка перегину.
Якщо провести через крайні точки горизонтальних ділянок ізотерм лінію (вона буде дзвоноподібною), то вся область діаграми в координатах (,) буде розділена на три області (рис. 2.19,б) - область рідких станів, область газоподібних станів і область двофазних станів ( в ній одночасно існують газоподібний та рідкий стан речовини). Зазначимо, що у рис. 2.19 б не відображено твердий стан речовини.
Область газоподібних станів, яка знаходиться вище критичної ізотерми, називають газом. Ізотерми у цій галузі нагадують ізотерми ідеального газу (рис. 2.19,а, ізотерма 5). У цій галузі температур речовина існує у газоподібному стані за будь-яких тисках і обсягах, тобто. проводячи ізотермічне стиск газу, не можна його за таких температур перетворити на рідину. Це пояснює той факт, що гелій та водень тривалий час за допомогою процесу ізотермічного стиснення не вдавалося перевести в рідкий стан (для гелію та водню критичні температури становили і відповідно). Якщо взяти газ, що знаходиться нижче критичної ізотерми, то при ізотермічному стисканні його можна перетворити на рідину. Тому, наголошуючи на цьому факті, у цій галузі газ називають ненасиченою парою.

Розглянемо докладніше ізотерму під номером 2 на рис. 2.19,а. Її можна поділити на три ділянки.
Ділянка -. При стисканні ненасиченої пари він переходить у насичений стан у точці.
Ділянка -. Відбувається конденсація насиченої пари, при постійному тиску, що дорівнює тиску насиченої пари при даній температурі. У цій галузі обсягів дві фази речовини – рідка та пароподібна – перебувають у рівновазі. При досягненні точки вся пара перетворюється на рідину.
Ділянка -. Тут спостерігається рідкий стан речовини. Зміна об'єму рідини зі збільшенням її тиску буде незначною. Тому ізотерми у цій галузі практично вертикальні.
Розглянемо докладніше, що відбувається у критичній точці(Параметри, відповідні їй, позначаються як , і ).
У критичній точціспостерігається критичний стан речовинидля нього зникає різницю між рідиною і насиченою парою. Це проявляється в тому, що при нагріванні в закритій посудині якоїсь рідини при досягненні критичної температури зникне межа поділу між рідиною і парою - вони утворюють єдину однорідну речовину (щільності пари та рідини збігаються, сили поверхневого натягу зникнуть, теплота пароутворення дорівнюватиме нулю) .
3. Порівняння теоретичних та експериментальних ізотерм. Розглянемо вид розрахункових ізотерм, які можна одержати з рівняння (2.86). Для цього перепишемо це рівняння у такому вигляді:
![]() . (2.88)
. (2.88)
Відомо, що таке кубічне рівняння має або один, або три речові корені. На рис. 2.19, наведено графік однієї з розрахункових ізотерм - для неї в області тисків () рішення рівняння (2.88) дає три речові корені (горизонтальна лінія перетинає ізотерму в трьох точках, відповідних значенням обсягу , і ). Це призводить до зигзагоподібної (хвилеподібної) поведінки ізотерми в області одночасного існування насиченої пари та рідини.

Така поведінка ізотерми у цій галузі не узгоджується з експериментом. В інших областях, де існує тільки рідина або тільки пара, спостерігається досить задовільна згода між експериментом і теорією.
Зазначимо, що хвилеподібні ділянки розрахункових ізотерм частково підтверджуються експериментом. Якщо створити умови, за яких у газі будуть відсутні центри конденсації (наприклад, порошинки або іони), то повільним ізотермічним стисненням (перехід 1-2-3) можна отримати так званий пересичена парайому відповідають на ізотермі стану, укладені між точками 2 і 3 (рис. 2.20,а). Тиск пересиченої пари перевищує тиск насиченої пари за цієї температури. Ці стани будуть метастабільними (малостійкими) – при виникненні центрів конденсації пересичена пара швидко перетворюється на рідину (перехід 3-4), виникає рівноважний стан між насиченою парою та рідиною.
Аналогічно можна отримати метастабільні стани перегрітої рідини. Для цього необхідно видалити з рідини та стінок судини, в якій вона знаходиться, центри пароутворення (наприклад, порошинки, бульбашки розчинених у рідині газів). Перегрітій рідині відповідають стани, розташовані на ізотермі між точками 6 і 7 (рис. 2.20,а), її температура буде вищою за температуру точки кипіння. Якщо рідини виникають центри пароутворення, вона миттєво закипає (перехід 7-8).
Стани, відповідні частини ізотерми між точками 3 та 7 (вони позначені пунктирною лінією), абсолютно нестійкі (рис. 2.20,а) і не реалізуються на практиці.
Наприклад, на рис. 2.20 б наведені графіки розрахункових ізотерм при різних температурах. При їх побудові необхідно враховувати, що площі фігур повинні бути однакові (рис. 2.20, в), це є наслідком другого початку термодинаміки.
4. Критичні параметри речовини. Розглянемо, як за допомогою експериментально визначених критичних параметрів речовини (), що відповідають критичній точці, можна оцінити постійні та , що входять до рівняння Ван-дер-Ваальса.
Критичній точці на критичній ізотермі відповідає точка перегину, причому у цій точці дотична до графіка буде горизонтальна. Це означає, що в цій точці дорівнюють нулю перша та друга похідні тиску газу за обсягом. Знайдемо ці похідні. Для цього перепишемо рівняння (12.99) у такому вигляді:
![]()
![]() ,
, ![]() .
.