Siz allaqachon bilganingizdek, karboksilik kislotalarni aniq yo'l bilan olib tashlashda, yashashga yaroqli aldegidni oksidlanishi mumkin.
Industrializmda bu jarayon katalizatorlar ishtirokida yana nordon yordami uchun amalga oshiriladi.
Karboksilik kislotalarning umumiy formulasini tahlil qilib, siz y molekulalariga qadar ikki qism - uglevod radikali (alkil) va funktsional guruh mavjudligini yodda tutishingiz mumkin.
Yaku karboksil deb ataladi. Funktsional guruh nomi karbonil >C=0 va gidroksid -OH nomiga o'xshaydi.
Karboksilik kislotalar sinfi juda xilma-xildir. Yangisidan oldin bitta, ikki asosli, to'yinmagan va aromatik kislotalar kiradi. Alec va karboksilik kislotalarning kichik sinflari tabiiy fanlar bo'yicha maktablarda va sinflarda o'qitish mavzusidir. Ikkita to'yinmagan kislotalar haqida ko'proq ma'lumot mavjud: Z 17 H 33 COOH - oleyk kislotasi (molekuladagi bitta pastki bo'g'in uchun qasos olish uchun) (50-rasm) í Z 17 H 31 COOH - linoleik kislota (molekuladagi ikkita pastki bog'lanish uchun qasos olish uchun) ). Kislota kislotalari yog 'deb ataladi va endi siz kislota kislotasiga nima uchun g'amxo'rlik qilayotganimizni tushundingiz - nodir yog'lar omboriga badbo'y hid kiradi.

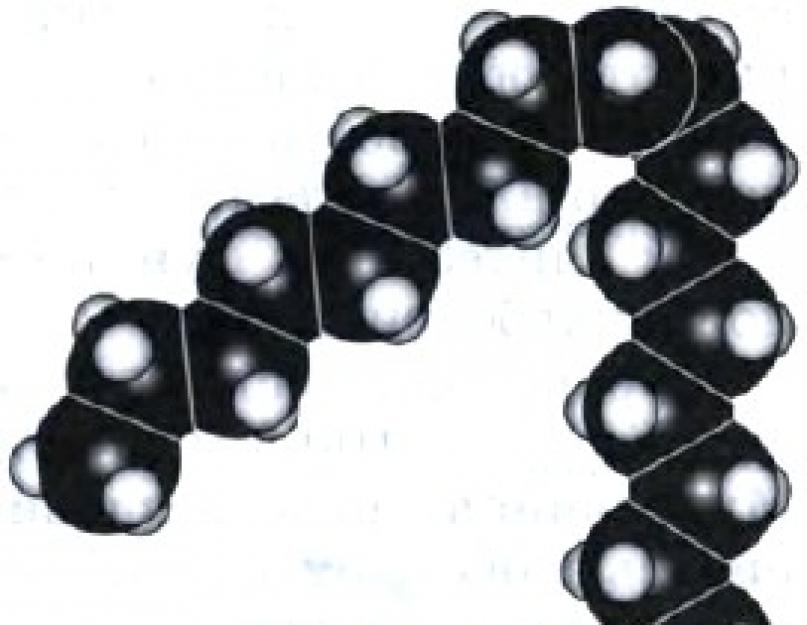
Mal. 50.
Oleyk kislota molekulasining masshtabli modeli
Biroq, bir asosli karboksilik kislotalarning chegarasiga murojaat qilaylik. Ushbu kislotalarning gomologik seriyasini yarmidan boshlash, chunki u induktsiya qilingan maqsadni takrorlamaydi - murashina yoki metan kislotasi
Ko'rinib turibdiki, bog'lanish molekulasidagi karboksil uglevod radikali bilan emas, balki chumoli aldegididagi karbonil kabi suv atomi bilan bo'ladi (51-rasm).

Mal. 51.
Formik (metan) kislotaning molekulyar modeli:
Ko'rinib turibdiki, kislotalar va shunga o'xshash aldegidlarning nomlari bir xil.
Chumoli kislotasini o'z ichiga olganlar boshqa bir asosli karboksilik kislotalarning molekulalariga o'xshaydi, bu ularning kimyoviy kuchlarining o'ziga xosligini ko'rsatadi. U aldegidlar kabi "sibir oynasi" reaktsiyasiga kiradi, tebranishlar ikkita funktsional guruhning sintezi natijasida molekuladir: karbonil va karboksil.
Formik kislota - kuchli hidli kislota (bp = 100,8 ° C), suvda yaxshi. Murashina kislotasi jirkanch! Siz teriga tushganingizda, siz afyunni keltirib chiqarasiz. Chumolilar, qichitqi o'tlar va boshqa meduza turlari sifatida ko'rilgan ziqna vatan kislotadan o'ch oladi (52-rasm).

Mal. 52.
Murashin kislotasi mahalliy odamdan qasos olish uchun, nima qilish kerak:
1 - meduza; 2 - kropiva; 3 - mura
Murashik kislota dezinfektsiyalash vositasi sifatida ishlatilishi mumkin va shuning uchun u oziq-ovqat, teri va farmatsevtika sanoatida, shuningdek, tibbiyotda turg'un ekanligini bilasiz. Krym tsgogo, vv vikoristovuyut qachon farbuvanní to'qima va qog'oz (Fig. 53).

Mal. 53.
Formik kislota infuzioni:
1 - Shkiryan hunarmandchiligi; 2 - matoni to'ldirish; 3 - dori
Otsova, abo etanoik, kislota

(Mal. 54) - bu har qanday suvda suv bilan aylanib yuradigan o'ziga xos o'tkir hidga ega bo'lmagan vatan. Otstovoy kislotaning suvli navlari "stol ocet" (assortimentning 3-5%), "Otsova mohiyati" (assortimentning 70-80%) nomi ostida sotiladi va oziq-ovqat sanoatida keng qo'llaniladi.

Mal. 54.
Okstoik (etanik) kislotaning molekula modeli:
1 - kulyastrizhneva; 2 - masshtabli
Optik kislota - farbing jarayonida, terilarda, lacofarbsda turg'un bo'lgan boy organik o'simliklarning yaxshi sotuvchisi (55-rasm). Crym tsgogo, octova kislotasi ê vihídnoy syrovina texnik jihatdan muhim boy organik materiallar ishlab chiqarish uchun: parcha tolalar, otrutokhymíkativ, kino va fotofilm va boshqalar. mohiyati.

Mal. 55.
Optik kislotaning turg'unligi:
1 - konservatsiya; 2 - parcha tolalar, to'qimachilik ishlab chiqarish; 3 - zhí uchun ziravorlar; 4-8 - organik ifloslantiruvchi moddalar ishlab chiqarish (pestitsidlar 4, laklar 5, farb 6, fototermik 7, elim 8)
Chegaraviy bir asosli karboksilik kislotalarning gomologik qatorida molekulyar massaning ortishi bilan ularning qalinlashishi, qaynash va erish harorati ortadi, suv tarkibi o'zgaradi.
Boshqa karboksilik kislotalar ham yog '(nima uchun taxmin qilingan) va qattiq nutqlar deb ataladi. Ce, masalan, palmitik 15 H 31 COOH (56-rasm, 1) va stearik C 17 H 35 COOH kislotasi (56-rasm, 2).

Mal. 56.
Molekulalarning masshtabli modellari:
1 - palmitik kislota; 2 - stearin kislotasi
Karboksilik kislotalarning kimyoviy kuchi ularning javobgar bo'lgan kislotalar turiga mansubligidan oldin bizga berilgan. Noorganik kislotalar, karboksilik kislotalar va elektrolitlarga o'xshab, zaifroq bo'lsa-da va ular teskari dissotsiatsiyalanadi:
Karboksilik kislotalarning suv tarkibi indikatorlarni tayyorlash bilan o'zgartiriladi.
Uglevod radikalining ortishi bilan elektr dissotsilanish darajasining o'zgarishi kuzatiladi.
Noorganik kislotalar singari, karboksilik kislotalar ham metallar, asosiy va amfoter oksidlar, asoslar, amfoter gidroksidlar va tuzlar bilan o'zaro ta'sir qiladi.
Shunday qilib, murashina va oktova kislotasi bir kungacha elektrokimyoviy kuchlanish qatorida turadigan metallar bilan o'zaro ta'sir qiladi:

Ci kislotalar asosiy va amfoter oksidlar bilan erigan tuzlar - formatlar va asetatlar bilan reaksiyaga kirishadi:
Xuddi shunday, murashina va oktova kislotasi asoslar va amfoter gidroksidlar bilan o'zaro ta'sir qiladi:
Vzaimodiyut qi kislotalar va kuchsiz kislotalarning iz tuzlari. Reaksiyalar oxirigacha boradi, go'yo qamal yoki gaz hal qilingandek:
Organik kislotalar, siz allaqachon bilganingizdek, spirtlar bilan eterlanish reaktsiyasiga kirishib, efirning buklanishini osonlashtiradi, shekilli, teng bo'ladi.

Tushunadigan yangi so'zlar
- karboksil guruhi.
- Karboksilik kislotalar. Chegaraviy bir asosli karboksilik kislotalar.
- Muhim bo'lmagan karboksilik kislotalar: oleyk va linoleik.
- Murashina va otsova kislotasi.
- Karboksilik kislotalarning kuchi: metallar, asosiy va amfoter oksidlar, asoslar, amfoter gidroksidlar va tuzlar bilan o'zaro ta'siri.
- Asetat formati.
- Esterifikatsiya reaktsiyasi. Katlanadigan havo
- Karboksilik kislotalarning turg'unligi.
So'rov va topshiriq
1. Qaysi nutq chegaraviy bir asosli karboksilik kislotalar deb ataladi?
Chegaraviy bir asosli karboksilik kislotalar organik birikmalar bo'lib, ularning molekulalarida bitta karboksil guruhi mavjud va uglevod radikallari mavjud.
2. Gomologik qatordagi karboksilik kislotalarning jismoniy kuchlarini o'zgartirish misolida yakísny o'zgarishlar sonining o'tishini ko'ring.
Molyar massa ortishi bilan erish nuqtasi va qaynash nuqtasi ortadi, nutq qalinligi ortadi. Gomologik qatorning birinchi to'qqizta vakili rídini, o'ninchisi esa yanada mustahkam nutqdir.
3. Noorganik va karboksilik kislotalar uchun qanchalik kuchli? Dalillarni teng reaktsiyalar bilan tasdiqlang.
4. Oleyk va linoleik kislotalar qanday reaksiyalarda noorganik birikmalar sifatida kirishi mumkin? Bu reaksiyalarning nomi nima? Muvofiqligingizni yozing. 
5. Chumoli kislotaning tuzilish formulasini shu tartibda yozish mumkin. Bundan buyon kislota ikki tomonlama funktsiyali nutq bo'ladi. Qanday qilib chaqirish mumkin? Boshqa kislotalarga xos bo'lgan qanday reaksiya chumoli kislotasini beradi?
6. Teng reaksiyalarni yozing, ular yordamida siz shunday transformatsiyani yaratishingiz mumkin: 
7. Qaysi nutqda qichitqi sepuvchi va meduza hujayralari chaqiriladi? Ushbu organizmlarni ko'rish natijasida kelib chiqqan opiatlar sonini qanday olib tashlash mumkin?
Chumoli kislotasi bilan Zhalíyucha dyya viklikana. Og'riq belgilarining o'zgarishi uchun kislotani neytrallash uchun soda bilan davolash kerak.
8. Oktoik kislotada uyning 20% ni qoplash uchun 250 g vape tayyorlangan va u 33,6 l (N.O.) karbonat angidrid bilan chiqarilgan. Yaku ob''emnu chastku karbonat angidridning ekshalatsiyasiga aylanish nazariy jihatdan mumkinmi? 
9. Qirolicha Kleopatra saroy tabibining roziligi bilan zargarlarga ma'lum bo'lgan eng marvaridli marvaridlarni yasagan, keyin esa uzoq vaqt davomida marvaridlarning ostimanini olib ketgan. Kleopatra qanday reaksiya yaratdi? Yake z'ednannya g'alaba qozondi?
Kleopatra zdíysnila reaktsiya vzaimodíí otstoí̈ kislota va kaltsiy karbonat. Marvaridlar bir xildan buklangan. Natijada, karbonat angidrid, kaltsiy asetat va suv yig'indisi bor edi. Men o'zim kaltsiy asetat ichdim.
10. 10,6 g chumoli va oktoin kislotalar yig'indisini neytrallash 200 g 4% natriy gidroksid bilan vitratlangan. Umumiy yig'indidagi kislotalarning massa ulushlarini kengaytiring. 
KARBON KISlotasi
Karboksilik kislotalar bir yoki bir nechta karboksil guruhlarini almashtirish uchun karboksilik kislotalar deb ataladi.
Karboksil guruhlar soni kislotaning asosliligini tavsiflaydi.
Oxir oqibat, karboksilik kislotalarning karboksil guruhlari orasida ular bir asosli karboksilik kislotalarga (bitta karboksil guruhini almashtiradi), ikki asosli (ikkita karboksil guruhini almashtiradi) va boy asosli kislotalarga bo'linadi.
Karboksilik kislotalar karboksil guruhi bilan bog'langan radikal shaklida bo'linadi, chegarada to'yinmagan va aromatik bo'linadi. Chegaraviy va to'yinmagan kislotalar alifatik va yog'li qator kislotalarining umumiy nomi ostida birlashtiriladi.
Monobasik karboksilik kislotalar
1.1 Gomologik seriyalar va nomenklatura
Bir asosli chegara karboksilik kislotalarning gomologik qatori (ular yog 'kislotalari deb ataladi) chumoli kislotadan kelib chiqadi.

Gomologik qator formulasi
IUPAC nomenklaturasi boy kislotalar uchun ularning arzimas nomlarini saqlashga imkon beradi, ular tabiiy dzhereloga o'xshaydi, ulardan boshqa kislota ko'rilgan, masalan, murashin, oktov, moy, valerian va boshqalar.
Katlama o'zgarishlari uchun kislotalarning nomlari kislota molekulasidagi bir xil miqdordagi uglerod atomlariga ega bo'lgan uglevodlardagi nomlarga ko'ra o'zgartiriladi va to'ldirish qo'shiladi. -ova bu so'zlar kislota. Murashin kislotasi H-COOH metanoik kislota, oktova kislotasi CH 3 -COOH etan kislotasi va boshqalar deb ataladi.
Ushbu tartibda kislotalar uglevodlarga o'xshaydi, ularning bir qatori karboksilga aylanadi:

Ratsional nomenklatura uchun suyultirilgan nayza bilan kislotalarning nomlarini yig'ishda ular o'xshash oktik kislotalar sifatida ko'riladi, ularning molekulalarida atomlar va suv radikallar bilan almashtiriladi, masalan, trimetilotsitrik kislota (CH 3) 3 C - COOH.
1.2 Karboksilik kislotalarning fizik quvvati
Faqat sof rasmiy pozitsiyalardan kelib chiqib, karboksil guruhini karbonil va gidroksil funktsiyalarining kombinatsiyasi sifatida ko'rib chiqish mumkin. Darhaqiqat, ularning o'zaro birma-bir ukollari shundayki, men ularning kuchini yana o'zgartiraman.
C=0 o'rash bog'ining qutblanishi karbonil ioni uchun juda kuchli, kislotali gidroksid guruhining tikuv atomidan erkin elektron betining qo'shimcha qisqarishi muvozanati uchun kuchli kuchayadi:

Nihoyat, gidroksiddagi O-H aloqasining zaiflashishi va atomni ko'rinadigan proton (H +) suviga bo'linish qulayligi. Karboksilning markaziy uglerod atomida qisqargan elektron bo'shliqning (d+) paydo bo'lishi, shuningdek, C-C bog'idagi s-elektronning karboksil guruhiga qisqarishiga va (aldegidlar va ketonlardagi kabi) qaytarilgan bo'shliqning paydo bo'lishiga olib keladi. a-karbonat kislota atomlarida elektron qalinligi (d+).
Barcha karboksilik kislotalar kislotali (ular ko'rsatkichlar) va tuzlarni metall gidroksidlari, oksidlari va metallarning karbonatlari va faol metallar bilan eritadi:
Karboksilik kislotalar ko'p hollarda suv dissotsiatsiyasida bir oz dunyo va ê zaif kislotalardan kamroq bo'lib, sezilarli darajada xlorid kislotasi, nitrat kislota va sulfat kislota kabi kislotalarni beradi. Shunday qilib, bir mol 16 litr suvda suyultirilganda, murat kislotasining dissotsilanish darajasi 0,06, ostinik kislota 0,0167, xlorid kislotasi esa bunday suyultirish bilan ko'proq dissotsiatsiyalanishi mumkin.
Ko'pgina monobazik karboksilik kislotalar uchun RK A \u003d 4,8, ko'proq murashik kislota pKa qiymatini pasaytiradi (taxminan 3,7), bu alkil guruhlarining elektron beruvchi ta'siri bilan izohlanadi.
Suvsiz mineral kislotalarda karboksilik kislotalar erigan karboksilik kislotalar bilan nordon bilan protonlanadi:

Yuqorida aytib o'tilgan dissotsilanmagan karboksilik kislota molekulasidagi elektron zichligi oshishi gidroksil kislota atomidagi elektron zichligini kamaytiradi va uni karbonil atomiga siljitadi. Bu halokat anion kislotalarda yanada aniqroq:

Buning natijasi aniondagi zaryadlarning tashqi tomonga o'zgarishi bo'lib, bu aslida A shaklida - karboksilat anioniga rezonansdir.
Birinchi chotiri bir qator karboksilik kislotalarning vakillari - ruhomí rídini, ular quruq havoda suv bilan aralashtiriladi. Molekulalarida besh-to'qqiz uglerod atomi (shuningdek, izobutirik kislota) mavjud bo'lgan kislotalar - yog'li qobiqlar, ularning suvdagi xilma-xilligi kichik.
Vishchi kislotalari (10-tur) qattiq jismlar bo'lib, ular suvdan deyarli farq qilmaydi, distillanganda, buyuk aqllarning ongida hidlar chiqariladi.
Murashina, oktova va propion kislotasi issiq hidni his qilishi mumkin; qatorning o'rta a'zolari nomaqbul hidga ega bo'lishi mumkin, eng kislotalilari hidlamaydi.

Karboksilik kislotalarning jismoniy kuchlari bo'yicha, suv aloqalari o'rnatilgandan so'ng sezilarli darajada bog'lanish ko'rsatiladi. Kislotalar slyudali suv bog'larini hosil qiladi, O-H bog'ining parchalari kuchli qutblangan. Bundan tashqari, karboksilik kislotalar karbonil dipolda kislota atomining ishtiroki uchun suv aloqalarini yaratishi mumkin, bu muhim elektronegativ bo'lishi mumkin. Darhaqiqat, qattiq va noyob po'latda karboksilik kislotalar asosan tsiklik ko'rinadigan dimerlarda topiladi: 
Bunday dimerik tuzilmalar polar bo'lmagan sotuvchilarda naslchilik zavodlarida gazga o'xshash zavodda yaratiladigan qo'shiq dunyosi tomonidan saqlanadi.
Kimyoviy quvvat
Kislotalar uchun uch turdagi reaksiyalar xarakterlidir: ionni suvli karboksil guruhi (tuzlari) bilan almashtirish; gidroksil guruhining ishtiroki uchun (katlanmış efirlar, kislota galogenidlari, kislota angidridlari ta'siri); suvni radikallar bilan almashtirish.
Tuz eritmasi. Karboksilik kislotalar metallar, ularning oksidlari, o'tloqlar yoki asoslar, ammiak yoki aminlar bilan o'zaro ta'sirlashganda tuzlarni osongina eritadi:
Karboksilik kislotalarning tuzlari xalq davlati tomonidan keng qo'llaniladi. Noxush hid polimer materiallarni katalizator, stabilizator sifatida, farb tayyorlashda va h.k.
Utvorennya buklangan efíriv. Kislota spirtlari bilan va katlama efirlarini bering:

Galogen kislotalarni kamaytirish. Kislota galogenidlarini fosforga yoki SOC1 2 ga bo'lishda kislota galogenidlari paydo bo'ladi:

Halogen angidridlar eng reaktiv nutq bo'lib, ular turli sintezlar uchun ishlatilishi mumkin.
Utvorennya kislota angidridlari. Karboksilik kislotalarning ikkita molekulasiga qo'shimcha ravishda, bir molekula suvni oling (suvda eruvchan nutq P 2 Pro 5 va ichida), karboksilik kislota angidridi eriydi:

Kislota angidridlari, kislota galoidlari kabi, yanada faolroqdir; hidlar faol suv bilan turli qatlamlarda yotqizilib, zaharli kislotalar va erkin kislotalarni osonlashtiradi:

Karboksilik kislotalarning galogenlanishi. Kislotalardagi uglevod radikallaridagi suvli atomlar reaksiyaga kirishish qobiliyatiga ko'ra alkanlardagi suv atomlariga o'xshaydi. Vignatok atom va suvga aylanadi, roztashovani at -karbonat atomi (karboksil bilan vositachi bog'lanishsiz). Shunday qilib, karboksilik kislotalarda yoki ularning kislotali xloridlarida galogenlarning (PC1 3, 1 2 va in) tashuvchilari ishtirokida xlor va brom ishtirokida a-suv atomlarining o'zi o'rnini bosadi:

Diya okislyuvachiv. Monobasik karboksilik kislotalar, mustahkam, dioksidlanishga chidamli. Ko'proq murashik kislota (2 í H 2 Pro gacha) va a-holatida uchinchi darajali uglerod atomiga ega bo'lgan kislotalar oson oksidlanadi. Oksidlanganda qolgan gidroksi kislotalar ajralib chiqadi:

Jonivorlarda bir asosli karboksilik kislotalar ham oksidlanadi va oksidlovchi atom har doim b-holatda to'g'ri bo'ladi. Masalan, qandli diabet bilan og'rigan bemorlarning organizmida butirik kislota b-gidroksibutirik kislotaga aylanadi:
Utvennya ketonlar Ketonlarni hosil qilish uchun karboksilik kislotalarning (krem chumoli kislotasi) kaltsiy va bariy tuzlarini quruq distillash. Shunday qilib, CaCO 3 va CH 3 COOH dan olingan kaltsiy asetatni distillash paytida dimetil keton, kaltsiy propionat - dietil ketonni distillash paytida eritiladi:

Utvorennya amidlar. Ammoniy kislotalarning tuzlari qizdirilganda amidlar paydo bo'ladi:
Utvorennya uglevodlarda. Karboksilik kislotalarning ko'lmak metallarining tuzlari o'tloqlar (piroliz) bilan birlashganda, karbonli nayzaning bo'linishi va dekarboksillanish sodir bo'ladi, buning natijasida kislotaning uglevod radikalida uglevod eriydi, masalan:
Eng muhim vakillari
Murashik kislota - kuchli hid bilan bezbarvna vatan. Kuchli agent sifatida u karbonat kislotaga oksidlanadi. Tabiatda murashina kislotasi chumolilar ko'rinishida, qichitqi o'tining sharbatida, jonzotlarning terida kuchli. Chumoli kislotadan gazlamalar tayyorlash jarayonida prujina sifatida, terilarni ko'nlashda, tibbiyotda, turli organik sintezlarda foydalanish.
Optik kislota - kuchli hid bilan bezbarvna vatan. Suv atirgul (70-80 %) ozon kislotasi malham mohiyati, 3-5% suvli eritmasi esa stol malhami deyiladi.
Optik kislota tabiatda keng qo'llaniladi. U jangda, terda, zhovch va shkir mavjudotlarida, roslinlarda o'ch oladi. asetat brodinní rídin, alkogol (sharob, pivo va boshqalar) scho qasos bilan Utvoryuêtsya.
Kimyo sanoatida asetat tikuvi, barvnikov, katlama efirlari, aseton, oktoik angidrid va tuzlar ishlab chiqarish uchun keng qo'llaniladi. Kharchovyy sanoatida oktova kislotasi mahsulotlarni konservalash uchun o'rinlidir va qandolatchilik pivo zavodida oktovoy kislotasining katlanadigan efirlari turg'un bo'ladi.
Olik kislota ê qabul qilib bo'lmaydigan hidli uy. Sigir yog'idagi buklanadigan efirga qarang. girkiy olííí yilda vílny staní znahoditsya da.
2. Ikki asosli karboksilik kislotalar
Chegaraviy ikki asosli kislotalarning gomologik qatorining Zagal formulasi ![]()
Misollar bo'lishi mumkin:

Chegaraviy ikki asosli kislotalar qattiq kristalli nutqdir. Xuddi shunday, u bir asosli kislotalar uchun mo'ljallangan bo'lganidek, uglerod atomlarining juft soniga ega bo'lgan chegara ikki asosli kislotalar yuqori haroratda eriydi, uglerod atomlarining juft bo'lmagan soniga ega bo'lgan qattiq homologlar pastroq. Juftlanmagan miqdordagi uglerod atomlari bo'lgan suvdagi kislotalarning xilma-xilligi ugleroddagi juft atomli kislotalarning xilma-xilligiga qaraganda sezilarli darajada kattaroqdir, bundan tashqari, suvdagi kislotalarning xilma-xilligi umr ko'rish davomiyligi bilan o'zgaradi.
Ikki asosli kislotalar ketma-ket dissotsiatsiyalanadi:
Eng kuchli monobazik kislotalar uchun hid kuchli. Ikki asosli kislotalarning dissotsilanish darajasi ularning molekulyar massasining ortishi bilan kamayadi.
Ikki asosli kislotalarning molekulalarida ikkita karboksil guruhi mavjud bo'lib, ular ikki qator o'xshash hidlarni beradi, masalan, o'rta va kislotali tuzlar, o'rta va kislotali buklangan efirlar:

Qizdirilganda oksalat va malon kislotalari CO 2 ni osongina chiqaradi:
Molekulasida beshta uglerod atomiga ega bo'lgan ikki asosli kislotalar, ya'ni süksinik va glutar kislotalar qizdirilganda suv elementlarini ajratib, ichki siklik angidridlarni beradi:

3. To'yinmagan karboksilik kislotalar
Bir bog'liq bo'lgan mavjud bo'lmagan monobazik kislotalarning omborini umumiy formula C n H 2 n -1 COOH bilan ko'rsatish mumkin. Har qanday bifunksional yarmi singari, ular kislotalar va olefinlar kabi reaktsiyalar bilan tavsiflanadi. a.b-asosiy bo'lmagan kislotalar yog 'kislotalarining kuchidan osonlikcha oshib ketishi mumkin, karboksil guruhi tartibida joylashgan bog'liq bo'g'inlarning bo'laklari kislotalik kuchini kuchaytiradi.
Akril kislota Eng oddiy to'yinmagan monobazik kislota
Oleinova, linoleik va linolenik kislotalar.
Oleyk kislotasi H 17 H 33 COOH ko'rinishida glitserin efiri tabiatda tildan tashqari kengayadi. Їí Budova formula bilan ifodalanadi
Oleyk kislota barrelsiz yog'li muhit bo'lib, suvdan engilroq, sovuqda 14 ° C da eriydigan kristalning asosiy qismida qattiqroq bo'ladi. Uning yuzasida sariq rang oksidlanadi.
Oleyk kislota molekulasi halogenga ikkita atom qo'shishga qodir: 
Katalizatorlar ishtirokida, masalan, Ni, oleyk kislota stearin kislotasiga o'tib, suvning ikki atomini qo'shadi.
Oleyk kislotasi sis-izomerdir (barcha tabiiy ravishda to'yinmagan yuqori molekulyar kislotalar, qoida tariqasida, cis-seriyadan oldin keladi).
Linoleva Z 17 H 31 COOH va linolenik Z 17 H 29 COOH kislotalari ko'proq to'yinmagan, quyi oleyk kislotadir. Glitserin bilan katlamali efirlarga o'xshaydi glitseridlar- hid ê bosh saqlash lyanoí̈ va kanop olíy:

Linoleik kislota molekulasi ikkita pastki havolaga ega. Won chotiri atom va suv chi galogen kelishi mumkin. Linoleik kislota molekulasi uchta pastki bo'g'inga ega bo'lib, u suvga galogenga oltita atom qo'shadi. Obidvi kislotasi, keladigan suv, stearin kislotasidan o'tadi.
Sorbin kislotasi
Trans-konfiguratsiyaga ega bo'lishi mumkin bo'lgan qaram bo'g'inning karboksil guruhi bilan bittadan ikkitasi olinishi mumkin; ê boy oziq-ovqat mahsulotlari uchun mo''jizaviy konservant: sabzavot konservalari, sirop, margarin, meva, baliq va go'sht mahsulotlari.
Maleinova va fumarik kislota. Etilen aloqalarini yo'q qilish uchun ikki asosli kislotalarning eng oddiylari ikkita strukturaviy izomerdir:

Bundan tashqari, boshqa kislotalar uchun ikkita mumkin bo'lgan konfiguratsiya mavjud:

Fumar kislotasi boy roslinlarda mavjud: u ayniqsa qo'ziqorinlarda keng tarqalgan. Malein kislotasi tabiatda uchramaydi.
Molik (oksiksüksin) kislotasi bilan qizdirilganda kislotaning buzilishi yo'q qilinadi:
To'liq himoya isitish bilan fumarik kislota bosh darajasi sifatida chiqadi; kuchliroq isitish bilan, molik kislotani distillash paytida malein kislotasi chiqadi.
Fumar va malein kislotasi berilganda bir xil burstin kislotasini beradi.
karboksilik kislotalar Karboksil guruhi joylashgan yarim qobiqlarni nomlang:
Karboksilik kislotalar quyidagilarga bo'linadi:
- bir asosli karboksilik kislotalar;
- ikki asosli (dikarboksilik) kislotalar (2 guruh UNSD).
Budovi karboksilik kislotalar quyidagilarga bo'linadi:
- alifatik;
- alitsiklik;
- aromatik.
Karboksilik kislotalarni qo'llang.


Karboksilik kislotalarga ega bo'lish.
1. Birlamchi spirtlarni kaliy permanganat va kaliy bixromat bilan oksidlanishi:

2. Bir uglerod atomida 3 ta galogen atomini almashtiruvchi uglevodlardagi galogen almashinuvlarining gidrolizlanishi:
3. Sianidlardan karboksilik kislotalarning saqlanishi:
Qizdirilganda nitril erigan ammoniy asetat bilan gidrolizlanadi:
Kislotalanganda har qanday kislota tushadi:
4. Grignard reagentlarining varianti:
5. Yig‘iladigan efirlarning gidrolizi:
6. Suvsiz kislotalarning gidrolizi:
7. Karboksilik kislotalarni saqlashning o'ziga xos usullari:
Chumoli kislotasi uglerod oksidi (II) bosim ostida chang natriy gidroksid bilan qizdirilganda chiqadi:
Optik kislota butanning kislotalanish orqali katalitik oksidlanishiga ega:
Benzo kislotasi gomologlarning kaliy permanganat bilan oksidlangan monosubstitusiyalari bilan chiqariladi:
Kannitsiaro reaktsiyasi. Benzaldegid xona haroratida 40-60% natriy gidroksid bilan ishlov beriladi.

Karboksilik kislotalarning kimyoviy kuchi.
Suvda karboksilik kislotalar dissotsilanadi:

Rivnavaga chapga katta zarar etkazdi, chunki karboksilik kislotalar kuchsizdir.
Himoyachilar kislotalilikni induktiv ta'sirga kiritadilar. Shunday qilib, shafoatchilar nosozliklarning elektron kuchi bilan zaryadlanadi va ular salbiy induktiv ta'sirni (-I) ayblashadi. Elektron qalinlashuvning kuchlanishini kislotaning kislotaliligini oshirishga keltiring. Elektrodonor o'rnini bosuvchi moddalar musbat induktiv zaryad hosil qiladi.

1. Utvornya tuzlari. Asosiy oksidlar, kuchsiz kislotalar tuzlari va faol metallar bilan reaksiya:

Karboksilik kislotalar kuchsiz, chunki mineral kislotalar va vitaminlar ularni suvli tuzlardan olib tashlash uchun:
2. Funksional o'xshash karboksilik kislotalarning qabul qilinishi:
3. Sulfat kislota ishtirokida kislotani spirt bilan qizdirganda yig’iladigan efirlar – esterlanish reaksiyasi:
4. Utvorennya amidlar, nitrillar:
3. Kislotalarning kuchi uglevod radikalining kuchiga o'xshaydi. Qizil fosfor ishtirokida reaksiya shunday davom etib, tajovuzkor mahsulotni hosil qiladi:
4. Reaktsiya keladi.

8. Dekarboksillanish. Reaktsiya o'tloqni sillujli metall karboksilik kislotadan qotishma orqali amalga oshiriladi:
9. Ikki asosli kislota oson hazm bo'ladi CO 2 qizdirilganda:
Mavzu bo'yicha qo'shimcha materiallar: Karboksilik kislotalar.
Kimyo kalkulyatorlar |
|
| Kun va kunni yakunlash uchun saytimizda onlayn kimyo. | |
Mayzhe barcha uylarda taxminiy hisoblanadi. Men ko'proq odamlar yoga asosi nima ekanligini bilaman. Ale scho tongning ê z kimyoviy nuqtalarini qo'lga kiritdi? Bu xususiyatlarni seriyada yana qanday qilib topishingiz mumkin? Keling, har bir ozuqa bilan bir asosli karboksilik kislotalarning chegaralarini saralashga harakat qilaylik. Tim xonada nafaqat otstova, balki boshqa, lekin shunga o'xshash kislotalar teri kabinasida mehmon yallig'langan qismlarini qolish ehtimoli ko'proq.
Karboksilik kislotalar sinfi: global xarakteristikasi
Kimyo fani nuqtai nazaridan, birinchi sinfga qadar sissin molekulalarini kiritish mumkin, chunki ular ayniqsa guruhlangan atomlar - karboksil funktsional guruh bo'lishi mumkin. Von BMTni ko'rishi mumkin. Shu tarzda, chegaraviy monobazik karboksilik kislotalar sifatida ishlatilishi mumkin bo'lgan yakuniy formula quyidagicha ko'rinadi: R-COOH, bu erda R qisman radikaldir, shuning uchun siz bir qator uglerod atomlarini kiritishingiz mumkin.
Vídpovídno gacha tsgogo, vyznachennya berilgan sinf spoluk bunday berilishi mumkin. Karboksilik kislotalar organik kislotali molekulalar bo'lib, ular bir yoki bir nechta funktsional guruhlar - COOH - karboksil guruhlarini o'z ichiga oladi.
Nutqni kislotalardan oldin qo'yadiganlar, karboksildagi suv atomining beqarorligi bilan izohlanadi. Elektron qalqon notekis taqsimlangan, chunki kislota guruhdagi eng elektronegativ hisoblanadi. O-H aloqalari kuchli qutblanishi bilan atom yanada yallig'lanadi. Vinni ko'rish oson, kimyoviy o'zaro ta'sirga kirishadi. Ushbu kislotaga vidpovidnih _ko'rsatkichlar quyidagi reaktsiyani beradi:

Zavdyaki atom suvi, karboksilik kislotalar kuch oksidlarini ko'rsatadi. Biroq, boshqa atomlarning mavjudligi ularga tanish bo'lishga, boshqa o'zaro ta'sirlarning boyligida ishtirok etishga imkon beradi.
Tasniflash
Siz karboksilik kislotalar guruhlariga bo'linadigan asosiy belgilarning spratini ko'rishingiz mumkin. Birinchisi, radikalning tabiati. Cym omilining orqasida:
- Alitsiklik kislotalar. Misol: xinna.
- Aromatik. misol: benzoin.
- Alifatik. Butt: otsov, akril, shavleva va boshqalar.
- Geterotsiklik. Misol: nikotin.
Agar molekuladagi aloqalar haqida gapiradigan bo'lsak, unda ikkita kislota guruhini ham ko'rishimiz mumkin:

Shuningdek, tasniflash belgisi bir qator funktsional guruhlar bo'lishi mumkin. Shunday qilib, siz bunday toifalarni ko'rasiz.
- Monobasik - bir nechta COOH guruhi. Stok: murashina, stearin, butan, valerian va boshqalar.
- Ikki asosiy- Vídpovídno, ikki guruh -SOON. Butt: shchavleva, malonova va boshqalar.
- Boy asosiy- limon, sut mahsulotlari va boshqalar.
Tarix
Vinochilik qadim zamonlardan beri rivojlangan. Va, ko'rinishidan, uning mahsulotlaridan biri oktova kislotasi. Shu sababli, ushbu sinfning mashhurligi tarixi Robert Boyl va Iogann Glauberning soatlarida ildiz otgan. Biroq, bu molekulalarning kimyoviy tabiatiga kelsak, u uzoq vaqt davomida muhokama qilinmagan.
Va uzoq vaqt davomida ular tirik mohiyatsiz organik moddalarni yaratish imkoniyatini aytib beradigan vitalistlardan hayratda qolishdi. Ale, allaqachon 1670 yilda D. Rey birinchi vakili - metan yoki chumoli kislotani kattalashtirdi. Zrobiv vinosi, tirik chumolilarning kolbasini isitish.
Keyinchalik Berzelius va Kolbe olimlari noorganik nutqlardan (yog'och junini distillash orqali) bu sporalarni sintez qilish imkoniyatini ko'rsatdilar. Natijada bula otstov tomonidan olib ketilgan. Bu daraja, karboksilik kislotalar (jismoniy kuch, budova) tug'ilgan va past alifatik spoluk barcha boshqa vakillari tan olinishi uchun zapochatkovo.
Jismoniy kuch
Bu yil barcha vakillar haqida xabar berildi. Teri z uchun, sanoatda zastosuvannya va tabiatda perebuvannya, shu jumladan, barcha parametrlarning xususiyatlarini bilish mumkin. Keling, karboksilik kislotalar nima ekanligini, ularning va boshqa parametrlarini ko'rib chiqaylik.
Bundan tashqari, siz bir nechta asosiy xarakterli parametrlarni nomlashingiz mumkin.
- Nayzalardagi ko'mirning bir necha atomlari kabi, ular beshtasiga etib boradilar, kuchli hidlaydi, chirigan va letki yorqin rangga ega. Beshdan ortiq - muhim yog'li nutq, ko'proq - qattiq, kerosinga o'xshash.
- Birinchi ikki vakilning soni yolg'izlik bilan to'lib-toshgan. Reshta suv olish uchun yotdi.
- Qaynayotgan harorat: lansyug qancha ko'p bo'lsa, shuncha ko'p pokaznik. Chim razgaluzhenisha tuzilishi, tim quyida.
- Erish nuqtasi: nayzadagi ko'mirdagi atomlar sonining paritetida cho'kish. Yigitlarda juda ko'p narsa bor, qo'shilmaganlar esa pastroq.
- Suv bilan ular yaxshiroq ishlaydi.
- Zdatni utvoryuvat mítsní vodny zv'yazki.

Bunday xususiyatlar hayotning simmetriyasi, shuningdek, hayotning billur devorlari va donoligi bilan izohlanadi. Eng oddiy va tuzilgan molekulalar nima, bu asosiy ko'rsatkichlar, karboksilik kislotalarni qanday berish kerak. Ushbu spoluchalarning jismoniy kuchlari gallusni va ularning fahshda g'alaba qozonish usullarini tanlashga imkon beradi.
Kimyoviy quvvat
Biz ko'proq nazarda tutganimizdek, berilgan kislotalar farq kuchini ko'rsatishi mumkin. Reaksiyalar qisman boy spolukning sanoat sintezi uchun muhim ahamiyatga ega. Sezilarli darajada eng muhim kimyoviy kuch, yaki monobazik karboksilik kislotani ko'rsatishi mumkin.
- Dissotsiatsiya: R-COOH = RCOO - + H +.
- U asosiy oksidlar bilan, shuningdek, ularning gidroksidlari bilan o'zaro ta'sir qilishini ko'rsatadi. Oddiy metallar bilan ular standart sxema bilan o'zaro ta'sir qiladi (ular uchun suvga qadar kuchlanish qatorida turish yaxshiroqdir).
- Kuchli kislotalar (noorganik) bilan u asos sifatida ishlatiladi.
- Zdatna birlamchi spirtga v_dnovlyuvatsya.
- Maxsus reaktsiya esterifikatsiyadir. Tse vza'modíya zí spirtlar z utvorennyam katlanadigan mahsulot - efir.
- Dekarboksillanish reaktsiyasi, ya'ni karbonat angidrid molekulalarining molekulaning yarmidan bo'linishi.
- Fosfor va oltingugurt kabi elementlarning halidlari bilan Zdatna vzaimodiyati.

Shubhasiz, ko'plab boy qirrali karboksilik kislotalar mavjud. Jismoniy ustunlik, kimyo kabi, dosit raznomanytny. Boshqa tomondan, shuni ta'kidlash kerakki, kuch yordamida, kislota kabi, barcha organik molekulalar noorganik hamkasblariga nisbatan zaifdir. Їxní dissotsilanish konstantalari 4.8 indikatoridan oshmaydi.
Chiqarish usullari
Chegarani olib tashlashingiz mumkin bo'lgan asosiy usullardan foydalaning karboksilik kislotalar .
1. Laboratoriyada oksidlovchi:
- spirtli ichimliklar;
- aldegidlar;
- alkiniv;
- alkilbenzollar;
- alkenlarni yo'q qilish.
2. Gidroliz:
- qatlamli efirlar;
- nitril;
- amidlar;
- trihaloalkanlar.
4. Sanoatda sintez nayzada ko'p miqdordagi uglerod atomlari bo'lgan uglevodlarning oksidlanishini kamaytiradi. Jarayon anonim qo'shimcha mahsulotlarni chiqarishdan kilka bosqichlarida amalga oshiriladi.
5. Deyaki okremi kislotasi (murashina, ottova, butirik, valerian va boshqalar) o'ziga xos yo'llarga, o'ziga xos tabiiy ingredientlarga ega.
Chegaraviy karboksilik kislotalarning asosiy asoslari: tuzlar
Karboksilik kislotalarning tuzlari sanoatning muhim qismidir. Qolganlarning o'zaro ta'siri natijasida hid paydo bo'ladi:
- metallar;
- asosiy oksidlar;
- o'tloqlar;
- amfoter gidroksidlar.

Qalay metallari, natriy va kaliy va katta chegara kislotalari - palmitik, stearik o'rtasida joylashgan o'rta bo'lgan qiymatlar ayniqsa muhimdir. Aje shunga o'xshash o'zaro bog'liqlik mahsulotlari - shirin, noyob va mustahkam.
Mila
Shunday qilib, shunga o'xshash reaktsiyani qanday qilish kerak: 2C 17 H 35 -COOH + 2Na \u003d 2C 17 H 35 COONa + H 2,
keyin tashkil etilgan mahsulot - natriy stearat - o'z tabiatiga ko'ra, juda aziz shirin, erta oqlik uchun g'olib bo'ladi.
Agar siz kislotani palmitik bilan, metallni kaliy bilan almashtirsangiz, u holda kaliy palmitati kamdan-kam hollarda qo'llar uchun shirin bo'ladi. Shuning uchun ishonch bilan aytish mumkinki, karboksilik kislotalarning tuzlari organik tabiat tomonidan haqiqatan ham muhimdir. Bu kasb o'z miqyosida juda katta. Agar siz odamlarning er yuzida qanchalik yoqimli bo'yalgan teriga ega ekanligini ko'rsatishni istasangiz, unda o'lchovni ko'rsatish noqulay.
Karboksilik kislotalarning efirlari
Organik nutqlarning tasnifida o'z o'rniga ega bo'lishi mumkin bo'lgan spoluklarning maxsus guruhi. Ce sinf utvoryuyuyutsya alkogol bilan karboksilik kislotalar reaktsiyasida hid. Bunday o'zaro ta'sirlarning nomi esterifikatsiya reaktsiyalaridir. Yorqin ko'rinishni teng ko'rsatish mumkin:
R, -COOH + R "-OH \u003d R, -COOR" + H 2 O.
Ikki radikal va ê buklangan efir mahsuloti. Shubhasiz, reaktsiya natijasida karboksilik kislota, alkogol, parchalanuvchi efir va suv sezilarli o'zgarishlarni tan oldi. Shunday qilib, suv kislota molekulasi sifatida kationga o'xshaydi va gidrokso-guruh bilan aralashadi, u spirtga bo'linadi. Urush natijasida suv molekulasi hosil bo'ladi. Kislotadan tashqarida qolgan guruhlash spirtda o'ziga radikal qo'shib, katlamali efir molekulasini hosil qiladi.

Nima uchun bu reaktsiyalar juda muhim va ularning mahsulotlarining ma'nosi qanday? Hammasi o'ng tomonda, buklangan havolar g'alaba qozonadi:
- oziq-ovqat qo'shimchalari;
- aromatik qo'shimchalar;
- parfyumni saqlash komponenti;
- chakana sotuvchilar;
- laklar, farb, plastmassa komponentlari;
- dorilar va boshqalar.
Ular virobnitlarning va'dalariga sodiq bo'lishlari uchun, behayolikda, keng qamrovli so'zlarni berish kerakligini angladim.
Etan kislotasi (otsova)
Bu alifatik qatorning monobazik karboksilik kislotasining chegarasi, chunki u butun dunyoda eng ko'p ishlatiladiganlardan biridir. Formula vv - CH 3 COOH. Bunday kenglik o'z kuchlari ustidan g'alaba qozondi. Adzhe spheri її vikoristannya vkrai shirokí.
- Vaughn ê grub qo'shimchasi E-260 kodi ostida.
- saqlash uchun kharchovíy sanoati da Vykoristovuêtsya.
- dorivor mahsulotlar sintezi uchun tibbiyotda Zastosovuetsya.
- Otrimanni zapashnyh spolok uchun komponent.
- Chakana sotuvchi.
- Do'stlik, uydirma jarayonining ishtirokchisi.
- Kimyoviy sintez va anonim nutqlarning reaktsiyalarida zaruriy komponent.
Misol uchun, farqlarning 80% ostovoy mohiyati deb ataladi va agar siz uni 15% ga suyultirsangiz, u holda vide shunchaki taxminiy hisoblanadi. Sof 100% kislotasi krizhanoy otstovoy deb ataladi.
Murashik kislota
Naipershy va bu sinfning eng oddiy vakili. Formula HCOON. Shuningdek, u E-236 kodi ostida oziq-ovqat qo'shimchasi hisoblanadi. ̛̛̛̛̛̛̱̱̱̱̱̱̰̱̰̰̰̰̰̰̰̰̰̰̰̰̳̱̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̳̈̈y zherela:
- murakhi ta bjoli;
- qichitqi o'ti;
- ignalar;
- mevalar.
Vikoristannyaning asosiy galereyalari:
Bundan tashqari, jarrohlikda kislotalilik va vikariylikdagi farq antiseptikga o'xshaydi.