11-bob kimyoviy kuchlar, jumladan kislotalar va asoslar mavzusini davom ettiradi.
Kimyo bilan 11-sonli ODE topshiriqdan oldin nazariya
Kislotalar
Men taxmin qilaman kislotalar - bular protonlarda (H+) ajraladigan kimyoviy birikmalardir. Eng oddiy kislotalar - xlorid kislota (HCl), kislota (H2SO4), nitrat kislota (HNO3) ishlatiladi.
Asoslar
Asoslar g - gidroksid ionlariga (OH-) ajraladigan birikmalar.
Eng oddiy eritmalar kaliy va natriy gidroksiddir (KOH va NaOH). Ularni kaustik deb atashlari bejiz emas. Hidi kuchli bo'lib, teriga urilganda chaqadi. Shuning uchun ularni kamsitish xavfsiz emas.
Keling, ushbu sinflarning kimyoviy organlarini ko'rib chiqaylik.
Kislotalarning kimyoviy kuchi
Biz kislotalarning tasnifini ko'rib chiqdik. Kimyoviy idoralarni qo'shimcha tekshirishdan oldin, ular tabiiy gaz kislotalarining tasnifini aniqlashni tavsiya qilaman.
Keling, kislotalarning kuchlarini ko'rib chiqishga o'tamiz:
- asosiy oksidlar bilan reaksiya: qoida tariqasida, kaltsiy oksidi va xlorid kislotasi o'rtasida reaktsiya paydo bo'ladi. Ushbu reaktsiyaning mahsulotlari tuz - kaltsiy xlorid, muzli yo'llarni qoplaydigan narsa va biz har kuni ichadigan suv.
- amfoter oksidlar bilan reaksiya masalan, sink oksidi:
- o'tloqlardan kislotalarning reaktsiyasi neytrallash deb ataladi. Misol tariqasida, natriy gidroksidning xlorid kislotasi bilan reaktsiyasi indüklenir, mahsulotlar tuz (bu holda oshxona) va suvdir.
- tuzlar bilan almashinish reaksiyalari, agar reaksiya natijasida alkogolsiz modda yoki gaz hosil bo'lsa. Qoidaga ko'ra, bariy xloridning sulfat kislota bilan reaktsiyasi qo'zg'atiladi, buning natijasida bariy sulfat va uchuvchi xlor cho'kmasi hosil bo'ladi.
- buzilmagan asoslar bilan reaktsiya, masalan, sulfat kislotadan mis gidroksidi:
- ularning tuzlaridan kuchsiz kislotalarning konsentratsiyasi, masalan, fosfor kislotasining xlorid kislota bilan tuzlari:
- metallar bilan reaksiya, magniyning xlorid kislotasi bilan suv - ko't - reaktsiyasidagi kuchlanish yonida nima turish kerak:
Asoslarning kimyoviy kuchi
Printsiplarning kimyoviy tamoyillarini o'rganishdan oldin, printsiplarning tasnifini tushunish muhimdir.
Keling, kuchning kimyoviy tamoyillarini tahlil qilishga o'tamiz:
- kislotalar bilan reaktsiya o'tkazildi - neytrallanish reaktsiyasi
- amfoter asoslar bilan reaksiya, masalan, sink va alyuminiy gidroksid:
- kislota oksidlari bilan reaksiya tuz va suv bilan. Butt - natriy gidroksidning kremniy oksidi bilan reaktsiyasi (shisha):
- tuzlar bilan almashinish reaksiyalari Qamal yoki gaz (ammoniya) qanday hosil bo'ladi. Misol - bariy gidroksidning natriy sulfat bilan reaksiyasi:
Kimyo bilan ODE spetsifikatsiyasining tipik variantlarini tanlash
Zavodning birinchi versiyasi
Xlorid kislotasi bilan reaksiyaga quyidagilar kiradi:
- nitrat sribla
- bariy nitrat
- sriblo
- kremniy oksidi
Keling, terining holatini ko'rib chiqaylik:
- Xlorid kislotasi va nitrat kesiladi. Sliver nitrat bo'laklari tuz bo'lib, yog'ingarchilik va gaz reaktsiyasini tayyorlash sifatida almashinuv reaktsiyasi mumkin. Mahsulotni nitrat kislota bilan qanday eritish mumkin (kamaytirilgan) va sriblo xloridA (yaralmagan - oq sirny qamal ). Bu shuni anglatadiki, reaktsiya mumkin va bu biz uchun javobdir.
- Bariy nitrat va xlorid kislotasi. Bu almashinish reaksiyasi mahsulotlari razchinni (azot kislotasi va bariy xlorid), shuning uchun reaktsiya yo'q .
- Sriblo suvdan keyin bir qatorda turing, shuning uchun oksidlovchi bo'lmagan kislotalar bilan reaksiyaga kirishmaydi V.
- Silikon oksidi - kislota oksidi і kislotalar bilan reaksiyaga kirishmaydi .
Kisli Smak, izndikatori boyicha di, eektrik pro -vidniy, amfoter oksidlar bilan asosiy, tuproqlar asoslari, efirv spirtlar omborlarini xiralashtiruvchi - organik kislotalarga kuch quvvati.
1. Suvda kislotalar suv kationlariga va kislotali ortiqcha anionlarga ajraladi, masalan:
Kislotalarning rangi indikatorlarning rangini o'zgartiradi: lakmus - qizil vinolar uchun, metil apelsin - qizilcha uchun, fenolftaleinning rangi o'zgarmaydi.
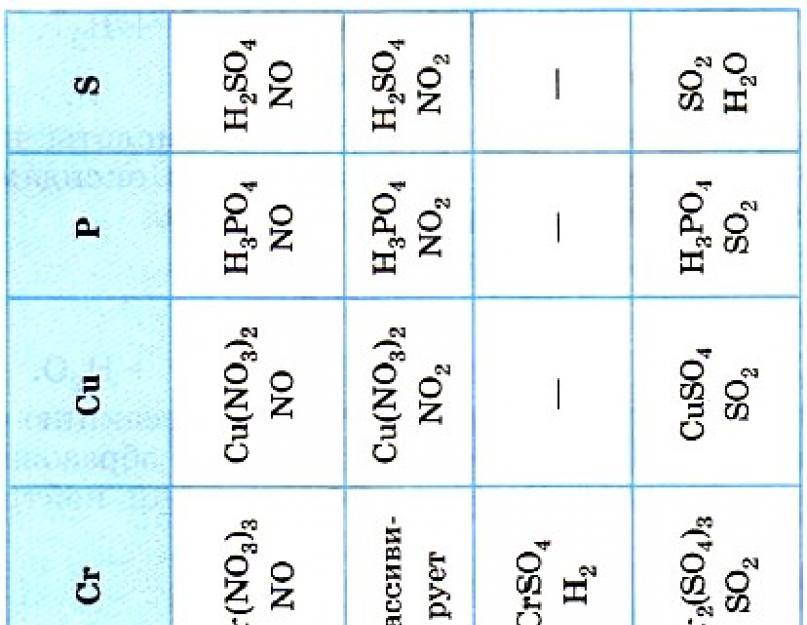
2. Vayron qiluvchi kislotalar elektrokimyoviy qatorda to'g'ridan-to'g'ri suv ustida turgan metallar bilan reaksiyaga kirishadi, ularning eng muhimi erigan tuzning reaktsiyasi natijasida hosil bo'lgan bir qator aqllarni qo'shish uchun. Noorganik va organik kislotalarning kuchini hisobga oladigan bo'lsak, HNO 3 va H 2 SO 4 (kons.) ning metallar bilan o'zaro ta'siri (19-jadval) boshqacha tarzda borishi aniq, ammo belgilangan kislotalarning o'ziga xos xususiyatlari keyinroq tushuntiriladi.
19-jadval
O'zaro ta'sirli mahsulotlar
nitrat va sulfat kislotalar bilan oddiy birikmalar

3. Noorganik va organik kislotalar asosiy va amfoter oksidlar bilan o‘zaro ta’sirlanib, zararli tuzlar hosil qiladi:

4. Ham kislotalar, ham boshqa kislotalar asoslar bilan reaksiyaga kirishadi. Ko'p asosli kislotalar neytral va kislotali tuzlarni zararsizlantirishi mumkin (neytralizatsiya reaktsiyasi orqali):

5. Kislotalar va tuzlar orasidagi reaksiya gaz yoki cho‘kma hosil bo‘lgandagina sodir bo‘ladi:

Fosfor kislotasi H 2 PO 4 ning kaltsiy fosfat Ca 3 (PO 4) 2 bilan o'zaro ta'siri sirtda qolgan buzilmagan cho'kma hosil bo'lishi orqali qo'llaniladi.
6. Qatlamli efirlarni faqat organik kislotalar bilan emas, balki kislotalar ham davolaydi:

Azot kislotasi va oltingugurt kabi barcha noorganik kislotalar:
Nitratlanganda tsellyulozaning ikki yoki uchta gidroksil guruhini o'z ichiga olgan shunga o'xshash reaktsiya katlama efirlarini olib tashlashga olib keladi: di-trinitroselüloza - tutunsiz porox ishlab chiqarish uchun zarur moddalar.
Hozirgi vaqtda mineral va organik kislotalarning vakillari alohida kuchga ega.
Azot HNO 3 va konsentrlangan oltingugurt H 2 SO 4 (kons.) kislotalarning kuchining o'ziga xos xususiyati shundaki, ular oddiy moddalar (metall va metall bo'lmagan) bilan o'zaro ta'sirlashganda oksidlovchi moddalar H+ kationlari bilan emas, balki nitrat va nitrat bilan reaksiyaga kirishadi. sulfat-ionlari. Bunday reaktsiyalar natijasida suv H 2 emas, balki boshqa moddalar ajralib chiqishini tushunish mantiqan to'g'ri keladi: bog'lovchi tuz va suv, shuningdek, yangilangan nitrat yoki sulfat ionlari mahsulotlaridan biri. konsentratsiyasi ííí kislotalar, bir qator kuchlanish va drenaj reaktsiyalarida metallning holati (harorat, metall detallashtirish darajasi va boshqalar).
Shuni ta'kidlash kerakki, metallarning ushbu kislotalar bilan reaktsiyasining uchinchi mahsuloti ko'pincha boshqa mahsulotlar bilan birlashtirilgan "guldasta" da hosil bo'ladi va 19-jadvalda eng muhim mahsulotlar ko'rsatilgan.
HNO 3 va H 2 SO 4 (kons.) kimyoviy xatti-harakatlarining bu xususiyatlari moddalar molekulalarida atomlarning o'zaro kelishi haqidagi kimyoviy reaksiya nazariyasini aniq ko'rsatib beradi. Bundan tashqari, shish va chumolilar kabi organik kislotalarning kuchi yordamida davolash mumkin.
Otik kislota CH 3 COOH, boshqa karboksilik kislotalar kabi, molekulada uglevod radikalini o'z ichiga oladi. Ba'zi mumkin bo'lgan reaktsiyalar suv atomlarini halogen atomlari bilan almashtirishni o'z ichiga oladi:
Kislota molekulasiga galogen atomlari kiritilsa, uning dissotsilanish bosqichi ancha rivojlangan. Masalan, xloroktik kislota 100 marta kuchliroq (nima uchun?).
Murashin kislotasi HCOOH esa uglevod radikal molekulasida yo'q. Atomni suv bilan almashtirish o'rniga, shuningdek, ikkita funktsiyali - aldegid kislotasi va boshqa karboksilik kislotalar bilan almashtirilganda, u "oyna oynasi" reaktsiyasini beradi:

Kargol kislotasi, erigan H 2 CO 3 suv va karbonat angidridga parchalanadi, ortiqcha ammiak ammoniy gidrokarbonatga aylanadi.
Kislotalar atomlar va suvni o'z ichiga olgan molekulalarni o'z ichiga olgan, metall va kislotali ortiqcha atomlar bilan almashtiriladigan yoki almashinadigan, yig'iladigan nutq deb ataladi.
Kislota molekulasida kislotalikning mavjudligi yoki yo'qligi sababli ular kislotalikka bo'linadi(H 2 SO 4 sulfat kislota, H 2 SO 3 sulfat kislota, HNO 3 nitrat kislota, H 3 PO 4 fosforik kislota, H 2 CO 3 karbonat kislota, H 2 SiO 3 kremniy kislotasi) va nordonsiz(HF gidroflorik kislota, HCl xlorid kislotasi (xlorid kislotasi), HBr gidrobromik kislota, HI gidroiod kislotasi, H 2 S gidroodik kislota).
Kislota molekulasidagi suv atomlarining soniga qarab kislotalar bir asosli (1 H atomi bilan), ikki asosli (2 H atomi bilan) va uch asosli (3 H atomi bilan) bo'lishi mumkin. Masalan, nitrat kislota HNO 3 bir asosli bo'lib, molekuladagi bo'laklarda bir atom suv, sulfat kislota H 2 SO 4 mavjud. – ikki asosli va boshqalar.
Atomlar va suv o'rnini bosadigan va metall bilan almashtiriladigan noorganik birikmalar juda kam.
Kislota molekulasining suvsiz qismi kislota qoldig'i deb ataladi.
Kislota ortiqcha bir atomdan (-Cl, -Br, -I) - oddiy kislotali ortiqcha yoki atomlar guruhidan (-SO 3, -PO 4, -SiO 3) - buklangan ortiqchalardan buklanishi mumkin.
Suvli eritmalarda almashinuv reaktsiyalari va kislotali ortiqcha moddalarning o'rnini bosish halokatga olib kelmaydi:
H 2 SO 4 + CuCl 2 → CuSO 4 + 2 HCl
Angidrid so'zi suvsiz kislota bo'lgan suvsiz degan ma'noni anglatadi. Masalan,
H 2 SO 4 – H 2 O → SO 3. Kislotasiz kislotalar angidridlarni yo'q qilmaydi.
Kislota nomi "naya" va ba'zan "va" qo'shilishi bilan kislota eriydigan element (kislota hosil qiluvchi) nomiga asoslangan: H 2 SO 4 - sirchana; H 2 SO 3 - vulgina; H 2 SiO 3 - kremniy va boshqalar.
Element juda ko'p nordon kislotalarni eritishi mumkin. Ko'rsatilgandan so'ng, agar element yuqori valentlikka ega bo'lsa (kislota molekulasida kislota atomlari ko'p bo'lsa) kislotaning nomi to'liq bo'ladi. Element pastroq valentlikni namoyon qilganligi sababli, kislotaning oxiri "tarkibida" bo'ladi: HNO 3 - azot, HNO 2 - azot.
Kislotalar suvdagi angidridlarni yo'q qilishi mumkin. Angidridlar suvda erimaydigan hollarda, kislota boshqa kuchli kislota qo'shilishi bilan almashtirilishi mumkin. Bu usul nordon va kislotali bo'lmagan kislotalarga xosdir. Kislotasiz kislotalarni suvli va metall bo'lmagan kislotalardan to'g'ridan-to'g'ri sintez qilish yo'li bilan suvdan olinadigan moddalarning parchalanishi bilan olib tashlash mumkin:
H 2 + Cl 2 → 2 HCl;
H2+S → H2S.
Gazga o'xshash moddalarni HCl va H 2 S va kislotalar bilan olib tashlash.
Eng g'ayrioddiy aqllar uchun kislotalar ham noyob, ham qattiqda uchraydi.
Kislotalarning kimyoviy kuchi
Kislotalarni indikatorlar bo'yicha eritib yuboring. Barcha kislotalar (kremniydan tashqari) suvda yaxshi eriydi. Maxsus nutq ko'rsatkichlari kislota mavjudligini aniqlash imkonini beradi.
Ko'rsatkichlar katlama birliklari seriyasidir. Turli xil kimyoviy moddalar bilan o'zaro ta'sir qilish orqali uning infuzionini o'zgartirish kerak. Neytral hududlarda hid bir xil bo'lsa-da, asosiy sohalarda u boshqacha. Kislota bilan o'zaro ta'sirlashganda, hid o'zining barbarligini o'zgartiradi: metil apelsin indikatori qizil rangga aylanadi va lakmus indikatori qizil rangga aylanadi.
Asosiy narsalar bilan o'zaro aloqada bo'ling barqaror kislotali ortiqcha o'z ichiga olgan suyultirilgan suv va tuz bilan (neytralizatsiya reaktsiyasi):
H 2 SO 4 + Ca(OH) 2 → CaSO 4 + 2 H 2 O.
Asosiy oksidlar bilan o'zaro ta'sir qilish suv va tuz qo'shilishi bilan (neytralizatsiya reaktsiyasi). Neytrallash reaksiyasidan olingan kislotaning ortiqcha kislotasini olib tashlash uchun:
H 3 PO 4 + Fe 2 O 3 → 2 FePO 4 + 3 H 2 O.
 Metalllar bilan o'zaro ta'sir qilish.
Kislotalarning metallar bilan o'zaro ta'siri uchun quyidagi bosqichlarni bajarish kerak:
Metalllar bilan o'zaro ta'sir qilish.
Kislotalarning metallar bilan o'zaro ta'siri uchun quyidagi bosqichlarni bajarish kerak:
1. metall kislotalarga nisbatan faollashishi mumkin (ba'zi hollarda metallarning faolligi ularning suvga reaktsiyasi bilan bog'liq). Metall qanchalik faol bo'lsa, kislotalar bilan o'zaro ta'sir kuchayadi;
2. Kislota kuchli bo'lishi mumkin (H+ suvini to'g'ri qo'shish uchun).
Kislota va metallarning kimyoviy reaktsiyalari sodir bo'lganda, tuz eriydi va suv paydo bo'ladi (metallarning nitrat va konsentrlangan sulfat kislotalar bilan reaksiyasiga qo'shimcha ravishda):
Zn + 2HCl → ZnCl 2 + H 2;
Cu + 4HNO 3 → CuNO 3 + 2 NO 2 + 2 H 2 O.
Oziq-ovqat tugab qoldimi? Kislotalar haqida ko'proq bilishni xohlaysizmi?
Repetitordan yordam olish uchun ro'yxatdan o'ting.
Birinchi dars - zarari yo'q!
sayt, Pershodzherelo ob'yazkovga yuborilgan materialni to'liq yoki qisman nusxalash bilan.
Taqdimotni oldindan tezlashtirish uchun o‘z Google Postingizni yarating va avval qarang: https://accounts.google.com
Slaydlar oldidagi taglavhalar:
Vykladach: Grudinina Tetyana Viktorivna Dars mavzusi: Kislotalar
Darsning maqsadi: Organik va noorganik kislotalarning tasnifi, nomlanishi, kuchi haqidagi bilimlarni tushunish va mustahkamlash.Noorganik va organik kislotalarning kimyoviy kuchlarining kuchini tushuntirishni oʻrganish.Reaksiyalarni va molekulyar va ion koʻrinishini toʻgʻri shakllantirishni oʻrganish.
Kislotalarning qiymatlari Tabiatdagi kislotalar Kislotalarning tasnifi Kislotalarning kimyoviy kuchi Kislotalarni olib tashlash Kislotalarning turg'unligi Dars rejasi:
Elektrolitlar kislotalar deb ataladi, bu kationlar dissotsilanganda suvda faqat gidratlangan ionlar hosil bo'ladi (H 3 O +). 1. Kislotalarning qiymati
1923 yilda Bernstead-Lauri tomonidan proto-litik nazariyaga asos solingan. Kislotalar H+ kationlarining donorlari bo'lgan molekulalar va ionlardir. H+ kationi proton deb ataladi, shuning uchun nazariya protolitik deb ataladi. Amerikalik kimyogar G.M.ning kislotalar va asoslarning elektron nazariyasiga o'xshash. Lyuis kislotalari elektron qabul qiluvchilar vazifasini bajaradigan reaktivlardir.
2. Tabiatdagi kislotalar Kislota taxtasi (nitrat, sulfat kislotalar) Kirpi tarkibidagi kislotalar (molik, otquloq, limon, sut, oleyk, kava va boshqalar) Hayvon va sabzavotlarning “kimyoviy buzilmasi”. Tishlaganda, muraxa kislotasini olib tashlash uchun uning qobig'i tozalanadi. Vikorista va kropiva.
Pedipalpid o'rgimchak o'z dushmanlariga gul otadi, u otik kislotadan iborat. Yassi millipedlar eng dahshatli narsa - gidrosiyan kislotasi bug'ini chiqaradi. Fly agaric tarkibida ibotenik kislota va muscimol mavjud. Tog'li toshlarning vayron bo'lishi va tuproqning yaratilishi. Likenlar granitni axlatga aylantiradigan kislotalarni ko'rishlari mumkin.
Vitaminlar: askorbin kislotasi, foliy kislotasi, orotova, pangamova, nikotin va boshqalar. Gialuron kislotasi suglob mastilining asosiy komponentidir. Aminokislotalar oqsillarni hazm qiladi. Qobiqdagi xlorid kislota kirpi oqsillarini parchalaydigan pepsinogen fermentini faollashtiradi, shuningdek, chirigan mikroflorani kamaytiradi. Odamlarda kislotalar.
Ombor orqasida: Kisen qasosi: H NO 3, H 2 SO 3; Kislotasiz: HCl, H2S. Asosligiga qarab: (kislotalarning asosliligi dissotsilanish jarayonida hosil bo'ladigan kationlar soniga qarab aniqlanadi). Monobasik: HBr, HNO 2; Ikki asosli: H 2 S, H 2 SO 4; Asosiysi: H 3 PO 4. Zavdannya. Kislotalarni nomlang va ularning tasnifi sanasini ayting: HClO3, H2S, H3PO4, HBr. 3. Kislotalarning tasnifi:
Metalllarning elektrokimyoviy diapazonida erigan metallar bilan suvga o'zaro ta'siri. 4. Kislotalarning kimyoviy kuchi: oksidlovchi, oksidlovchi, magniy asetatning oksidlanishi.
Asosiy va amfoter oksidlar bilan o'zaro ta'siri. Mustaqil ravishda:
Alohida va alohida bo'lmagan poydevorlar bilan o'zaro ta'sir qilish. O'rta va kislotali tuzlarni sozlash mumkin. Bu reaksiya neytrallanishdir. Mustaqil ravishda: 1 mol (ortiqcha) 1 mol natriy vodorod sulfat (kislota tuzi) 1 mol 2 mol natriy sulfat (o'rta tuz)
Kuchli kislota buzilmagan tuzning kuchsiz kislotasi bilan birlashtirilishi mumkin. Mustaqil ravishda:
Xlorid kislotasi Nikel bilan qoplangan, xromlangan, galvanizlangan va hokazolarda shkala va korroziyani parchalash uchun. po'lat va chavun ekstraktlari Bug 'qozonlarida kireçni tozalash uchun Ftor kislotasi HF. Termitlar va boshqa chivinlarning oldini olish uchun yog'ochni o'tkazing. Kislota turg'unligi
Sirxanik kislota Fosfor va azot moddalarini olish uchun Vibuxovye smolalarini olishda Bo'lak tolalar Barvniki Plastmassalari Batareyalarni to'ldirish
Azot kislotasi Nitrat kislotalarning jonli ishlab chiqarilishi Vibuxov Rechovin Likarski Rechovin Barvniki Plastmassalar
Topshiriq 1. Formulalarni yozing va kislotalarni tasnifiga ko'ra tavsiflang: kremniy kislotasi, ftorik kislota. Zavdannya 2. Fosfor kislotasi bilan quyidagi reaktivlar reaksiyaga kirishadi: K, SO 2, Na 2 SO 4, Na 2 CO 3, MgO, Ag, Ba (OH) 2. Xavfsiz
Buyruq 1. H 2 SiO 3 - kislotali, ikki asosli, razchinnaya bo'lmagan, zaif HF - kislotali bo'lmagan, bir asosli, bo'sh, zaif Buyruq 2. Turlari
Dars uchun rahmat!!!
Cerechoviny molekulyar budova. Kislota molekulalarining atomlari kovalent qutb bog'lari bilan bog'langan. Tupurish natijasida hosil bo'lgan suv atomi va elektron manfiy atom (kislota, kislota yoki galogen atomi) o'rtasidagi bog'lanishlarning qutblanishi qanchalik katta bo'lsa, bu bog'larning soni shunchalik ko'p geterolitik tarzda ajraladi. Bu shuni anglatadiki, suvdagi kationlarning miqdori ko'proq bo'ladi va o'rtasi kislotaliroq bo'ladi. Katta ahamiyatga ega bo'lgan narsa nafaqat qutblanish, balki bog'lanishning polarizatsiyasi. Polarizatsiya - bu faol reagentlar ta'sirida bog'lanishning qutblanish qobiliyati. Masalan, suv molekulalari.
Kislotalarning tasnifi
Kislotalarning kislota atomlari o'rniga suv atomlari bo'yicha, zo'ravonlik darajasi va boshqa belgilari bo'yicha tasnifi. Div jadvali 1.
|
Tasniflash belgilari |
Kislotalar guruhi |
dumba |
|
Nordonning ko'rinishi |
||
|
Bezkisnev |
||
|
Asosiylik (metall bilan almashtirilishi mumkin bo'lgan suv atomlari soni) |
Monobaz |
|
|
Ikkilik |
||
|
Tribasic |
||
|
Rozchinnist |
Rozchinni |
|
|
Nerozchinni |
||
|
Parvozlik |
||
|
Chaqaloqlar |
||
|
Elektrolitik dissotsilanish bosqichi |
N2SO4, HNO3, HCl |
|
|
Barqarorlik |
Barqaror |
H3PO4, N2SO4, HCl |
|
Beqaror |
1. Metallar bilan reaksiya.
Metallar, bir qator metallar bilan aralashtirilgan (1-rasm) suvga, kislotalardan suvni olib tashlash.
Mg + 2HCl = MgCl2 + H2
Konsentrlangan holda azotі sirchaniy kislota reaktsiyasi anionning ortiqcha miqdoridan kelib chiqadi. Suv ko'rinmaydi. Kichik 2.
Cu + 4HNO3(oxiri) = Cu (NO3)2 + 2NO2 + H2O
Cu + 2H2SO4(oxiri) = Cu SO4 + SO2 + H2O
2. Asosiy va amfoter oksidlar bilan reaksiyasi tuz va suv bilan.
K2O+ HNO3 = KNO3 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
3. Tuzlar bilan reaksiya. Kislotalar turli tuzlar bilan reaksiyaga kirishadi, reaksiya natijasida mahsulotlardan biri qamalga tushib qoladi, natijada bo'lmagan reaksiyalar eritmasi muvozanatni o'ngga siljitadi va uni amalda qaytarib bo'lmaydigan holga keltiradi.
N2SO4 + BaCl2 = BaSO4↓ +2 HCl
H2CO3 + BaCl2 = BaCO3↓ +2 HCl
4. Asoslar va amfoter gidroksidlar bilan reaksiyaga kirishing.
KOH + HNO3 = KNO3 + H2O
Al(ON)3 + 3HCl = AlCl3 + 3H2O
NaOH + HNO3 = NaNO3 + H2O
5. Kislota-asos ko'rsatkichlari yordamida kislotalarni aniqlash.
Nordon muhitda lakmus qizil fermentatsiya bilan shishiradi. Metil apelsin qizil rangda, fenolftalin esa erkindir.
Kislotalarni ushlab turishning asosiy usullari
1. Oddiy eritmalardan kislotali bo'lmagan kislotalarni ajratib olish mumkin.
2. Kislotalarning kislotaliligini kislotali oksidlarni hidratsiya qilish yo'li bilan olib tashlash mumkin.
N2O5 + H2O → 2HNO3
SO3 + H2O → H2SO4
3. Kislotalarni kuchsiz kislotalardan kuchli kislotalardan, uchuvchanlardan uchuvchan bo'lmaganlarga, uchuvchanlardan uchuvchan bo'lmaganlarga olib tashlash. Masalan, kuchli xlorid kislotasi ularning tuzlarining zaifroq xususiyatlarini yo'q qiladi.
CH3COONa + HCl = CH3COOH + NaCl
NaSl (qattiq) + H2SO4 = NaNSO4 + HCl
4. Kislotalarni ma'lum tuzlar yoki galogenidlarni gidrolizlash yo'li bilan olib tashlash mumkin.
Al2 S3 +6 H2O → 2Al(OH)3↓+ 3H2S
PCl5 + H2O → H3PO4 + 5HCl
Svante Arrhenius tomonidan kislotalar va asoslar nazariyasi. Von elektrolitik dissotsilanish nazariyasiga asoslanadi. Shunga o'xshab, kislotalar suvda gidratlangan ionlarni va kislotali ortiqcha anionlarni eritadigan moddalardir. Va aftidan, asoslar suvda metall kationlari va gidroksil guruhi anionlariga ajraladigan bir qator birikmalardir.
Bronsted va Louri nazariyasi. Ushbu nazariyaga muvofiq kislotalar molekulalar va ionlar bo'lib, ular bu reaktsiyada proton donorlari va o'rinbosarlari protonlarni qabul qiluvchi molekulalar va ionlar, ya'ni qabul qiluvchilardir.
Organik kimyoda Lyuis nazariyasi asosiy hisoblanadi. Kislota - bu bo'sh valent orbitallarni o'z ichiga olgan molekula yoki ion, buning natijasida ular elektron bug'larini, masalan, suv ionlari, metall ionlari, oksidlar va bir qator tuzlarni qabul qila oladi. Ion suvini almashtirmaydigan Lyuis kislotalari aprotik deb ataladi. Proton o'z ichiga olgan kislotalar boshqa kislotalar sinfi hisoblanadi.
Lyuis nazariyasining asosini elektron juft donorlarni hosil qiluvchi molekula yoki ion tashkil etadi: barcha anionlar, ammiak, aminlar, suv, spirtlar, galogenlar.
Kislotalar va Lyuis asoslari o'rtasidagi reaktsiyaga misol.
AlCl3+ Cl- → Cl4-
Bu o'zaro ta'sir aromatik birikmalarning galogenlanishi uchun asosdir.
Usanovich nazariyasi. Ushbu nazariyada kislota kationlarni ajratish yoki anionlarni qo'shish qobiliyatiga ega bo'lgan qismdir. Shubhasiz, bu oldinga va orqaga o'rnatish. Bu nazariya kamdan-kam qo'llaniladi, chunki u juda noaniq bo'lib qoldi. Ko'rinib turibdiki, undan oldin, ionlar ishtirokidagi har qanday o'zaro ta'sirlar kislota-asosgacha kamayishi mumkin. Lekin bu juda oson emas.
Kislota ionlarga qanday ajralishini aniq tavsiflash uchun elektrolitik dissotsilanish bosqichini tushunishdan tashqari, quyidagi tushunchalardan foydalaning: dissotsiatsiya konstantasi. Dissotsiatsiya konstantasi katta ob'ektning (kislota, tuz yoki kompleks) ko'proq kichikroq narsalarda uxlab qolishdan teskari dissotsiatsiyalanish qobiliyatini ko'rsatadigan doimiy konstantaning bir turi. Dissotsiatsiya konstantasi dissotsiatsiyalanmagan shaklga bo'lingan, ularning stoxiometrik koeffitsientlari bosqichida ion konsentratsiyasining qo'shilishi sifatida hisoblanadi.
Nutqning boy valent ionlari bilan dissotsiatsiyasida dissotsiatsiya xuddi shunday tezlikda sodir bo'ladi. Teri bosqichi uchun dissotsiatsiya konstantasining qiymati yuqoriroq.
Uch asosli borik kislotaning dissotsiatsiyasini qo'llashH3 BO3 .
I bosqich: H3BO3 ↔ H+ + H2BO3-
I bosqich: H2BO3- ↔ H+ + HBO32-
I bosqich: NVO32- ↔ N+ + KO33-
Ushbu bosqichlarda teri uchun dissotsiatsiya konstantalarining parchalanishi quyidagicha ko'rinadi:
![]()
![]()
![]()
Dissotsiatsiya konstantalarining bu qiymatlari ko'pgina asosiy nutqlarning asosan birinchi bosqichga ko'ra dissosiatsiyalanishiga asoslanadi.
Inson tanasida uchta noorganik kislota katta rol o'ynaydi. Tse - fosforik kislota, xlorid kislotasi. Fosfor kislotasi qon bufer tizimlarining omboriga kiring. Buferlar oz miqdorda kislotalar yoki asoslarni qo'shganda ularning kunlik pH qiymatini o'zgartiradigan narsalardir. Ushbu tizimlar bemorda qonning kislotaliligini saqlab qolish va tor intervallarni saqlash uchun talab qilinadi. Ortiqcha fosfor kislotasi nuklein kislotalar va ko'plab fermentlar kabi ko'plab biologik faol moddalarning ortiqcha miqdoridan oldin kiradi. Bizning cho'tkalarimiz kaltsiy fosfat gidroksidi Ca10 (PO4) 6 (OH) 2 yoki kaltsiy gidroksiapatitdan tashkil topgan va tishlarimiz kaltsiy florapatit Ca10 (PO4) 6F2 dan iborat. Kichik 8.


Vugilna Kislota qon tampon tizimlarida ham saqlanadi. Amalda, bunday tizimlar tez va oson sozlanishi va qondagi karbonat angidrid miqdori o'zgarishi mumkin.
Solyana kislota shlank sharbatida mavjud. Bu oqsillarning denatüratsiyasi va shishishini oldini oladi, bu esa ularni fermentlar tomonidan parchalanishini osonlashtiradi. U fermentlarni talab qiladigan kislotali moddani hosil qiladi. Von shank sharbatining antibakterial tarkibi uchun javobgardir.
JERELA
dzherelo video - https://www.youtube.com/watch?v=KqOwvPrN8W4
Dzherelo taqdimoti - http://ppt4web.ru/khimija/kisloty5.html