VIZNACHENNYA
Surma- davriy sistemaning ellik birinchi elementi. Belgilangan - lotincha "stibium" dan Sb. Beshinchi davrda aylantirilgan, VA guruhi. Metalllarga qo'llang. Asosiy zaryad hali ham 51.
Surma tabiatda surmalik bilan birlashganda - surmacy glitter]6 yoki antimonit, Sb 2 S 3 ko'rinishida topiladi. Surmaning er qobig'idagi o'rni juda kichik bo'lishidan qat'i nazar, surma uzoq vaqtdan beri mavjud. Bu jiddiy baxtning tabiatining kengligi va bu taxmindan xalos bo'lish qulayligi bilan izohlanadi.
Eng yaxshi holatda surma kumush-oq kristallarni hosil qiladi (1-rasm), ular metall yaltiroq hosil qiladi va qalinligi 6,68 g / sm 3 ni tashkil qiladi. Ko'rinishidan metallga o'xshash bo'lsa-da, kristalli surma pürüzlülüğüne ega va quyi birlamchi metallarga qaraganda issiqlik va elektr tokini o'tkazishda ancha samarali. Boshqa va alotropik modifikatsiyalari tufayli kristalli surma kremi.
Kichik 1. Surma. Tashqi ko'rinish.
Surmining atom va molekulyar massasi
Rechoviny ning Vidnosna molekulyar massasi(M r) - berilgan molekulaning massasi uglerod atomi massasining 1/12 qismidan necha marta katta ekanligini ko'rsatadigan raqam va elementning atom og'irligi(A r) - kimyoviy element atomlarining o'rtacha massasi uglerod atomining 1/12 massasidan necha marta oshadi?
Surma bo'laklari monoatomik Sb molekulalari shaklida namoyon bo'ladi, ularning qiymatlari atom va molekulyar massalari birlashadi. badbo'y hidlar qimmatroq bo'ladi 121,760.
Surmi izotoplari
Ko'rinib turibdiki, tabiatda surma ikkita barqaror izotopga ega bo'lishi mumkin: 121 Sb (57,36%) va 123 Sb (42,64%). Ularning massa soni mos ravishda 121 va 123 ga etadi. Surmiy 121 Sb izotopiga atom yadrosi ellik bir proton va yetmishta neytronni o'z ichiga oladi va 123 Sb izotopi bir xil miqdordagi proton va etmish ikki neytronga ega.
Surmiyning massa soni 103 dan 139 gacha bo'lgan noyob beqaror izotoplari, shuningdek, yigirmadan ortiq izometrik yadrolari mavjud bo'lib, ular orasida tez parchalanish davriga ega eng uzoq umr ko'radigan 125 Sb izotopi mavjud.ivnim 2,76 roku.
Ioni surmi
Surmiy atomining hozirgi energiya darajasida valentlik bo'lgan beshta elektron mavjud:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 3 .
Kimyoviy o'zaro ta'sirlar urushi orqali surma o'zining valentlik elektronlarini beradi. Bu ularning donoridir va musbat zaryadlangan ionga aylanadi va boshqa atomdan elektronlarni qabul qiladi. Bu ularning qabul qiluvchisi va manfiy zaryadlangan ionga aylanadi:
Sb 0 -3e → Sb 3+;
Sb 0 -5e → Sb 5+;
Sb 0 +3e → Sb 3-.
Surmi molekulasi va atomi
Haqiqiy dunyoda surma monoatomik Sb molekulalari sifatida hosil bo'ladi. Surmi atomi va molekulasini tavsiflovchi kuch dinamikasini ko'rib chiqaylik:
Float surmi
Qotishmaga qattiqlik berish uchun surma kiritiladi. Surma, qo'rg'oshin va oz miqdordagi qalay bilan birlashtirilgan qotishma Drukhar metalli deb ataladi va u Drukar shriftini tayyorlash uchun ishlatiladi. Ushbu surma va qo'rg'oshin qotishmasi (5 dan 15% Sb) kimyo sanoati uchun qo'rg'oshin akkumulyatorlari, choyshablar va quvurlar plitalarini ishlab chiqarish uchun ishlatiladi.
Muammolarni hal qilish uchun murojaat qiling
BOT 1
Surma
Surma-Va; va.[forscha. surma - metall]
1. Kimyoviy element (Sb), ko'k-oq metall (u texnologiyada turli xil qotishmalarda uchraydi, boshqacha qilib aytganda). Surmi eritish zavodi. Surmini sirka bilan birlashtirish.
2. Qadim zamonlar uchun: qora soch uchun farba, briv, viy. Olib keling, surma bilan qoshlarni torting. Yuzingizda surmi qidiring.
◁ Surmyanii, -a, -oe (1 raqam). S-chi ruda. S-i qotishmasi. S. blisk(Surma va sirkaga o'xshash qo'rg'oshin-kulrang mineral).
surma(lot. Stibium), davriy sistemaning V guruhining kimyoviy elementi. Bu modifikatsiya orqali amalga oshiriladi. Birlamchi surma (sir deb ataladi) - mavimsi-oq kristallar; qalinligi 6,69 g/sm 3 t mp 630,5 ° S. Shamolda u o'zgarmaydi. Eng muhim mineral antimonit (surmian blisk). Qo'rg'oshin va qalay (akkumulyator, metall, podshipnik va boshqalar), o'tkazgich materiallari asosidagi qotishmalarning komponenti.
SurmaSurma (lat. Stibium), Sb, ("stibium" deb o'qing), atom raqami 51, atom og'irligi 121,75 bo'lgan kimyoviy element. Tabiiy surma ikkita barqaror izotopdan iborat: 121 Sb (massa farqi 57,25%) va 123 Sb (42,75%). Davriy jadvalning 5-davrida VA guruhi tomonidan aylantirilgan. Tashqi to'pning elektron konfiguratsiyasi 5 s 2
p 3
. Oksidlanish darajasi +3, +5, kamdan-3 (valentlik III, V). Atomning radiusi 0,161 nm. Ion radiusi Sb 3+ 0,090 nm (koordinatsion raqamlar 4 va 6), Sb 5+ 0,062 nm (6), Sb 3-0,208 nm (6). Keyingi ionlanish energiyalari 8,64, 16,6, 28,0, 37,42 va 58,8 eV ga teng. Paulingga ko'ra elektronegativlik (div. Pauling Linus) 1,9.
Tarixiy fon
Surma bizning eramizdan uch ming yil oldin Sxod yerlarida tashkil etilgan. Elementning lotincha nomi Surma Qadimgi Yunonistonda olingan "Stibi" minerali bilan bog'liq. Ruscha "surma" turkcha "surme" ga o'xshaydi - qoshlarni qoralash uchun (qoraytirish uchun kukun jiddiy porlash minerali bilan tayyorlangan). 15-asrda Chernets Vasil Valentin Drukar yozuvini quyish uchun surmi, qotishma va qo'rg'oshinni kesish jarayonini tasvirlab berdi. U tabiiy oltingugurtli surmani jiddiy tosh deb atagan. O'rta asrda surmi preparatlari tibbiy maqsadlarda qo'llanilgan: surmi ichimliklar, sharob, surmidan tayyorlangan kosalardagi vitriman (bu "qusish toshini" K 1/2H 2 O yaratgan).
Tabiatdan ma'lum
Yer qobig'ining siljishi massa bo'yicha 5 · 10 - 5% ni tashkil qiladi. Tabiatda ona davlatida uchraydi. Taxminan 120 ta mineral mavjud bo'lib, ularda Sb, asosiy daraja va sulfid Sb 2 S 3 ko'rinishi (surmiy blisk, antimonit, stibnit) mavjud. Sulfidning Sb 2 O 3 kislotasi bilan oksidlanish mahsuloti oq surmiy rudasi (valentinit va senarmontit) hisoblanadi. Surma koʻpincha qoʻrgʻoshin, mis va ota rudalarida (tetraedrit Cu 12 Sb 4 S 13, jamesonit Pb 4 FeSb 6 S 14) uchraydi.
Otrimannya
Surma eritilgan sulfid Sb 2 S 3 suyuqlikdan chiqariladi:
Sb 2 S 3 +3Fe=2Sb+3FeS,
Cho'kma sulfid Sb 2 S 3 va ekstrakte qilingan karbonat angidrid qo'shilishi:
Sb 2 S 3 +5O 2 =Sb 2 O 4 +3SO 2,
Sb 2 O 4 +4C=2Sb+4CO. Elektrolitik tozalashdan sof surma (99,9%) olinadi. Polimetall rudalarni qayta ishlash jarayonida ajratilgan qoʻrgʻoshin konsentratlaridan surma ham olinadi.
Jismoniy va kimyoviy kuchlar
Surma kumushrang kulrang, zangori tusli, tiniq metall bo'lmagan. Sira surma, Sb I, rombedral burmali ( a=0,45064 nm, a=57,1°), g'ayrioddiy aqllarni anglatadi. Erish nuqtasi 630,5 ° S, qaynash nuqtasi 1634 ° S. Kuchliligi 6,69 g / sm3. 5,5 GPa da Sb I kubik modifikatsiyasiga o'tadi Sb II, 8,5 GPa da - olti burchakli Sb III, 28 GPa dan yuqori - Sb IV.
Oltingugurt surma sharsimon tuzilishga ega bo'lib, bu erda Sb atomi to'p atrofida uchta tomir bilan piramidali bog'langan (o'lchovlararo masofa 0,288 nm) va boshqa to'pdagi eng yaqin uchta tomirga (o'lchovlararo masofa 0,338 nm) ulangan. Surmaning uchta amorf modifikatsiyasi mavjud. Yog 'surmasi nordonni noyob stibin SbH 3 bilan reaksiyaga solib, oz miqdorda kimyoviy bog'langan suvda aralashtirish orqali davolanadi. (div. vodorod). Qizdirilganda yoki aniqlanganda sariq surma o'tkazgich quvvatiga ega bo'lgan qora surma (qalinligi 5,3 g/sm 3) ga o'zgaradi.
SbCl 3 ni elektroliz qilish jarayonida oz miqdorda kimyoviy bog'langan xlorni saqlash uchun Vibuch surmasi kichik oqimda hosil bo'ladi (gradalanganda tebranadi). Qora surma, 400 ° C ga kirmasdan qizdirilganda va Vibux surmasi maydalanganda metall oltingugurtli surmaga aylanadi. Metall surma (Sb I) o'tkazgichdir. O'ralgan zonaning kengligi 0,12 eV ni tashkil qiladi. Diamagnetik. Xona haroratida metall surma tiniq bo'lib, oyog'ida kukunga osonlikcha maydalanadi, 310 ° C dan yuqori bo'lsa, u plastikdir, shuningdek, yuqori tozalikdagi plastik surma monokristallari.
Antimonidlar ayrim metallar bilan reaksiyaga kirishadi: qalay antimonid SnSb, nikel Ni 2 Sb 3, NiSb, Ni 5 Sb 2 va Ni 4 Sb. Surma xlorid, gidroflorik va sulfat kislotalar bilan o'zaro ta'sir qilmaydi. Konsentrlangan nitrat kislota parchalangan beta-antimonik kislota HSbO 3 ni eritish uchun ishlatiladi:
3Sb + 5HNO 3 = 3HSbO 3 + 5NO + H 2 O.
Surma kislotalarning formulasi Sb 2 O 5 · n H 2 O. Konsentrlangan H 2 SO 4 bilan surmiyum (III) sulfat Sb 2 (SO 4) 3 eritmasi bilan reaksiyaga kirishadi:
2Sb + 6H 2 SO 4 = Sb 2 (SO 4) 3 + 3SO 2 + 6H 2 O.
Surma 600 °C gacha havoga chidamli. Keyinchalik qizdirilganda u Sb 2 O 3 ga oksidlanadi:
4Sb + 3O 2 = 2Sb 2 O 3.
Surmiy (III) oksidi amfoter kuchga ega va o'tloqlar bilan reaksiyaga kirishadi:
Sb 2 O 3 + 6NaOH + 3H 2 O = 2Na 3.
va kislotalar:
Sb 2 O 3 + 6HCl = 2SbCl 3 + 3H 2 O
Sb 2 O 3 700 ° C ga qizdirilganda kislota Sb 2 O 4 oksidini hosil qiladi:
2Sb 2 O 3 + O 2 = 2Sb 2 O 4.
Bu oksid darhol Sb(III) va Sb(V) bilan aralashtiriladi. Uning tuzilishi birdan birgacha oktaedral guruhlarga ega. Surma kislotalarini ehtiyotkorlik bilan sug'orish bilan antimon pentoksidi Sb 2 O 5 eritiladi:
2HSbO 3 = Sb 2 O 5 + H 2 O,
kislotali quvvatni ochib beradi:
Sb 2 O 5 + 6NaOH = 2Na 3 SbO 4 + 3H 2 O,
va oksidlanadi:
Sb 2 O 5 + 10HCl = 2SbCl 3 + 2Cl 2 + 5H 2 O
Surmi tuzlari oson gidrolizlanadi. Gidrokso tuzlarining cho'kishi Sb(III) uchun pH 0,5-0,8 va Sb(V) uchun pH 0,1 da boshlanadi. Gidroliz mahsulotini tuz/suv nisbati va reaktivlar ketma-ketligiga muvofiq saqlang:
SbCl 3 + H 2 O = SbOCl + 2HCl,
4SbCl 3 + 5H 2 O = Sb 4 O 5 Cl 2 + 10HCl.
Ftor bilan (div. FLUOR) Surma SbF 5 pentafloridni aylantiradi. Hidroflorik kislota HF bilan o'zaro ta'sirlashganda kuchli kislota H hosil bo'ladi.SbCl 5 pentaklorid va SbCl 3 trixlorid aralashmasi bilan Cl 2 ga kukun qo'shilganda surma yonadi:
2Sb + 5Cl 2 = 2SbCl 5, 2Sb + 3Cl 2 = 2SbCl 3.
Brom bilan (div. BRIM) va yod (div. IOD) Sb origalogenidlar bilan reaksiyaga kirishadi:
2Sb + 3I 2 = 2SbI 3.
Suv ichganda (div. SIROVORID) Sb(III) va Sb(V) suv sathida H 2 S, ammoniy sulfid (NH 4) 2 S bilan reaksiyaga kirishadigan apelsin-qizil trisulfid Sb 2 S 3 yoki apelsin pentasulfidi Sb 2 S 5 hosil bo'ladi:
Sb 2 S 3 + 3 (NH 4) 2 S = 2 (NH 4) 3 SbS 3,
Sb 2 S 5 + 3 (NH 4) 2 S = 2 (NH 4) 3 SbS 4.
Men suv ichaman (div. vodorod) Sb tuzida stibin gazi SbH 3 ko'rinadi:
SbCl 3 + 4Zn + 5HCl = 4ZnCl 2 + SbH 3 + H 2
Qizdirilganda stib Sb va H2 ga parchalanadi. Surmidan stibinga o'xshash organik birikmalarni ajratib oling, masalan, orimetilstibin Sb (CH 3) 3:
2SbCl 3 + 3Zn(CH 3) 2 = 3ZnCl 2 + 2Sb(CH 3) 3
Zastosuvannya
Surma qo'rg'oshin va qalay (batareya plitalari, drukar shriftlari, podshipniklar, ionlashtiruvchi tsilindrlar bilan ishlash uchun quruq ekranlar, idishlar uchun), mis va rux (badiiy quyish uchun) asosidagi qotishmalarning tarkibiy qismidir. Sof surmu vikoristlar antimonidlarni federal hokimiyatdan ajratish uchun kurashmoqda. Yig'iladigan sintetik dorivor preparatlar omboriga kiring. Gum vikoristini tayyorlashda surmium pentasulfid Sb 2 S 5 dan foydalaning.
Fiziologik harakat
Surma mikroelementlarga kamayadi va inson organizmida u og'irlik bo'yicha 10 -6% ni tashkil qiladi. Tirik organizmlarda doimo mavjud bo'lib, fiziologik va biokimyoviy rollari tushuntirilmagan. Qalqonsimon bezda to'planib, uning funktsiyasini bostiradi va endemik guatrni keltirib chiqaradi. Biroq, ular o'simlik yo'liga botganda, surmi qichqirmaydi, Sb (III) tuzining bo'laklari past navli mahsulotlar hosil bo'lganligi sababli u erda gidrolizlanadi. Ichish va tikish Sb burundan qon ketishiga, jiddiy "isitma isitmasi", pnevmosklerozga olib keladi, teriga zarar etkazadi, davlat funktsiyalarini buzadi. Surmi GDC aerozollari uchun ishchi sohada 0,5 mg/m 3 atmosfera havosida 0,01 mg/m 3. GDK tuproqda 4,5 mg/kg, suvda 0,05 mg/l.
Ensiklopedik lug'at. 2009 .
Sinonimlar:Boshqa lug'atlarda "surma" nima ekanligiga hayron bo'ling:
Surma, vi... Ruscha og'zaki ovoz
- (Forscha sourme). Tabiatda yorqinlik bilan birlashtirilgan metall; Vikorista tibbiyotda qusish kabi. Rus tilidagi omborga etib kelgan xorijiy so'zlarning lug'ati. Chudinov A.N., 1910. Surma surma, metall kulrang rang; urish V. 6,7; …… Rus tilidagi xorijiy so'zlar lug'ati
Surma, surmi, surmi, surmi, surmi, surma, surma, surmi, surma, surma, surmi, surme, surmah (Dzherelo: "A. A. Zaliznyak ortidagi paradigma katta ta'kidlangan") ... Slivni shakllantiradi.
Surma, masalan, Old. viraz: shishgan qoshlar (Habakkuk 259). W tur., jinoiy. tat. surmä surma vid sur farbuvati, tat. sørmä surma (R. 4, 829 va boshqalar); div. Mi. TEl. 2, 161; Rasänen, Neufil. Mitt. , 1946 yil, 114-bet; Zaionchkovskiy, JR 19, 36; Maks Vasmer tomonidan rus tilining etimologik lug'ati
- (Sb belgisi), davriy sistemaning beshinchi guruhining sof metall elementi. Eng keng tarqalgan ruda - surmiy sulfid, Sb2S3. Surma turli qotishmalarda, ayniqsa materiallarda vikorizatsiya qilingan qo'rg'oshinga qattiqlik berish uchun vikorizatsiya qilinadi. Ilmiy-texnik entsiklopedik lug'at
- (lot. Stibium) Sb, davriy tizimning V guruhining kimyoviy elementi, atom raqami 51, atom og'irligi 121,75. Bu modifikatsiya orqali amalga oshiriladi. Asl surma (janob deb ataladi) mavimsi-oq kristallar; Qalinligi 6,69 g/sm³, erish temperaturasi 630,5 .C. Ustida… … Buyuk ensiklopedik lug'at
Surma, surmi, ko'plik. yo'q, do'stim. (Forscha surma metall). 1. Kimyoviy element qattiq va tendon kumushsimon oq metall, qattiqlashadi. texnikdan turli qotishmalarda, gartu tayyorlash uchun Drukarskiy ma'lumotnomasidan. 2. Sizni aqldan ozdirgan o‘shalar. Tlumachny lug'ati...... Ushakovning Tlumachny lug'ati
- (Kosmetikada g'olib bo'lgan Farba). Belgini bo'yash. Tatar, turk, musulmon xotinlarini nomlang. Atamalar lug'ati... Maxsus nomlar lug'ati
Surma kimyoviy elementi (frantsuz antimoine, inglizcha surma, nemis antimoni, lot. stibium, yulduz belgisi - Sb, yoki Regulus antimonii; atom qiymati = 120, O = 16 kabi) - yorqin kumush-oq metall, qo'pol plitalar m kristalli yoki zarracha yovuzlik, erigan eritmadan tutilgan suyuqlikdan hayratda. Surma vismut (div.) kabi kubga yaqin bo'lsa ham, to'mtoq romboidlarda kristallanadi va urish mumkin. vaga 6.71-6.86. Native surma yaltiroq sariyog' ko'rinishida o'tkirlashadi, bu kesish, kesish va mishjak o'rniga; urish vaga її 6,5-7,0. Bu chinni taburet tagida osonlikcha kukunga aylanadigan eng qimmatli metallardir. S.ni 629,5° da eritadi [Yangi qiymatlar uchun (Heykok va Nevill. 1895)) va oq issiqda distillanadi; Juftning kuchi aniqlanganligi aniqlandi, chunki 1640 ° da u ancha katta bo'lib chiqdi, zarrachada ikkita atomni qabul qilish kamroq zarur - Sb 2 kattaliklari: 1572 da 10,743 va 1640 da 9,781, shuning uchun haqida gapiring Bu zarralar qizdirilganda dissotsilanadi. Sb 2 zarrasi uchun qalinligi 8,3 ga teng deb hisoblanganligi sababli, bu "metall" ning tayyor emasligi haqida eng oddiy tarzda, o'ng qo'l bilan tashqi ko'rinishiga zid bo'lgan Sb 3 monoatomik zarracha shaklida gapirish mumkin. metallar. Xuddi shu mualliflar bug'ning vismut, amitset va fosforga ta'sirini o'rgandilar. Bi 1 qismda faqat bittasi nashr etilgan ko'rinadi; yangi topilgan qalinligi uchun: 1700 ° da 10,125 va 1600 ° da 11,983 va Bi 1 va Bi 2 uchun hisoblangan quvvat 7,2 va 14,4 ga etadi. Fosfor P 4 (515 ° - 1040 ° da) va mitselyarning qismlari qizdirilganda 4 (860 ° da) ajraladi, bu juda muhim, ayniqsa P 4: 1700 ° 3P 4 da faqat bitta qism - kimdir o'ylashi mumkin - 2P ga aylanadi 2 a As4 tashqi tomondan As2 ga aylanishi ma'lum. Shunday qilib, bu elementlar orasida davriy tizimning kichik guruhlaridan birini tashkil etuvchi eng katta metall juftlik kuchiga ko'ra vismutdir; Nometallning kuchi fosforning eng katta dunyosi bilan bog'liq bo'lib, u bir vaqtning o'zida mish'yak va eng kichik dunyo bilan tavsiflanadi - S.]]. S., masalan, quruq gaz oqimi bilan distillash mumkin. suv, chunki u nafaqat shamolda, balki suv bug'ida ham yuqori tezlikda osongina oksidlanadi.
2Sb + 3H2O = Sb2O3 + 3H2;
Agar S.ning mayda boʻlagini non ustida lehim trubkasi oldida eritib, oʻnga yaqin balandlikdan qogʻoz trubkaga tashlasangiz, oq tutun oksidi hosil qiluvchi pishirilgan sharlar massasini olasiz. Haddan tashqari haroratda C. ochiq havoda oʻzgarmaydi. Natijalarning shakllari va S.ning barcha kimyoviy suvlari elementlarning davriy tizimining V guruhiga, eng kichik metall kichik guruhiga, shuningdek, fosfor, mishyak va vismutni ham oʻz ichiga oladi; qolgan ikkita elementga xuddi IV guruhdagi qalay qo'rg'oshin bilan bir xil darajaga olib boriladi. Yarimo'tkazgichlarning ikkita eng muhim turi mavjud - SbX 3 va SbX 5, uch valentli va besh valentli; Bu turlarning bir vaqtning o'zida va birlashganligi aniq. S.ning galogenidlari reaksiyalar shakllari haqida aytilganlardan ayniqsa aniq koʻrinadi. Trixlorolog
Sb2 S3 + 3HgCl2 = 2SbCl3 + 3HgS
bunda retortda eng uchuvchan oltingugurtli simob chiqariladi va SbCl 3 distillangan holda pishgan bo'lib, sigir yog'iga (Butyrum Antimonii) o'xshash xamirga aralashtiriladi. 1648 yilgacha uchuvchi mahsulot tarkibida simob borligiga ishonishgan; Kimning taqdiri Glauber bunday yashirinlikning xiyonatini ko'rsatmoqda. Vino retortidagi ortiqcha kuchli qizdirilsa, u ham bug'lanadi va kinobar (Cinnabaris Antimonii) HgS ning kristalli sublimatsiyasini beradi. Eng oson yo'li - Sb + 1 ½ Cl2 = SbCl3 qizdirilganda xlorning kuchli oqimini qoldirib, S. metallidan SbCl 3 ni tayyorlash va metall so'rilgach, pentaklorid bilan aralashtirish mumkin bo'lgan noyob mahsulot chiqadi. S., kukunli S. qo'shilishi orqali juda oson uyg'otilishi mumkin:
3SbCl5 + 2Sb = 5SbCl3;
SbCl 3 tugagach, distillash talab qilinadi. Sulfat kislotani shifobaxsh xlorid kislotasi bilan qizdirish orqali ortiqcha SbCl 3 ajralib chiqadi, bu esa sulfat kislotaning rivojlanishiga olib keladi:
Sb2 S3 + 6HCl = 2SbCl3 + 3H2 S.
Bunday parchalanish S. oksidi xlorid kislotada eritilganda sodir bo'ladi. Nordon sharobni distillashda avval suv va ortiqcha xlorid kislotasi qo'shiladi, bu SbCl 3 ni birlashtiradi - bu birinchi qismlarda sariq (xlor infuzioni mavjudligi sababli) va undan keyin unumdor bo'lishini anglatadi. Trichlorist S. 73,2° da eriydigan va 223,5° qaynaydigan, bugʻsiz aralashmada eriydigan kristall massa boʻlib, uning kuchi SbCl 3 formulasiga va bugungi kungacha eng zamonaviy 7,8 ga toʻliq mos keladi. Von shamoldan suvni tortadi, aniq ko'rishda eriydi, undan sulfat kislotasi ustidagi eksikatorda turganida uni yana kristall ko'rinishda ko'rish mumkin. Suvda (oz miqdorda) tarqatish maqsadida SbCl 3 boshqa, shunga o'xshash xlorid kislota tuzlariga to'liq o'xshaydi, lekin ko'p miqdorda suvda SbCl 3 ni tarqatadi, bu esa uni boshqa oksixloridlarga aylantiradi, nyanga ko'ra.
SbCl3 + 2H 2 O = (HO)2 SbCl + 2HCl = OSbCl + H 2 O + 2HCl
ta 4SbCl 3 + 5H 2 O = O5 Sb4 Cl2 + 10HCl
beqaror suvning haddan tashqari chegaralarini qanday o'rnatish kerak (oraliq ombordan oksixloridni olib tashlash uchun); xlor surmadan to'liq chiqarilgunga qadar katta miqdorda suv olib keling. Suvda shunga o'xshash oksixloridlarning oq kukunlari mavjud va SbCl 3 ning bir qismi shikastlanib, yuqori hajmdagi suvda cho'kishi mumkin. Xlorid kislotasini qo'shib, siz qamalni qayta eritib, uni SbCl 3 ga aylantirishingiz mumkin. Shubhasiz, S. oksidi (div. bundan keyin) vismut oksidi kabi kuchsiz asosdir va shuning uchun suv - ortiqcha - S.ning oʻrta tuzlarini asosiy tuzga aylantirib, yangi kislota hosil qiladi yoki, bu holda, oksixloridda; Xlorid kislota qo'shilishi reaksiyaga kirishuvchi suv miqdorini o'zgartirishga o'xshaydi, bu esa oksikloridning SbCl 3 ga aylanishiga olib keladi. Suv SbCl 3 bilan reaksiyaga kirishganda chiqadigan oq cho'kma deyiladi Algorot kukuni tibbiy maqsadlarda (masalan, 16-asrda) yashagan Verona shifokori nomiga.
Eritilgan S. trixlorid xlor bilan eritilsa, S. pentaklorid olinadi:
SbCl3 + Cl2 = SbCl5
R. Rose tomonidan (1835). Ularni metall S.dan olish mumkin, uning kukuni xlorli idishga quyilsa, xuddi shu joyda yonib ketadi:
Sb + 2 ½ Cl2 = SbCl5.
Bu havoda chekadigan va yoqimsiz hidga ega bo'lgan bepusht yoki ozgina sarg'ish muhit; sovuqda u kichik bosh kabi kristallanadi va -6 ° da eriydi; SbCl 3 teshigi mavjud, ammo distillash paytida u qisman parchalanadi:
SbCl5 = SbCl3 + Cl2;
22 mm bosim ostida, 79 ° da qaynatiladi - kengaymasdan (lavabolarda, SbCl 3 ning qaynash harorati = 113,5 °). 218 ° va 58 mm bosim ostida bug'ning kuchi soatiga 10,0 ni tashkil qiladi, bu qisman formulaga mos keladi (SbCl 5 uchun bug'ning kuchi 10,3 ga teng). Hisoblangan suv miqdori bilan 0 ° SbCl 5 kristalli gidrat SbCl 5 + H 2 O ni beradi, u xloroformdan ajralib chiqadi va 90 ° da eriydi; Ko'p miqdorda suvdan tiniq eritma chiqadi, u sulfat kislota ustida bug'langanda, xloroformga o'xshamaydigan boshqa kristalli gidrat Sbyl 5 + 4H 2 O ni beradi (Anschutz va Evans, Weber). SbCl 5 issiq suvga kislota xlorid sifatida qo'shiladi, ortiqcha kislotali hidrat beradi (quyida bo'linish). S. pentakloristdan trikloristga oʻtish oson, chunki hozirgi birikmalar tarkibida xlor mavjud boʻlib, buning natijasida u koʻpincha organik kimyoda xlorlash uchun ishlatiladi; tse - "xlorga o'tish". Trichlorist S. kristalli birikmalar, suspenziyalangan tuzlarni maʼlum xloridli metallar bilan birlashtirish uchun ishlatiladi; Turli yarim o'tkazgichlar va oksidlar bilan surma pentaklorid ham xuddi shunday natijalar beradi. Biz boshqa galogenidlar va SbF 3 va SbF 5, SbBr3, SbJ3 va SbJ 5 bilan surmitlarni ko'ramiz.
, yoki surmiyaga qarshi angidrid, triklorid C. turiga tegishli bo'lib, bug'ning bir xil kuchida (1560 ° da, V. Meyer, 1879) Sb 2 O3 formulasi bilan ifodalanishi mumkin, bu esa nisbati bo'yicha 19,9 ga teng ekanligi aniqlandi. endi sharob bo'yicha bu oksid ko'rsatildi Sb 4 O6 formulasini bering, xuddi miyokard va fosfor angidridlari kabi. S. oksidi tabiatda valentin, tinchlantiruvchi oqlar, rombik tizimning yorqin prizmalari shaklida uchraydi, masalan. vagi 5,57, va yaqinda - senarmontit - barsiz yoki kulrang oktaedrlar, s. vaga. 5.2-5.3, shuningdek, tuproqli ko'rinish beradi - jiddiy himoya - turli rudalar C. Oksid oltingugurt bilan purkalganda ham paydo bo'ladi C. va Sbyl 3 da amorf kristalli sof ko'rinishda suvning qoldiq mahsuloti sifatida namoyon bo'ladi. Obrobtz bir metr bilan -to -sisty -azot azot bilan azot kislotasi bilan isitiladigan oksidi S. Maili Kolir, isitiladi zhovtíê bilan, bir xil harorat erish í, narestí, viparovo da biloma issiq. Sovutilganda eritilgan oksid kristall ko'rinishga ega bo'ladi. Oksid shamol ta'sirida qizdirilganda u nordon bo'lib, uchuvchan bo'lmagan SbO 2 oksidiga yoki, ehtimol, Sb 2 O4 ga aylanadi (quyida bo'linish). S. oksidining asosiy kuchlari yanada zaifroq bo'lib, bu muhimroqdir; tuzlar ko'pincha asosiy hisoblanadi. Mineral nordon kislotalardan bir sirchana zdatna tuzlar S. beradi; Lehim Sil SB 2 (SO4) 3 qaymoqqa, agar metall kislota bilan konsentrlangan oksid bilan qizdirilsa, jonli Masi I kristalida, dovful zarba zarba zarbasida tasbeh kislotali kislotalar; suv uni asosiy kislota va asosiy tuzga ajratadi. Masalan, organik kislotalar bilan tuzlar mavjud. tartarik kislotaning asosiy surma-kaliy tuzi yoki qusuq tosh KO-CO-CH(OH)-CH(OH)-CO-O-SbO + H2O (Tartarus emeticus), suvga qo'shing (21 ° da 12,5 qism). S. oksidi esa, aksincha, kuchsiz angidrid xossalariga ega boʻlib, SbCl 3 eriguncha oʻyuvchi kaliy yoki soda dozasini qoʻshish orqali oson oshib ketadi: eriydigan oq choʻkma, avvalgidek, ortiqcha reagentga eriydi. discord alyuminiy tuzlari uchun joy. Surma kislotasining kaliy va natriy tuzlari uchun muhim ahamiyatga ega, masalan, qaynoq suvdan Sb 2 O3 natriy gidroksidida kristallanadi. natriy surma NaSbO2 + 3H2 O, yorqin oktaedrlarda; Bunday tuzlar ham mavjud - NaSbO 2 + 2HSbO2 va KSbO 2 + Sb2 O3 [Ehtimol, bu asosiy tuz, kaliy-surma, ortosurm kislotasi sifatida ko'rib chiqilishi mumkin -
]. Kislota polikislota yoki metakislota (fosforik kislotalarning nomlariga o'xshash), HSbO 2 noma'lum; ortopirokislota shaklida: H 3 SbO3 yuqorida ko'rsatilgan tartarik kislota tuzining eritmasiga nitrat kislota qo'shilganda va butun mahsulot 100 ° haroratda quritilgandan so'ng saqlanadigan nozik oq kukun shaklida paydo bo'ladi; H 4 Sb2 O5 trisulfat kislotani mis sulfatga shunday miqdorda qo'shib o'rnatiladiki, filtrat oktik kislota bilan to'q sariq rangli cho'kma hosil qilishni to'xtatadi - cho'kma keyin oq rangga aylanadi va Qozon ombori bo'lishi mumkin.
S. pentaklorid turining yopishqoq oksidi Surmiy angidridi Sb2 O5. Kukun C. yoki oksidga energetik qaynayotgan nitrat kislota qoʻllanilganda ajralib chiqadi; bir marta shifo topgan kukun, keyin muloyimlik bilan isitiladi; Vín tuman zavichay domyshka pastki oksidi. Sof shaklda angidridni antimon kislotasi tuzlaridan ajratish mumkin, ularni nitrat kislota bilan eritib, elementlar suvdan chiqarilgunga qadar cho'kmaning qizdirilishiga imkon beradi; Bu suvda erimaydigan chaynalgan kukun bo'lib, bu uning qizil rangdagi ko'k lakmus qog'ozini tayyorlash qobiliyatini ko'rsatadi. Nitrat kislotada angidrid mutlaqo parchalanmagan, xlorid (mitik) kislotada u hech bo'lmaganda butunlay parchalanadi; Ammiak bilan qizdirilganda, bino bug'lanadi. Stokda surma angidridining uchta gidrati mavjud bo'lib, ular fosforik angidridning gidratlariga o'xshaydi. Ortosurmik kislota H3 SbO4 kaliy metaantimon kislotasidan suyultirilgan nitrat kislota bilan ishlov berish yo'li bilan chiqadi va 100 ° da yuvilgan va quritilganidan keyin omborda saqlanadi; 175° da von meta-kislota HSbO3 ga aylanadi; norozi hidrat - oq kukunlar, ayniqsa kaliy gidroksidi va, eng muhimi, suvda; kuchliroq qizdirilganda ular angidridga aylanadi. Pirosurmiy kislotasi(Fremi uni meta-kislota deb ataydi) C. pentakloridda issiq suv bilan chiqadi.U oq choʻkmaga oʻxshaydi, havoda quritilganda H 4 Sb2 O7 + 2H 2 O ni oʻz ichiga oladi va 100° da oʻzgaradi. suvsiz kislotaga aylanadi, ya'ni 200 ° ( Va u suv ostida turganda oddiygina meta-kislotaga aylanadi. Perik kislota suvda kuchliroq, orto kislotadan past; Sovuq ammiak bilan xuddi shunday ishlaydi, orto kislota buni qilmaydi. Tuzlar faqat meta-perik kislota uchun ishlatiladi, bu, shubhasiz, orto-kislota HSbO 3 + H 2 O formulasini berish huquqini beradi, uni meta-kislota gidrati bilan o'z ichiga oladi. Metall nitrat kukuni (yoki sof oltingugurtdan) selitra bilan eritilganda natriy va kaliy metazollari ajralib chiqadi. KNO 3 dan suv bilan yuvilganidan keyin oq kukun chiqadi, suvda eriydi va kristallanishni boshlaydi; noldan ko'rilgan va 2KSbO3 + 3H2O suv bilan 100 ° da quritilgan; 185 ° da suvning bir qismini iste'mol qiladi va KSbO 3 + H2 O ga aylanadi. Natriy gidroksidi 2NaSbO3 + 7H2 O ni o'z ichiga oladi, 200 ° da 2H 2. iste'mol qiladi. Bu tuzda yangi karbon kislotasi eritilishi mumkin: agar siz kaliy tuzi eritmasidan 2 o'tsangiz, unda bunday kislotali tuzning muhim cho'kmasi chiqadi 2K 2 O∙3Sb2 O5 + 7H2 O (100° da quritgandan so'ng, p quritish bo'lsa. 350 ° da boshqa 2H 2 O ni olib tashlaydi). Agar meta-kislota issiq ammiakda erigan bo'lsa, u holda sovutilganda ammoniy tuzi (NH 4 )SbO3 kristallanadi, bu sovuqda eritilganda muhim ahamiyatga ega. Oksidlovchi S. oksidi, kaliy gidroksidi (kaliy surma), xameleon va keyin bugʻ filtratida eritilib, distillangan. kislotali kaliy pirosuroksid 2 H2 Sb2 O7 + 4H2O gacha; Bu tuz suv bilan aralashtiriladi (20° - 2,81 qism suvsiz tuz 160 qism suv) va natriy tuzini aniq tahlil qilish uchun reagent bo'lib xizmat qiladi (o'rta diapazonda), chunki u xuddi shunday kristalli Na 2 H2 Sb2 tuzidir. O7 + 6H2 Suvga qarash juda muhim. Aytish mumkinki, bu natriy tufayli eng muhimi, ayniqsa spirtli ichimliklar mavjudligida; Agar mahsulot tarkibida 0,1% dan kam natriy tuzi bo'lsa, bu tuzning kristalli cho'kmasiga olib keladi. Litiy, ammoniy va past tuproqli metallarning surmian tuzining qoldiqlari ham axlatni hosil qiladi, keyin, shubhasiz, bu metallar ilgari olib tashlangan. Boshqa metallarning tuzlari ajralishi yoki suvda erimasligi muhim ahamiyatga ega; hidlarni suyuqlikdan kristalli cho'kindilar shaklida ajratish mumkin va kislotali tuzlarda kuchsiz kislotalar bilan o'zgarishi mumkin, kuchli kislotalar esa kuchli kislotani eritishi mumkin. Antimonitlarning aksariyati xlorid kislotada eritiladi.
Teri yuzasi kuchli qizdirilganda, yana bir oksid paydo bo'ladi, Sb 2 O4 o'zi:
Sb2 O5 = Sb2 O4 + ½O2 í Sb 2 O3 + ½O2 = Sb2 O4.
Bu oksiddan shunday foydalanish mumkinki, u uch valentli va besh valentli S.ni oʻz ichiga oladi, keyin bu holda u ortosurmik kislotaning oʻrta quvvati Sb "" SbO4 yoki asosiysi OSb-SbO 3 metakislotasi hisoblanadi. Bu oksid yuqori haroratlarda eng barqaror bo'lib, qizil qo'rg'oshin (qo'rg'oshin) va ayniqsa vismutning o'xshash Bi 2 O4 (vismut) oksidiga o'xshaydi. Sb 2 O4 uchuvchan bo'lmagan oq kukun bo'lib, kislotalarga juda sezgir va tabiiy oltingugurt bilan qizdirilganda Sb 2 O3 bilan bir vaqtda chiqadi.- Sb2 O4 o'tloqlarda uchraydi; kaliy bilan eritilganda va suv bilan yuvilganda, issiq suvda erigan va K 2 SbO5 ni o'z ichiga olgan oq mahsulot paydo bo'ladi; Bu tuzga o'xshash modda, ehtimol, ortosurmik kislotaning tuzga o'xshash tuzi (OSb) K 2 SbO4. Xlorid kislota bunday tuzni K 2 Sb4 O9 kislotali tuzi bilan cho'kadi, uni pirosurmik kislotaning qo'shilgan tuzi (OSb) 2 K2 Sb2 O7 bilan aralashtirish mumkin. Tabiatda kaltsiy va mis uchun xuddi shunday suspenziyalangan (?) tuzlar mavjud: Romeit (OSb) CaSbO4 va amyolit (OSb) CuSbO4. Sb 2 O4 koʻrinishini kilkis tahlilida S. deb hisoblash mumkin; Nordon metallni chayish va uni havoga yaxshi kirish imkoniyati bilan (ochiq tigelda) muhrlab qo'yish va tigeldan yonuvchi gazlarning tigel ichiga yo'qolmasligi uchun ehtiyot bo'lish kerak.
Kumush metallarni tayyorlash usuliga ko'ra, masalan va amyshak, xuddi shu metallarga ko'proq huquqlar, pastki xrom bilan sug'urta qilinishi mumkin. Kislotali eritmalarda (ayniqsa, xlorid kislota ishtirokida) mavjud boʻlgan barcha uch valentli S. fermentlangan suv bilan aralashtirilganda trisir sof S., Sb 2 S3 ning toʻq sariq-qizil choʻkmasiga aylanadi, bu esa qoʻshimcha ravishda suv bilan aralashtiriladi. Pentavalent S. ishtirokida, shuningdek, xlorid kislota ishtirokida, ayniqsa, Sb 2 S3 va kuchli sirop bilan yaxshilab aralashtirilgan bo'lishi kerak bo'lgan fermentlangan suv bilan beshta oltingugurt S. Sb 2 S5 ning sarg'ish-qizil rangli kukunini bering; sof Sb 2 S5 chiqadi, agar boshlang'ich haroratda ortiqcha gidratlangan suv bibariya tuzi (Bunsen) bilan kislotalangan bo'lsa; Sb 2 S3 miqdorida va bir kun davomida issiq nordon suvni o'tkazib yuborsangiz, ularni kuchli suv bilan olib tashlang; Tuproqning harorati qancha past bo'lsa va suv oqimi qanchalik ko'p bo'lsa, Sb 2 S3 va suyuqlik shunchalik kam ajralib chiqadi va Sb 2 S5 shunchalik tozalanadi (Bosêk, 1895). Boshqa tomondan, Sb 2 S3 va Sb 2 S5, shuningdek, sichqonlarga o'xshash birikmalar angidridlarning kuchiga ega bo'lishi mumkin; tioangidridlar; Oltingugurt ammoniy yoki oltingugurtli kaliy, natriy, bariy va boshqalar bilan birlashganda ular, masalan, tiozollarni beradi. Na 3 SbS4 va Ba 3 (SbS4)2 yoki KSbS 2 va ichida. Bu tuzlar, ehtimol, fosfor guruhi elementlarining nordon tuzlariga o'xshaydi; ular sulfonik kislotalar deb ataladi, bu esa organik sulfonik kislotalarning tuzlari to'g'risida chalkashlikka olib keladi, ular sulfonik kislotalar deb ataladi. bular angidridlar va bu asoslar bilan.] Trisirchist C. Sb 2 S3 nomlari ostida jiddiy baxt S.ning eng muhim rudasini ifodalaydi; kristalli va qadimgi sharsimon tosh jinslarning keng doirasi mavjud; Cornwallis, Ugorshchina, Transylvania, Westphalia, Black Forest, Bohemia, Sibirda topilgan; Yaponiyada ayniqsa katta, yaxshi yoritilgan kristallar, Borneoda esa ko'proq muhim konlar mavjud. Sb 2 S3 prizmalarda kristallanadi va birinchi navbatda o'zgaruvchan-kristalli, metall nashrida kulrang-qora massalarni hosil qiladi; urish vaga 4.62; eriydigan va oson kukunli, barmoqlarni grafit kabi eritadi va uzoq vaqtdan beri ustaralarni kesish uchun kosmetika sifatida ishlatilgan (Injil, Hizqiyo payg'ambar kitobi, XXIII, 40); "Surma" nomi bilan u so'riladi va, ehtimol, bizda shu maqsadda hali ham singib ketmoqda. Savdoda qora kumush S. (Antimonium crudum) - eritilgan ruda; Ushbu material kulrang rang, metall porlash va kristal qo'shilishi bilan ifodalanadi. Tabiatda qo'shimcha ravishda, masalan, turli abraziv metallar (tiopodlar) bilan tuzga o'xshash Sb 2 S3 ko'proq birikmalar mavjud. SbS3 va Rudida, Sb 2 S3 tashqari, sof rux, mis, shilimshiq va mysh'yak, deb atalmish mohiyati. la'nati rudalar. Agar trisir kristalli eritilsa, u qattiqlashguncha (suvga quyiladi) tez sovutilishi mumkin, u amorf ko'rinishda chiqadi va shuning uchun kamroq ta'sir qilishi mumkin. Vaga, o'zi 4.15, qo'rg'oshin-kulrang rangga ega, yupqa to'plarda u sümbül-qizil kabi ko'rinadi va kukunning ko'rinishi qizil-jigarrang dog'ga ega; Kristalli ko'rish bilan ishlaydigan elektr ishlarini qilmang. Bu ovoz. surmiya jigari(hepar antimontii), yak to osgan kristall sb 2 s3 bir vaqtning o’zida fokus bo’lsa, men anti-monk Kaliyuning erituvchisi [Roschini qurilish kilinati kisen pechkasi. Sb 2 S3 va selitraning kukun aralashmasidan (teng miqdorda) tayyorlanadigan jigarning yana bir turi va reaktsiya aralashmaga tashlangan pishirilgan voguil bilan boshlanadi va asta-sekin qo'shilish va jinnilik, qasos bilan yanada kuchliroq davom etadi, KSbS 2 va KSbO 2, ko'proq K 2 SO4, shuningdek, surma kislotasining donasi (K-tuz).]:
2Sb2 S3 + 4KOH = 3KSbS2 + KSbO2 + 2H2 O
Shunday qilib, siz amorf trisir sof S.ni osongina ajratib olishingiz mumkin, buning uchun pechkani suv bilan to'kib tashlang va filtratni sulfat kislota bilan filtrlang yoki kristalli Sb 2 S3 ni qaynayotgan KOH (yoki K 2 3) bilan seping va keyin filtratni yoying. kislota; Ikkala turdagi cho'kmalarda ham yuqori darajada suyultirilgan kislota (nihoyat tish toshlari) va suv bilan yuvib tashlang va 100 ° da quriting. Natijada och qizil-jigarrang, oson ifloslangan, xlorid kislotada, oʻyuvchi va karbonat kislotalarda erigan S.ning oltingugurtli kukuni, ancha yengilroq, quyi kristall Sb 2 S3 hosil boʻladi. Sof oltingugurtning shunga o'xshash preparatlari, garchi to'liq sof bo'lmasa ham, qadimgi davrlardan boshlab "mineral kermes" nomi bilan paydo bo'lgan va tibbiyotda va farb sifatida turg'un bo'lgan. Sb 2 S3 gidratining kislotali suv bilan qaynatilganda chiqadigan va S. oksidini erituvchi toʻq sariq-koʻk choʻkmasi 100—130° da suvni emiradi (vaʼda qiladi), 200° da qora rangga aylanadi; Suyultirilgan xlorid kislota to'pi ostida karbonat angidrid gazi qaynoq suvda eriydi (Mitchellning ma'ruzasi, 1893). Agar qusuq toshining erishi uchun yorqin suv qo'shsangiz, kaltsiy xlorid va boshqa ba'zi tuzlar qo'shilganda cho'kma hosil bo'lgan koloidal Sb 2 S3 ning to'q sariq-qizil (yorug'langanda) rangini ko'rasiz. Suvni reaktivda isitish natijasida metall to'liq yangilanmaguncha Sb 2 S3 hosil bo'ladi, azotli atmosferada u faqat tarqaladi. Kristalli Sb 2 S3 boshqa oltingugurt birikmalarini tayyorlash uchun ishlatiladi, shuningdek, Bertolet oltingugurt va boshqa oksidlovchi moddalar aralashmasida qaynayotgan suyuqlik sifatida pirotexnika maqsadlarida shved nordonlari boshlari omboriga kiradi va u uchun ishlatiladi. boshqa ateşleyiciler, u ham dorivor ahamiyatga ega - hayvonlar (otlar) uchun tashuvchi sifatida Pyatisirchist S. oziq-ovqatda ko'rsatilganidek, yoki suyultirilgan kislotaning suyultirilgan tiosollarning suyultirilgan kislotalari bilan tarqalishi orqali olib tashlanishi mumkin:
2K 3 SbS4 + 6HCl = Sb2 S5 + 6KCl + 3H2 S.
Bu tabiatda keng tarqalgan emas, lekin uzoq vaqtdan beri tashqarida; Glauber (1654 r.) metall tayyorlanganda shifo topadigan shlakdan, tatar va selitra, otik kislota bilan eritilganda surmish yaltirashidan ajratib olishni tasvirlab berdi va uni tashuvchi sifatida tavsiya qildi b (Panacea antimonialis seu oltingugurt purgans universal). ). Shu sababli, tahlil paytida o'ng tomonda onaga xabar berish kerak: kislotali suvni 4 va 5-analitik guruhlardan olamiz; qolganlar orasida S. ham bor; Sb 2 S5 va Sb 2 S3 ko'rinishiga qarab (hayratlanarli darajada kattaroq) yoki faqat Sb 2 S Z ko'rinishiga qarab cho'kadi (agar cho'kma holatida yarim tip SbX 5 bo'lmagan bo'lsa), so'ngra u bilan mustahkamlanadi. oltingugurtli metallardan ko'p miqdorda oltingugurtli ammoniy 4-guruhlar qamalda yo'qoladi; SB 2 S3 do'stim bir vydfiltruvannya cho'kindi bilan Vygudi Amonia Tyosoli turi, Roschini yilda SB 2 S5 Men Potim barcha C. Viyavlyat yilda amonym ning bagatosirchystim kesib. 5-guruhning oltingugurt metallari bilan, ular keyingi tadqiqotlarda bo'lgani kabi. Pentasirchistaya S. suvda buzilmaydi, kislotali oʻtloqlarning suv eritmalarida, ularning karbonat kislota tuzlari va kislotali oʻtloq metallarida, shuningdek, sulfat ammoniy va issiq ammiakda oson ajraladi, ammoniy karbonatda emas. Agar Sb 2 S5 issiq nurga duchor bo'lsa yoki suv ostida 98 ° da, shuningdek, suvsiz yoki shamolsiz qizdirilsa, u quyidagicha parchalanadi:
Sb2 S5 = Sb2 S3 + 2S
Natijada dorivor xlorid kislota bilan qizdirilganda oltingugurt, oltingugurtli suv va SbCl 3 ni beradi. Tiozurmik kislota ampi, yoki Na 3 SbS4 + 9H 2 O tarkibidagi yirik muntazam tetraedrlarda, barsiz yoki sariq rangda kristallanadigan "sil Schlippe", Sb 2 S3 va oltingugurt aralashmasi kaustik natriy konsentratsiyasiga qarab eritilganda ajratilishi mumkin ii. yoki suvsiz sulfat kislota va Sb 2 S3 ni ugillar bilan birlashtirish va qaynatib, so'ngra olingan qotishmani oltingugurt bilan suv bilan maydalash. Bu tuzlar kerakli reaktsiyaga ega va sovigan tuzlar va ayni paytda achchiq-metall ta'mga ega. Xuddi shunday, kaliy tuzini olib tashlash mumkin va Sb 2 S5 BaS dan ajratilganda bariy tuzi paydo bo'ladi; Bu tuzlar kristallarni K3 SbS4 + 9H2 O va 3 (SbS4 )2 + 6H 2 O bilan tinchlantiradi. Pentasirxist S. kauchukni vulkanizatsiya qilishda (div.) davolaydi va unga jigarrang-qizil rang beradi. Surmiya suvi
2SbH3 + 6S = Sb2 S 3 + 3H2 S
nima uchun apelsin-chervona vidozmina Sb 2 S3 olasiz; zulmatda va zulmatda ochilmagan harakat tartibi, uning o'zi quyidagi hollarda ochiladi:
2SbH3 + 3H 2 S = Sb2 S3 + 6H2.
Agar siz nitrat eritmasidan SbH 3 (3 H 2) ni o'tkazib yuborsangiz, siz qora cho'kma olasiz, bu Surmyanistlar sriblo metall buyumlar uyi bilan:
SbH3 + 3AgNO3 = Ag3 Sb + 3HNO3;
Natijada S. kondensatsiyalanadi va tabiatda rangi oʻzgaradi. Kislotali o'tloqlarning erishi o'sib borayotgan jigarrang rangning SbH 3 va shamoldan loy hosil bo'lishi bilan parchalanadi. Shu kabi suvlar shilimshiq suvni xarakterlaydi; xafa bo'lgan suvlar ammoniy turiga o'xshash moddalarni berishning kundalik tartibini aniqlamaydi; hidlar gidroksid mavjudligini ko'rsatishi va kislotalarning kuchini aniqlashi mumkin. Boshqa suvga asoslangan S., suvda kambagʻal, analogiyaga koʻra, ishonchliligidan nomaʼlum; metalleva S., elektroliz yo'li bilan olib tashlangan va shish, suvga olib kelishi mumkin; Bu erda Vibuxova kabi asetilen yoki azot kislotasi kabi shunga o'xshash suv manbai bo'lishi mumkin. S. uchun uchuvchi, gazga oʻxshash suv aloqasining yaratilishi uni ayniqsa metall boʻlmaganlarga oʻtkazish imkonini beradi; va uning metall emasligi, shubhasiz, metallar bilan turli xil qotishmalarni ishlab chiqarish bilan bog'liq. Metall-organik qismlar
Z. turgʻunlikning kattaroq ahamiyatini bilish; ularda S. mavjudligi mustahkamlik va qattiqlikni oshiradi va sezilarli qattiqlik bilan u bilan birlashtirilgan metallarning tiniqligini oshiradi. Qoʻrgʻoshin va S.dan hosil boʻlgan qotishma (4 soat va 1 soat hisoblang) Drukar harflarini quyish uchun ishlatiladi, buning uchun qotishmalar ko'pincha ma'lum miqdorda qalay (10-25%), ba'zan esa hatto tayyorlanadi. bir oz midi (2% ga yaqin). Shunday ovoz "Britaniya metalli" - 9 qismli qalay, 1 qismli mis va mis (0,1% gacha) qotishmasi; Sharob choynak, qozon va boshqalarni tayyorlash uchun ishlatiladi. idishlar "Oq yoki ishqalanishga qarshi metall" - podshipniklar uchun qotib qolgan qotishmalar; Bunday qotishmalarda taxminan 10% S. va 85% gacha qalay mavjud boʻlib, u kamida yarmi qoʻrgʻoshin (Babbit metalli) bilan almashtiriladi, bundan tashqari, 5% gacha mis boʻlib, ularning bir qismi poʻstlogʻiga tushadi C. 1,5 gacha. %, qotishma biladigan qo'rg'oshin, 7 soat C. 3 soatlik yuvish bilan "Reaumur qotishmasi" yarating, bu juda qattiq va fayl bilan ishlov berilganda uchqun hosil qiladi. va Cu 2 Sb (Regulus Veneris) aralashmasi bilan binafsha rangli qotishma. Karbon kislotasi metallari va vugillalar bilan sintez qilish uchun tayyorlangan natriy yoki kaliy bilan qotishmalar, shuningdek, tish toshlari bilan qovurilgan oksid, assimilyatsiya qilish uchun hamma narsa olinadi. ish ochiq havoda qilingan, lekin kukunlar ko'rinishida va shifobaxsh metalning sezilarli miqdori bilan, shamolda o'z-o'zini ish bilan ta'minlash juda ko'p, suvda esa suv bor, parchalanish va kislotali o'tloqni beradi. qamalda surmi kukuni. S.ning organometalik birikmalarini olib tashlash uchun 12% gacha kaliy va vikoristni o'z ichiga oladi (div. Qotishmalar).
2SbCl3 + 3ZnR2 = 2SbR 3 + 3ZnCl2,
bu erda R = CH 3 yoki C 2 H5 va in., shuningdek, RJ, yodid spirti radikallari va qotishma C. kaliy bilan o'zaro ta'siri bilan. Trimetilstibin Sb(CH3)3 81° da qaynatiladi, sp. vaga 1,523 (15°); trietilstibin 159 ° da qaynatiladi, sp. vaga 1324 (16°). Ularni suv bezovta qilmasligi mumkin, ammo ular ertalab o'zlariga g'amxo'rlik qilishlari uchun tsibula radini hidiga to'ladilar. RJ bilan ulanish, stibíni berish stibonium yodis R4 Sb-J, undan - uglevodlar bilan almashtirilgan yodid ammoniy, fosfoniy va arsoniy radikallariga mutlaqo o'xshash - o'zgaruvchan o'tloqlar kuchiga ega bo'lishi mumkin bo'lgan almashtirilgan stboniumlar R 4 Sb-OH oksidlarining asosiy gidratlarini ajratib olish mumkin. iv. Ale, qo'shimcha ravishda, shartlar hatto ikki valentli elektropozitiv metallar bilan konteynerlariga o'xshaydi; badbo'y hid nafaqat xlor, oltingugurt va nordon, masalan, tuzga o'xshash hid bilan osongina birlashtiriladi. (CH 3 )3 Sb=Cl2 va (CH 3 )3 Sb=S va oksid, masalan (CH 3 )3 Sb=O yoki, masalan, rux kabi kislotalardan suvni olib tashlash orqali.
Sb(C2H5)3 + 2ClH = (C2H5)3 Sb = Cl2 + H2.
Oltingugurt metallari gidroksidi tuzlar bilan reaksiyaga kirishib, tuzlardan cho'kadi, masalan:
(C2 H5) 3 Sb = S + CuSO4 = CuS + (C2 H5) 3 Sb = SO4.
Oltingugurt kislotasini kaustik barit bilan cho'ktirish orqali siz sulfat kislota stibin oksidini olib tashlashingiz mumkin:
(C2 H5 )3 Sb = SO 4 + (OH) 2 = (C 2 H5 )3 Sb = O + BaSO 4 + H 2 O.
Bunday oksidlar ehtiyotkorlik bilan shamollatish bilan chiqadi; hidlar suv bilan yo'q qilinadi, kislotalarni zararsizlantiradi va muhim metallarning oksidlarini o'z ichiga oladi. Omborning orqasida va stibinlarning oksidlari fosfinlar va arsinlarning oksidlariga mutlaqo o'xshaydi, lekin ular asosiy hokimiyat organlari tomonidan ulardan farqlanadi. Natriy benzol gidroksid bilan reaksiyaga kirishganda ajralib chiqadigan trifenilstibin Sb (C6 H5 )3, SbCl 3 ni fenilxlorid bilan birlashtiradi va 48° da eriydigan shaffof tabletkalarda kristallanadi, u galogenlar bilan birlashadi, lekin yorqin yoki CH 3 J bilan emas: Stibinlarning metall quvvatini kamaytiradi, izlaydi; Bir xil turdagi o'xshash yarimo'tkazgichlarning metalldan ko'ra ko'proq metall bo'lishi muhimroqdir, bu mutlaqo teskari: chegara radikallarini yo'q qiladigan iR3 yong'in kelishidan oldin yaratilmaydi va i(C 6 5 )3. beradi (C 6 H5 )3 Bi=Cl2 í (C 6 H5 )3 Bi = Br 2 (div. Vismut). Elektropozitiv xususiyatga erishish uchun metall ikki valentli atomga o'xshash aloqa paydo bo'lishi uchun elektronegativ fenillarni zaiflashtirish kerak. S. S. Kolotov.
Entsiklopedik lug'at F.A. Brokxaus va I.A. Efron. - S.-Pb.: Brockhaus-Efron. – GOLD (lat. Aurum), Au (“aurum” o‘qing), atom raqami 79, atom og‘irligi 196,9665 kimyoviy element. Uzoq vaqtdan beri ko'rilgan. Tabiatda bitta barqaror 197Au izotopi mavjud. Tashqi va old elektron qobiqlarning konfiguratsiyasi. Ensiklopedik lug'at
- (frantsuzcha Chlore, nemischa Chlor, inglizcha Chlorine) galogenidlar guruhidan element; Yogo Cl belgisi; atomik vaga 35.451 [Stasdan Z rozrahunku Klark ma'lumotlari] O = 16 da; Cl 2 ning bir qismi, bu Bunsen va Regnault tomonidan topilgan kuchga juda mos keladi ...
- (xim.; Fosfor fransuz, fosfor nim., fosfor ingliz va lot., P belgilari, inod Ph; atomik vaga 31 [Yangi atomik vaga F. topilgan (van der Plaats) shunday: 30,93 bilan qoʻshiqni yangilash usuli. F. metallning yordami... Entsiklopedik lug'at F.A. Brokxaus va I.A. Efrona
Entsiklopedik lug'at F.A. Brokxaus va I.A. Efrona
- (Soufre frantsuz, oltingugurt yoki brimstone ingliz, Schwefel nim., then yunon, lat. Oltingugurt, yulduz belgisi S; atom qiymati 32,06 da O = 16 [Stas tomonidan kumush kumush ombori orqasidagi qiymatlar Ag 2 S] ) eng muhim metall bo'lmagan elementlarga joylashtirilishi.… … Entsiklopedik lug'at F.A. Brokxaus va I.A. Efrona
- (Platin frantsuz, Platina yoki um English, Platin nym.; Pt = 194,83, K. Seibertga ko'ra O = 16 sifatida). P. chaqiruvi boshqa metallarga hamroh bo'ladi va bu metallarning kimyoviy kuchlari orqasida unga qo'shilganlari nomidan voz kechilgan. Entsiklopedik lug'at F.A. Brokxaus va I.A. Efrona
- (Soufre frantsuz, oltingugurt yoki brimstone ingliz, Schwefel nim., thenon yunon, lat. Oltingugurt, yulduz belgisi S; atom qiymati 32,06 da O = 16 [Stas tomonidan sof kumush Ag2S ombori orqasidagi qiymatlar]) qo'ying sonigacha eng muhim metall bo'lmagan elementlar. Von...... Entsiklopedik lug'at F.A. Brokxaus va I.A. Efrona
Y; va. [forscha. surma metall] 1. Kimyoviy element (Sb), zangori oq metall (u texnologiyada turli qotishmalarda uchraydi, boshqacha qilib aytganda). Surmi eritish zavodi. Surmini sirka bilan birlashtirish. 2. Qadimgi zamonlar uchun: qora soch uchun farba, soch olish, soch. Ensiklopedik lug'at
- (Forscha sourme). Tabiatda yorqinlik bilan birlashtirilgan metall; Vikorista tibbiyotda qusish kabi. Rus tilidagi omborga etib kelgan xorijiy so'zlarning lug'ati. Chudinov A.N., 1910. Surma surma, metall kulrang rang; urish V. 6,7; …… Rus tilidagi xorijiy so'zlar lug'ati
Surma oddiy kimyoviy moddadir, davriy jadvalning 51-sonli Sb elementi. Kimyogarlar uni moddalar, metalloidlar, shuningdek, metallar va nometalllarning kuchini ochib beruvchi moddalar sifatida tasniflashadi.
Surma tabiatda tabiiy shaklda va ko'pincha minerallar omborida uchraydi (ularning yuzdan ortig'i ma'lum); qo'rg'oshin, mis va yog'och rudalari omborida. Tijorat ahamiyatiga ega bo'lgan faqat bitta mineral mavjud - stibnit (surmiy sulfid).
Maxsuslikni ko'ring
Surma 4 ta metall alotropik modifikatsiyaga ega va 3 ta amorf: sariq surma, qora, vibuxova. Metall surma, bor ser surma - kumushga o'xshash qatronlar ko'k rangli quyma, metallga o'xshash, qattiq, deyarli maydalangan va kukunga aylanadi. Juda yuqori tozalikdagi metall surma plastikdir. Nutq oddiy onglarda barqaror, oqim va issiqlikni o'tkaza olmaydi, bu dirijyorning kuchiga olib kelishi mumkin. Metall uchun noyob kislotalilikka ega - u sovutilganda kengayadi, shuning uchun u drukar harflarini tayyorlash uchun ishlatiladi.
Qizdirilganda yoki yorqin tiniqlanganda, sariq surma o'tkazuvchanlik kuchiga ega qora surmaga aylanadi. Vibuxov surmasi maydalanganda tebranadi. Qo'shiqchi aqllar uchun qora ta vibuxova surma metallevuga boring.
Surma juda ko'p metallarni parchalaydi (ular bilan intermetalik birikmalar hosil qiladi). Kimyoviy reaksiyalar III va V valentlikka ega. Kislota bilan oksidlanish 600 °C gacha qizdirishni talab qiladi. Konsentrlangan nitrat va sulfat kislotalar, “qirollik yondirgich” bilan, galogenlar va xlor bilan reaksiyaga kirishadi.
Surma, ayniqsa Sb III, shuningdek, uning yarim o'tkazgichlari, odamlar va hayvonlarning tanasida mavjud bo'lgan mikroelement bo'lsa-da, sofdir. Kimyoviy reagent tanada to'planishi mumkin, bu qalqonsimon bez va qalqonsimon bez funktsiyasining pasayishiga olib keladi. Kon qazish ishlarida, rudalarni qayta ishlash va qotishmalarni eritishda himoya qilishning individual xususiyatlarini hisobga olish kerak. Pari va ichilgan surmi organlar faoliyatining buzilishi, bosh aylanishi, burundan qon ketishi, terining tirnash xususiyati va kasalliklarga olib keladi. Surmini stravoxid orqali olish unchalik xavfsiz emas, uning bo'laklari parchalanish jarayonida gidrolizlanadi va tanadan chiqariladi.
Surma 2-sinfdagi toksik moddalarga qo'shiladi va shamol, suv, kanalizatsiya va tuproq bilan birgalikda sanitariya me'yorlari bilan tartibga solinadi.
Zastosuvannya
 - Surma omborga maksimal 200 ta qotishma bilan kiradi. Qotishmaga surma qo'shilishi uning qattiqligini oshiradi. Ayniqsa, qoʻrgʻoshin, qalay, mis va vismut bilan qotishmalardan podshipniklar, drukar shriftlari, agressiv suyuqliklarni (qattiq qoʻrgʻoshin) pompalash uchun quvurlar, shrapnellar va shrapnellar tayyorlash uchun eruvchan, ammo qattiq, aşınmaya bardoshli qotishmalarni olib tashlash uchun foydalanish keng tarqalgan.
- Surma omborga maksimal 200 ta qotishma bilan kiradi. Qotishmaga surma qo'shilishi uning qattiqligini oshiradi. Ayniqsa, qoʻrgʻoshin, qalay, mis va vismut bilan qotishmalardan podshipniklar, drukar shriftlari, agressiv suyuqliklarni (qattiq qoʻrgʻoshin) pompalash uchun quvurlar, shrapnellar va shrapnellar tayyorlash uchun eruvchan, ammo qattiq, aşınmaya bardoshli qotishmalarni olib tashlash uchun foydalanish keng tarqalgan.
- surmiyning tebranish bilan ishlaydigan asosiy qismi akkumulyator plitalari va batareyalar ishlab chiqarish uchun qattiq qo'rg'oshin (qotishma 15% Sb gacha bo'lishi mumkin) ishlab chiqarishga ketadi. Bu metall, shuningdek, tebranishdan elektrodlar, kabel qoplamalari va quruq ekranlarni ishlab chiqarish uchun ham ishlatiladi.
- germaniy, indiy, galiy va alyuminiy bilan surmi qotishmalari - yuqori sifatli o'tkazgichlar. Surmi telurid termoelektrik qotishmalar omboriga kiradi.
- Surmi oksidi (III) - surmi sanoatida eng ko'p talab qilinadigan birikma. Issiqlikka chidamli matolar va emallar, ko'zoynaklar, keramika, to'qimachilik, olovga chidamli moddalarni saqlash uchun mos bo'lgan yuqori termal barqarorlikka ega. Bunga asoslangan mato kemalarni, shu jumladan ularning suv osti qismlarini ishlab chiqarish uchun ishlatiladi. Surmium trioksidi metallurgiya va o'tkazgichlar ishlab chiqarish uchun yuqori toza Sb qazib olish uchun vikorizatsiya qilinadi.
- Surmiy sulfidlari III va V pirotexnika vositalaridan, ishlab chiqarishdan olinadi  qoplarni o'tkazish, zanjabil boshlari omborida, kauchukni vulkanizatsiya qilish uchun, dorivor begona o'tlar uchun ayniqsa elastik va issiqlikka chidamli saqich omborida (qurt saqichlari).
qoplarni o'tkazish, zanjabil boshlari omborida, kauchukni vulkanizatsiya qilish uchun, dorivor begona o'tlar uchun ayniqsa elastik va issiqlikka chidamli saqich omborida (qurt saqichlari).
- Surma trixlorid kimyo sanoatida yuqori tozalikdagi surmani saqlash uchun, organik sintezda, noyob suvsiz agentni saqlash uchun jamlangan. Analitik kimyo bo'yicha vikorist; to'qimachilik sanoatida mordan sifatida.
– Surma shisha, chinni va kulolchilik sanoati uchun mo‘l-ko‘l materiallar va pigmentlar omboriga, bo‘yash uchun surma materiallari omboriga boradi. Sof surmiyaning qovurilgan dispers kukuni "Zalizna Black" farbining asosidir.
- Bundan tashqari, lyuminestsent lampalarda surma turg'unlashadi; dorivor preparatlarda; g-viprominion va neytronlar natijasida, qo'rg'oshinsiz lehimda.
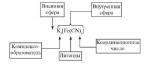
Kimyoviy reagentlar, laboratoriya jihozlari va himoya vositalari do'konida keng assortimentdagi kimyoviy reagentlar, shu jumladan surma (III) oksidlari mavjud.
SURMA, Sb (turkcha srme, lotincha Stibium * a. surma; n. Antimon; f. antimon; i. antimonio), Mendelev davriy sistemasining V guruhining kimyoviy elementi, atom raqami 51, atom ogʻirligi 121,75. Tabiiy surma 121 Sb (57,25%) va 123 Sb (42,75%) ikkita barqaror izotoplar yig'indisidan iborat. Sb ning massa raqamlari 112 dan 135 gacha bo'lgan 20 dan ortiq individual radioaktiv izotoplari mavjud.
Surma uzoq vaqtga borib taqaladi (miloddan avvalgi 3-ming yillikda Bobilda undan idishlar tayyorlangan). Miloddan avvalgi 2-ming yillik boshlarida Misrda. Antimonit kukuni (tabiiy sulfid Sb 2 S 3) kosmetik mahsulot sifatida ishlatiladi. Surmi va spolukni olish kuchi va usulining batafsil tavsifi birinchi marta 1604 yilda kimyogar Vasiliy Valentin () tomonidan berilgan. Fransuz kimyogari A.Lavuazye (1789) surmani antimoin nomi bilan kimyoviy elementlar qatoriga kiritgan.
Surma - ko'k rangli va metall nashrida kumush-oq rang; Surmining kristall va 3 ta amorf shakllari mavjud (Vibuxova, Chorna va Jovta). Kristalli surma (shuningdek, mahalliy) olti burchakli panjaraga ega a = 0,4506 nm; qalinligi 6618 kg/m 3 erish t 630,9°C; qaynash harorati 1634 ° S; issiqlik o'tkazuvchanligi 23,0 Vt/(mK); u holda molyar issiqlik sig'imi 25,23 JDmol.K); elektr ta'minoti 41.7.10-4 (Ohm.m); chiziqli kengayishning harorat koeffitsienti 15.56.10 -6 K -1; diamagnetik. Surma qarsillab turadi, bo'linish tekisliklari bo'ylab osongina bo'linadi, kukunga yuviladi va kiyish uchun o'zini oqlamaydi. Surmining mexanik kuchi uning tozaligidadir. Surma metallarga aqliy ravishda keltiriladi. Vibuxov surmasi (qalinligi 5640-5970 kg/m 3) shishib dotikaga aylanadi; SbCl 3 ni elektroliz qilish orqali hal qilinadi. Qora surma (qalinligi 5300 kg/m 3 ) koʻmir bilan sovutilganda chiqadi; Birinchi modifikatsiya kislotani noyob hidrid SbH 3 orqali o'tkazishdir. Bu metastabil birikmalar bilan qorong'u modifikatsiya bo'lib, vaqt o'tishi bilan kristall fazaga o'tadi.
Spolukslardagi surma valentlikni ko'rsatadi +5, +3, -3; Kimyoviy nuqtai nazardan, u faol emas va issiqlik ta'sirida erish nuqtasiga oksidlanmaydi. Antimon kislotasi faqat eritilgan eritma bilan o'zaro ta'sir qiladi, bu Sb2O 3 ni tinchlantiradi; suv va azot oddiy aqlga ta'sir qilmaydi. Galogenlar bilan faol ta'sir o'tkazadi (krem F 2). Surma xlorid va sulfat kislotalarda butunlay eriydi. Metalllar bilan birlashganda, surma antimonidlarni hosil qiladi. Antimon kislotasining muhim korroziy tuzlari - antimonatlar (V) (Me SbO 3 .3H 2 Pro, Me - Na, K) va metaantimonatlar (III) (Me SbO 2 .3H 2 Pro) amaliy qiziqish uyg'otadi. hokimiyat uchun katta ahamiyatga ega. Surma zaharli, GDC 0,5 mg/m3.
Surmining yer qobigʻida (klark) oʻrtacha miqdori 5,10-5%, oʻta asosli jinslarda 1,10-5%, asosli 1,10-4%, kislotali 2,6-10-5%. Surma gidrotermal tug'ilgan joylarda to'plangan. Surmiy, shuningdek surmiya-simob, surmiy-qo'rg'oshin, oltin-surmiy, surmiy-volfram jinslari ma'lum. Z 27