VUGLEROD, C (a. carbon; n. Kohlenstoff; f. carbone; i. carbono), - მენდელიევის პერიოდული სისტემის IV ჯგუფის ქიმიური ელემენტი, ატომური ნომერი 6, ატომური მასა 12.041. ბუნებრივი ნახშირი წარმოიქმნება 2 სტაბილური იზოტოპის ჯამისგან: 12 C (98,892%) და 13 C (1,108%). ასევე არსებობს ნახშირბადის 6 რადიოაქტიური იზოტოპი, რომელთაგან ყველაზე მნიშვნელოვანია კოსმოსური ევოლუციის 14 N ნეიტრონები).
Vouglets v_domy z ღრმა ანტიკურობა. ხის vikoristovuvsya აღმოჩენის ლითონები საწყისი მადნები, და ალმასის - yak. ქვანახშირის ქიმიურ ელემენტად აღიარება მიბმული იყო ფრანგი ქიმიკოსის ა.ლავუაზიეს (1789) სახელებთან.
ცვლილებები და სიმძლავრე ნახშირში
ქვანახშირის 4 კრისტალური მოდიფიკაციაა: გრაფიტი, ბრილიანტი, კარაბინი და ლონსდალეიტი, რომლებსაც ძლიერ აპროტესტებენ მათი დომინირება. კარაბინი არის ნახშირის ნაჭერი, რომელიც არის შავი ფერის წვრილად კრისტალური ფხვნილი, რომლის კრისტალური სტრუქტურა ხასიათდება ნახშირის ორი ატომის არსებობით, რომლებიც პარალელურად ლპება ერთიდან ერთზე. სისქე 3230-3300 კგ/მ 3 თბოტევადობა 11,52 ჯ/მოლ.კ. ლონსდალეტის გამოვლინებები მეტეორიტებში და ოტრიმანის ნაჭერში; მისი სტრუქტურა და ფიზიკური ძალა საკმარისად დეტალურად არ არის დადგენილი. ნახშირისთვის დამახასიათებელია ასევე ბანაკი მოუწესრიგებელი აგებულებით - ე.წ. ამორფული ქვანახშირი (ჭვარტლი, კოქსი, სოფელი ვუგილია). "ამორფული" ნახშირის ფიზიკური ძალა ძლიერ დეპონირებულია ნაწილაკების დისპერსიისა და სახლების არსებობის გამო.
ქიმიური ძალა ნახშირში
ნახშირის ძირში ჟანგვის ხარისხია +4 (ყველაზე ფართო), +2 და +3. უდიდესი გონებისთვის ქვანახშირი ქიმიურად ინერტულია, მაღალი ტემპერატურისთვის ეს ხდება ელემენტების სიმდიდრით, რაც აჩვენებს ძლიერ შთამაგონებელ ძალას. ნახშირის ქიმიური აქტივობა იცვლება სერიაში "ამორფული" ნახშირი, გრაფიტი, ბრილიანტი; მჟავე ამინდთან ურთიერთქმედება ნახშირის ამ სხვადასხვა ტიპებში შეინიშნება 300-500°С, 600-700°С, 850-1000°С ტემპერატურაზე ნახშირორჟანგის (CO 2) და მონოქსიდის (CO) ნახშირის ხსნარებთან. დიოქსიდი განსხვავდება წყლისგან გახსნილი კარბოლის მჟავით. ქვანახშირის ყუნწის ყველა ფორმა lugіv і მჟავები. ჰალოგენებთან ნახშირბადი პრაქტიკულად არ ერევა (კრიმ გრაფიტი, რომელზეც F 2 900 ° C-ზე მაღალია, რეაგირებს), ამიტომ ჰალოგენები ამოღებულია ირიბად. აზოტოვანი დამაბინძურებლების შუაგულში, ციანიტური წყლის HCN (ჰიდროციანური მჟავა) და იოგოს რიცხვითი დანაკარგების პრაქტიკულ მნიშვნელობას დიდი პრაქტიკული მნიშვნელობა აქვს. 1000 ° C-ზე მაღალ ტემპერატურაზე ნახშირბადი ურთიერთქმედებს მდიდარ ლითონებთან, რომლებიც ქმნიან კარბიდს. უნდა წარმოქმნას ნახშირის შეუსაბამობა გამოჩენილ არაორგანულ და ორგანულ მწარმოებლებში.
ნახშირის ყველაზე მნიშვნელოვანი ძალა არის ერთ-ერთი ატომის შექმნა, რომელიც აყალიბებს მინერალურ ქიმიურ კავშირებს მათ შორის, ისევე როგორც მათ და ამ სხვა ელემენტებს შორის. ნახშირბადის უნარი, დაამყაროს 4 თანაბარი ვალენტური ბმა ნახშირბადის სხვა ატომებთან, იძლევა სხვადასხვა ტიპის ნახშირბადის ჩონჩხების ფორმირებას (წრფივი, გაფორმებული, ციკლური); სწორედ ეს ძალები ხსნის ნახშირის როლს ყველა ორგანული ველის, ზოკრემისა და ყველა ცოცხალი ორგანიზმის ცხოვრებაში.
ქვანახშირი ბუნებასთან ახლოს
ნახშირის საშუალო რაოდენობა დედამიწის ქერქში არის 2,3,10% (მასისთვის); ამავდროულად, ნახშირის ძირითადი მასა კონცენტრირებულია დანალექ მთიან ქანებში (1%), თუმცა სხვა მთიან ქანებში ეს ელემენტის აბსოლუტურად დაბალი და დაახლოებით იგივე (1-3,10%) კონცენტრაციაა. ქვანახშირი გროვდება ზედა ნაწილთან და მისი არსებობა დაკავშირებულია ძირითადად ცოცხალ მეტყველებასთან (18%), ხესთან (50%), kam'yanim vugillya (80%), ნაფტასთან (85%), ანტრაციტთან (96%) და ასევე. დოლომიტებითა და ვაპნიაკებით. Vіdomo ponad 100 მინერალი ნახშირში, კალციუმის, მაგნიუმის და რკინის კარბონატების ყველაზე ფართო სპექტრით (კალციტი CaCO 3, დოლომიტი (Ca, Mg) CO 3 და სიდერიტი FeCO 3). დედამიწის ქერქში დაგროვილი ნახშირით, ხშირად ხდება სხვა ელემენტების დაგროვება, რომლებიც შეიწოვება ორგანული მეტყველებითა და წყლით, რომლებიც დეპონირდება დღის დაკრძალვის შემდეგ, გაურკვეველი მინდვრების დანახვისას. დიდი რაოდენობით CO 2 დიოქსიდი ჩანს ატმოსფეროში დედამიწიდან ვულკანური აქტივობისა და ორგანული ხანძრის დაწვის დროს. ატმოსფეროდან CO2-ს იღებენ როსლინები ფოტოსინთეზის პროცესში და დიფუზირდება ზღვის წყალში, რაც ქმნის დედამიწის ნახშირბადის წრის ყველაზე მნიშვნელოვან ლანკას. მნიშვნელოვან როლს ასრულებს კოსმოსის ქვანახშირი; მზეზე ნახშირი სიგანით მე-4 ადგილს იკავებს წყლის, ჰელიუმის და მჟავის შემდეგ, რომელიც მონაწილეობს ბირთვულ პროცესებში.
Zastosuvannya და vikoristannya
ყველაზე მნიშვნელოვანი ხალხი-ხელისუფლება ნახშირის დადებაა იმის გათვალისწინებით, რომ ხალხის მიერ გაფლანგული პირველადი ენერგიის წყაროების დაახლოებით 90% ორგანულად ზის. არსებობს ნაფტას გაძლიერების ტენდენცია და მაწონის მსგავსი, უფრო სიროვინის მსგავსი სხვადასხვა ქიმიური ვირობნიტებისთვის. მე ასევე დავასახელებ ხალხის სახელმწიფოებრიობის როლს ქვანახშირში, ვიდობუტიუმში, როგორც კარბონატებში (მეტალურგია, სიცოცხლე, ქიმიური წარმოება), ბრილიანტები (საიუველირო ნაწარმის გაფორმება, ტექნოლოგია) და გრაფიტი (ბირთვული ტექნოლოგია, ცეცხლის ჭურჭელი, ზეთისხილი, დეიაკი ვიდი მასტილი და ა.შ.) . ბიოგენური გასვლის ნაშთებში 14 C იზოტოპის აქტივობისთვის მითითებულია їх საუკუნე (რადიოკარბონული დათარიღების მეთოდი). 14 C ფართოდ გამოიყენება როგორც რადიოაქტიური მაჩვენებელი. მნიშვნელოვანი მნიშვნელობაა ყველაზე დიდი იზოტოპი 12 C - ამ იზოტოპის ატომის მასის მეთორმეტე ნაწილი აღებულია, როგორც ქიმიური ელემენტების ატომური მასის ერთეული.
ვუგილია
ზ (ნახშირბადი), ელემენტების პერიოდული სისტემის არალითონური ქიმიური ელემენტი IVA ქვეჯგუფი (C, Si, Ge, Sn, Pb). ზუსტრიხი ბუნებაში ჰგავს ალმასის კრისტალებს (ნახ. 1), გრაფიტს ან ფულერენს და სხვა ფორმებს და შედის ორგანული (მატყლი, ნაფტა, არსებები და როსლინი და სხვა) და არაორგანული გამოსვლების (ვაპნიაკი, ხარჩოვას სოდა და სხვა) საწყობში. ქვანახშირი ფართოდ არის გაფართოვებული და ალე იოგოს ნაცვლად დედამიწის ქერქში მხოლოდ 0,19%-ია (განც. ასევე ALMAZ; FULEREN).
ქვანახშირი ფართოდ არის vikoristovuєtsya ერთი შეხედვით მარტივ გამოსვლებში. მოდით შევხედოთ ძვირადღირებულ ბრილიანტებს, რომლებიც სამკაულების შემკულობის საგანია, დიდი მნიშვნელობა აქვს ბრილიანტის დამზადებას - საფქვავი და საჭრელი ხელსაწყოების მოსამზადებლად. სოფელი ვოგილია და ნახშირის სხვა ამორფული ფორმები გამოიყენება დეკონტამინაციისთვის, გაწმენდისთვის, გაზების ადსორბციისთვის ტექნოლოგიის დარგებში, ღია ზედაპირიდან ადსორბენტის საწყობისთვის. აბრაზიული ხელსაწყოს მოსამზადებლად კარბიდი, ნახევრად ქვანახშირი ლითონებით, აგრეთვე ბორით და სილიციუმით (მაგალითად, Al4C3, SiC, B4C) მუშავდება მაღალი სიხისტეთ და ვიკორით. ქვანახშირი შევიდეს ფოლადის და შენადნობების საწყობში ელემენტის ფოლადში და კარბიდების დანახვისას. ფოლადის ჭურჭლის ზედაპირის ზრდა ნახშირთან მაღალი ტემპერატურისთვის (ცემენტაცია) მნიშვნელოვნად ზრდის ზედაპირის სიმტკიცეს და აცვიათ წინააღმდეგობას.
ასევე ALLOY. ბუნებაში არსებობს გრაფიტის უპიროვნო ფორმები; deakі otrimani ნაჭერი; є ამორფული ფორმები (მაგალითად, კოქსი სოფელ ვუგილიაში). ჭვარტლი, ფუნჯის ხე, შავი ლამპარი, აცეტილენის ჭვარტლი იხსნება ნახშირწყლების მჟავიანობის არარსებობისას. ასე რომ, თეთრი ნახშირის ტიტულები, როგორც ჩანს, სუბლიმაციას უკეთებს პიროლიზურ გრაფიტს შემცირებული წნევით - გრაფიტის ფოთლების კრისტალების ხრაშუნა უფსკრული მახვილი კიდეებიდან.
ისტორიული მტკიცებულება.გრაფიტი, ბრილიანტი და ამორფული ნახშირი უძველესი დროიდან. დიდი ხანია ცნობილია, რომ გრაფიტით შეიძლება სხვა მასალის მონიშვნაც და თავად სახელწოდება „გრაფიტი“, რომელიც წააგავს ბერძნულ სიტყვას, რაც ნიშნავს „დაწერას“, 1789 წელს შემოგვთავაზა ა.ვერნერმა. Prote іstorіya grafіtu ჩახლართული, ხშირად აღებული ახალი სიტყვებისთვის, scho vodіyut მოსწონს zvnіshnіmi ფიზიკური ავტორიტეტები, მაგალითად molybdenіt (მოლიბდენის სულფიდი), ერთი საათის განმავლობაში vvazhavsya graphіt. გრაფიტის სხვა სახელებს შორისაა "შავი ტყვია", "კარბიდის ჩამოსხმა", "ბრწყინვალე ტყვია". 1779 წელს კ.შელემ დაადგინა, რომ გრაფიტის დაჟანგვა შესაძლებელია ნახშირორჟანგის ზემოქმედებით. ადრე ინდოეთში ბრილიანტების პოვნა იყო ცნობილი, ხოლო ბრაზილიაში ძვირადღირებული ქვები კომერციულად ღირებული გახდა 1725 წელს; გვარი პვდენი აფრიცის მახლობლად აღმოაჩინეს 1867 წელს. მე-20 საუკუნეში. ბრილიანტების მთავარი მწარმოებლები არიან PAR, Zahir, Botswana, Namibia, Angola, Sierra Leone, ტანზანია და რუსეთი. ნაჭერი ბრილიანტები, რომლის ტექნოლოგია 1970 წელს შეიქმნა, სამრეწველო მიზნებისთვის არის დაწნული.
ალოტროპია.როგორ არის აგებული მეტყველების სტრუქტურული ერთეულები (ატომები მონატომური ელემენტებისთვის ან მოლეკულები პოლიატომური ელემენტებისთვის და ნახევარი) სათითაოდ უფრო დიდი ქვედა კრისტალური ფორმით, ამ ფენომენს ეწოდება ალოტროპია. ნახშირს აქვს სამი ალოტროპული მოდიფიკაცია - ბრილიანტი, გრაფიტი და ფულერენი. ალმასის კანში ნახშირბადის ატომი შეიძლება განლაგდეს ტეტრაჰედრულად სუციდში, რაც ქმნის კუბურ სტრუქტურას (ნახ. 1a). ასეთი სტრუქტურა იძლევა ბმის მაქსიმალურ კოვალენტობას და ნახშირბადის კანის ატომის ოთხივე ელექტრონი ადგენს მაღალი თანამეგობრობის C-C ობლიგაციებს, ტობტო. სტრუქტურას აქვს ყოველდღიური ელექტრონული გამტარობა. ამიტომ, ბრილიანტი სუნთქავს მისი გამტარობის, დაბალი თბოგამტარობის, მაღალი სიხისტის გამო; ყველაზე რთული სხვა გამოსვლებიდან (ნახ. 2). C-C ბმის გასახსნელად (ბმა არის 1,54, კოვალენტური რადიუსი 1,54/2 = 0,77) ტეტრაედრულ სტრუქტურაში საჭიროა დიდი რაოდენობით ენერგია, რის გამოც ხასიათდება ალმასი, სიდიდის რიგი მეწამული სიხისტით. მაღალი დნობის წერტილით (3550°C).

ნახშირბადის კიდევ ერთი ალოტროპული ფორმაა გრაფიტი, რომელიც ძლიერ ეწინააღმდეგება ალმასს დომინირებისთვის. გრაფიტი არის რბილი შავი მეტყველება, რომელიც დამზადებულია კრისტალებისგან, რომლებიც ადვილად ირხევა, სუნთქავს ძლიერი ელექტრული გამტარობით (ელექტრული ოპირი 0,0014 Ohm * სმ). ამიტომ, გრაფიტი ჩერდება რკალის ნათურებსა და ღუმელებში (ნახ. 3), რომლებიც საჭიროებენ მაღალ ტემპერატურას. მაღალი სისუფთავის გრაფიტი გადატვირთულია ბირთვულ რეაქტორებში, როგორც ნეიტრონების დანამატი. დნობის წერტილის ტემპერატურა მოძრავი მანძილით არის 3527 ° C. ძლიერი წნევით, გრაფიტი სუბლიმირებულია (მყარი მდგომარეობიდან გაზში გადადის) 3780 ° C ტემპერატურაზე.

გრაფიტის სტრუქტურა (ნახ. 1,ბ) არის შედედებული ექვსკუთხა რგოლების სისტემა გრძელი რგოლებით 1.42 (მნიშვნელოვნად მოკლე, ბრილიანტით დაბალი), მაგრამ ამ კანით ნახშირბადის ატომი სამია (და არა ქოტირი, როგორც ალმასში). ) კოვალენტური ვარსკვლავების ენები გაორმაგებულია სუზიდებთან, ხოლო მეოთხე რგოლი (3,4) ძალიან გრძელია კოვალენტური კავშირისთვის და სუსტად უკავშირდება მათ შორის გრაფიტის ბურთულების მოთავსების პარალელურად. ნახშირბადში მეოთხე ელექტრონი მიუთითებს გრაფიტის ელექტრული გამტარობის სიცხეზე - რაც უფრო დიდია გრძელი და ნაკლები მაგნიტური ბმა, მით ნაკლებია გრაფიტის კომპაქტურობა, რომელიც ალმასის შემთხვევაში ჩნდება გრაფიტის ქვედა სიმტკიცეში ( გრაფიტის სისქეა 2, 26 გ/სმ3, ბრილიანტი - 3,51 გ/სმ3). Z tієї კარგად იწვევს დოტიკზე ლორწოვან გრაფიტს და ადვილად არბილებს მეტყველების ნაჭრებს, რომლებიც გამარჯვებულია ზეთის და ზეითუნის ფიქალის მოსამზადებლად. სტილუსის ტყვიის სიკაშკაშე უფრო მნიშვნელოვანია, ვიდრე გრაფიტის არსებობა. ნახშირის ბოჭკოები შეიძლება იყოს ნაქსოვი მაღალი ხარისხით და შეიძლება დაგრეხილი ნაჭერი ნაკერის ან სხვა ნართის მოსამზადებლად მაღალი ნახშირით. მაღალ წნევაზე და ტემპერატურაზე, კატალიზატორის, მაგალითად, მარილის თანდასწრებით, გრაფიტი შეიძლება ბრილიანტად გადაიქცეს. ბრილიანტის ნაჭრის სამრეწველო შეძენის რეალიზაციის მთელი პროცესი. ალმასის კრისტალები იზრდება კატალიზატორის ზედაპირზე. Rivnavaga გრაფიტის ბრილიანტი გამოიყენება 15,000 ატმ და 300 K ან 4000 ატმ და 1500 K. ნაჭერი ბრილიანტი შეიძლება ნახშირწყლებიდან აიღოთ. ამორფულ ფორმებში შემიძლია კარბონიზაცია, რომელიც არ აფუჭებს კრისტალებს, მივიყვანო სოფელი ვუგილია, რომელიც მიიღება ხის გაცხელებით განმეორებითი დაშვების გარეშე, ნათურის და გაზის ჭვარტლი, რომელიც დაბალ ტემპერატურაზე წყდება ნახშირწყლებში მარილიანობის დროს არასტაგნაციურ ამინდში და კონდენსირდება. ცივ ზედაპირზე, kistkove vugillya - სახლი კალციუმის ფოსფატი ტექსტილის პროცესებში, და ნავიტის ქვა ვუგილია (ბუნებრივი რეხოვინა სახლებით) და კოქსი, მშრალი ჭარბი, კოქსის წვა ქვის ვუგილია და ნაფტას საბადოების მშრალი დისტილაციის მეთოდით (ბიტუმიანი ვუგილია). , ტობტო. გათბობა განმეორებითი წვდომის გარეშე. კოკა გამოიყენება ჩავუნის დნობისთვის, შავ და ფერად მეტალურგიაში. კოქსირებისას ასევე გამოიყენება აირისმაგვარი პროდუქტები - კოქსის ღუმელის აირი (H2, CH4, CO და სხვა) და ქიმიური პროდუქტები, როგორიცაა გოგირდი ბენზინის მოსაცილებლად, ფარბი, დობრივი, ფარმაცევტული პრეპარატები, პლასტმასი და ა.შ. კოქსის წარმოების ძირითადი აპარატის - კოქსის ღუმელის სქემა ნაჩვენებია ნახ. 3. სხვადასხვა სახის ქვანახშირი და ჭვარტლი გაჟღენთილია ფხვიერი ზედაპირით და ვიკოროზია, როგორც ადსორბენტი გაზის გამწმენდისთვის, ასევე, როგორც კატალიზატორები. ნახშირის სხვადასხვა ფორმის წარმოებისთვის საჭიროა ქიმიური ტექნოლოგიის სპეციალური მეთოდები. ნაჭერი გრაფიტი გამოიყენება ანტრაციტის ან ნაფტა კოქსის შესაწვავად ნახშირბადის ელექტროდებს შორის 2260 ° C ტემპერატურაზე (აჩესონის პროცესი) და ვიკორისტი ზეთისა და ელექტროდების წარმოებაში, კრემს ლითონების ელექტროლიტური მოცილებისთვის.
ბუდოვა ატომ ვუგლეციუ.ყველაზე სტაბილური ნახშირბადის იზოტოპის ბირთვი მასით 12 (სიგანე 98,9%) აქვს 6 პროტონი და 6 ნეიტრონი (12 ნუკლეონი), ტრიომინით შერეული კვარტეტებით, კანი შეიცავს 2 პროტონს და ორ ნეიტრონს, ჰელიუმის ბირთვის მსგავსად. ნახშირბადის მეორე სტაბილური იზოტოპია 13C (ბლ. 1.1%), ხოლო კვალი რაოდენობით ბუნებაში არასტაბილური იზოტოპი 14C გვხვდება 5730 წლის პერიოდით, რომელიც შეიძლება b-მოდიფიცირებული იყოს. ცოცხალი ნივთიერების ნორმალურ ნახშირბადოვან ციკლში მიიღეთ სამი იზოტოპის ბედი CO2-ის სახით. ცოცხალი ორგანიზმის სიკვდილის შემდეგ ვიტრატა მიმაგრებულია ნახშირბადთან და შესაძლებელია C- ობიექტების დათარიღება, რომელთა შურისძიებაც შესაძლებელია, რაც არღვევს 14C რადიოაქტიურობის დონეს. 14CO2-ის b-მოდიფიკაციის შემცირება პროპორციულია სიკვდილის შემდეგ საათისა. 1960 წელს W. Libbie-ს მიენიჭა ნობელის პრემია რადიოაქტიურ ნახშირბადთან მუშაობისთვის.
ასევე რადიოაქტიურობის თარიღი. მთავარ სადგურში ნახშირბადის 6 ელექტრონი ქმნის ელექტრონულ კონფიგურაციას 1s22s22px12py12pz0. მეორე ტოლის ჭოტირის ელექტრონები ვალენტურები არიან, რომლებიც ასახავს ნახშირბადის პოზიციას პერიოდული სისტემის IVA ჯგუფში (დივ. ელემენტთა პერიოდული სისტემა). გაზის ფაზაში ატომის სახით ელექტრონის გადაადგილების ნამსხვრევები დიდ ენერგიას მოითხოვს (დაახლოებით 1070 კჯ/მოლ), ნახშირბადი არ ხსნის იონურ კავშირებს სხვა ელემენტებთან, რისთვისაც საჭიროა ელექტრონის გადაადგილება მიღება დადებითი і მან. მიუხედავად იმისა, რომ ელექტრონეგატიურია, რომელიც 2,5-მდეა, ნახშირბადი არ ავლენს ძლიერ სპორიდობას ელექტრონის მიმართ, როგორც ჩანს, არ არის ელექტრონების აქტიური მიმღები. რომ არ არის სხილნი, რათა utvochennya ნაწილი უარყოფითი მუხტი. Ale s ხშირად ionny ხასიათი zv'yazku deyakі spoluky uglezyu іsnuyut, მაგალითად, karbidi. კუთხეებში ნახშირბადი აჩვენებს ჟანგვის მე-4 სტადიას. იმისათვის, რომ ზოგიერთმა ელექტრონმა შეძლოს ბმების განათებაში მონაწილეობა, აუცილებელია 2s-ელექტრონების გაუფუჭება და ამ ელექტრონების გადახტომა 2pz-ორბიტალზე; რომელზედაც იქმნება 4 ტეტრაჰედრული ბმული მათ შორის 109 ° ჭრილით. ვალენტური ელექტრონების გვერდებზე ნახშირბადი ნაკლებად ხშირად იწევს შიგნით, ამიტომ ნახშირბადი ქმნის მაგნიტურ კოვალენტურ კავშირებს Z-Z ტიპის დედამიწის ატომებს შორის, გლობალური ელექტრონული ფსონის დახმარებით. ასეთი კავშირის განვითარების ენერგია არის 335 კჯ/მოლი, ხოლო Si-Si ბმულისთვის ის ხდება მხოლოდ 210 კჯ/მოლ, რაც მეტია, ვიდრე Si-Si-არასტაბილური ბმა. ბმის კოვალენტური ბუნება შენარჩუნებულია მაღალრეაქტიული ჰალოგენების ნახშირბადთან, CF4 და CCl4-თან კომბინაციაში. ნახშირბადის ატომი zdatnі მიღებულ ბმაზე აყენებს კანის ნახშირბადის ატომის ერთზე მეტ ელექტრონს; ასე რომ, utvoryuyuyutsya podvіyna C \u003d C და potrіyna CєS zv'yazku. სხვა ელემენტები ასევე ამყარებენ კავშირს მათ ატომებს შორის, მაგრამ მხოლოდ შენობის ქვანახშირი აყალიბებს მკვებავ შუბებს. მაშასადამე, ნახშირისთვის არის ათასობით სპოლკი, რომელსაც ეწოდება ნახშირწყლები, ზოგიერთ ქვანახშირში წყალთან და ნახშირბადის სხვა ატომებთან, რომლებიც აკმაყოფილებენ დოვგიურ შუბებს ან კილცევის სტრუქტურებს.
ქიმია ორგანული. ამ ველებში შესაძლებელია წყლის ჩანაცვლება სხვა ატომებით, ყველაზე ხშირად კისენით, აზოტით და ჰალოგენებით და უპიროვნო ორგანული ველების ხსნარებით. მათ შორის მნიშვნელოვანი მნიშვნელობა იკავებს ფტორ ნახშირწყლებს - ნახშირწყლებს, რომლებშიც წყლები იცვლება ფტორით. ასე რომ, ისინი არიან სუპრალინგვურად ინერტული და ვიქტორები, როგორც პლასტმასის და ზეთოვანი მასალები (ფტორნახშირბადები, ასე რომ, ნახშირწყლებში, წყლის ყველა ატომში, რომელიც ცვლის ფტორის ატომებს) და როგორც დაბალი ტემპერატურის გამაგრილებელი აგენტები (სიცივები, ან ფრეონები, - ფტორქლორის ნახშირწყლები). 1980-იან წლებში შეერთებულმა შტატებმა ფიზიკოსებმა აჩვენეს ნახევრად ნახშირი, რომელშიც ნახშირბადის ატომები შერწყმულია 5 ან 6 ნაჭრებად, რაც C60 მოლეკულას აქცევს ცარიელი ტომრის ფორმას, რომელსაც შეუძლია დაასრულოს სიმეტრია. ფეხბურთი m'ya cha. ამ დიზაინის ნატეხები ეფუძნება "გეოდეზიურ გუმბათს", რომელიც აღმოაჩინა ამერიკელმა არქიტექტორმა და ინჟინერმა ბაკმინსტერ ფულერმა, სახელების ახალი კლასი სახელებიდან "buckminsterfulerenes" ან "fulerenes" (და ასევე მოკლედ - "fasiballs" ან "buckyballs") . ფულერენი - სუფთა ნახშირბადის მესამე მოდიფიკაცია (კრიმინალი ალმასამდე და გრაფიტი), რომელიც შედგება 60 ან 70 (და მეტი) ატომისგან, - ბულა ამოიღო ნახშირბადის ფრაქციულ ნაწილაკებზე ლაზერული მოდიფიკაციის შედეგად. დასაკეცი ფორმის ფულერენი წარმოიქმნება ნახშირბადის რამდენიმე ასეული ატომისგან. C60 CARBON მოლეკულის დიამეტრი არის 1 ნმ. ასეთი მოლეკულის ცენტრში არის საკმარისი ადგილი ურანის დიდი ატომისთვის.
ასევე FULLERENI.
სტანდარტული ატომური მასა. 1961 წელს, თეორიული და გამოყენებითი ქიმიის საერთაშორისო კრებულმა (IUPAC) და ფიზიკამ მიიღო ნახშირბადის 12C იზოტოპი, როგორც ატომური წონის ერთეული, ატომური წონის მჟავის მასშტაბის მასშტაბით, რომელიც ადრე იყო გამოყენებული. ნახშირბადის ატომური წონა ამ სისტემაში არის 12.011, ასე რომ, ეს არის საშუალო ნახშირბადის სამი ბუნებრივი იზოტოპისთვის მათი გრძედი ბუნებაში გაუმჯობესებით.
ატომის მასა. Chemіchnі vlastivostі vugletsyu vugletsyu deyih yogo spoluk. Deyakі ნახშირბადის ფიზიკური და ქიმიური ძალა, რომელიც იწვევს სტატისტიკას ქიმიური ელემენტები. ნახშირის რეაქციის შენობა დეპონირებულია იოგოს მოდიფიკაციის, ტემპერატურისა და დისპერსიის სახით. დაბალ ტემპერატურაზე ნახშირის ყველა ფორმა ინერტულია, მაგრამ გაცხელებისას ისინი მჟავე იჟანგება, აფერხებს ოქსიდებს:

წვრილად დაშლილ ნახშირბადს აქვს ზედმეტად მჟავე სამშენებლო ატმოსფერო, როდესაც გაცხელდება ან ნაპერწკლები ჩნდება. პირდაპირი დაჟანგვის კრემი ეფუძნება ოქსიდების შენარჩუნების თანამედროვე მეთოდებს. ნახშირბადის სუბოქსიდი C3O2 იხსნება მალონის მჟავას დეჰიდრატაციით P4O10-ზე:
C3O2 შეიძლება ჰქონდეს მიუღებელი სუნი, რომელიც ადვილად ჰიდროლიზდება, აღადგენს მალონის მჟავას.
ნახშირბადის მონოქსიდი (II) CO იხსნება ჟანგვის დროს, იქნება ეს ნახშირბადის მოდიფიკაცია არა მჟავეების გონებაში. რეაქცია ეგზოთერმულია, ჩანს 111,6 კჯ/მოლი. კოქსი თეთრ სიცხეზე რეაგირებს წყალთან: C + H2O = CO + H2; გაზის ჯამს, რომელიც დნება, ეწოდება "წყლის გაზი" და არის გაზის მსგავსი ცეცხლი. CO ასევე იხსნება ნაფტოპროდუქტების არათანაბარი წვის შემთხვევაში, სახსენებელ ძვლებში ის გვხვდება მანქანის გამონაბოლქვებში, გამოდის ჭიანჭველა მჟავას თერმული დისოციაციის დროს:
CO-ში ნახშირბადის დაჟანგვის სტადია არის +2, ხოლო ნახშირბადის ნატეხები უფრო სტაბილურია +4-ის დაჟანგვის სტადიამდე, შემდეგ CO ადვილად იჟანგება მჟავით CO2-მდე: CO + O2 (r) CO2 და რეაქცია არის ძლიერ ეგზოთერმული (283 კჯ/მოლ). CO zastosovuyut სამრეწველო summіshі z H2 და სხვა წვადი აირები, როგორიცაა ფერმკრთალი ან გაზის მსგავსი გამწოვი. 500°C-მდე გაცხელებისას CO ხსნის CO2-ს მსოფლიოში, მაგრამ 1000°C-ზე ის თანაბარი ხდება CO2-ის დაბალი კონცენტრაციის დროს. CO რეაგირებს ქლორთან, გარდაქმნის ფოსგენს - COCl2, ანალოგიურად მიმდინარეობს რეაქციები სხვა ჰალოგენებთან, გოგირდთან რეაქციები გამოდის კარბონილის სულფიდი COS, ლითონებით (M) CO ხსნის სხვადასხვა საწყობის M (CO) x კარბონილებს, რომლებიც რთული ნახევარებია. კარბონილის მარილი იხსნება სისხლის ჰემოგლობინის CO-სთან ურთიერთქმედებისას, ცვლის ჰემოგლობინის რეაქციას მჟავესთან, ამიტომ კარბონილის ნერწყვი არის მიცნიშა. ამის შედეგად ჰემოგლობინის ფუნქცია იბლოკება, როგორც კლიტინის მჟავიანობის გადამტანი, თითქოს ის მოკვდეს (და პირველ რიგში ტვინის უჯრედები ზარალდება). (არის CO-ს სხვა სახელი - "ჭადნი გაზი"). უკვე 1% (მოც.) როგორც ჩანს, სახიფათოა ადამიანებისთვის, რადგან ცნობილია, რომ ასეთ ატმოსფეროში 10 წუთზე მეტია. SO-ს ფიზიკური სიმძლავრის აქტები მითითებულია ცხრილებში. ნახშირორჟანგი, ან ნახშირბადის ოქსიდი (IV) CO2, იხსნება ელემენტარული ნახშირბადის დაწვისას, იგი ზედმეტად მჟავე ხდება სითბოთი (395 კჯ / მოლი). CO2 (ტრივიალური სახელი - "ნახშირორჟანგი") ასევე იხსნება სრულად დაჟანგული CO-ს, ნავთობპროდუქტების, ბენზინის და სხვა ორგანული ნაერთების შემთხვევაში. წყალში სხვადასხვა კარბონატებთან ერთად, ჰიდროლიზის შედეგად, CO2 ასევე ჩანს:
ეს რეაქცია ხშირად გვხვდება ლაბორატორიულ პრაქტიკაში CO2-ის შეკავებისთვის. ეს გაზი შეიძლება მოიხსნას ბიკარბონატული ლითონების გამოწვისას:
ზეგახურებული ორთქლის გაზის ფაზის ურთიერთქმედების შემთხვევაში CO-სთან:
როდესაც spalyuvannі ნახშირწყლები და їx kisnevirobnyh, მაგალითად:

ანალოგიურად, საკვები პროდუქტები იჟანგება ცოცხალ ორგანიზმში სითბოს და სხვა სახის ენერგიის დანახვით. როდესაც რბილ გონებაში დაჟანგვა მიმდინარეობს შუალედური ეტაპების გავლით, შემდეგ კი საბოლოო პროდუქტები იგივეა - CO2 და H2O, მაგალითად, ციკლების ჩაყრის საათი ფერმენტების დუღილის ქვეშ, ზოკრემა ფერმენტაციის დროს. გლუკოზა:
ნახშირორჟანგისა და ლითონის ოქსიდების მდიდარი ტონაჟი გვხვდება კარბონატების სამრეწველო თერმული განაწილებაში:

CaO დიდი რაოდენობით არის გამარჯვებული ცემენტის წარმოების ტექნოლოგიაში. კარბონატების თერმული სტაბილურობა და სითბოს დანაკარგი მათ განაწილებაზე სქემის მიხედვით იზრდება CaCO3 სერიებში (დივ. ელექტრონული ბუდოვა ჟანგბადის ნახშირბადი. ნებისმიერი სახის ნახშირბადის ოქსიდის ელექტრონული სიცოცხლე შეიძლება აღწერილი იყოს სამმაგი რეზონანსული სქემებით ელექტრონული წყვილების განსხვავებული განაწილებით - სამმაგი რეზონანსული ფორმებით:

ოქსიდირებული ნახშირის ულვაშები ხაზოვან სიცოცხლეს თიშავს.
ვუგლიკის მჟავა.როდესაც C2 წყალთან ურთიერთქმედებს, ნახშირმჟავა H2CO3 იხსნება. CO2-ის უდიდეს სახეობაში (0,034 მოლ/ლ), მოლეკულების მხოლოდ ნაწილი შთანთქავს H2CO3-ს, ხოლო CO2-ის დიდი ნაწილი გვხვდება ჰიდრატირებული CO2*H2O სადგურში.
კარბონატი.კარბონატები იხსნება ლითონის ოქსიდების CO2-თან ურთიერთქმედებით, მაგალითად, Na2O + CO2 -> NaHCO3, გაცხელებისას ისინი იშლება CO2 დანახვით: 2NaHCO3 -> Na2CO3 + H2O + CO2 მათი რიცხვი უფრო მნიშვნელოვანია ვიდრე სოლვეის მეთოდი:

კიდევ ერთი მეთოდია სოდის ამოღება CO2-დან და NaOH-დან

კარბონატ-იონის CO32 შეიძლება იყოს ბრტყელი O-C-O ჭრილით, ტოლი 120° და გრძელი CO-ბმულით 1.31
(დივ. ასევე LUZHIV VIROBNITSTVO).
ჰალიდები ნახშირში.ქვანახშირი გაცხელებისას ურთიერთქმედებს შუამავლობის გარეშე ჰალოგენებთან, რაც ხელს უწყობს ტეტრაჰალიდებს, ალოე ვერას, რეაქციის სიჩქარე და პროდუქტის გამოსავლიანობა მცირეა. მაშასადამე, ნახშირბადის ჰალოგენი ამოღებულია სხვა მეთოდებით, მაგალითად, ნახშირბადის ქლორის დისულფიდი ამოღებულია CCl4-ით: CS2 + 2Cl2 -> CCl4 + 2S იოგო, როგორც ნახევარმთვარე, ასე რომ, ტემპერატურის მსგავსად, აფეთქების ფოსგენის ხსნარი (გაზის მსგავსი აფეთქება). მეტყველება). თავად CCl4 ასევე ვირუსულია და დაქუცმაცებულ ძვლებში ჩასუნთქვის შემთხვევაში შეიძლება გამოიწვიოს ღვიძლის დაზიანება. СCl4 იხსნება ფოტოქიმიურ რეაქციებში მეთანს СH4-სა და Сl2-ს შორის; ამავდროულად შესაძლებელია მეთანის არამწვავე ქლორირების პროდუქტების - CHCl3, CH2Cl2 და CH3Cl დაშლა. ანალოგიურად, რეაქციები მიმდინარეობს სხვა ჰალოგენებთან.
რეაქცია გრაფიტზე.გრაფიტი, როგორც ნახშირბადის მოდიფიკაცია, რომელიც იფეთქება ექვსკუთხა რგოლების ბურთებს შორის დიდი უფსკრულით, შედის არაპირველ რეაქციებში, მაგალითად, ლითონის გუბეები, ჰალოგენები და მარილის მჟავები (FeCl3) შეაღწევს ბურთებს შორის, აკმაყოფილებენ K C8 ტიპს. , KC16 KClO3 ტიპის ძლიერ ჟანგვის აგენტები მჟავე გარემოში (გოგირდის ან აზოტის მჟავა) ხსნის მეტყველებას დიდი მოცულობის კრისტალური მარცვლებით (6-მდე ბურთებს შორის), რაც აიხსნება მჟავე ატომებისა და წარმონაქმნების შეწოვით. ზედაპირზე მათ შედეგად და დაჟანგვის utvoryayutsya კარბოქსილის ჯგუფები (-COOH ) - ნახევარი ტიპის დაჟანგული გრაფიტის ან მელიტის (ბენზოლჰექსაკარბოქსილის) მჟავა C6(COOH)6.
კარბიდი.ქვანახშირი მზადდება სხვადასხვა მასალის ლითონებით, ბორით და სილიციუმით, რომლებსაც კარბიდები ეწოდება. ყველაზე აქტიური ლითონები (IA-IIIA ქვეჯგუფი) ხსნიან მარილის მსგავს კარბიდებს, მაგალითად, Na2C2, CaC2, Mg4C3, Al4C3. მრეწველობაში კალციუმის კარბიდი მიიღება კოქსისა და ვაიპისგან შეურაცხმყოფელი რეაქციებისთვის:

კარბიდები არ არის ელექტროგამტარები, შეიძლება იყოს უნაყოფო, ჰიდროლიზებული ნახშირწყლებში, მაგალითად CaC2 + 2H2O = C2H2 + Ca(OH)2 აცეტილენი C2H2, რომელიც იხსნება რეაქციის შედეგად, ემსახურება როგორც ნაყოფიერი სიროვინა ორგანულ ნაერთებში. ციკავიის, ნამსხვრევების მთელი პროცესი წარმოადგენს გადასვლას არაორგანული ბუნების სიროვინიდან ორგანული ნაერთების სინთეზზე. კარბიდებს, რომლებიც გამოიყენება აცეტილენის ჰიდროლიზში, ეწოდება აცეტილიდები. სილიციუმის კარბიდებსა და ბორს (SiC და B4C) აქვთ კოვალენტური ბმები ატომებს შორის. გარდამავალი ლითონები (ელემენტები B-ქვეჯგუფი) ნახშირით გაცხელებისას ასევე ხსნიან ცვალებადი საწყობის კარბიდს ლითონის ზედაპირზე ნაპრალებში; მათი zv'yazok ახლოს არის მეტალთან. ამ ტიპის კარბიდის აგენტები, მაგალითად WC, W2C, TiC და SiC, აქვთ მაღალი სიხისტე და ცეცხლგამძლე თვისებები და აქვთ კარგი ელექტროგამტარობა. მაგალითად, NbC, TaC და HfC არის ყველაზე ცეცხლგამძლე მეტყველება (m.p. = 4000-4200 ° C), დენიობიუმის კარბიდი Nb2C არის სუპერგამტარი 9,18 K-ზე, TiC და W2C სიმტკიცე ალმასთან ახლოს და სიმტკიცე B4C (ალმასის სტრუქტურული ანალოგი). ) 9.5-ით ჩამორჩება მოჰსის სკალას (დივ. სურ. 2). ინერტული კარბიდი ფიქსირდება, ისევე როგორც გარდამავალი ლითონის რადიუსი აზოტით მოწამვლა. NH2CONH2 სეხოვინი მოყვანილია ჯგუფის მწვერვალზე - აზოტ-მეგობრული, რომელიც ერთი შეხედვით ჩერდება. Secovina მიიღება NH3-დან და CO2-დან, როდესაც თბება ვიცეზე:
Dicyane (CN)2 ხშირად უწოდებენ ფსევდოჰალოგენს ჰალოგენებისა და იოგოს მსგავსი ძალის გამო. დიციანს აქვს მსუბუქი დაჟანგვა ციანიდ-იონის მჟავით, წყლის პეროქსიდით ან Cu2+ იონით: 2CN- -> (CN)2 + 2e. ციანიდ-იონი, როგორც ელექტრონის დონორი, ადვილად ასრულებს რთულ რეაქციებს გარდამავალი ლითონის იონებით. CO-ს მსგავსად, ციანიდი-იონი არის otrutoyu, pov'yazuyuchi საცხოვრებლის მნიშვნელოვანი ნაწილი ცოცხალ ორგანიზმში დერეფნისა. ციანიდის კომპლექსურ იონებს შეიძლება ჰქონდეთ ზოგადი ფორმულა []-0,5x, სადაც x არის ლითონის კოორდინაციის რიცხვი (კომპლექსის წარმომქმნელი აგენტი), რომელიც ემპირიულად აღემატება ლითონის იონის ჟანგვის მდგომარეობის ქვემეორე მნიშვნელობას. ასეთი რთული იონების კონდახები є (ქვემოთ გამოწვეული ბუდოვის დეიაკის იონები) ტეტრაციანონიკელატი (II) -იონი [] 2-, ჰექსაციანოფერატი (III) [] 3-, დიციანოარგენატი [] -:

კარბონილები.ნახშირბადის მონოქსიდის შენობა შუამავლობის გარეშე რეაგირებს მდიდარ ლითონებთან ან მეტალის იონებთან, რაც ხელს უწყობს რთული ნახევრების შექმნას, როგორც მათ კარბონილებს უწოდებენ, მაგალითად Ni (CO) 4, Fe (CO) 5, Fe2 (CO) 9, [] 3, Mo (CO) ) 6, [ ] 2. ბმული ამ შემთხვევებში მსგავსია ციანოკომპლექსის აღწერილობაში მოცემულ ბმულზე. Ni(CO)4 - მფრინავი მეტყველება, რომელიც მოპირკეთებულია ნიკელის და სხვა ლითონების წყალგამაგრებისთვის. სტრუქტურებში ჩავუნისა და ფოლადის სტრუქტურის გაუარესება ხშირად დაკავშირებულია კარბონილის ხსნარებთან. წყალი შეიძლება შევიდეს კარბონილის საცავში და განადგურდეს კარბონილის ჰიდრიდები, როგორიცაა H2Fe(CO)4 და HCo(CO)4, რომლებიც აჩვენებენ მჟავე ძალას და რეაგირებენ მდელოსთან: H2Fe(CO)4 + NaOH -> NaHFe(CO)4 + H2O V_domi ასევე კარბონილის ჰალოგენები, მაგალითად Fe (CO) X2, Fe (CO) 2X2, Co (CO) I2, Pt (CO) Cl2, de X - იქნება ეს ჰალოგენი
(დივ. ასევე ლითონ-ორგანული ფურცლები).
ნახშირწყლებში. Vіdomo bezlіch spoluk წყლის სიბნელეში
(div. CHEMISTRY ORGANIC).
ლიტერატურა
სუნიაევი ზ.ი. ნაფტოვის ქვანახშირი. მ., 1980 ჰიპერკოორდინირებული ნახშირის ქიმია. მ., 1990 წ
კოლიერის ენციკლოპედია. - Vіdkrite suspіlstvo. 2000 .
სინონიმები:საინტერესოა, რა არის "VUGLEROD" სხვა ლექსიკონებში:
ნუკლიდების ცხრილი Zagalnі vіdomostі სახელი, სიმბოლო Vuglets 14, 14C
ნუკლიდების ცხრილი Zagalnі vіdomostі დასახელება, სიმბოლო Vuglets 12, 12C Neutronіv 6 Protonіv 6 ნუკლიდის სიმძლავრე ატომური მასა 12.0000000(0) ... Wikipedia
ქვანახშირი - ცე, შესაძლოა, მთავარი და უმნიშვნელოვანესი ქიმიური ელემენტი დედამიწაზე და ამისთვისაც, დამატებით იქმნება სხვადასხვა ველების კოლოსალური რაოდენობა, როგორც არაორგანული, ასევე ორგანული. ქვანახშირი არის ყველა ცოცხალი არსების საფუძველი, შეიძლება ითქვას, რომ ნახშირი, ისევე როგორც წყალი და მაწონი, არის სიცოცხლის საფუძველი ჩვენს პლანეტაზე! ვაგლეტები შეიძლება განსხვავდებოდეს ფორმებით, რადგან ისინი არ ჰგვანან ფიზიკურ და ქიმიურ ძალებს და არც გარეგნულად. ალე ყველა ცე ვუგლეტს!
ისტორია
Vouglets buv vіdomiy chelovedstve s davn_h დიდი ხნის წინ. გრაფიტმა და ვუგილამ გაიმარჯვეს ძველმა ბერძნებმა, ხოლო ალმასები ცნობილი იყო ინდოეთში. მართალია, გრაფიტს ხშირად ცდებიან მსგავსი გარეგნობის იატაკად. პროტე, გრაფიტის მავ ფართოდაა დარგული ძველად, ზოკრემა ფოთოლი. Navit yogo სახელი წააგავს ბერძნულ სიტყვას "grafo" - "ვწერ". ზეთისხილში გრაფიტი ამავე დროს გადამდებია. ბრილიანტებით ვაჭრობა ჯერ ბრაზილიაში დაიწყო მე-18 საუკუნის პირველ ნახევარში, ამავდროულად აღმოაჩინეს ანონიმური გვარები და 1970 წელს გაფართოვდა ალმასების ცალმხრივად შეძენის ტექნოლოგია. ასეთი დაქუცმაცებული ბრილიანტები ოსტატურად, ბუნებრივ კარგად, საკუთარი შავით, სამკაულებშია.
ქვანახშირი ბუნებასთან ახლოს
ნახშირბადის ყველაზე მნიშვნელოვანი რაოდენობა მიიღება ატმოსფეროში და ჰიდროსფეროში ნახშირორჟანგის სახით. ქვანახშირის ატმოსფეროში არის დაახლოებით 0,046%, და კიდევ უფრო მეტი - წმინდა ოკეანის მიმოფანტულ ხედში.
გარდა ამისა, რაც უფრო მეტს ვსვამდით, ქვანახშირი ცოცხალი ორგანიზმების საფუძველია. მაგალითად, 70 კგ მასის ათას ადამიანს აქვს დაახლოებით 13 კგ ნახშირი! ცე ნაკლები ერთ ადამიანში! და ნახშირი იგივეა ყველა ზრდასა და არსებაში. ღერძი და გაიხარე...
Krugoobіg vugleciu in prirodі
ნახშირის ალოტროპული მოდიფიკაციები
ვოგლეტი უნიკალური ქიმიური ელემენტია, რაც მას ე.წ. ეს მოდიფიკაციები არის კრისტალური, ამორფული და ჰგავს მტევანებს.
ბროლის მოდიფიკაციები შეიძლება იყოს სწორი კრისტალი. tsієї ჯგუფების ტყუილია: ბრილიანტი, ფულერიტი, გრაფიტი, ლონსდალეიტი, ნახშირბადის ბოჭკოები და მილები. უფრო მნიშვნელოვანია ნახშირის კრისტალური მოდიფიკაციები რეიტინგის „ნაივერდული მასალები მსოფლიოში“ პირველ თვეებში.
 ნახშირის ალოტროპული ფორმები: ა) ლონსდალეიტი; ბ) ბრილიანტი;
ნახშირის ალოტროპული ფორმები: ა) ლონსდალეიტი; ბ) ბრილიანტი; გ) გრაფიტი; დ) ამორფული ნახშირი; ე) C60 (ფულერენი); ვ) გრაფენი;
ზ) ერთი ბურთიანი ნანომილაკი
სხვა ქიმიური ელემენტების პატარა სახლებიდან ნახშირისგან დამზადებული ამორფული ფორმები. ამ ჯგუფის ძირითადი წარმომადგენლები არიან: ვუგილია (კამიანი, სოფელი, აქტიური), ჭვარტლი, ანტრაციტი.
ყველაზე დახვეწილი და მაღალტექნოლოგიური პირობა ნახევრად მაგარია მტევნის დანახვაზე. მტევანი არის სპეციალური სტრუქტურა, თუ ნახშირბადის ატომები დაფქვილია ისე, რომ დააკმაყოფილოს ცარიელი ფორმა, რადგან ის შუაში ივსება სხვა ელემენტების ატომებით, მაგალითად, წყლით. ამ ჯგუფს არ ჰყავს ამდენი წარმომადგენელი, მასში შედის ნახშირბადის ნანოკონები, ასტრალი და ბიკარბონატები.
 გრაფიტი - ალმასის "ბნელი მხარე".
გრაფიტი - ალმასის "ბნელი მხარე". Zastosuvannya vugletsyu
იმ იოგას ნახევარდედის ნახშირს უდიდესი მნიშვნელობა აქვს ადამიანის ცხოვრებაში. დედამიწაზე დამკვიდრებული ცეცხლის ძირითადი ტიპების ნახშირებიდან - ბუნებრივი აირი და ნაფტა. ქვანახშირი ფართოდ არის დაკავებული ქიმიურ და მეტალურგიულ მრეწველობაში, ყოველდღიურ ცხოვრებაში, მანქანათმშენებლობასა და მედიცინაში. ალოტროპული მოდიფიკაციები ალმასის მონაცვლეობაში გამოიყურება სამკაულებში, ფულერიტი და ლონსდალეიტი რაკეტების წარმოებაში. შუაღამისას მექანიზმებისთვის მზადდება სხვადასხვა ზეთები, ტექნიკურად აღჭურვილი და უხვად განსხვავებული. Promislovіst ამავე დროს არ შეუძლია ნახშირის გარეშე, vikoristovuєtsya skrіz!
მემორანდუმი "ნიკიფორივსკის საშუალო განათლების No1 სკოლა"
ქვანახშირი და იოგოს მთავარი არაორგანული ფილები
ესე
ვიკონავი: სტუდენტი 9B კლასი
სიდოროვი ალექსანდრე
მასწავლებელი: სახაროვა ლ.მ.
დიმიტრივკა 2009 წ
შესვლა
თავი I. ყველაფერი ნახშირის შესახებ
1.1. ქვანახშირი ბუნებასთან ახლოს
1.2. ნახშირის ალოტროპული მოდიფიკაციები
1.3. ქიმიური ძალა ნახშირში
1.4. Zastosuvannya vugletsyu
როზდილ II. ნახშირის არაორგანული გროვა
ვისნოვოკი
ლიტერატურა
შესვლა
ვუგლეტები (ლათ. Carboneum) C არის მენდელიევის პერიოდული სისტემის IV ჯგუფის ქიმიური ელემენტი: ატომური ნომერი 6, ატომური მასა 12,011 (1). მოდით შევხედოთ ატომის სიცოცხლეს ნახშირში. ნახშირბადის ატომის ენერგიის დონეზე არის რამდენიმე ელექტრონი. წარმოდგენილია გრაფიკულად:
Vuglets buv v_domy z davnіh-დიდი ხნის წინ და іm'ya pershov_dkrivach tsgogo ელემენტი nevіdome.
ნაპრიკინცი XVII ს. ავერანისა და ტარჯონის ფლორენციელი მღვდლები ცდილობდნენ მცირე რაოდენობის ბრილიანტის შერწყმას ერთ დიდ ბრილიანტში და გააცხელეს ისინი საძილე მაღაროების საწყობის დასახმარებლად. ბრილიანტები გამოჩნდა, ზედაპირზე იწვა. 1772 წელს გვ. ფრანგმა ქიმიკოსმა ა. ლავუაზიემ აჩვენა, რომ CO2 შეიწოვება ალმასის წვის დროს. ლიში 1797 გვ. ინგლისური მოსაზრებები S. Tennant didov_v _გრაფიტისა და ვუგილიას ბუნების იდენტურობა. ნახშირბადის ოქსიდთან (IV) თანაბარი რაოდენობის ქვანახშირისა და ალმასის დაწვის შემდეგ, ისინი ერთნაირი აღმოჩნდა.
ნახშირის მრავალფეროვნება, რომელიც აიხსნება სხვა ელემენტების ატომების ერთ-ერთი ატომის სხვადასხვაგვარად აგებულებით, ნახშირბადის პოზიციის გაზრდით სხვა ელემენტების შუაში.
თავიმე. ყველაფერი ნახშირის შესახებ
1.1. ქვანახშირი ბუნებასთან ახლოს
ქვანახშირი ბუნებაში ცნობილია როგორც თავისუფალ ბანაკში, ისე იატაკის დათვალიერებისას.
ვილნიის ქვანახშირი ალმასის, გრაფიტისა და კარაბინის დანახვისას იკვეთება.
ბრილიანტები უფრო იშვიათია. ყველაზე დიდი ცნობილი ბრილიანტი არის "კულინანი", რომელიც აღმოაჩინეს 1905 წელს. პივდენი აფრიკაში, მასით 621,2 გ და 10 × 6,5 × 5 სმ. მოსკოვის Diamond Fund-ში გროვდება მსოფლიოში ერთ-ერთი უდიდესი და ულამაზესი ბრილიანტი - „ორლოვი“ (37,92 გ).
ჩემს სახელს ბრილიანტს დავარქმევ, ოტრიმავ ვ_დ კაკალი. „ადამასი“ - შეუჩერებელი, შეუვალი. ბრილიანტების ყველაზე მნიშვნელოვანი გვარი გვხვდება პივდენის აფრიკაში, ბრაზილიაში, იაკუტიაში.
დიდი რაოდენობით გრაფიტს ყიდულობენ FRN, შრი-ლანცი, ციმბირი, ალტაი.
სათავე ნახშირბადის მინერალები: მაგნიტი МgСО 3 , კალციტი (ვაპნისპარი, ვაპნიაკი, მარმური, კრეიდა) CaCO 3 , დოლომიტი CaMg (СО 3) 2 და ში.
წვადი კოპალინის ულვაშები - ნაფტა, გაზი, ტორფი, ქვები და ქვანახშირის ქარიშხალი, ფიქალი - ნახშირზე დაფუძნებული. დახურეთ საწყობის უკან ქვანახშირის deyakі vykopnі vugіllya, scho mіstjat მდე 99%.
სანამ ნახშირი მოდის დედამიწის წითელას 0,1%.
ნახშირბადის ოქსიდის (IV) დანახვისას ატმოსფეროში 2 ნახშირბადი შედის. ჰიდროსფეროში არის დიდი რაოდენობით CO 2.
1.2. ნახშირის ალოტროპული მოდიფიკაციები
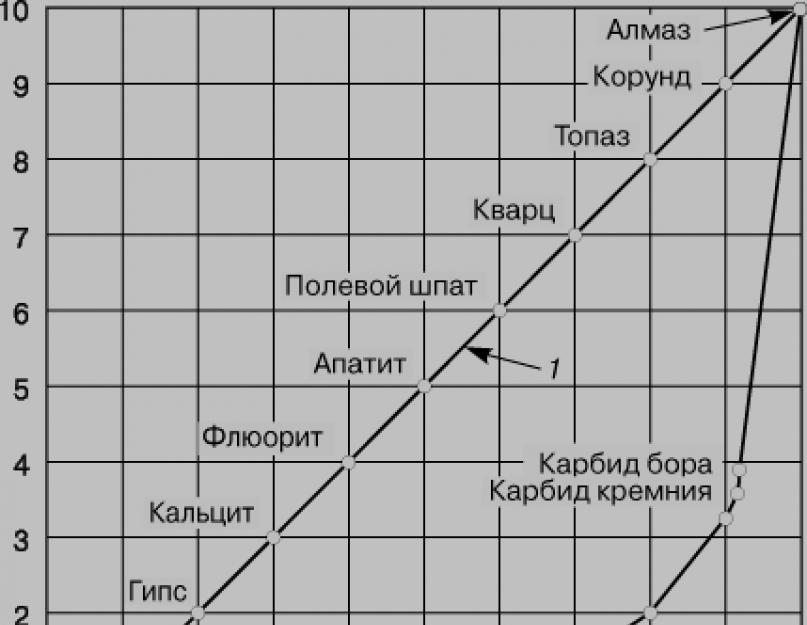
ელემენტარული ნახშირბადი ქმნის სამ ალოტროპულ მოდიფიკაციას: ბრილიანტი, გრაფიტი, კარაბინი.
1. ბრილიანტი არის უფერო, მკაფიო ბროლის მეტყველება, რომელიც ძლიერად არღვევს სინათლის ცვლილებას. ალმასის ნახშირბადის ატომები ხელახლა იყიდება სადგურზე sp 3 -ჰიბრიდიზაცია. გაღვიძებულ მდგომარეობაში იწყება ნახშირბადის ატომებში ვალენტური ელექტრონების გაფუჭება და ზოგიერთი დაუწყვილებელი ელექტრონების მიღება. როდესაც ქიმიური კავშირები დამყარდება, ელექტრონული სიბნელეები იშლება იმავე გრეხილი ფორმით და ფართოვდება სივრცეში ისე, რომ მათი ცულები ჩნდება პირდაპირ ტეტრაედრის ზევით. როდესაც წრეების წვეროები გადაკვეთს ნახშირბადის მცირე ატომებს, კოვალენტური ბმები 109 ° 28"-ის კიდეზე ციმციმდება და იქმნება ატომური ბროლის ბადე, რომელიც დამახასიათებელია ალმასისთვის.
ნახშირბადის ატომი ტყავია ალმასში chotirma іnshimi-ის ნაჭრებით, შუაში დახრილი სწორი ხაზებით ტეტრაედრების ცენტრში ზევით. ტეტრაედრების ატომებს შორის 0,154 ნმ აღწევს. ყველა კავშირის მნიშვნელობა იგივეა. ამ რანგში ალმასის ატომები კიდევ უფრო ძლიერად არის „შეფუთული“. 20°C-ზე ალმასის სისქე ხდება 3,515 გ/სმ 3. ეს აიხსნება იოგას ღვინის სიმკვრივით. Diamant ცუდია ელექტრული საყრდენის გასატარებლად.
1961 წელს რადიანსკის კავშირს გადაეცა ხელნაკეთობა გრაფიტისგან სინთეზური ბრილიანტების წარმოებისთვის.
ალმასის სამრეწველო სინთეზის დროს, ვიკორუსი წარმოიქმნება 1000 მპა წნევაზე და 1500-დან 3000°C-მდე ტემპერატურაზე. პროცესი ტარდება კატალიზატორების თანდასწრებით, რომლებიც შეიძლება იყოს ლითონი, მაგალითად, Ni. ბრილიანტების ძირითადი მასა, რომელიც ჩამოყალიბებულია არის პატარა კრისტალები და ალმასის ხერხი.
ალმასი, 1000°C-ზე მეტი ტემპერატურის გარეშე გაცხელებისას, გარდაიქმნება გრაფიტად. 1750 ° C ტემპერატურაზე, ალმასის ტრანსფორმაცია გრაფიტზე სწრაფია.
ალმასის სტრუქტურა
2. გრაფიტი - ნაცრისფერ-შავი კრისტალური მეტყველება მეტალის ელვარებით, წერტილზე მსუქანი, სიხისტის მიხედვით შესაძლებელია ქაღალდის დახვევა.
გრაფიტის კრისტალებში ნახშირბადის ატომები ხელახლა იყიდება sp 2 -ჰიბრიდიზაციის სადგურზე: კანი მათგან შედგება სამი კოვალენტური ბმა სუციდური ატომებით. Kuti mizh სწორი ხაზებით zv'yazkіv dovnyuyut 120 °. შედეგად იქმნება ბადე, რომელიც ყალიბდება სწორი ექვსცალისაგან. Vіdstan mіzh suіdnіmi ბირთვები аtomіv vіdnії sredinі სფერო і ხდება 0,142 ნმ. კანის ატომის გარე სფეროს მეოთხე ელექტრონი იკავებს p-ორბიტალს გრაფიტში, რომელიც არ მონაწილეობს ჰიბრიდიზაციაში.
ნახშირბადის არაჰიბრიდული ელექტრონის ატომები ორიენტირებულია ბურთის სიბრტყეზე პერპენდიკულარულად და სათითაოდ გადაფარვით ქმნის მარჯვენა σ-ბმას. სუსიდნის სფეროები ბროლის გრაფიტში გვხვდება ერთი და იგივე 0,335 ნმ მანძილზე და სუსტად არის მიბმული ერთმანეთთან, რაც მთავარია ვან დერ ვაალის ძალებით. მაშასადამე, გრაფიტს აქვს დაბალი მექანიკური ძალა და ადვილად იყოფა ზოლებად, თითქოს ძალის ძალების ძალით. გრაფიტში ნახშირბადის ატომების ბურთებს შორის რგოლს ხშირად ლითონის ხასიათი აქვს. ეს ხსნის იმ ფაქტს, რომ გრაფიტი კარგია ელექტრული საყრდენის გასატარებლად, მაგრამ ის მაინც არც ისე კარგია, როგორც ყრიან.
გრაფიტის სტრუქტურა
გრაფიტის ფიზიკური ძალა მკვეთრად განსხვავდება სწორი ხაზებისთვის - ნახშირბადის ატომების პერპენდიკულარული და პარალელური ბურთულებისთვის.
განმეორებითი წვდომის გარეშე გაცხელებისას, გრაფიტმა არ იცის ყოველდღიური ცვლილებები 3700°C-მდე. მითითებული ტემპერატურის მიხედვით ღვინოები მერყეობენ, არ დნება.
გრაფიტის ნაჭერი მიიღება ქვის ბამბის უმოკლეს კლასებიდან 3000 ° C ტემპერატურაზე ელექტრო ღუმელებში ჰაერის წვდომის გარეშე.
გრაფიტი თერმოდინამიკურად სტაბილურია ტემპერატურისა და წნევის ფართო დიაპაზონში, რის გამოც იგი მიღებულია როგორც სტანდარტული ქვანახშირის წისქვილი. გრაფიტის სისქეა 2265 გ/სმ 3.
3. კარბინი - შავი ფერის კრისტალური ფხვნილი. მის კრისტალურ სტრუქტურაში ნახშირბადის ატომები დაკავშირებულია ერთი და სამმაგი რგოლებით, რომლებიც შედგენილია ხაზოვანი შუბებით.
−С≡С−С≡С−С≡С−
ქიუს გამოსვლა წაართვა ვ.ვ. კორშაკი, ა.მ. სლადკოვიმი, ვ.ი. კასატოჩკინიმი, იუ.პ. კუდრიავცევი XX საუკუნის 60-იანი წლების კობოზე.
წლისთვის დადასტურდა, რომ კარაბინი შეიძლება გამოყენებულ იქნას სხვადასხვა ფორმით და შურისძიების პოლიაცეტილენის, ისევე როგორც პოლიკუმულენის ლანცეტების, ზოგიერთ ნახშირბადის ატომში და დაკიდება ჩამოკიდებული რგოლებით:
C=C=C=C=C=C=
ბუნებაში ცოდნის უკანასკნელი კარაბინი მეტეორიტის პირშია.
კარაბინი შეიძლება გამოყენებულ იქნას როგორც დენის გამტარი; კარაბინის ფიზიკური სიმძლავრის კრისტალურ ხსნარში ნახშირბადის ატომებით შუბების დაყენების სხვადასხვა ტიპის შეერთებების და სხვადასხვა მეთოდების გამო, ისინი შეიძლება შეიცვალოს ფართო დიაპაზონში. წვდომის გარეშე გაცხელებისას 2000 C-ზე მეტია, კარაბინი სტაბილურია, 2300 C-მდე ტემპერატურაზე შესაძლებელია გრაფიტზე გადატანა.
ბუნებრივი ნახშირი შედგება ორი იზოტოპისგან
(98,892%) და (1,108%). გარდა ამისა, ატმოსფეროში გამოვლინდა რადიოაქტიური იზოტოპის უმნიშვნელო სახლები, რომლებსაც ფლობს ბილიკი.ადრე ისინი პატივს სცემდნენ, რომ სოფელი ვუგილია, ჭვარტლი და კოქსი ახლოს არის სუფთა ნახშირის საწყობთან და იბრძვიან ძალაუფლებისთვის ალმასსა და გრაფიტში, არის ქვანახშირის დამოუკიდებელი ალოტროპული მოდიფიკაცია ("ამორფული ქვანახშირი"). თუმცა, დადგინდა, რომ მეტყველება შედგება ყველაზე კრისტალური ნაწილაკებისგან, რომლებშიც ატომებში ნახშირბადი ისევეა მიბმული, როგორც გრაფიტი.
4. ვუგილა - წვრილად დეტალური გრაფიტი. Utvoryuєєtsya at term_chnomu rozladann_ vugletsev_snyh poluk წვდომის გარეშე poіtrya. ვოგილიას ძალაუფლებისთვის ცილისწამება მოძველებული სახით, ოტრიმანის ამ მეთოდის ოტრიმანის სუნის გამო. წადით და შური იძიეთ იმ პატარა სახლებზე, რომლებსაც ისინი თავიანთ ძალას უნერგავენ. vugіllya-ს ყველაზე მნიშვნელოვანი ჯიშებია კოკა, სოფლის ვუგილია, ჭვარტლი.
კოქსი გამოვა ყოველ საათში ქვის ვგილის გაცხელებიდან ჰაერზე წვდომის გარეშე.
სოფელი ვუგილია სახლდება, როდესაც ხე თბება ჰაერზე წვდომის გარეშე.
ჭვარტლი არის წვრილი გრაფიტის კრისტალური ფხვნილი. Utvoryuetsya როდესაც იწვის ნახშირწყლები (ბუნებრივი აირი, აცეტილენი, ტურპენტინი და ა.შ.) ჰაერის ზომიერი ხელმისაწვდომობით.
უფრო აქტიური ნახშირი - ფოროვანი სამრეწველო ადსორბენტები, რომლებიც წარმოიქმნება უფრო მნიშვნელოვანი ნახშირით. ადსორბციას უწოდებენ თიხას მყარი აირებისა და გამოსვლების ზედაპირზე. აქტიური ვუგილი მყარი პალიტრების უარყოფისთვის (ტორფი, კამიანი ვუგილის ყავისფერი ტონი, ანტრაციტი), იოგო რე-კროსერის პროდუქტის ხე (სოფლის ვუგილა, ტირსი, ქაღალდის ვიბრანტების ვიდხოდივი), viddhodiw shkiyrya, მატერიალური არსების არსება და სტოკ-ის ვარაუდით. Vougillya, რომელიც ავლენს მაღალ მექანიკურ ძალას, ვიბრირებს ქოქოსის და სხვა მთების ნაჭუჭებიდან, ხილის თასებიდან. ნახშირის სტრუქტურა წარმოდგენილია ყველა გაფართოების ფორებით, პროტეადსორბციის უნარი და ადსორბციის თანმიმდევრულობა ნაჩვენებია მიკროფორების ნაცვლად გრანულების ერთ მასაში ან მოცულობაში. აქტიური ნახშირბადის ბოჭკოების წარმოქმნით, გარე მასალა ექვემდებარება თერმულ დამუშავებას განმეორებითი წვდომის გარეშე, რის შედეგადაც ჩანს წყალი და ხშირად ფისი. ამ შემთხვევაში ყალიბდება ვოგილის დიდი ფოროვანი სტრუქტურა. მიკროფოროვანი სტრუქტურის მოსაშორებლად, გააქტიურება შეიძლება განხორციელდეს ან გაზის ან ორთქლის დაჟანგვით, ან ქიმიური რეაგენტების დამუშავებით.
ᲓᲐᲜᲘᲨᲜᲣᲚᲔᲑᲐ
ვუგლეტები- პერიოდული ცხრილის მეექვსე ელემენტი. აღნიშვნა - ლათინური "carboneum"-დან. ფესვები სხვა პერიოდში, IVA ჯგუფი. დაწექით არალითონებზე. ბირთვის დატენვა 6-მდეა.
ქვანახშირი ბუნებაში გვხვდება, როგორც თავისუფალ ბანაკში, ისევე როგორც რიცხვების დათვალიერებისას. Vilniy vuglets zaustrichaetsya ჰგავს ალმასის და გრაფიტის. Crim of vikopny vugillya, დედამიწის მწვერვალებზე არის ნავთობის დიდი შესყიდვები. დედამიწის ქერქში დიდებულ ძვლებს აქვთ ნახშირმჟავას მარილები, განსაკუთრებით კალციუმის კარბონატი. მცენარის ზედა ნაწილში არის ნახშირორჟანგი. ნარეშტი, მზარდი და ქმნილებადი ორგანიზმები წარმოიქმნება ლაპარაკისაგან, რომლის შუქზეც ნახშირი იღებს ბედს. ამგვარად, ეს ელემენტი ერთ-ერთი ყველაზე ფართოა დედამიწაზე, თუმცა სინათლის მთლიანი რაოდენობა დედამიწის ქერქში მხოლოდ დაახლოებით 0,1%-ია (წონა).
ნახშირბადის ატომური და მოლეკულური მასა
მეტყველების აშკარა მოლეკულური წონა (M r) არის რიცხვი, რომელიც გვიჩვენებს, რამდენჯერ მეტია მოცემული მოლეკულის მასა ნახშირბადის ატომის მასის 1/12-ზე და ელემენტის ხილულ ატომურ მასაზე (A r ) არის რამდენჯერმე ქიმიური ელემენტის ატომების საშუალო მასა მეტია ნახშირბადის ატომის 1/12 მასაზე
თავისუფალ წისქვილში ნატეხები არის ნახშირი მონოატომური მოლეკულების გარეგნულად, ატომური და მოლეკულური წონის მნიშვნელობები განსხვავდება. სუნი 12.0064-მდეა.
ნახშირბადის ალოტროპია და ალოტროპული მოდიფიკაციები
თავისუფალ წისქვილში ნახშირი ჰგავს ალმასს, რომელიც კრისტალიზდება კუბურ და ექვსკუთხა (ლონსდალეიტი) სისტემებში და გრაფიტი, რომელიც დევს ექვსკუთხა სისტემამდე (ნახ. 1). ასე რომ, შექმენით ქვანახშირი, ისევე როგორც ვუგილიას სოფელი, კოკა და ჭვარტლი თიშავს უწესრიგო სტრუქტურას. ასევე, ალოტროპული მოდიფიკაციები, აღმოფხვრილი სინთეზური გზით - ce კარაბინი და პოლიკუმულენი - განსხვავდება ნახშირბადით, შთაგონებული -C=C ან C=C= ტიპის ხაზოვანი შუბის პოლიმერებით.
მალ. 1. ქვანახშირის ალოტროპული მოდიფიკაციები.
ასევე არსებობს ნახშირის ალოტროპული მოდიფიკაციები, რომლებსაც შეიძლება ვუწოდოთ: გრაფენი, ფულერენი, ნანომილები, ნანობოჭკოები, ასტრალენი, ნახშირი, კოლოსალური ნანომილები; ამორფული ნახშირი, ნახშირის ნანოკვირტები და ნახშირის ნანოქაფი.
ნახშირბადის იზოტოპები
ბუნებაში ნახშირბადი იმყოფება ორ სტაბილურ იზოტოპში 12 C (98,98%) და 13 C (1,07%). ბოლო მასობრივი რიცხვები არის 12 და 13 სულ. ნახშირბადის 12 C იზოტოპისთვის ატომის ბირთვი უდრის ექვს პროტონს და ექვს ნეიტრონს, ხოლო 13 C იზოტოპისთვის - პროტონების და ხუთი ნეიტრონის იგივე რაოდენობა.
ჩვენ ვიყენებთ ნახშირბადის 14 C-ის ერთ ცალ (რადიოაქტიურ) იზოტოპს მსგავსი დაშლის პერიოდით, რომელიც უდრის 5730 წელს.
იონი ნახშირში
ატომის იმავე ენერგეტიკულ დონეზე, ვაკარბონიზაციას ვახორციელებ є chotiri ელექტრონები, yakі є valent:
1s 2 2s 2 2p 2 .
ქიმიური ურთიერთქმედების ომის საშუალებით ნახშირს შეუძლია დახარჯოს თავისი ვალენტური ელექტრონები. იყავი დონორი და გარდაიქმნება დადებითად დამუხტულ იონად, რათა მიიღოს ელექტრონი სხვა ატომიდან, ტობტოდან. იყოს მიმღები და გარდაიქმნება უარყოფითად დამუხტულ იონად:
0 -2e → 2+ ;
0 -4e → 4+ ;
0 +4e → 4- .
მოლეკულა და ატომი
თავისუფალ ბანაკში ნახშირბადი იმყოფება C მონოატომური მოლეკულების დანახვაზე. მოდით გავაცნოთ მოქმედებების ძალა, რომელიც ახასიათებს ატომს და ნახშირბადის მოლეკულას:
შეაერთეთ ნახშირი
ქვანახშირის ყველაზე გავრცელებული შენადნობი მთელ მსოფლიოში არის ფოლადი და ჩავუნი. ფოლადი-ცე ლითონის ჩამოსხმა ნახშირით, ნახშირის ნაცვლად, 2%-ზე მეტია. ჩავუნში (ასევე მარილის შენადნობი ნახშირით) ნახშირის ნაცვლად მეტი - 2-დან 4%-მდე.
გამოიყენეთ ამოცანების გადაწყვეტა
კონდახი 1
| მენეჯერი | ნახშირბადის ეს ობსიაგის ოქსიდი (IV) ჩანს (n.o.) 500 გრ ვაპნიაკის მოხარშვისას, რომელსაც შეუძლია დაფაროს სახლების 0,1 მასობრივი ნაწილი. |
| გამოსავალი | მოდით ჩამოვწეროთ ვიპალ ვაპნიაკის თანაბარი რეაქცია: CaCO 3 \u003d CaO + CO 2 -. ჩვენ ვიცით სუფთა ვაპნიაკის მასა. პირველი ნახევრისთვის მნიშვნელოვანია სახლების გარეშე მასის პირველი ნახევრისთვის: w გამჭვირვალე (CaCO 3) = 1 - w მინარევები = 1 - 0.1 = 0.9. m clear(CaCO 3) = m(CaCO 3) xw clear(CaCO 3); მ სუფთა (CaCO 3) \u003d 500 × 0.9 \u003d 450 გ. Razrahuyemo ბევრი სიტყვა vapnyak: n (CaCO 3) \u003d m გამჭვირვალე (CaCO 3) / M (CaCO 3); n (CaCO 3) \u003d 450/100 \u003d 4,5 მოლი. Vіdpovіdno თანაბარ რეაქციამდე n(CaCO 3) :n(CO 2) = 1:1, ასევე n (CaCO 3) \u003d n (CO 2) \u003d 4,5 მოლი. ტოდი, ნახშირბადის ობსიაგის ოქსიდი (IV), რომელიც ნახეთ, უფრო ძვირი იქნება: V(CO 2) \u003d n(CO 2) × V მ; V (CO 2) \u003d 4.5 × 22.4 \u003d 100.8 ლიტრი. |
| ვიდპოვიდი | 100,8 ლ |
კონდახი 2
| მენეჯერი | რამდენის შეცვლა გჭირდებათ, 11,2 გრ კალციუმის კარბონატის გასანეიტრალებლად რა შეგიძლიათ გააკეთოთ 0,05 მასის ჩასმა, ან 5% ქლორიანი წყალი? |
| გამოსავალი | ჩვენ ვწერთ კალციუმის კარბონატის ნეიტრალიზაციის თანაბარ რეაქციას ქლორიანი წყლით: CaCO 3 + 2HCl \u003d CaCl 2 + H 2 O + CO 2 -. ჩვენ ვიცით მეტყველების რაოდენობა კალციუმის კარბონატთან: M(CaCO 3) = Ar (Ca) + Ar (C) + 3×A r (O); M(CaCO 3) \u003d 40 + 12 + 3 × 16 \u003d 52 + 48 \u003d 100 გ / მოლ. n (CaCO 3) \u003d m (CaCO 3) / M (CaCO 3); n (CaCO 3) \u003d 11.2 / 100 \u003d 0.112 მოლი. ძალაშია თანაბარ რეაქციაზე n (CaCO 3) : n (HCl) = 1: 2, ასევე n(HCl) \u003d 2 × n (CaCO 3) \u003d 2 × 0.224 მოლი. საგულისხმოა, რომ მეტყველების მასა არის ქლორიანი წყალი, რომელიც შურისძიებაა როზჩინში: M(HCl) \u003d Ar (H) + Ar (Cl) \u003d 1 + 35.5 \u003d 36.5 გ / მოლ. m (HCl) \u003d n (HCl) × M (HCl) \u003d 0,224 × 36,5 \u003d 8,176 გვ. როზრაჰუემო მასუ როზჩინი ქლორის წყალი: მ ხსნარი (HCl) = m(HCl) × 100 / w (HCl); მ ხსნარი (HCl) = 8,176 × 100/5 = 163,52 გვ. |
| ვიდპოვიდი | 163,52 გ |