3. Будова кістки
4. Остеогістогенез
1. До скелетних сполучних тканин відносяться хрящові та кістковітканини, що виконують опорну, захисну та механічну функції, а також беруть участь в обміні мінеральних речовин в організмі.
Хрящова тканинаскладається з клітин - хондроцитів, хондробластів та щільної міжклітинної речовини, що складається з аморфного та волокнистого компонентів. Хондробластирозташовуються поодиноко по периферії хрящової тканини. Є витягнутими сплощеними клітинами з базофільною цитоплазмою, що містить добре розвинену зернисту ендоплазматичну мережу і апарат Гольджі. Ці клітини синтезують компоненти міжклітинної речовини, виділяють їх у міжклітинне середовище та поступово диференціюються в дефінітивні клітини хрящової тканини. хондроцити.Хондробласти мають здатність мітотичного поділу. У надхрящниці, що оточує хрящову тканину, містяться неактивні, малодиференційовані форми хондробластів, які за певних умов диференціюються в хондробласти, що синтезують міжклітинну речовину, а потім і в хондроцити.
Хондроцити за ступенем зрілості, по морфології та функції поділяються на клітини I, II та III типу. Всі різновиди хондроцитів локалізуються в глибших шарах хрящової тканини в особливих порожнинах. лакунах. Молоді хондроцити (I типу) мітотично діляться, проте дочірні клітини опиняються в одній лакуні та утворюють групу клітин – ізогенну групу. Ізогенна група є загальною структурно-функціональною одиницею хрящової тканини. Розташування хондроцитів в ізогенних групах різних хрящових тканинах неоднаково.
Міжклітинна речовинахрящової тканини складається з волокнистого компонента (колагенових або еластичних волокон) і аморфної речовини, в якій містяться головним чином сульфатовані глікозаміноглікани (передусім хондроїтинсерні кислоти), а також протеогликани. Глікозаміноглікани пов'язують велику кількість води і зумовлюють щільність міжклітинної речовини. Крім того, аморфна речовина містить значну кількість мінеральних речовин, що не утворюють кристали. Судини у хрящовій тканині в нормі відсутні.
Залежно від будови міжклітинної речовини хрящові тканини поділяються на гіалінову, еластичну та волокнисту хрящову тканину.
Гіалінова хрящова тканинахарактеризується наявністю в міжклітинній речовині лише колагенових волокон. При цьому коефіцієнт заломлення волокон та аморфної речовини однаковий і тому на гістологічних препаратах волокна у міжклітинній речовині не видно. Цим пояснюється певна прозорість хрящів, що складаються з гіалінової хрящової тканини. Хондроцити в ізогенних групах гіалінової хрящової тканини розташовуються як розеток. За фізичними властивостями гіалінова хрящова тканина характеризується прозорістю, щільністю та малою еластичністю. В організмі людини гіалінова хрящова тканина широко поширена і входить до складу великих хрящів. (Щитоподібний і перснеподібний),трахеї та великих бронхів, що складає хрящові частини ребер, покриває суглобові поверхні кісток. Крім того, майже всі кістки організму в процесі розвитку проходять через стадію гіалінового хряща.
Еластична хрящова тканинахарактеризується наявністю у міжклітинній речовині як колагенових, так і еластичних волокон. При цьому коефіцієнт заломлення еластичних волокон відрізняється від заломлення аморфної речовини, тому еластичні волокна добре видно в гістологічних препаратах. Хондроцити в ізогенних групах еластичної тканини розташовуються у вигляді стовпчиків або колонок. За фізичними властивостями еластична хрящова тканина непрозора, еластична, менш щільна та менш прозора, ніж гіалінова хрящова тканина. Вона входить до складу еластичних хрящів: вушної раковини та хрящової частини зовнішнього слухового проходу, хрящів зовнішнього носа, дрібних хрящових гортань та середніх бронхів, а також становить основу надгортанника.
Волокниста хрящова тканинахарактеризується вмістом у міжклітинній речовині потужних пучків із паралельно розташованих колагенових волокон. При цьому хондроцити розташовуються між пучками волокон у вигляді ланцюжків. За фізичними властивостями характеризується високою міцністю. В організмі зустрічається лише в обмежених місцях: складає частину міжхребцевих дисків (фіброзне кільце),а також локалізується в місцях прикріплення зв'язок та сухожилля до гіалінових хрящів. У цих випадках чітко простежується поступовий перехід фіброцитів сполучної тканини до хондроцитів хрящової тканини.
Розрізняють такі два поняття, які не можна плутати – хрящова тканина та хрящ. Хрящова тканина- це різновид сполучної тканини, будова якої викладено вище. Хрящ- це анатомічний орган, який складається з хрящової тканини та надхрящниці. Надхрящниця покриває хрящову тканину зовні (за винятком хрящової тканини суглобових поверхонь) та складається з волокнистої сполучної тканини.
У надхрящниці виділяють два шари:
зовнішній – фіброзний;
внутрішній - клітинний або камбіальний (ростковий).
У внутрішньому шарі локалізуються малодиференційовані клітини. прехондробластиі неактивні хондробласти, які в процесі ембріонального та регенераційного гістогенезу перетворюються спочатку на хондробласти, а потім на хондроцити. У фіброзному шарі знаходиться мережа кровоносних судин. Отже, надхрящниця, як складова хряща, виконує такі функції: забезпечує трофікою безсудинну хрящову тканину; захищає хрящову тканину; забезпечує регенерацію хрящової тканини за її пошкодження.
Трофіка гіалінової хрящової тканини суглобових поверхонь забезпечується синовіальною рідиною суглобів, а також судин кісткової тканини.
Розвиток хрящової тканиниі хрящів(Хондрогістогенез) здійснюється з мезенхіми. Спочатку мезенхімні клітини в місцях закладки хрящової тканини посилено проліферують, округляються і утворюють осередкові скупчення клітин. хондрогенні острівці. Потім ці округлені клітини диференціюються в хондробласти, синтезують та виділяють у міжклітинне середовище фібрилярні білки. Потім хондробласти диференціюються в хондроцити I типу, які синтезують і виділяють не тільки білки, а й глікозаміноглікани та протеоглікани, тобто формують міжклітинну речовину. p align="justify"> Наступною стадією розвитку хрящової тканини є стадія диференціювання хондроцитів, при цьому з'являються хондроцити II, III типу і формуються лакуни. З мезенхіми, що оточує хрящові острівці, формується надхрящниця. У процесі розвитку хряща відзначається два види росту хряща: інтерстиціальне зростання - за рахунок розмноження хондроцитів та виділення ними міжклітинної речовини; опозиційне зростання – за рахунок діяльності хондробластів надхрящниці та накладання хрящової тканини по периферії хряща.
Вікові зміни переважно відзначаються в гіаліновій хрящовій тканині. У літньому та старечому віці у глибоких шарах гіалінового хряща відзначається відкладення солей кальцію (омелення хряща),проростання в цю область судин, а потім заміщення обвапненої хрящової тканини кістковою тканиною. осифікація. Еластична хрящова тканина не піддається звапнінню та окостеніння, проте еластичність хрящів у літньому віці також знижується.
2. Кісткова тканинає різновидом сполучної тканини та складається з клітин та міжклітинної речовини, в якій міститься велика кількість мінеральних солей, головним чином фосфат кальцію. Мінеральні речовини становлять 70% кісткової тканини, органічні - 30%.
Функції кісткових тканин:
механічна;
захисна;
участь у мінеральному обміні організму – депо кальцію та фосфору.
Клітини кісткової тканини: остеобласти, остеоцити, остеокласти. Основними клітинами у сформованій кістковій тканині є остеоцити. Це клітини відростчастої форми з великим ядром та слабовираженою цитоплазмою (клітини ядерного типу). Тіла клітин локалізуються у кісткових порожнинах – лакунах, а відростки – у кісткових канальцях. Численні кісткові канальці, анастомозируя між собою, пронизують всю кісткову тканину, сполучаючись з периваскулярними просторами, і утворюють дренажну системукісткової тканини. У цій дренажній системі міститься тканинна рідина, за допомогою якої забезпечується обмін речовин не тільки між клітинами та тканинною рідиною, а й міжклітинною речовиною. Для ультраструктурної організації остеоцитів характерна наявність у цитоплазмі слабовираженої зернистої ендоплазматичної мережі, невеликого числа мітохондрій та лізосоми, центріолі відсутні. У ядрі переважає гетерохроматин. Всі ці дані свідчать про те, що остеоцити мають незначну функціональну активність, яка полягає в підтримці обміну речовин між клітинами і міжклітинною речовиною. Остеоцити є дефінітивними формами клітин та не діляться. Утворюються вони з остеобластів.
Остеобластимістяться тільки в кістковій тканині, що розвивається. У сформованій кістковій тканині вони відсутні, але містяться зазвичай в неактивній формі в окістя. У кістковій тканині, що розвивається, вони охоплюють по периферії кожну кісткову пластинку, щільно прилягаючи один до одного, утворюючи подобу епітеліального пласта. Форма таких клітин, що активно функціонують, може бути кубічною, призматичною, незграбною. У цитоплазмі остеобластів міститься добре розвинена зерниста ендоплазматична мережата пластинчастий комплекс Гольджі, багато мітохондрій. Така ультраструктурна організація свідчить про те, що ці клітини є синтезуючими та секретуючими. Дійсно, остеобласти синтезують білок колаген та глікозоаміноглікани, які потім виділяють у міжклітинний простір. За рахунок цих компонентів формується органічний матрикс кісткової тканини. Потім ці клітини забезпечують мінералізацію міжклітинної речовини за допомогою виділення солей кальцію. Поступово, виділяючи міжклітинну речовину, вони ніби замуровуються і перетворюються на остеоцити. При цьому внутрішньоклітинні органели значною мірою редукуються, синтетична та секреторна активність знижується та зберігається функціональна активність, властива остеоцитам. Остеобласти, що локалізуються в камбіальному шарі окістя, знаходяться в неактивному стані, синтетичні та транспортні органели слабо розвинені. При подразненні цих клітин (у разі травм, переломів кісток і так далі) у цитоплазмі швидко розвивається зерниста ендоплазматична мережа та пластинчастий комплекс, відбувається активний синтез та виділення колагену та глікозоаміногліканів, формування органічного матриксу (кісткова мозоль)а потім і формування дефінітивної кісткової тканини. Таким способом за рахунок діяльності остеобластів окістя відбувається регенерація кісток при їх пошкодженні.
Отеокласти- костеруйнуючі клітини, у сформованій кістковій тканині відсутні. Але містяться в окісті і в місцях руйнування та перебудови кісткової тканини. Оскільки в онтогенезі безперервно здійснюються локальні процеси перебудови кісткової тканини, то у цих місцях обов'язково присутні й остеокласти. У процесі ембріонального остеогістогенезу ці клітини грають важливу рольта визначаються у великій кількості. Остеокласти мають характерну морфологію: по-перше, ці клітини є багатоядерними (3-5 і більше ядер), по-друге, це досить великі клітини (діаметром близько 90 мкм), по-третє, вони мають характерну форму - клітина має овальну форму але частина її, прилегла до кісткової тканини, є плоскою. При цьому в плоскій частині виділяють дві зони:
центральна частина - гофрована містить численні складки та острівці;
периферична (прозора) частина тісно стикається з кістковою тканиною.
У цитоплазмі клітини, під ядрами, розташовуються численні лізосоми та вакуолі різної величини. Функціональна активність остеокласту проявляється так: у центральній (гофрованій) зоні основи клітини з цитоплазми виділяються вугільна кислота та протеолітичні ферменти. Вугільна кислота, що виділяється, викликає демінералізацію кісткової тканини, а протеолітичні ферменти руйнують органічний матрикс міжклітинної речовини. Фрагменти колагенових волокон фагоцитуються остеокластами та руйнуються внутрішньоклітинно. За допомогою цих механізмів відбувається резорбція(Руйнування) кісткової тканини і тому остеокласти зазвичай локалізуються в поглибленнях кісткової тканини. Після руйнування кісткової тканини за рахунок діяльності остеобластів, що виселяються із сполучної тканини судин, відбувається побудова нової кісткової тканини.
Міжклітинна речовинакісткової тканини складається з основної речовини та волокон, в яких містяться солі кальцію. Волокна складаються з колагену I типу і складаються в пучки, які можуть розташовуватись паралельно (упорядковано) або неупорядковано, на підставі чого й будується гістологічна класифікація кісткових тканин. Основна речовина кісткової тканини, як і інших різновидів сполучних тканин, складається з глікозаміногліканів і протеогліканів, проте хімічний склад цих речовин відрізняється. Зокрема в кістковій тканині міститься менше хондроїтинсерних кислот, але більше лимонної та інших кислот, які утворюють комплекси із солями кальцію. У процесі розвитку кісткової тканини спочатку утворюється органічна матриксосновна речовина і колагенові (осеїнові, колаген II типу) волокна, а потім уже в них відкладаються солі кальцію (головним чином фосфорнокислі). Солі кальцію утворюють кристали гідроксиаппатиту, що відкладаються як в аморфній речовині, так і в волокнах, але невелика частина солей відкладається аморфно. Забезпечуючи міцність кісток, фосфорнокислі солі кальцію одночасно є депо кальцію та фосфору в організмі. Тому кісткова тканина бере участь у мінеральному обміні.
Класифікація кісткових тканин
Розрізняють два різновиди кісткових тканин:
ретикулофіброзну (грубоволокнисту);
пластинчасту (паралельно волокнисту).
У ретикулофіброзний кісткової тканинипучки колагенових волокон товсті, звивисті та розташовуються невпорядковано. У мінералізованій міжклітинній речовині в лакунах безладно розташовуються остеоцити. Пластинчаста кісткова тканинаскладається з кісткових пластинок, у яких колагенові волокна чи його пучки розташовуються паралельно кожної пластинці, але під прямим кутом до ходу волокон у сусідніх пластинках. Між пластинками у лакунах розташовуються остеоцити, тоді як їх відростки проходять у канальцях через пластинки.
В організмі людини кісткова тканина представлена майже виключно пластинчастою формою. Ретикулофіброзна кісткова тканина зустрічається лише як етап розвитку деяких кісток (тем'яних, лобових). У дорослих людей вони знаходяться в області прикріплення сухожиль до кісток, а також на місці окостенілих швів черепа (стрілоподібний шов луски лобової кістки).
При вивченні кісткової тканини слід диференціювати поняття кісткова тканина та кістка.
3. Кістка- це анатомічний орган, основним структурним компонентом якого є кісткова тканина. Кістка як орган складається з наступних елементів:
кісткова тканина;
окістя;
кістковий мозок (червоний, жовтий);
судини та нерви.
Окістя (періост)оточує по периферії кісткову тканину (за винятком суглобових поверхонь) і має будову подібну до надхрящниці. У окісті виділяють зовнішній фіброзний і внутрішній клітинний або камбіальний шари. У внутрішньому шарі містяться остеобласти та остеокласти. У окісті локалізуються виражена судинна мережа, з якої дрібні судини через канали, що прободають, проникають в кісткову тканину. Червоний кістковий мозок розглядається як самостійний орган і відноситься до органів кровотворення та імуногенезу.
Кісткова тканинау сформованих кістках представлена тільки пластинчастою формою, однак у різних кістках, у різній ділянці однієї кістки вона має різну будову. У плоских кістках та епіфізах трубчастих кісток кісткові пластинки утворюють поперечини. (трабекули), що складають губчасту речовину кістки. У діафізах трубчастих кісток пластинки прилягають одна до одної та утворюють компактну речовину. Однак і в компактній речовині одні пластинки утворюють остеони, інші є загальними.
Будова діафіза трубчастої кістки
На поперечному зрізі діафіза трубчастої кістки розрізняють наступні шари:
окістя (періост);
зовнішній шар загальних чи генеральних пластин;
шар остеонів;
внутрішній шар загальних чи генеральних пластин;
внутрішня фіброзна пластинка ендост.
Зовнішні загальні платівкирозташовуються під окістям у кілька шарів, не утворюючи однак повні кільця. Між платівками розташовуються в лакунах остеоцити. Через зовнішні пластинки проходять канали, що прободають, через які з окістя в кісткову тканину проникають прободаючі волокна і судини. За допомогою прободаючих судин у кістковій тканині забезпечується трофіка, а волокна, що прободають, пов'язують окістя з кістковою тканиною.
Шар остеонівскладається з двох компонентів: остеонів та вставкових пластин між ними. Остеон- є структурною одиницею компактної речовини трубчастої кістки. Кожен остеон складається з:
5-20 концентрично нашарованих пластин;
каналу остеону, у якому проходять судини (артеріоли, капіляри, венули).
між каналами сусідніх остеонівє анастомози. Остеони складають основну масу кісткової тканини діафіза трубчастої кістки. Вони розташовуються подовжньо трубчастою кісткою відповідно силовим і гравітаційним лініям і забезпечують виконання опорної функції. При зміні напряму силових ліній в результаті перелому або викривлення кісток остеони, що не несуть навантаження, руйнуються остеокластами. Однак такі остеони руйнуються не повністю, а частина кісткових пластин остеону по його довжині зберігається і такі частини остеонів, що залишилися, називаються вставними платівками. Протягом постнатального онтогенезу постійно відбувається перебудова кісткової тканини - одні остеони руйнуються (резорбуються), інші утворюються і тому між остеонами завжди знаходяться вставні пластини, як залишки попередніх остеонів.
Внутрішній шар загальних платівокмає будову аналогічну зовнішньому, але він менш виражений, а в області переходу діафіза в епіфізи загальні платівки продовжуються трабекули.
Ендост - тонка сполучно-тканинна платівка, що вистилає порожнину каналу діафіза Шари в ендості чітко не виражені, але серед клітинних елементів містяться остеобласти та остеокласти.
Хрящова тканина є особливим видом сполучної тканини та у сформованому організмі виконує опорну функцію. У щелепно-лицьовій ділянці хрящ входить до складу вушної раковини, слухової труби, носа, суглобового диска скронево-нижньощелепного суглоба, а також забезпечує зв'язок між дрібними кістками черепа.
Залежно від складу, метаболічної активності та здатності до регенерації розрізняють три типи хрящової тканини – гіаліновий, еластичний та волокнистий.
Гіаліновий хрящ формується першим на ембріональній стадії розвитку, і в певних умовах з нього утворюються решта двох видів хряща. Ця хрящова тканина визначається у складі реберних хрящів, хрящового кістяка носа і утворює хрящі, що покривають поверхні суглобів. Він має більш високу метаболічну активність порівняно з еластичним і волокнистим типами і містить велику кількість вуглеводів і ліпідів. Це дозволяє здійснювати активний синтез білків та диференціювання хондрогенних клітин для оновлення та регенерації гіалінового хряща. З віком у гіаліновому хрящі відбувається гіпертрофія та апоптоз клітин з подальшим звапнінням позаклітинного матриксу.
Еластичний хрящ має подібну будову з гіаліновим хрящем. З такої хрящової тканини сформовані, наприклад, вушні раковини, слухова труба та деякі хрящі гортані. Для цього типу хряща характерна присутність у хрящовому матриксі мережі еластичних волокон, міститься мала кількість ліпідів, вуглеводів та хондроїтинсульфатів. З огляду на низьку метаболічну активність еластичний хрящ не обвапнюється і практично не регенерується.
Волокнистий хрящ за своєю структурою займає проміжне положення між сухожиллям та гіаліновим хрящем. Характерною особливістюволокнистого хряща є наявність у міжклітинному матриксі великої кількості колагенових волокон, переважно І типу, які розташовуються паралельно одна одній, а клітини у вигляді ланцюжка між ними. Волокнистий хрящ завдяки своїй особливій будові може зазнавати значних механічних навантажень як при стисканні, так і розтягуванні.
Хрящовий компонент скронево-нижньощелепного суглоба представлений у вигляді диска волокнистого хряща, який розташовується на поверхні суглобового відростка нижньої щелепи та відокремлює його від суглобової ямки скроневої кістки. Так як волокнистий хрящ не має надхрящниці, живлення клітин хряща здійснюється через синовіальну рідину. Склад синовіальної рідини залежить від транссудації метаболітів із кровоносних судин синовіальної оболонки до суглобової порожнини. Синовіальна рідина містить низькомолекулярні компоненти - іони Na+, K+, сечову кислоту, сечовину, глюкозу, які близькі у кількісному співвідношенні до плазми крові. Однак вміст білків у синовіальній рідині в 4 рази вищий, ніж у плазмі крові. Крім глікопротеїнів, імуноглобулінів синовіальна рідина багата на глікозаміноглікани, серед яких перше місце займає гіалуронова кислота, присутня у вигляді натрієвої солі.
2.1. СТРУКТУРА І ВЛАСТИВОСТІ ХРАЩОВОЇ ТКАНИНИ
Хрящова тканина, подібно до будь-якої іншої тканини, містить клітини (хондробласти, хондроцити), які занурені у великий міжклітинний матрикс. У процесі морфогенезу хондрогенні клітини диференціюються в хондробласти. Хондробласти починають синтезувати і секретувати в хрящовий матрикс протеоглікани, які стимулюють диференціювання хондроцитів.
Міжклітинний матрикс хрящової тканини забезпечує її складну мікроархітектоніку та складається з колагенів, протеогліканів, а також неколагенових білків – в основному глікопротеїнів. Колагенові волокна переплетені в тривимірну мережу, яка пов'язує інші компоненти матриксу.
У цитоплазмі хондробластів міститься велика кількість глікогену та ліпідів. Розпад цих макромолекул у реакціях окисного фосфорилювання супроводжується утворенням молекул АТФ, необхідних для синтезу білків. Синтезовані в гранулярній ендоплазматичній мережі та комплексі Гольджі протеогликани та глікопротеїни упаковуються у везикули та виділяються у міжклітинний матрикс.
Гнучкість хрящового матриксу визначається кількістю води. Для протеогліканів характерний високий рівень зв'язування води, чим і зумовлені їх розміри. Хрящовий матрикс містить до 75%
води, що пов'язана з протеогліканами. Високий ступінь гідратації обумовлює великі розміри міжклітинного матриксу та дозволяє здійснювати живлення клітин. Висушений агрекан після зв'язування води може збільшитися в об'ємі в 50 разів, однак через обумовлені колагеновою мережею обмеження набухання хряща не перевищує 20 % від максимально можливого значення.
При стисканні хряща вода разом з іонами витісняється з областей навколо сульфатованих та карбоксильних груп протеоглікана, групи зближуються, і сили відштовхування між їх негативними зарядами перешкоджають подальшому стиску тканини. Після зняття навантаження відбувається електростатичне тяжіння катіонів (Na + , К + , Са 2+) з наступним припливом води до міжклітинного матрикса (рис. 2.1).
Рис. 2.1.Зв'язування води протеогліканами у матриксі хряща. Витіснення води при його стисканні та відновлення структури після зняття навантаження.
Колагенові білки хрящової тканини
Міцність хрящової тканини визначають колагенові білки, які представлені колагенами II, VI, IX, XII, XIV типів та занурені в макромолекулярні агрегати протеогліканів. Перед колагенів II типу припадає близько 80-90% всіх колагенових білків хряща. Інші 15-20% колагенових білків - так звані мінорні колагени IX, XII, XIV типів, які зшивають фібрили колагену II типу та ковалентно пов'язують глікозаміноглікани. Особливістю матриксу гіалінового та еластичного хрящів є присутність колагену VI типу.
Колаген IX типу, виявлений у гіаліновому хрящі, не тільки забезпечує взаємодію колагену II типу з протеогліканами, а й регулює діаметр фібрил колагену II типу. З колагеном IX типу за своєю структурою подібний колаген X типу. Цей тип колагену синтезується лише гіпертрофованими хондроцитами ростової платівки та накопичується навколо клітин. Ця унікальна властивість колагену X типу передбачає участь цього колагену в процесах кісткоутворення.
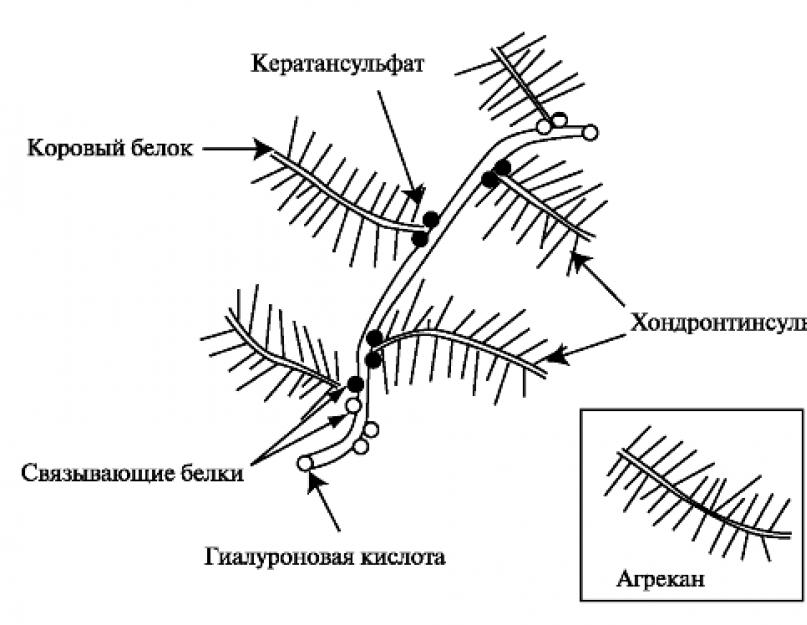
Протеоглікани. Загалом вміст протеогліканів у хрящовому матриксі досягає 3%-10%. Основним протеогліканом хрящової тканини є агрекан, який збирається в агрегати з гіалуроновою кислотою. За формою молекула агрекана нагадує пляшковий йоржик і представлена одним поліпептидним ланцюгом (коровий білок) з приєднаними до нього до 100 ланцюгів хондроїтинсульфату та близько 30 ланцюгів кератансульфату (рис. 2.2).

Рис. 2.2.Протеоглікановий агрегат хрящового матриксу. Протеоглікановий агрегат складається з однієї молекули гіалуронової кислоти та близько 100 молекул агрекану.
Таблиця 2.1
Неколагенові білки хрящової тканини
Назва | Властивості та функції |
Хондрокальцин | Кальцій-зв'язуючий білок, що є C-пропептидом колагену II типу. Білок містить 3 залишки 7-карбоксиглутамінової кислоти. Синтезується гіпертрофічними хондробластами та забезпечує мінералізацію хрящового матриксу |
Gla-білок | На відміну від кісткової тканини в хрящі є високомолекулярний Gla-білок, який містить 84 амінокислотні залишки (у кістки - 79 амінокислотних залишків) та 5 залишків 7-карбоксиглутамінової кислоти. Є інгібітором мінералізації хрящової тканини. При порушенні його синтезу під впливом варфарину утворюються вогнища мінералізації з наступним звапнінням хрящового матриксу |
Хондроадерін | Глікопротеїн з мол. масою 36 кДа, багатий на лейцин. Короткі олігосахаридні ланцюги, що складаються з сіалових кислот та гексозамінів, приєднуються до залишків серину. Хондроадерин пов'язує колагени II типу та протеоглікани з хондроцитами та контролює структурну організацію позаклітинного матриксу хрящової тканини. |
Білок хряща (CILP) | Глікопротеїн з мол. масою 92 кДа, що містить олігосахаридний ланцюг, пов'язаний з білком N-глікозидним зв'язком. Білок синтезується хондроцитами, бере участь у розщепленні протеогліканових агрегатів та необхідний для підтримки сталості структури хрящової тканини. |
Матрілін-1 | Адгезивний глікопротеїн з мол. масою 148 кДа, що складається з трьох поліпептидних ланцюгів, пов'язаних дисульфідними зв'язками. Існує кілька ізоформ цього білка - матрилін -1,-2,-3,-4. У здоровій зрілій хрящовій тканині матрилін не виявляється. Він синтезується в процесі морфогенезу хрящової тканини та гіпертрофічними хондроцитами. Його активність проявляється при ревматичному артриті. При розвитку патологічного процесу пов'язує фібрилярні волокна колагену II типу з протеоглікановими агрегатами і таким чином сприяє відновленню структури хрящової тканини |
У структурі корового білка агрекану виділяють N-кінцевий домен, який забезпечує зв'язування агрекану з гіалуроновою кислотою і низькомолекулярними білками, і С-кінцевий домен, що зв'язує агрекан з іншими молекулами міжклітинного матриксу. Синтез компонентів протеогліканових агрегатів здійснюється хондроцитами, і остаточний процес формування завершується в міжклітинному матриксі.
Поряд з великими протеогліканами в хрящовому матриксі є малі протеоглікани: декорин, біглікан і фібромодулін. Вони становлять лише 1-2% від загальної маси сухої речовини хряща, проте їхня роль дуже велика. Декорин, зв'язуючись у певних ділянках з волокнами колагену II типу, бере участь у процесах фібриллогенезу, а біглікан бере участь у формуванні білкової матриці хряща у процесі ембріогенезу. Зі зростанням ембріона кількість біглікану в хрящовій тканині зменшується і після народження цей протеоглікан зникає зовсім. Регулює діаметр колагену II типу фібромодулін.
Крім колагенів та протеогліканів, у позаклітинному матриксі хряща містяться неорганічні сполуки та невелика кількість неколагенових білків, характерних не тільки для хряща, але й для інших тканин. Вони необхідні для зв'язування протеогліканів з колагеновими волокнами, клітинами, а також окремих компонентів хрящового матриксу в єдину мережу. Це адгезивні білки - фібронектин, ламінін та інтегрини. Більшість специфічних неколагенових білків у хрящовому матриксі присутні тільки в період морфогенезу, звапніння хрящового матриксу або з'являються при патологічних станах (табл. 2.1). Найчастіше це кальційзв'язуючі білки, що містять залишки 7-карбоксиглутамінової кислоти, а також глікопротеїни, багаті на лейцин.
2.2. ФОРМУВАННЯ ХРАЩОВОЇ ТКАНИНИ
На ранній стадії ембріонального розвитку хрящова тканина складається з недиференційованих клітин, що містяться у вигляді аморфної маси. У процесі морфогенезу клітини починають диференціюватися, аморфна маса збільшується і набуває форми майбутнього хряща (рис. 2.3).
У позаклітинному матриксі хрящової тканини, що розвивається, кількісно і якісно змінюється склад протеогліканів, гіалуронової кислоти, фібронектину і колагенових білків. Перехід від
Рис. 2.3.Етапи формування хрящової тканини.
Прехондрогенних мезенхімальних клітин до хондробластів характеризується сульфатуванням глікозаміногліканів, збільшенням кількості гіалуронової кислоти і передує початку синтезу специфічного для хряща великого протеоглікану (агрекан). На початкових

На етапах морфогенезу синтезуються високомолекулярні сполучні білки, які пізніше піддаються обмеженому протеолізу з утворенням низькомолекулярних білків. Молекули агрекану за допомогою низькомолекулярних білків зв'язуються з гіалуронової кислотою і формуються протеогліканові агрегати. В подальшому кількість гіалуронової кислоти знижується, що пов'язано як зі зниженням синтезу гіалуронової кислоти, так і підвищенням активності гіалуронідази. Незважаючи на зниження кількості гіалуронової кислоти, довжина окремих її молекул, необхідних для формування протеогліканових агрегатів при хондрогенезі, зростає. Синтез колагену II типу хондробластами відбувається пізніше синтез протеогліканів. Спочатку прехондрогенні клітини синтезують колагени I і III типу, тому в цитоплазмі зрілих хондроцитів виявляють колаген I типу. Далі в процесі хондрогенезу відбувається зміна компонентів позаклітинного матриксу, що контролюють морфогенез та диференціювання хондрогенних клітин.
Хрящ як попередник кістки
Всі закладки кісткового скелета проходять три стадії: мезенхімну, хрящову та кісткову.
Механізм звапніння хряща є дуже складним процесом і до кінця ще не вивчений. Фізіологічному звапніння схильні точки окостеніння, поздовжні перегородки в нижній гіпертрофічній зоні зачатків хряща, а також прилеглий до кістки шар суглобового хряща. Імовірною причиною такого розвитку подій є присутність на поверхні гіпертрофічних хондроцитів лужної фосфатази. У схильному звапніння матриксі утворюються так звані матриксні бульбашки, що містять фосфатазу. Вважають, що ці бульбашки є, мабуть, первинною областю мінералізації хряща. Навколо хондроцитів зростає локальна концентрація фосфатних іонів, що сприяє мінералізації тканини. Гіпертрофічні хондроцити синтезують і виділяють у матрикс хряща білок - хондрокальцин, що має здатність зв'язувати кальцій. Для схильних до мінералізації областей характерні високі концентрації фосфоліпідів. Їхня присутність стимулює утворення кристалів гідроксиапатиту в цих місцях. У зоні звапніння хряща відбувається часткова деградація протеогліканів. Ті з них, яких деградація не торкнулася, гальмують звапніння.
Порушення індуктивних взаємин, і навіть зміна (затримка чи прискорення) термінів появи і синостезування центрів окостеніння у складі окремих закладок кісток, зумовлюють формування структурних дефектів черепа у зародка людини.
Регенерація хряща
Пересадка хряща в межах одного і того ж виду (так звані алогенні трансплантації) зазвичай не супроводжується виникненням реципієнта симптомів реакції відторгнення. Такого ефекту не вдається досягти щодо інших тканин, оскільки трансплантати цих тканин піддаються атакам та руйнуванню клітинами імунної системи. Утруднений контакт хондроцитів донора з клітинами імунної системи реципієнта, насамперед, обумовлений наявністю у хрящі великої кількості міжклітинної речовини.
Найбільшу регенеративну здатність має гіаліновий хрящ, що пов'язано з високою метаболічною активністю хондроцитів, а також присутністю надхрящниці - щільної волокнистої неоформленої сполучної тканини, що оточує хрящ і містить велику кількість кровоносних судин. У зовнішньому шарі надхрящниці присутній колаген I типу, а внутрішній шар сформований хондрогенними клітинами.
Завдяки таким особливостям пересадка хрящової тканини практикується в пластичній хірургії, наприклад, для реконструкції понівеченого контуру носа. При цьому алогенна пересадка одних хондроцитів, без навколишньої тканини, супроводжується відторгненням трансплантата.
Регуляція метаболізму хрящової тканини
Формування та зростання хрящової тканини регулюється гормонами, факторами росту та цитокінами. Хондробласти є клітинамимішенями для тироксину, тестостерону та соматотропіну, які стимулюють ріст хрящової тканини. Глюкокортикоїди (кортизол) гальмують проліферацію та диференціювання клітин. Певну роль у регуляції функціонального стану хрящової тканини виконують статеві гормони, які пригнічують вивільнення протеолітичних ферментів, що руйнують матрикс хряща. До того ж сам хрящ синтезує інгібітори протеїназ, що пригнічують активність протеїназ.
Цілий ряд факторів зростання - ТФР-(3, фактор росту фібробластів, інсуліноподібний фактор росту-1 стимулюють зростання та розвиток
хрящової тканини. Зв'язуючись з рецепторами мембран хондроцитів, вони активують синтез колагенів і протеогліканів і цим сприяють підтримці сталості хрящового матриксу.
Порушення гормональної регуляціїсупроводжується надлишковим або недостатнім синтезом факторів росту, що призводить до різноманітних дефектів у формуванні клітин та міжклітинного матриксу. Так, ревматоїдний артрит, остеоартрит та інші захворювання пов'язані з підвищеним утворенням скелетогенних клітин, і хрящова тканина починає заміщатися на кісткову. Під впливом тромбоцитарного фактора росту самі хондроцити починають синтезувати ІЛ-1α і ІЛ-1 (3, накопичення яких пригнічує синтез протеогліканів і колагенів II і IX типів. Це сприяє гіпертрофії хондроцитів і в кінцевому підсумку звапніння міжклітинного матриксу. активацією матриксних металопротеїназ, що беруть участь у деградації хрящового матриксу.
Вікові зміни у хрящовій тканині
При старінні в хрящі відбуваються дегенеративні зміни, змінюється якісний та кількісний склад глікозаміногліканів. Так, ланцюги хондроїтинсульфату в молекулі протеоглікану, що синтезуються молодими хондроцитами, майже в 2 рази довші, ніж ланцюги, що виробляються більш зрілими клітинами. Чим довше молекули хондроїтинсульфату у складі протеоглікану, тим більше води структурує протеоглікан. У зв'язку з цим протеоглікан старих хондроцитів пов'язує менше води, тому хрящовий матрикс людей похилого віку стає менш пружним. Зміна мікроархітектоніки міжклітинного матриксу в окремих випадках є причиною розвитку остеоартриту. Також у складі протеогліканів, синтезованих молодими хондроцитами, міститься велика кількість хондроїтин-6-сульфату, а у людей похилого віку, навпаки, в хрящовому матриксі переважають хондроїтин-4-сульфати. Стан хрящового матриксу визначається і довжиною ланцюгів глікозаміногліканів. У молодих людей хондроцити синтезують коротколанцюжковий кератансульфат, а з віком ці ланцюги подовжуються. Також спостерігається зменшення розмірів протеогліканових агрегатів за рахунок скорочення не тільки ланцюгів глікозаміногліканів, а й довжини корового білка в одній молекулі протеоглікана. При старінні у хрящі збільшується вміст гіалуронової кислоти від 0,05 до 6%.
Характерним проявом дегенеративних змін хрящової тканини є її нефізіологічне звапніння. Зазвичай воно зустрічається у людей похилого віку і характеризується первинною дегенерацією суглобового хряща з подальшим ураженням компонентів суглоба, що зчленовуються. Змінюється структура колагенових білків та руйнується система зв'язків між колагеновими волокнами. Ці зміни пов'язані як з хондроцитами, так і компонентами матриксу. Виникаюча гіпертрофія хондроцитів призводить до зростання маси хряща у ділянці хрящових порожнин. Поступово зникає колаген II типу, який заміщається колагеном типу X, що бере участь у процесах костеутворення.
Захворювання, пов'язані з вадами розвитку хрящової тканини
У стоматологічній практиці найчастіше маніпуляції проводять на верхній та нижній щелепах. Існує ряд особливостей їх ембріонального розвитку, пов'язані з різними шляхами еволюції цих структур. У зародка людини на ранніх етапах ембріогенезу у складі верхньої та нижньої щелеп виявляється хрящ.
На 6-7-му тижні внутрішньоутробного розвитку в мезенхімі нижньощелепних відростків починається утворення кісткової тканини. Верхня щелепа розвивається разом з кістками лицьового скелета і піддається окостеніння набагато раніше ніж нижньощелепна кістка. До 3-місячного віку ембріона на передній поверхні кістки вже відсутні місця злиття верхньої щелепи з кістками черепа.
На 10-му тижні ембріогенезу у складі майбутніх гілок нижньої щелепи утворюються вторинні хрящі. Один з них відповідає виростковому відростку, який у середині плідного розвитку заміщається кістковою тканиною за принципом ендохондрального окостеніння. Також вторинний хрящ утворюється вздовж переднього краю вінцевого відростка, який зникає перед народженням. У місці зрощення двох половинок нижньої щелепи є один або два острівці хрящової тканини, які окостеніють на останніх місяцях внутрішньоутробного розвитку. На 12-му тижні ембріогенезу з'являється виростковий хрящ. На 16-му тижні виросток гілки нижньої щелепи вступає в контакт із закладкою скроневої кістки. Необхідно відзначити, що гіпоксія плода, відсутність або слабкий рух зародка сприяє порушенню утворення суглобових щілин або повному злиттю епіфізів закладок кісток, що протилежать. Це призводить до деформації відростків нижньої щелепи та їх зрощення зі скроневою кісткою (анкілоз).
Вони виконують механічну, опорну, захисну функцію. У них пружна щільна міжклітинна речовина. Вміст води до 70-80%, мінеральних речовин до 4-7%, органічні речовини становлять до 10-15%, і в них переважають білки, вуглеводи та вкрай мало ліпідів. У них виділяються клітини та міжклітинна речовина. Клітинний склад всіх різновидів хрящових тканин однаковий і включає хондробласти – малодиференційовані, ущільнені клітини з базофільною цитоплазмою, вони здатні проліферувати та виробляти міжклітинну речовину. Хондробласти диференціюються в молоді хондроцити, набувають овальної форми. Вони зберігають здатність до проліферації та вироблення міжклітинної речовини. Потім малі диференціюються у більші, округлі зрілі хондроцити. Вони втрачають здатність до проліферації та вироблення міжклітинної речовини. Зрілі хондроцити в глибині хряща накопичуються в одній порожнині і називаються ізогенними групами клітин.
Відрізняються хрящові тканини будовою міжклітинної речовини та волокнистими структурами. Розрізняють гіалінову, еластичну та волокнисту хрящові тканини. Вони беруть участь в утворенні хрящів і утворюють гіаліновий, еластичний та волокнистий хрящ.
Гіаліновий хрящ вистилає суглобові поверхні, знаходиться в зоні з'єднання ребер з грудиною та в стінці повітроносних шляхів. Зовні покритий надхрящницею – перихондрій, що містить кровоносні судини. Е периферична частина складається з більш щільної сполучної тканини, а внутрішня частина з пухкої містить фібробласти і хондробласти. Хондробласти виробляють та виділяють міжклітинну речовину та обумовлюють апазіційне зростання хряща. У периферичній частині власне хряща є молоді хондроцити. Вони проліферують, виробляють та виділяють хондромукою (хондроїтинсульфати + протеоглікани), забезпечуючи зростання хряща зсередини.
У середній частині хряща знаходяться зрілі хондроцити та ізогенні групи клітин. Між клітинами розташовується міжклітинна речовина. Воно містить основну речовину та колагенові волокна. Судини відсутні, харчується він дифузно з судин окістя. У молодому хрящі міжклітинна оксифільна речовина, поступово стає базофільною. З віком, починаючи з центральної частини, в нм відкладаються солі кальцію, хрящ звапніє, стає крихким, ламким.
Еластичний хрящ – утворює основу вушної раковини, у стінці повітроносних шляхів. Він аналогічний за будовою гіалінового хряща, але містить не колагенові, а еластичні волокна, і в нормі він ніколи не звапняється.
Волокнистий хрящ - він знаходиться в зоні переходу зв'язок, сухожилля з кістковою тканиною, в ділянці, де кістки покриті гіаліновим хрящем і в зоні міжхребцевих сполук. У ньому грубі пучки колагенових волокон йдуть подовжньо осі натягу, будучи продовженням сухожильних ниток. Волокнистий хрящ у сфері прикріплення до кістки більше нагадує гіаліновий хрящ, а області переходу в сухожилля – на сухожилля.
⇐ Попередня1234
Живлення хрящової тканини йде шляхом дифузії речовин із кровоносних судин надхрящниці. У тканину суглобових хрящів поживні речовини проникають із синовіальної рідини або з судин прилеглої кістки.
Хрящова тканина: функції, особливості будови, види, відновлення
Нервові волокна також локалізуються в надхрящниці, звідки окремі відгалуження безм'якотних нервових волокон можуть проникати всередину хрящової тканини.
Гіаліновий хрящ
Еластичний хрящ
Волокнистий хрящ
Функції кісткових тканин:
1) опорна;
2) механічна;
остеоцити. Це клітини відростчастої форми з великим ядром та слабо вираженою цитоплазмою (клітини ядерного типу). Тіла клітин локалізуються у кісткових порожнинах (лакунах), а відростки – у кісткових канальцях. Численні кісткові канальці, анастомозуючи між собою, пронизують кісткову тканину, повідомляючись периваскулярним простором, утворюють дренажну систему кісткової тканини. У цій дренажній системі міститься тканинна рідина, за допомогою якої забезпечується обмін речовин не тільки між клітинами та тканинною рідиною, а й у міжклітинній речовині.
Остеобласти
Остеокласти
Міжклітинна речовина
Кістка
Класифікація кісткових тканин
⇐ Попередня1234
Схожа інформація:
- Взаємне розташування прямих.
Пошук на сайті:
Хрящова тканина - будова, види, розташування в організмі.
⇐ Попередня1234
Хрящова тканина (textus cartilaginus) утворює суглобові хрящі, міжхребцеві диски, хрящі горла, трахеї, бронхів, зовнішнього носа. Складається хрящова тканина з хрящових клітин (хондробластів та хондроцитів) та щільної, пружної міжклітинної речовини.
Хрящова тканина містить близько 70-80% води, 10-15% органічних речовин, 4-7% солей. Близько 50-70% сухої речовини хрящової тканини це колаген. Міжклітинна речовина (матрикс), що виробляється хрящовими клітинами, складається з комплексних сполук, до яких входять протеоглікани. гіалуронова кислота, молекули глікозаміногліканів. У хрящовій тканині присутні клітини двох типів: хондробласти (від грец. chondros - хрящ) та хондроцити.
Хондробласти - це молоді, здатні до мітотичного поділу округлі або овоїдні клітини. Вони продукують компоненти міжклітинної речовини хряща: протеоглікани, глікопротеїни, колаген, еластин. Цитолемма хондробластів утворює безліч мікроворсинок. Цитоплазма багата РНК, добре розвиненою ендоплазматичною мережею (зернистою та незернистою), комплексом Гольджі, мітохондріями, лізосомами, гранулами глікогену. Ядро хондробласта, багате на активний хроматин, має 1-2 ядерця.
Хондроцити - це великі зрілі клітини хрящової тканини. Вони округлі, овальні чи полігональні, з відростками, розвиненими органелами. Хондроцити розташовуються в порожнинах - лакунах, оточені міжклітинною речовиною. Якщо у лакуні одна клітина, то така лакуна називається первинною. Найчастіше клітини розташовуються у вигляді ізогенних груп (2-3 клітини), що займають порожнину вторинної лакуни. Стінки лакуни складаються з двох шарів: зовнішнього, утвореного колагеновими волокнами, та внутрішнього, що складається з агрегатів протеогліканів, які входять у контакт з глікокаліксом хрящових клітин.
Структурною та функціональною одиницею хрящів є хондрон, утворений клітиною або ізогенною групою клітин, навколоклітинним матриксом та капсулою лакуни.
Живлення хрящової тканини йде шляхом дифузії речовин із кровоносних судин надхрящниці. У тканину суглобових хрящів поживні речовини проникають із синовіальної рідини або з судин прилеглої кістки. Нервові волокна також локалізуються в надхрящниці, звідки окремі відгалуження безм'якотних нервових волокон можуть проникати всередину хрящової тканини.
Відповідно до особливостей будови хрящової тканини розрізняють три види хряща: гіаліновий, волокнистий та еластичний хрящ.
Гіаліновий хрящ, з якого у людини утворені хрящі дихальних шляхів, грудних кінців ребер та суглобових поверхонь кісток. У світловому мікроскопі основна речовина його є гомогенною. Хрящові клітини чи ізогенні групи їх оточені оксифільною капсулою. У диференційованих ділянках хряща розрізняють прилеглу до капсули базофільну зону та розташовану назовні від неї оксифільну зону; разом ці зони утворюють клітинну територію, чи хондриновий шар. Комплекс хондроцитів із хондриновою кулею зазвичай приймають за функціональну одиницю хрящової тканини – хондрон. Основну речовину між хондронами називають інтертериторіальними просторами.
Еластичний хрящ(Синонім: сітчастий, пружний) відрізняється від гіалінової наявністю в основному речовині гілкових мереж еластичних волокон. З нього збудовані хрящ вушної раковини, надгортанника, врисбергові та санторінові хрящі гортані.
Волокнистий хрящ(Синонім сполучнотканинний) розташований у місцях переходу щільної волокнистої сполучної тканини в гіаліновий хрящ і відрізняється від останнього наявністю в основному речовині справжніх колагенових волокон.
7.Кісткові тканина-розташування, будова, функції
Кісткова тканина є різновидом сполучної тканини та складається з клітин та міжклітинної речовини, в якій міститься велика кількість мінеральних солей, головним чином фосфат кальцію. Мінеральні речовини становлять 70% кісткової тканини, органічні – 30%.
Функції кісткових тканин:
1) опорна;
2) механічна;
3) захисний (механічний захист);
4) участь у мінеральному обміні організму (депо кальцію та фосфору).
Клітини кісткової тканини – остеобласти, остеоцити, остеокласти. Основними клітинами у сформованій кістковій тканині є остеоцити. Це клітини відростчастої форми з великим ядром та слабо вираженою цитоплазмою (клітини ядерного типу).
Функції хрящової тканини
Тіла клітин локалізуються у кісткових порожнинах (лакунах), а відростки – у кісткових канальцях. Численні кісткові канальці, анастомозуючи між собою, пронизують кісткову тканину, повідомляючись периваскулярним простором, утворюють дренажну систему кісткової тканини. У цій дренажній системі міститься тканинна рідина, за допомогою якої забезпечується обмін речовин не тільки між клітинами та тканинною рідиною, а й у міжклітинній речовині.
Остеоцити є дефінітивними формами клітин та не діляться. Утворюються вони з остеобластів.
Остеобластимістяться тільки в кістковій тканині, що розвивається. У сформованій кістковій тканині вони містяться зазвичай у неактивній формі в окістя. У кістковій тканині, що розвивається, остеобласти охоплюють по периферії кожну кісткову пластинку, щільно прилягаючи один до одного.
Форма цих клітин може бути кубічною, призматичною та незграбною. У цитоплазмі остеобластів містяться добре розвинена ендоплазматична мережа, пластинчастий комплекс Гольджі, багато мітохондрій, що свідчить про високу синтетичну активність цих клітин. Остеобласти синтезують колаген та глікозаміноглікани, які потім виділяють у міжклітинний простір. За рахунок цих компонентів формується органічний матрикс кісткової тканини.
Ці клітини забезпечують мінералізацію міжклітинної речовини у вигляді виділення солей кальцію. Поступово виділяючи міжклітинну речовину, вони ніби замуровуються і перетворюються на остеоцити. При цьому внутрішньоклітинні органели значною мірою редукуються, синтетична та секреторна активність знижується і зберігається функціональна активність, властива остеоцитам. Остеобласти, що локалізуються в камбіальному шарі окістя, знаходяться в неактивному стані, синтетичні та транспортні органели в них розвинені слабо. При подразненні цих клітин (у разі травм, переломів кісток тощо) у цитоплазмі швидко розвиваються зерниста ЕПС та пластинчастий комплекс, відбувається активний синтез та виділення колагену та глікозаміногліканів, формування органічного матриксу (кісткової мозолі), а потім і формування дефінітивної кісткової. тканини. Таким способом за рахунок діяльності остеобластів окістя відбувається регенерація кісток при їх ушкодженні.
Остеокласти- костеруйнуючі клітини, у сформованій кістковій тканині відсутні, але містяться в окістя і в місцях руйнування та перебудови кісткової тканини. Оскільки в онтогенезі безперервно здійснюються локальні процеси перебудови кісткової тканини, то й у цих місцях обов'язково присутні й остеокласти. У процесі ембріонального остеогістогенезу ці клітини відіграють дуже важливу роль і присутні у великій кількості. Остеокласти мають характерну морфологію: ці клітини є багатоядерними (3 – 5 і більше ядер), мають досить великий розмір (близько 90 мкм) та характерну форму – овальну, але частина клітини, що прилягає до кісткової тканини, має плоску форму. У плоскій частині можна виділити дві зони: центральну (гофровану частину, що містить численні складки та відростки, і периферична частина (прозору) тісно стикається з кістковою тканиною. У цитоплазмі клітини, під ядрами, розташовуються численні лізосоми і вакуолі різної величини.
Функціональна активність остеокласту проявляється так: у центральній (гофрованій) зоні основи клітини з цитоплазми виділяються вугільна кислота та протеолітичні ферменти. Вугільна кислота, що виділяється, викликає демінералізацію кісткової тканини, а протеолітичні ферменти руйнують органічний матрикс міжклітинної речовини. Фрагменти колагенових волокон фагоцитуються остеокластами та руйнуються внутрішньоклітинно. За допомогою цих механізмів відбувається резорбція (руйнування) кісткової тканини, тому остеокласти зазвичай локалізуються в поглибленнях кісткової тканини. Після руйнування кісткової тканини за рахунок діяльності остеобластів, що виселяються із сполучної тканини судин, відбувається побудова нової кісткової тканини.
Міжклітинна речовинакісткової тканини складається з основної (аморфної) речовини та волокон, у яких містяться солі кальцію. Волокна складаються з колагену і складаються в пучки, які можуть розташовуватись паралельно (упорядковано) або неупорядковано, на підставі чого і будується гістологічна класифікація кісткових тканин. Основна речовина кісткової тканини, як і інших різновидів сполучних тканин, складається з глікозамін- та протеогліканів.
У кістковій тканині міститься менше хондроїтинсерних кислот, але більше лимонної та інших, які утворюють комплекси із солями кальцію. У процесі розвитку кісткової тканини спочатку утворюється органічний матрикс – основна речовина та колагенові волокна, а потім уже в них відкладаються солі кальцію. Вони утворюють кристали – гидрооксиапатити, які відкладаються як і аморфному речовині, і у волокнах. Забезпечуючи міцність кісток, фосфорнокислі солі кальцію також одночасно і депо кальцію і фосфору в організмі. Таким чином, кісткова тканина бере участь у мінеральному обміні організму.
При вивченні кісткової тканини слід чітко розділяти поняття «кісткова тканина» та «кістка».
Кістка- Це орган, основним структурним компонентом якого є кісткова тканина.
Класифікація кісткових тканин
Розрізняють два різновиди кісткових тканин:
1) ретикулофіброзну (грубоволокнисту);
2) пластинчасту (паралельно волокнисту).
В основі класифікації лежить характер розташування колагенових волокон. У ретикулофіброзній кістковій тканині пучки колагенових волокон товсті, звивисті та розташовуються неупорядковано. У мінералізованій міжклітинній речовині в лакунах безладно розташовуються остеоцити. Пластинчаста кісткова тканина складається з кісткових пластинок, в яких колагенові волокна або їх пучки розташовуються паралельно в кожній пластинці, але під прямим кутом до ходу сусідніх волокон пластинок. Між пластинками у лакунах розташовуються остеоцити, тоді як їх відростки проходять у канальцях через пластинки.
В організмі людини кісткова тканина представлена майже виключно пластинчастою формою. Ретикулофіброзна кісткова тканина зустрічається лише як етап розвитку деяких кісток (тем'яних, лобових). У дорослих людей вона знаходиться в області прикріплення сухожиль до кісток, а також на місці окостенілих швів черепа (стрілоподібного шва, луски лобової кістки).
⇐ Попередня1234
Схожа інформація:
- I. ВИДИ, ФОРМИ І НАПРЯМКИ ОРГАНІЗАЦІЇ САМОСТІЙНОЇ РОБОТИ СТУДЕНТІВ
- ІІ. Види, умови та форми надання медичної допомоги
- Артеріальне повнокров'я. Причини, види, клініко-морфологічна характеристика.
- Атрофія: фактори, механізми, види, клініко-морфологічна характеристика. Бура атрофія печінки, міокарда, скелетних м'язів.
- Базовою класифікацією джерел трудового права є їх розташування за юридичною силою.
- Бюджетні фонди: поняття, види, призначення.
- Взаємне розташування поверхневих м'язів
- Взаємне розташування прямих.
- Види, властивості та закономірності емоцій та почуттів
- Види, типи та техніко-економічна характеристика фасувально-пакувального обладнання
- Позабюджетні фонди: поняття, види, порядок та джерела їх формування та напрямки використання. Порядок затвердження звітів про їхнє виконання.
- Зовнішньоекономічна діяльність. Концепція, види, суб'єкти.
Пошук на сайті:
Хрящова сполучна тканина людини
Однією з різновидів сполучної тканини, що є в організмі людини, є хрящ. Відрізняється хрящова сполучна тканина відносно високою щільністю та пружністю міжклітинної речовини, що обволікає групи хондроцитів та окремі клітини. Від кісткової тканини (а також від інших тканин) хрящ відрізняється повною відсутністю кровоносних судин і нервів. Оболонкою хряща виступає перихондрій, який також називають надхрящницею. Хрящова сполучна тканина (ХСТ) може виконувати функцію жорсткої скелетної основи у деяких тварин або формує пружні ділянки скелета, покриваючи краї кісток і утворюючи особливі прошарки, що амортизують (як, наприклад, міжхребцеві диски). Словом, основними функціями хрящової сполучної тканини є: опорна та функція формування зчленувань.
Будова хрящової тканини
Як уже зазначалося вище, хрящова тканина складається не тільки з самого хряща, але і з надхрящниці (перихондрія), яка в свою чергу включає внутрішній шар пухкої волокнистої сполучної тканини (РВСТ) та зовнішній шар щільної волокнистої неоформленої сполучної тканини (ПВНСТ). До складу РВСТ (поряд з хондроцитами та міжклітинною речовиною, що складається з волокон, інтерстиціальної води та аморфної речовини) входять також напівстволові та стовбурові клітини, система кровоносних судин, нерви та хондробласти. Об'єм хондроцитів становить приблизно до 10% від загальної маси хрящової сполучної тканини. Найбільше у ХСТ міжклітинної речовини, що відрізняється досить високою гідрофільністю, а відповідно забезпечує можливість доставки в клітини необхідних поживних речовиніз кровоносних капілярів перихондрія за рахунок процесів дифузії. Хрящ може бути склоподібним (у разі однорідності міжклітинної речовини), волокнистим або сітчастим.
Хондроцити
Дифферон хондроцитів, з яких складається хрящова сполучна тканина, включає хондробласти, стовбурові та напівстволові клітини, а також до нього входять зрілі та молоді хондроцити. Хондроцити - це похідні хондробластів, а крім того, це клітини, які єдині з клітинних популяцій, що є в хрящовій тканині, знаходяться в лакунах. Розрізняють молоді та зрілі хондроцити. Перші багато в чому ідентичні хондробластам. У них довгаста форма, досить великий апарат Гольджі, а також вони можуть продукувати глікопротеїни і білок для еластичних і колагенових волокон. Зрілі клітини-хондроцити овальні за формою і менш здатні до синтезу, якщо порівняти з хондроцитами молодими. Хондроцити можуть ділитися та формувати окремі клітинні групи, обрамлені єдиною капсулою. У склоподібному хрящі можуть бути клітинні групи числом до 12 клітин у кожній, а в інших типах хрящової тканини ізогенні групи містять, як правило, меншу кількість клітин.
Хрящові тканини: класифікація та гістогенез
Хрящова сполучна тканина розвивається не тільки на ембріональному рівні, а й у дорослих особин (регенерація тканини). У період розвитку хряща утворюється так званий хрящовий дифферон, в якому послідовно змінюють один одного стовбурові та напівстволові клітини, а потім хондробласти та хондроцити. На початковій стадії хрящового ембріогенезу формується невеликий хондрогенний острівець. Далі відбувається диференціація хондробластів з подальшою появою хрящового матриксу та волокон. На завершальній стадії ембріогенезу хрящова закладка переживає інтерстиціальне або апазіційне зростання.
Хрящові тканини
При першому тканина збільшується зсередини (властиво як ембріонального періоду, так і процесів регенерації), а при другому тканина нашаровується з подачі хондробластів, що діють у перихондрії.
Регенерація та вікові зміни
Хрящі відновлюються за рахунок глюкозаміну та хондроїтин сульфату. Ці компоненти є будівельним матеріалом, завдяки якому відбувається відновлення еластичності та структури суглобів, усувається артрозний біль, заповнюється недостатній обсяг тканини, посилюється дія препаратів протизапального характеру. Регенерація хрящової тканини здійснюється з камбіальних клітин перихондрію (наростають нові хрящові шари). Цей процес може протікати на повну силу лише у дитячому віці, а дорослі регенерація хряща, на жаль, відбувається в повному обсязі. Зокрема, на місці втраченої хрящової тканини формується ПВНСТ. З віком людини, його волокниста та еластична хрящові тканини не зазнають практично жодних змін. У той же час, склоподібний хрящ (гіалінова хрящова тканина) схильний до трансформацій у кісткову тканину і до звапніння.
Гіалінова хрящова тканина
Склоподібна тканина локалізується переважно у хрящах гортані, носа, бронхів, трахеї, ребер, суглобів, а також у хрящових пластинах росту, присутніх у трубчастих кістках. Складається гіаліновий хрящ із хондроцитів і, відповідно, міжклітинної речовини, яка у свою чергу включає колагенові волокна, інтерстиціальну воду та протеоглікани. Приблизно 20-25% загального обсягу посідає колагенові волокна, а 5-10% на протеогликани. Останні не допускають мінералізації склоподібної хрящової тканини, а інтерстиціальна вода, обсяг якої досягає 65-85%, сприяє амортизації хряща та нормальному обміну речовин у сполучній тканині, переносячи поживні компоненти, метаболіти та солі. Різновидом склоподібного хряща є суглобовий хрящ. Однак при цьому він не має надхрящниці, а отримує необхідні живильні елементи із синовіальної рідини. У хрящі суглобовому може бути виділено: безклітинна зона (поверхнева), проміжна зона і так звана глибока зона, тобто. зона взаємодії хрящової тканини з кістковою.
Еластична та волокниста хрящові тканини
Хрящова сполучна тканина, яка називається еластичною, локалізується в ріжкоподібних, надгортанних, черпалоподібних (у голосових відростках) і клиноподібних хрящах гортані. Крім того, еластична хрящова тканина зустрічається у вушній раковині та євстахієвій трубі. Даний різновид тканини особливо потрібний там, де потрібна здатність ділянок органів до зміни форми та обсягу, а також до зворотних деформацій. До складу еластичної тканини входять хондроцити, що складається з аморфної речовини (і волокон) міжклітинної речовини.
Хрящова тканина, звана волокнистою, локалізується в суглобових менісках і дисках, міжхребцевих дисках (в їх фіброзних кільцях), в лонному зчленуванні (симфізі), в зонах фіксації сухожиль до гіалінового хряща і кісток, а також на поверхню. нижньощелепного суглобів. Волокниста хрящова сполучна тканина складається з подовжених одиночних хондроцитів та міжклітинної речовини. Останнє включає значну кількість волокон колагену та досить малий обсяг аморфної речовини. Зазвичай колагенові волокна розміщені у міжклітинній речовині у вигляді пучків, що розташовуються паралельно та впорядковано.
Види хрящової тканини та її будова
Хрящова тканина- Різновид пружної, щільної сполучної тканини, що має опорно-механічну функцію.
Переважний склад хрящової тканини: хондроцити, хондробласти.
Види хрящової тканини
— Гіалінова (склоподібна)- знаходиться в трубках дихальних шляхів, на закінчення реберних кісток та в суглобах.
— Волокниста (сполучнотканинна)– служить для з'єднання щільної тканини із волокнистою структурою гіалінового хряща.
— Еластична (має сітчасту структуру)- міститься в щільних частинах вушних раковин, гортані (санторінові, врисбергові, черпалоподібний, щитовидний, перстневидний хрящі), надгортаннику.
Функції хрящової тканини
- Забезпечення надійного з'єднання із збереженням рухливості між окремими елементами опорно-рухового апарату (наприклад, між кістковими частинами хребта);
- Задіяння в процесах вуглеводного обміну.
Повна регенерація хрящової тканиниспостерігається у людини у дитячому віці. З віком 100% відновлення неможливо: пошкоджені хрящові тканини відновлюються частково, з паралельним формуванням дома травми ПВНСТ.
При механічному пошкодженні суглоба або якщо руйнація спричинена наслідком хвороби, можлива заміна суглоба на штучний.
Підтримку природних функцій хрящової тканини надають препарати з хондроїтином натрію сульфат, глюкозаміном.
Хороший терапевтичний ефектна початкових стадіях проблем з хрящовою тканиною виявляють помірні фізичні вправи та курс протизапального лікування з одночасним вживанням препаратів з легкозасвоюваним кальцієм.
Розвиток проблем зумовлюють:
- травми,
- інфекційні захворювання,
- Надмірні фізичні навантаження протягом тривалого періоду,
- Переохолодження,
- Спадковість.
Позитивний ефект від протизапальної терапії спостерігається як при прийомі препаратів внутрішньо, так і при зовнішньому застосуванні. Ефективність останнього методу впливу ґрунтується на високій гідрофільності хрящової тканини. За рахунок цього лікарські препарати, що проникають у шкіру, швидко виявляються безпосередньо в осередку захворювання.
Всі наші кістки у процесі ембріонального (зародкового) розвитку утворюються із хрящів. У дорослої людини вони становлять трохи більше 2% маси тіла. Кістки ростуть завдяки діафізарному хрящу, подовжуються вони до того часу, доки закриваються звані зоны роста1. Однак деякі з них збільшуються протягом усього життя людини. Встановлено, що постійно ростуть, хоч і малими темпами, нижня щелепа, ніс, вушні раковини, ступні ніг та кисті рук.
Найчастіше спортсмени залишають спорт через травми суглобово-зв'язкового апарату. Його слабке місце – хрящ. Проблеми з хребтом також зумовлені в основному патологією міжхребцевих хрящів.
Можна сказати, що у спортивній травматології лікування хрящів є турботою № 1. При цьому деякі автори вважають, що відновлюються вони не більше ніж на 50%, ставлячи таким чином під сумнів можливість повного відновлення спортивної працездатності. Спробуємо докладніше розглянути, що таке хрящ і визначити межі та методи його регенерації.
Хрящова тканина - один з різновидів сполучної тканини, яка виконує в організмі опорні функції. Неодмінним атрибутом хряща, крім суглобового, є надхрящниця, що забезпечує його харчування та зростання. У суглобах хрящ оголений і контактує безпосередньо із внутрішнім середовищем суглоба — синовіальної рідиною. Вона виконує роль своєрідного мастила між поверхнями суглобів, що труться, покритих гладким гліаїновим хрящем. Хрящі кісток та хребта постійно відчувають як статичне, так і динамічне навантаження. Хрящі носа, гортані, бронхів, фіброзних трикутників у серці здійснюють також опорну функцію.
Структура хряща дозволяє йому відчувати оборотну деформацію і в той же час зберігати здатність до обміну речовин та розмноження. Головні його компоненти - хрящові клітини (хендроцити) та позаклітинний матрикс, що складається з волокон та основної речовини. Причому більшу частину маси хряща становить саме міжклітинна речовина.
Залежно від переважання колагенових, еластичних волокон або основної речовини розрізняють гіаліновий, еластичний та волокнистий хрящ.
Особливістю хряща, в порівнянні з іншими видами тканин в організмі, є те, що в ньому мало клітин і вони оточені великою кількістю міжклітинного простору - матриксу. Хрящ так погано відновлюється після пошкоджень саме тому, що в ньому дуже мало клітин, здатних розмножуватися, і основна частина репарації (відновлення) йде за рахунок позаклітинного матриксу. В еластичному хрящі (гортані, носа, вушної раковини) міститься багато еластину (з нього, наприклад, на 30% складається вухо людини).
У суглобовому хрящі дуже багато води (у хрящі головки стегнової кістки молодого чоловіка- 75 г на 100 г тканини). Глауронова кислота допомагає матриксові зв'язувати воду, чим і забезпечуються пружні та еластичні властивості тканини.
У гіаліновому хрящі, який найчастіше є внутрішньосуглобовою поверхнею, половину всього матриксу становить колаген — основний білок сполучної тканини. Тільки сухожилля та дерма (глибокий шар шкіри) перевершують матрикс за насиченістю колагеном. Найбільша його концентрація у суглобових хрящах зосереджена поверхневій зоні.
Колаген - поняття збірне, існують кілька його видів. Різні по хімічного складуТим не менше, вони складаються з дуже великих молекул, згорнутих в потрійні спіралі. Така будова волокон робить їх дуже міцними на скручування, розтягування та розрив. Кожен із трьох ланцюгів має поліпептидну структуру.
Якщо ми проаналізуємо склад поліпептидних ланцюгів будь-якого з трьох видів колагену (у людини їх налічується саме три), то побачимо, що найбільша питома вага амінокислоти гліцину. Слідом за ним за питомою вагою слідують амінокислоти промен (пролін -?) та аланін. Іноді аланін «переважує» пролін, а іноді навпаки, пролін за своєю питомою вагою перевершує аланін.
Еластичні хрящі (наприклад, носа та вух) містять у своєму матриксі переважно еластин, який, подібно до колагену, формує міцні волокна. Вони тонші за колагенові, але відрізняються великою міцністю. Тканини, що містять велику кількість еластину здатні до великих оборотних деформацій. Основною амінокислотою еластину (як і колагену) є гліцин. За ним за відсотковим змістом слідують аланін, пролін та валін.
Еластіна, як і колагену, існує кілька видів. Волокна еластину теж мають пептидний характер та спіралеподібну форму. Цим і пояснюється їхня велика розтяжність. Спіраль, однак, не потрійна, а одинарна, тому волокна еластину тонша за колагенові. У різних хрящів у матриксі переважають або колагенові, або еластинові волокна. Усі вони переплетені у міцну тривимірну мережу. Колагенова (еластинова) мережа «утримує» всередині хряща та інші молекули як механічно, і з допомогою електростатичних зв'язків.
Біомеханічні властивості хрящів роблять їх високоспецифічними та по суті унікальними компонентами опорно-рухового апарату.
Вони:
а) приймають він дію зовнішніх механічних сил стискування і розтягування; розподіляють ці сили рівномірно, поглинають та розсіюють їх, переводячи аксіально спрямовані сили в тангенціальні (у суглобах кінцівок, хребта тощо);
б) утворюють стійкі до зношування поверхні зчленувань скелета, беруть участь у формуванні мастильного апарату в синовіальних суглобах;
в) є місцем прикріплення та опорою для м'яких тканин та м'язів; утворюють порожнини в місцях контакту із зовнішнім середовищем (хрящі носа, вух, органів дихання).
Вважається, що хрящовий матрикс складається з трьох основних компонентів:
1) волокнистий колагеновий каркас, який утворює тривимірну мережу переплетень;
2) молекули протеогліканів, які заповнюють петлі волокнистого каркасу;
3) вода, що вільно переміщається між переплетеннями каркасу і молекулами протеогліканів.
Суглобовий хрящ не має кровоносних судин. Він харчується дифузно, поглинаючи поживні речовини із синовіальної рідини.
Колагеновий каркас є хіба що «скелетом» хряща. Він має велику пружність по відношенню до сил розтягування і в той же час чинить відносно слабкий опір навантаженню на стиск. Тому внутрішньосуглобові хрящі (наприклад: меніски та суглобові поверхні стегнової та гомілкових кісток) легко пошкоджуються при компресійних (стискаючих) навантаженнях і майже ніколи при навантаженнях на розтягування (на розрив).
Протеоглікановий компонент матриксу відповідає за здатність хряща зв'язувати воду. Вона може видалятися за межі хряща в синовіальну рідину і повертатися назад. Саме вода як несжимаемая субстанція забезпечує достатню жорсткість хряща. Її переміщення рівномірно розподіляє зовнішнє навантаження по всьому хрящу, в результаті чого відбувається ослаблення зовнішніх навантажень і оборотність деформацій, що виникають при навантаженнях.
Еластичні хрящі гортані, трахеї містять дуже невелику кількість судин. Колагенові хрящі суглобів взагалі містять судин. Велике механічне навантаження на хрящ несумісне з васкуляризацією (судинним забезпеченням). Обмін у такому хрящі здійснюється завдяки переміщенню води між компонентами матриксу. Вона містить усі необхідні хрящам метаболіти. Тому в них різко уповільнено як анаболічні, так і катаболічні процеси. Звідси погане їхнє посттравматичне відновлення, на відміну від хрящів з васкуляризацією.
Крім гліаїнового та еластичного хрящів виділяють ще одну групу - волокнистий, або фіброзний хрящ. Фіброз означає «волокно». Матрикс фіброзного хряща утворений колагеновими волокнами, однак, порівняно, скажімо, з гліаїновим хрящем пучки колагенових волокон товстіші і не мають структури тривимірного переплетення. Вони орієнтовані, переважно, паралельно одне одному. Їх напрямок відповідає векторам сил натягу та тиску. З фіброзного хряща складаються міжхребцеві диски, що відрізняються великою міцністю. Великі колагенові волокна та їх пучки розташовуються у міжхребцевих дисках циркулярно. Крім міжхребцевих дисків, волокнистий хрящ знаходиться в місцях прикріплення сухожиль до кісток або хрящів, а також у зчленуванні лобкових кісток.
Підтримка всієї структурної цілісності матриксу хряща залежить повністю від хондроцитів. І хоча їх маса невелика, вони синтезують проте біополімери, з яких складається матрикс - колаген, еластин, протеоглікони, глікопротеїни, і т.д. При питомій вазі від 1 до 10% загального обсягу хрящової тканини хондроцити забезпечують утворення великих мас матриксу. Вони також контролюють всі катаболічні реакції в хрящі.
У чому причина низької метаболічної активності хряща? Тільки в одному – у малій кількості клітин (1-10%) в одиниці об'єму тканини. У перерахунку на чисту клітинну масу рівень метаболізму хондроцитів не менше, ніж в інших клітин організму. Особливо низьким метаболізмом відрізняються суглобові хрящі та пульподні ядра міжхребцевих дисків. Саме ці структури відрізняються найменшою кількістю хондроцитів (1% від загальної маси хряща) і саме вони найгірше відновлюються після пошкоджень.
Окисні процеси в хрящі протікають в основному анаеробним (безкисневим) шляхом. Так, наприклад, хондроцити пульпозних ядер міжхребцевих дисків на 99% харчуються анаеробно і лише на 1% аеробно. У середньому ж кисневе окислення у хрящовій тканині як мінімум у 50 разів менш інтенсивне, ніж у звичайних тканинах організму. Анаеробний характер окислення в хондроцитах - це захисно-пристосувальна реакція, що склалася у процесі еволюції. І це не дивно, якщо врахувати, що хрящ не має (глаїновий, фіброзний) або майже не має (еластичного) кровопостачання. Якщо розпочати введення кисню в простір, прикордонне з хрящем, то дифузія в хрящ О2 як поліпшує його трофіку, але, навпаки, різко погіршує її.
Наскільки низька метаболічна активність хряща можна зрозуміти з наступного порівняння. Білковий склад печінки повністю оновлюється за 4(!) дні. Колаген хрящів оновлюється лише на 50% за 10(!) років. Тому стає зрозумілим, що будь-яка травма хрящової тканини практично невиліковна, якщо не вжити спеціальних заходів, спрямованих на збільшення числа хондроцитів, які сформують новий матрикс.
Регенерація хрящової тканини як фізіологічна, так і репаративна (відновна) безпосередньо залежить від гормонального фону та модулюючої дії тих чи інших гормонів. Так, наприклад, глюкокортикоїдні гормони пригнічують анаболічні реакції в хондроцитах, інгібують синтез колагену та протеогліканів, викликають дефіцит глауронової кислоти в синовіальній рідині та в матриксі. І ця гнітюча дія глюкокортикоїдів більш виражена, якщо вона поєднується зі стисненням (компресією) хряща. В принципі, в цьому немає нічого дивного, якщо врахувати, що глюкокортикоїди пригнічують гліколіз — анаеробне окиснення глюкози в хрящі. Регенерація без енергетичного забезпечення стає просто неможливою. Інсулін стимулює синтез колагену в матриксі хрящової тканини, проте ця стимуляція невелика і має опосередкований характер.
Найсильнішим фактором, що стимулює як фізіологічний, так і репаративний синтез у хрящовій тканині, є соматотропний гормон. Спорідненість хрящів до соматотропного гормону відсутня як така. Однак під дією соматотропного гормону в печінці утворюється інсуліноподібний фактор росту (ІРФ-1), який і має власне анаболічну дію на всі тканини, включаючи хрящову. Сам собою гормон росту здатний надавати анаболическое дію на клітини лише тому випадку, якщо його концентрація у 2000 разів перевищує фізіологічну. Таке можливе тільки в пробірці і повністю виключається у реального життя. Застосовуючи соматотропін з репаративною метою необхідно пам'ятати, що його вплив на синтез ІРФ-1 можливий лише в умовах нормальної роботи печінки, за відсутності серйозних захворювань, інакше ІРФ-1 просто не синтезуватиметься і введення соматотропіну не дасть жодного результату. Здатність соматомедину посилювати регенерацію хрящової тканини у 100 разів перевищує ефект від введення в організм інсуліну та тестостерону. ІРФ-1 - це єдиний фактор, що викликає поділ (розмноження) хондроцитів. Інші анаболічні фактори організму (а їх досить багато) такої здатності не мають.
Гормони щитовидної залози можуть посилювати відновлення та фізіологічне зростання хрящів, якщо застосовувати їх у малих кількостях, близьких до фізіологічних. Тоді вони мають анаболічну дію на всі тканини організму. У середніх та великих кількостях гормони щитовидної залози мають ще більшу анаболічну дію, проте, при цьому вони викликають енергетичний дефіцит (термогенний ефект) та посилення катаболізму.
Катаболізм при цьому посилюється більшою мірою, ніж анаболізм і активність деструктивних процесів перевищує синтетичну активність. Як би не посилювався анаболізм зі збільшенням доз тірсоїдних гормонів, катаболізм посилюється ще більше і про це необхідно пам'ятати.
Тиреокальцитонін – єдиний гормон щитовидної залози, що посилює відновлення та зростання хрящової тканини у будь-яких кількостях, але для цього його необхідно застосовувати ізольовано, окремо від тироксину та трийєдироніну – «основних» гормонів щитовидної залози.
Гормон паращитовидних залоз (паратиреоїдний гормон) має помірно стимулюючу дію на регенерацію хряща.
Тестостерон – основний андроген організму помірно стимулює біосинтетичні процеси в хрящах, а естрогени – жіночі статеві гормони, навпаки, гальмують її.
Анаболічні стероїди мають здатність викликати регенерацію хряща набагато більшою мірою, ніж чистий тестостерон і це не дивно, якщо врахувати, що вони мають анаболічну дію, яка в кілька разів перевищує анаболічну дію тестостерону.
Цікаво, що матрикс – породження хондроцитів – живе своїм самостійним життям. Він здатний модулювати дію різних гормонів на хондроцити, послаблюючи або посилюючи їх дію. Впливаючи на матрикс, можна змінити стан хондроцитів як на кращу, так і на гіршу сторону. Видалення частини матриксу викликає негайну інтенсифікацію біосинтезу відсутніх у ньому макромолекул. Більше того, одночасно посилюється проліферація (розростання) хондроцитів. Кількісні зміни в матриксі здатні спричинити їх якісні зміни.
Тривале обмеження рухів у суглобі (гіпсова іммобілізація та ін) призводить до зменшення маси хрящів. Причина напрочуд проста: у нерухомому суглобі відсутнє перемішування синовіальної рідини. При цьому дифузія молекул у хрящову тканину сповільнюється та харчування хондроцитів погіршується. Недолік прямого компресивного навантаження (на стиск) так само призводить до погіршення живлення хондроцитів. Хрящу потрібне хоча б мінімальне компресійне навантаження для підтримки нормальної трофіки. Надмірне навантаження на розтяг в експерименті викликає переродження хряща з розвитком грубих фіброзних волокон.
Дуже складний вплив на стан внутрішньосуглобових хрящів має синовіальна оболонка. Вона може посилювати анаболізм хрящової тканини, так і посилювати її катаболізм. Видалення синовіальної оболонки різко погіршує трофіку хрящів, яка відновлюється лише після її відростання.
Хондроцити здатні до ауторегуляції. Вони синтезують спеціальні фактори зростання, що стимулюють розростання сусідніх хондроцитів. Поки що їх структура повністю не розшифрована. Відомо лише те, що вони мають поліпептидну природу.
Усі хрящі, але особливо хрящі опорно-рухового апарату постійно піддаються мікротравматизації. Насамперед це стосується міжхребцевих дисків, найбільш вразлива частина яких — пульпозне ядро. Вже у підлітковому віці (починаючи з 16-ти років) починаються дистрофічні зміни у міжхребцевих дисках шийного відділу хребта. У перерахунку на одиницю поперечного перерізу він несе навантаження набагато більше, ніж будь-який інший відділ хребта, включаючи поперековий. Насамперед дистрофічні зміни стосуються пульпозного ядра. Частина його клітин гине та заміщається грубою сполучною тканиною. Аналогічні, але менш виражені зміни відбуваються і в самому міжхребцевому диску. Місцями відбувається осередкове розростання хондроцитів. Організм прагне відновити пошкоджений хрящ та запускає репаративні процеси. Однак у місцях загибелі хондроцитів знаходиться грубоволокниста сполучна тканина – своєрідний рубець. І якраз у ньому, там, де вони необхідні, хондроцити відновитися не можуть. Їхнє розростання відбувається по периферії рубцевої тканини, де вони, власне, і не потрібні. Це призводить до непотрібної деформації хряща, що порушує його функції. Основна функція хряща - опорна та стабілізуюча. При розвитку дегенеративних і дистрофічних процесів у міжхребцевих дисках хребці втрачають стабільність і поступово стають гіпермобільними, які легко зміщуються. Їх гіпермобільність може викликати здавлення навколишніх м'яких тканин. Набряк м'яких тканин, у свою чергу, викликає здавлення судин, що проходять в них, і нервів з розвитком відповідних симптомів. Організм прагне відновити стабільність суглобово-зв'язувального апарату. Відбувається розростання окремих ділянок хребців як своєрідних кісткових виростів — «усів». Ці «вуса» здавлюють прилеглі м'які тканини, викликаючи їх набряк і вторинне здавлювання прилеглих судин і нервів. Весь комплекс змін кістково-хрящового апарату в даному випадку носить назву остеохондрозу, хоча цей термін дуже розпливчастий, неконкретний, і взагалі-то, малонауковий.
Якщо в шийному відділіхребта негативні явища розвиваються з підліткового віку, то в поперековому відділі, де навантаження на одиницю поперечного перерізу набагато нижче – починаючи з 25-30 років. Загалом вони мають такий самий морфологічний характер, як і в шийному відділі, але відрізняються клінічними (медичними) ознаками. У шийному відділі хребта крізь поперечні відростки шийних хребців проходять великі артерії, що живлять всю основу мозку та його стовбурову частину, де знаходиться життєво важливі центри (дихання, кровообіг і т.д.). З розвитком шийного остеохондрозу відбувається поступове непомітне стискання цих артерій з недостатністю мозкового кровообігу. При цьому практично не буває (або вони бувають дуже рідко) жодних болючих ознак процесу. У поперековому відділі хребта картина дещо інша. З цього відділу виходять нервові коріння, що несуть чутливі волокна від нижніх кінцівок і рухові волокна до м'язів ніг. Поперековий остеохондроз насамперед проявляється різними больовими симптомами, порушенням чутливості та рухової сфери. При цьому жодних життєво важливих функцій організму не порушує. Шийний остеохондроз ніякими болючими ознаками себе не виявляє і особливих незручностей не завдає, проте може призвести до серйозних порушень мозкового кровообігу, аж до інсультів з розвитком паралічів.
Шийний остеохондроз проявляється різними симптомами, які можуть симулювати інші захворювання. Погіршення мозкового кровообігу проявляється зниженням працездатності, швидкою стомлюваністю, головним болем. Втома очей, мушки перед очима, відчуття «піску в очах» є характерними ознакамишийного остеохондрозу. Дзвін у вухах та погіршення слуху частіше говорять про порушення мозкового кровообігу внаслідок остеохондрозу, ніж про захворювання слухового апарату. За останніми даними, 85% всіх крововиливів у мозок у пізньому віці спричинені не віковою патологією артерій як такої, а здавленням шийних артерій внаслідок поширеного шийного остеохондрозу.
Вікові зміни еластичних хрящів не мають фатального характеру. Вони виражаються в основному в осифікації - накопиченні кальцію і не призводять до помітного порушення функцій.
У глиамінових хрящах суглобів вже з 30-річного віку виявляється фібриляція — розволокнення хрящової поверхні. При мікроскопічному дослідженні на поверхні хряща виявляються розломи та розщеплення. Розщеплення хряща відбувається як вертикальному, і у горизонтальному напрямі. При цьому місцями зустрічаються скупчення клітин хрящової тканини як реакція у відповідь організму на руйнування хряща. Іноді відзначається вікове збільшення (!) Товщини суглобових хрящів як дію у відповідь на дії механічних (тренування) факторів. Вікову еволюцію хрящів колінного суглоба багато дослідників відзначають починаючи вже з 40-річного віку. Найбільш істотна зміна, що відзначається при старінні хряща, - це зменшення вмісту води, що автоматично призводить до зниження його міцності.
Звідси надзвичайна складність посттравматичного лікування. Більше того, іноді непросто буває навіть збереження нормального стану хрящів під час звичайного тренувального процесу. Зростання м'язової тканини випереджає зміцнення суглобово-зв'язувального апарату і особливо його хрящової частини. Тому рано чи пізно навантаження досягають такої величини, яку хрящова частина опорно-рухового апарату вже не може витримати. В результаті виникають «неминучі» травми, що важко заліковуються, через які спортсмен іноді розлучається зі спортом. Самостійне відновлення хряща ніколи не буває повним. У разі хрящ відновлюється на 50% від вихідної величини. Однак це не означає, що подальше його відновлення неможливе. Воно можливе при грамотному фармакологічному впливі, покликаному викликати, з одного боку, розмноження хондроцитів, з другого — зміна стану матриксу хряща. Проблема відновлення хряща багаторазово ускладнюється ще й тим, що на місці загиблої хрящової тканини розвивається рубцева тканина. Вона не дає хрящу регенерувати у потрібному місці. Компенсаторне розростання ділянок хряща по сусідству з місцем ушкодження призводить до його деформації, ускладнюючи завдання фармакологічної стимуляції зростання. Втім, всі ці складності переборні, якщо деформований хрящ спочатку піддати хірургічній корекції.
Потенційні можливості регенерації хряща досить великі. Він може регенерувати за рахунок власного потенціалу (розмноження хондроцитів та зростання матриксу) та, що не менш важливо, за рахунок інших видів сполучної тканини, які мають спільне з ним походження. Тканини, що примикають до хряща, мають здатність до переорієнтації своїх клітин і перетворення їх на хрящеподібну тканину, яка непогано справляється зі своїми функціями. Візьмемо для прикладу найчастіший вид ушкоджень – ушкодження внутрішньосуглобового хряща.
Джерелом регенерації є:
1) сам хрящ;
2) синовіальна оболонка суглоба, що наростає з країв дефекту і перетворюється на хрящеподібну тканину;
3) кісткові клітини, які, не забуватимемо, мають хрящове походження і при необхідності можуть трансформуватися «назад» у тканину, що нагадує за своєю будовою хрящову;
4) клітини кісткового мозку, які можуть бути джерелом регенерації при глибоких ушкодженнях хрящів у поєднанні з кістковим ушкодженням.
Відразу після травми спостерігається «вибух» мітоїчної активності хондроцитів, які розмножуються і формують новий матрикс. Процес цей спостерігається протягом 2-х тижнів після пошкодження, проте ремодулювання поверхні хряща триває не менше 6 місяців, а повністю припиняється лише через рік. Якість «нового» хряща, звичайно ж, поступається якістю «старого». Якщо, наприклад, пошкоджений гіаліновий внутрішньосуглобовий хрящ, то через 3-6 місяців виростає регенерат, що має характер гіаліново-фіброзного молодого хряща, а через 8-12 місяців, він вже перетворюється на типовий фіброзний хрящ з матриксом, що складається з щільно прилеглих один до одного колагенових волокон.
Всі дослідники хрящової тканини одностайні в одному: хрящ не здатний відновити втрачене лише за рахунок власних внутрішніх ресурсів та механізмів. Їх вистачає щонайбільше на 50% регенерату. Ще деякий приріст регенерату здійснюється за рахунок інших видів сполучної тканини, про які ми вже говорили, але про повне 100% відновлення хряща говорити все одно не доводиться. Все це вносить неабияку частку песимізму в оцінку можливості одужання після серйозної травми хряща, проте приводи для оптимізму все-таки є. Досягнення фармакології та трансплантології на сьогоднішній день такі, що можна говорити про повну компенсацію навіть дуже серйозних хрящових дефектів, хоч би як це було трудомістко.
Повнота відновлення пошкодженої хрящової тканини багато в чому залежить від якості заходів посттравматичного періоду, коли тільки формується гематома1. Потім вона просочується особливого роду білком - фібрином, що пропотіває з плазми крові, і перетворюється на рубцеву тканину. А вона, як ми знаємо, є серйозною перешкодою для розвитку саме тут повноцінного регенерату. Тому відразу ж після травми необхідно вжити всіх можливих заходів для запобігання розвитку гематоми та набряку м'яких тканин. Травмовану ділянку треба охолодити. Для цього його обкладають льодом, зрошують хлоретиленом. Якщо пошкоджений суглоб кінцівки, його можна просто помістити під струмінь холодної води. Дуже важливою є своєчасна допомога кваліфікованого лікаря-травматолога. Місцеві новокаїнові блокади не тільки знеболюють травмовану ділянку, а й перешкоджають розвитку набряку та запалення. Блокади можна повторювати доти, доки мине гострий період. Якщо в результаті забиття суглоба стався крововилив у його порожнину - гемартроз, то необхідно якнайшвидше відкачати кров із суглоба. Зробити це нескладно звичайним шприцом. Іноді відкачувати кров і транссудат (рідина, що пропотіватиме в порожнину суглоба з плазми крові) доводиться кілька разів поспіль. У жодному разі не можна чекати, поки кров «розсмокчеться сама». Потік крові в результаті випадання особливого роду білка - фібрину може розвинутись велика кількість рубцевої тканини. Пошкоджений суглоб може залишитися деформованим і збільшеним у розмірах. Сумним прикладом може бути «кентус» у тих, хто займається карате. Розбиті суглоби пальців збільшуються в розмірах через крововиливи і так залишаються збільшеними через те, що з них вчасно не відкачують кров. Незважаючи на жахливий вид кулаки з розбитими суглобами набагато слабші за звичайні і дуже легко ушкоджуються після повторного травмування.
У підгострому періоді, коли набряк м'яких тканин та больовий синдром суттєво знижені, необхідно подбати, щоб якнайповніше розсмокталася пошкоджена тканина. З цією метою застосовує протеолітичні ферменти (трипсин, хелеотрипсин, папаїн та ін), які вводяться в пошкоджену ділянку за допомогою електрофорезу. Хороший ефект дають глюкокортикоїдні гормони - гідрокортизон, преднізолон та ін. Як і протеолітичні ферменти вони вводяться місцево, в уражену область - чи то міжхребцевий диск, чи суглоби кінцівок. Гідрокортизон вводять за допомогою ультразвуку, а преднізолон електрофорезом. Іноді вводять глюкокортикоїдні гормони у порожнині суглобів, наприклад, при лікуванні травм колінного суглоба. У нього найскладніша будова та лікувати його травми дуже непросто. Меніски – внутрішньосуглобові хрящі у колінних суглобах при ушкодженнях практично не зростаються. Тому, якщо є надриви або відриви частин менісків, їх необхідно якомога раніше видалити. Легше «виростити» регенерат на місці віддаленого меніска (а такий регенерат обов'язково зростає), ніж домогтися загоєння пошкодженого меніска. На щастя, останніми роками широкого розвитку набула артроскопія і операції на колінному суглобі стають дедалі більш щадними. Артроскоп дозволяє за допомогою волокнистої оптики заглянути всередину суглоба не розкриваючи його (виробляються лише кілька отворів). Через артроскоп проводиться і оперативне втручання. Іноді буває так, що внаслідок травми меніск залишається цілим, але відривається від свого прикріплення. Якщо раніше такий меніск завжди видаляли, то тепер дедалі більше з'являється спеціалістів, які пришивають відірваний меніск на місце. Після освіження країв рани пришитий меніск приростає на місце.
Якщо при артроскопії виявляється розволокнення тих чи інших хрящових поверхонь, їх шліфують, «скусують» спеціальними кусачками волокна і ділянки деформованого хряща. Якщо цього не зробити, то наступні заходи, вжиті для посилення регенерації хрящової тканини, можуть призвести до зростання деформованого хряща та порушення його опорних функцій.
При поверхневих ушкодженнях можна досягти повного відновлення хряща, застосовуючи сильнодіючі фармакологічні засоби. За останні 40 років експериментальних та клінічних робіт свою високу ефективність довів лише один єдиний препарат – соматотропний гормон (СТГ). Він стимулює зростання хрящової тканини у 100 разів сильніше, ніж введення тестостерону та інсуліну. Ще більший ефект має комбіноване введення СТГ та тиреокальцитоніну — особливого роду гормону щитовидної залози, який посилює репарацію як кісткової, так і хрящової тканини. Виняткова ефективність дії СТГ на репарацію хряща обумовлено тим, що стимулює безпосередньо розподіл хондроцитів. Використовуючи СТГ, теоретично можна довести кількість хондроцитів до будь-якої потрібної кількості. Вони, у свою чергу, відновлюють матрикс до необхідного обсягу, синтезуючи всі його компоненти, починаючи з колагенових волокон і закінчуючи протеогліканами. Недоліком СТГ є те, що його не можна застосовувати місцево, вводячи безпосередньо в зону ураження хрящової тканини, оскільки він діє опосередковано. СТГ викликає утворення в печінці інсуліноподібного фактора росту (ІРФ-1), який і має сильний анаболічний ефект. Парентеральне (ін'єкційне) його введення викликає зростання не тільки пошкоджених хрящів, а й нормальних теж, а це небажано, адже в організмі існують кістки, в яких хрящові зони росту не закриваються протягом усього життя. Тривале введення великих доз СТГ у сформований організм може спричинити диспропорцію скелета. Хоча треба сказати, що у уражений хрящ він діє сильніше, і явних деформацій скелета під час лікування СТГ у науковій літературі немає.
В останні роки синтезовано лікарську форму ІРФ-1, яку все ширше застосовують ін'єкційно замість соматотропіну. Оскільки ІРФ-1 діє безпосередньо на тканині (в т.ч. і на хрящову), виникає зманлива перспектива використовувати його для місцевого введення (електрофорез, ультразвук і т.д.). Таке застосування ІРФ-1 дозволило б локалізувати його дію місцем ураженого хряща та виключити дію на здорові хрящі організму.
Непогана дія на відновлення хряща і оточуючої його сполучної тканини надають анаболічні стероїди (АС). За ефективністю вони стоять на другому місці після ІРФ-1 та соматотропного гормону, хоча безпосередньо поділу хондроцитів вони не викликають. Анаболічні стероїди, однак, прискорюють фізіологічну регенерацію та потенціюють анаболічну дію інсуліну та інших ендогенних анаболічних факторів, блокують дію катаболічних гормонів (глюкокортикоїдів). Практичне застосування АС у хірургічній та травматологічній практиці довело їх високу ефективність. Дуже шкода, що досі не розроблено лікарських форм АС для локального застосування. Це дозволило б створювати високі концентрації лікарської речовини саме у місці ушкодження та запобігати системним (на рівні всього організму) побічним діям. На жаль, дослідження у цій сфері ніким не фінансуються через зарахування АС до допінгових засобів у спорті.
Деякі дослідники в галузі молекулярної біології представили дуже переконливий матеріал, що доводить, що стимулятори (2-адренергічних рецепторів здатні симулювати анаболічні ефекти соматомединів і, зокрема, щодо хрящової тканини. Механізм такої дії не цілком зрозумілий. Не виключено, що просто підвищується чутливість печінки до ендогенного соматотропного гормону і зростає синтез в печінці ІРФ-1.Однією з найсильніших виборчих стимуляторів (2-адренергічних рецепторів є кленбутерол. Цей препарат не має гормональних ефектів і, водночас, має хорошу анаболічну дію. Подібно до ІРФ-1 він стимулює зростання хрящової тканини і може з успіхом застосовуватися в посттравматичному відновлювальному періоді.Препаратів, що стимулюють (2-адренорецептори багато, але особливо хотілося б відзначити такий старий і перевірений засіб як адреналін. Адреналін - гормон мозкової речовини надниркових залоз навіть при тривалому курсовому застосуванні ії не викликає звикання. У великих дозах адреналін впливає переважно на а-адренорецептори. Відбувається звуження судин шкіри, підвищення артеріального тиску, підвищення рівня цукру на крові. Малі дози адреналіну не торкаються а-адренорецепторів, стимулюють (2-адренорецептори. Розширюються судини м'язів, знижуються рівень цукру в крові та артеріальний тиск. Розвивається загальна анаболічна дія і, особливо по відношенню до хрящової тканини. Щоденне введення малих (саме малих!). доз адреналіну добре зарекомендував себе як засіб, що сприяє регенерації.
Деякі вітаміни у великих фармакологічних дозуваннях здатні суттєво збільшити викид у кров ендогенного соматотропіну. Пальму першості тут містить нікотинова кислота (вітамін РР). Внутрішньовенне введення порівняно невеликих доз нікотинової кислоти здатне збільшити базальну секрецію СТГ у 2-3 рази. Збільшує секрецію гормону росту вітамін К, тільки застосовувати його необхідно в помірних дозах, щоб не підвищити надмірно згортання крові.
Незважаючи на те, що матрикс хрящової тканини є похідним хондроцитів, зміна його стану може покращити та їхню діяльність. Стан матриксу можна покращити, застосовуючи великі дози аскорбінової кислоти у поєднанні з вітаміном Р. Особливо сильно аскорбінова кислота впливає на стан колагенових структур. Тому її традиційно використовують для посилення синтезу колагену, особливо у поєднанні з гліцином та анаболічними стероїдами. Застосовується також поєднання великих доз аскорбінової кислоти з лізином, аланіном та проліном.
Стан хрящового матриксу внутрішньосуглобових хрящів можна тимчасово поліпшити за допомогою речовин, що вводяться в синовіальну рідину. В останні роки особливо широко використовується введення в суглоб 15% розчину полівінілпіролідону, де він перебуває приблизно 5-6 днів, потім повторюють процедуру, іноді кілька разів. Полівінілпіролідон служить своєрідним тимчасовим «протезом» внутрішньосуглобової рідини. Він покращує тертя внутрішньосуглобових поверхонь, тимчасово знімаючи навантаження із суглобового хряща. У випадках тяжких, незворотних ушкодженнях хрящової тканини використовується протезування, яке з розвитком оперативної техніки дає дедалі більше обнадійливі результати. Вже нікого не здивуєш протезами міжхребцевих дисків. Робляться небезуспішні спроби протезування внутрішньосуглобових хрящів (менісків) колінних суглобів.
Дуже перспективним напрямком є введення у пошкоджені ділянки суспензії хондроцитів. Слабка регенерація хрящової тканини, як ми пам'ятаємо, зумовлена малою кількістю хрящових клітин (хондроцитів) на одиницю маси хрящової тканини. Чужорідні хондроцити, будучи введеними, скажімо, порожнину суглоба не викликають реакції відторгнення, т.к. мають слабку імунногенну активність. Вони здатні розмножуватися та утворювати нову хрящову тканину. Застосовують завись хондроцитів, отриману з хрящів великої рогатої худоби, померлих людей. Найбільш перспективним є використання ембріональних (зародкових) хрящових клітин. Вони взагалі не викликають імунної відповіді та, розмножуючись, викликають утворення нової хрящової тканини. На жаль, всі роботи із зародковими клітинами носять поки що експериментальний характер і не увійшли до широкої практики. Але це справа недалекого майбутнього. Проблема репарації хрящової тканини незабаром має бути вирішена. Для цього вже є всі причини.
1 Припинення зростання більшості кісток у довжину можуть бути ознакою того, що вже можливе лікування, наприклад, анаболічними стероїдами, які призводять до передчасного закриття ростової зони хряща, якщо ростові зони узе закриті (що з рентгенівського знімку променевої кістки молодої людини), то вже відсутня небезпека надто швидко закрити зони зростання застосування стероїди, отже, їх застосування можна розпочинати.
1 Дослівно це означає «кров'яна пухлина», але термін зовсім відповідає суті явища. Гематома - це дифузно пошкоджена тканина, набрякла від крові.
З журналу "Muscle Nutrition Review" № 8
Однією з різновидів сполучної тканини, що є в організмі людини, є хрящ. Відрізняється хрящова сполучна тканина відносно високою щільністю та пружністю міжклітинної речовини, що обволікає групи хондроцитів та окремі клітини. Від кісткової тканини (а також від інших тканин) хрящ відрізняється повною відсутністю кровоносних судин і нервів. Оболонкою хряща виступає перихондрій, який також називають надхрящницею. Хрящова сполучна тканина (ХСТ) може виконувати функцію жорсткої скелетної основи у деяких тварин або формує пружні ділянки скелета, покриваючи краї кісток і утворюючи особливі прошарки, що амортизують (як, наприклад, міжхребцеві диски). Словом, основними функціями хрящової сполучної тканини є: опорна та функція формування зчленувань.
Будова хрящової тканини
Як уже зазначалося вище, хрящова тканина складається не тільки з самого хряща, але і з надхрящниці (перихондрія), яка в свою чергу включає внутрішній шар пухкої волокнистої сполучної тканини (РВСТ) та зовнішній шар щільної волокнистої неоформленої сполучної тканини (ПВНСТ). До складу РВСТ (поряд з хондроцитами та міжклітинною речовиною, що складається з волокон, інтерстиціальної води та аморфної речовини) входять також напівстволові та стовбурові клітини, система кровоносних судин, нерви та хондробласти. Об'єм хондроцитів становить приблизно до 10% від загальної маси хрящової сполучної тканини. Найбільше ХСТ міжклітинної речовини, що відрізняється досить високою гідрофільністю, а відповідно забезпечує можливість доставки в клітини необхідних поживних речовин з кровоносних капілярів перихондрія за рахунок процесів дифузії. Хрящ може бути склоподібним (у разі однорідності міжклітинної речовини), волокнистим або сітчастим.
Хондроцити
Дифферон хондроцитів, з яких складається хрящова сполучна тканина, включає хондробласти, стовбурові та напівстволові клітини, а також до нього входять зрілі та молоді хондроцити. Хондроцити - це похідні хондробластів, а крім того, це клітини, які єдині з клітинних популяцій, що є в хрящовій тканині, знаходяться в лакунах. Розрізняють молоді та зрілі хондроцити. Перші багато в чому ідентичні хондробластам. У них довгаста форма, досить великий апарат Гольджі, а також вони можуть продукувати глікопротеїни і білок для еластичних і колагенових волокон. Зрілі клітини-хондроцити овальні за формою і менш здатні до синтезу, якщо порівняти з хондроцитами молодими. Хондроцити можуть ділитися та формувати окремі клітинні групи, обрамлені єдиною капсулою. У склоподібному хрящі можуть бути клітинні групи числом до 12 клітин у кожній, а в інших типах хрящової тканини ізогенні групи містять, як правило, меншу кількість клітин.
Хрящові тканини: класифікація та гістогенез
Хрящова сполучна тканина розвивається не тільки на ембріональному рівні, а й у дорослих особин (регенерація тканини). У період розвитку хряща утворюється так званий хрящовий дифферон, в якому послідовно змінюють один одного стовбурові та напівстволові клітини, а потім хондробласти та хондроцити. На початковій стадії хрящового ембріогенезу формується невеликий хондрогенний острівець. Далі відбувається диференціація хондробластів з подальшою появою хрящового матриксу та волокон. На завершальній стадії ембріогенезу хрящова закладка переживає інтерстиціальне або апазіційне зростання. При першому тканина збільшується зсередини (властиво як ембріонального періоду, так і процесів регенерації), а при другому тканина нашаровується з подачі хондробластів, що діють у перихондрії.
Регенерація та вікові зміни
Хрящі відновлюються за рахунок глюкозаміну та хондроїтин сульфату. Ці компоненти є будівельним матеріалом, завдяки якому відбувається відновлення еластичності та структури суглобів, усувається артрозний біль, заповнюється недостатній обсяг тканини, посилюється дія препаратів протизапального характеру. Регенерація хрящової тканини здійснюється з камбіальних клітин перихондрію (наростають нові хрящові шари). Цей процес може протікати на повну силу лише у дитячому віці, а дорослі регенерація хряща, на жаль, відбувається в повному обсязі. Зокрема, на місці втраченої хрящової тканини формується ПВНСТ. З віком людини, його волокниста та еластична хрящові тканини не зазнають практично жодних змін. У той же час, склоподібний хрящ (гіалінова хрящова тканина) схильний до трансформацій у кісткову тканину і до звапніння.
Гіалінова хрящова тканина
Склоподібна тканина локалізується переважно у хрящах гортані, носа, бронхів, трахеї, ребер, суглобів, а також у хрящових пластинах росту, присутніх у трубчастих кістках. Складається гіаліновий хрящ із хондроцитів і, відповідно, міжклітинної речовини, яка у свою чергу включає колагенові волокна, інтерстиціальну воду та протеоглікани. Приблизно 20-25% загального обсягу посідає колагенові волокна, а 5-10% на протеогликани. Останні не допускають мінералізації склоподібної хрящової тканини, а інтерстиціальна вода, обсяг якої досягає 65-85%, сприяє амортизації хряща та нормальному обміну речовин у сполучній тканині, переносячи поживні компоненти, метаболіти та солі. Різновидом склоподібного хряща є суглобовий хрящ. Однак при цьому він не має надхрящниці, а отримує необхідні живильні елементи із синовіальної рідини. У хрящі суглобовому може бути виділено: безклітинна зона (поверхнева), проміжна зона і так звана глибока зона, тобто. зона взаємодії хрящової тканини з кістковою.
Еластична та волокниста хрящові тканини
Хрящова сполучна тканина, яка називається еластичною, локалізується в ріжкоподібних, надгортанних, черпалоподібних (у голосових відростках) і клиноподібних хрящах гортані. Крім того, еластична хрящова тканина зустрічається у вушній раковині та євстахієвій трубі. Даний різновид тканини особливо потрібний там, де потрібна здатність ділянок органів до зміни форми та обсягу, а також до зворотних деформацій. До складу еластичної тканини входять хондроцити, що складається з аморфної речовини (і волокон) міжклітинної речовини.
Хрящова тканина, звана волокнистою, локалізується в суглобових менісках і дисках, міжхребцевих дисках (в їх фіброзних кільцях), в лонному зчленуванні (симфізі), в зонах фіксації сухожиль до гіалінового хряща і кісток, а також на поверхню. нижньощелепного суглобів. Волокниста хрящова сполучна тканина складається з подовжених одиночних хондроцитів та міжклітинної речовини. Останнє включає значну кількість волокон колагену та досить малий обсяг аморфної речовини. Зазвичай колагенові волокна розміщені у міжклітинній речовині у вигляді пучків, що розташовуються паралельно та впорядковано.